7224例药品不良反应报告数据分析
邵 震
7224例药品不良反应报告数据分析
邵 震
目的 统计分析长春市收集的药品不良反应报告的数据信息,了解长春市药品不良反工作发展的趋势和不足,促进药品安全警戒信号的收集工作,促使临床合理用药。方法 通过国家药品不良反应监测系统下载2016年长春市收集的7224例合格药品不良反应报告,对其数据进行统计分析。结果 7224例报告中医疗机构上报占97.12%,新的和严重的报告占30.16%,涉及药品属于国家基本药物目录内药品的报告占报告总数的29.11%,不良反应的发生主要集中在45~64岁的中老年人群中。结论 医疗机构的上报比例上升,药品生产企业上报比例偏低,新的和严重的报告占比偏低,中老人的不良反应报告比例有小幅增高的趋势。
药品不良反应;合理用药;药品安全警戒;基本药物;国家药品不良反应监测系统
自八十年代我国开始监测药品不良反应数据以来,药品不良反应监测在药品上市后的安全性研究方面起到了不可替代的作用。2016年的国家药品不良反应监测年度报告中提及当年全国共收到 143万份报告,每百万人口平均报告数量已经达到1068份,其中新的和严重的药品不良反应/事件报告有42.3万余份,占比为29.6%。本研究通过对2016年长春市食品药品安全监测中心收集到的合格药品不良反应报告7224份进行数据统计分析,全面反映长春市药品不良反应监测实际情况和药品不良反应的发展趋势,与国内外的数据进行比较,发现监测工作中存在的不足之处,提升药物警戒信号收集能力,提高安全用药水平[1],促进临床合理用药,提升主动监测水平[2]。
1 资料与方法
1.1 资料来源 在“国家药品不良反应监测系统”中设置报告国家接收时间为 2016年 1月 1日至2016年12月31日,导出长春市食品药品安全监测中心收集的合格药品不良反应报告,共计7224份。
1.2 分析方法 依据世界卫生组织(WHO)药品不良反应术语集,利用“国家药品不良反应监测系统”数据和统计学方法对合格药品不良反应报告中的患者情况、药品品种、给药途径、不良反应临床表现类型、基本药物不良反应情况、新的和严重的报告情况、不良反应结果等重点项目进行统计分析。
2 结果
2.1 药品不良反应/事件报告数量 7224份报告中,医疗机构上报7016例,占97.12%;药品经营企业上报153例,占2.12%;生产企业报告55例,占0.76%。
2.2 报告人职业分布 报告人职业统计显示,医师占69.24%(5002例),药师占14.17%(1024例),护士占10.62%(767例),其他占5.94%(429例),不详占0.03%(2例)。
2.3 涉及患者情况 男女患者比例为0.806:1,不良反应发生主要集中在45岁以上的中老年人群,年龄分布见表1。
2.4 药品不良反应/事件报告涉及药品情况 西药的病例报告占 77.28%(5583例),中药占 21.01%(1518例),生物制品占1.70%(123例)。其中,药品不良反应/事件报告涉及药品数量排名前三位的分别是心血管系统用药(725例)、消化系统用药(377例)以及神经系统用药(340例)。
心血管系统用药排名前五的药品是马来酸桂哌齐特注射液(46例)、前列地尔注射液(37例)、丹参川芎嗪注射液(31例)、硝酸异山梨酯注射液(29例)、注射用肌氨肽苷(28例);消化系统用药排名前五的药品是注射用奥美拉唑钠(35例)、注射用泮托拉唑钠(34例)、多烯磷脂酰胆碱注射液(20例)、复方甘草酸单铵注射液(16例)、注射用还原型谷胱甘肽(16例);神经系统用药排名前五的药品是天麻素注射液(36例)、曲克芦丁脑蛋白水解物注射液(30例)、注射用脑蛋白水解物(19例)、长春西汀注射液(16例)、盐酸右美托咪定注射液(13例)。
7224例报告中,中药不良反应/事件报告涉及药品数量排名前五的药品是喜炎平注射液(92例)、舒血宁注射液(74例)、丹红注射液(69例)、参麦注射液(49例)、注射用丹参多酚酸盐(43例);而生物制品不良反应/事件报告涉及药品数量排名前五的药品是注射用小牛血去蛋白提取物(24例)、小牛血去蛋白提取物(12例)、小牛血清去蛋白注射液(12例)、注射用核糖核酸Ⅱ(12例)、重组人干扰素α 2b注射液(10例)。
2.5 剂型分析 病例报告涉及药品剂型排名前5的有注射剂、片剂、注射液、粉针剂和胶囊剂,报告数量合计占总数的90.72%(6554例),见表2。
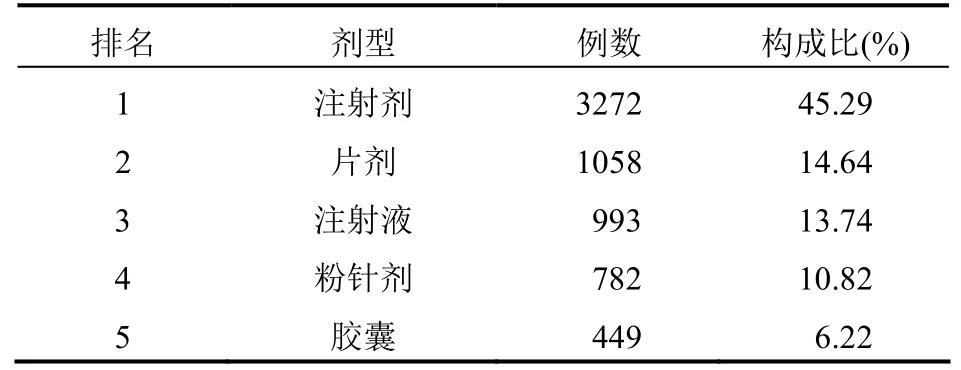
表2 7224例药品不良反应报告涉及药品剂型排名前5统计情况
2.6 涉及药品给药途径分布 7224例药品不良反应报告涉及药品给药途径排名前5的见表3,其中以静脉滴注和口服给药为主要途径,合计占比 90.42%(6532例)。
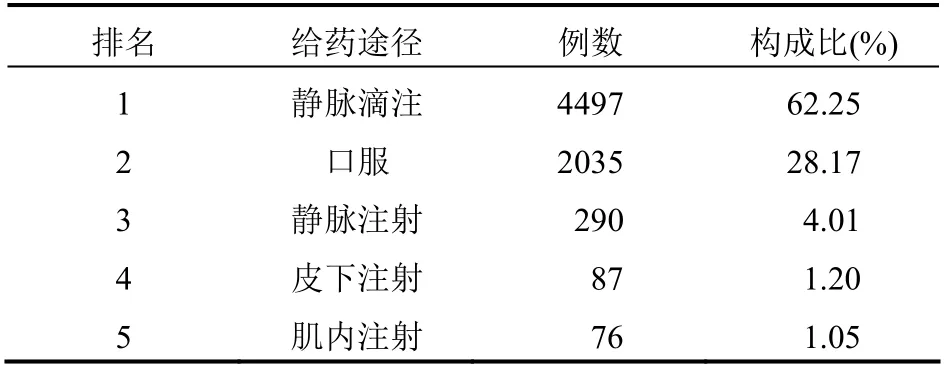
表3 7224例药品不良反应报告涉及药品给药途径排名前5统计情况
2.7 累及系统及主要不良反应表现 按照《药品不良反应术语集》对药品不良反应名称进行规范,并按照累及系统和器官进行分类。其中,胃肠系统损伤占31.40%(2268例)、皮肤及其附件损伤占24.38%(1761例)、神经系统损伤12.04%(870例)、全身性损伤占10.08%(728例),心血管系统损伤占4.40%(318例),血管损伤和出凝血障碍占3.28%(237例),呼吸系统损伤占 3.27%(236例),血液系统损伤占2.31%(167例),免疫功能紊乱和感染占2.27%(164例),用药部位损伤占1.85%(134例)。
2.8 新的和严重的药品不良反应报告情况 药品不良反应报告中新的和严重的报告共2179例,合计占报告总数的 30.16%。其中,严重的不良反应报告74例,占报告总数的 1.02%。新的和严重的药品不良反应报告及患者年龄主要集中发生在15~65岁以上患者中。见表4。

表4 2179例新的和严重的药品不良反应报告涉及患者年龄分布
2.9 国家基本药物目录内药品不良反应报告情况分析
2.9.1 涉及基本药物的报告总体情况 7224例药品不良反应报告中涉及的怀疑药品属于国家基本药物的共2103例,占29.11%。其中,新的和严重的报告数量为591份,占28.10%。涉及国家基本药物的报告上报来源为医疗机构占 97.15%(2043例),经营企业占2.09%(44例),生产企业占0.76%(16例)。
2.9.2 涉及患者情况 2103份报告中,男女比例1:1.23。按照医学年龄分布,统计不同年龄段人群由基本药物目录内药品引起的不良反应病例报告构成比情况,见表5。
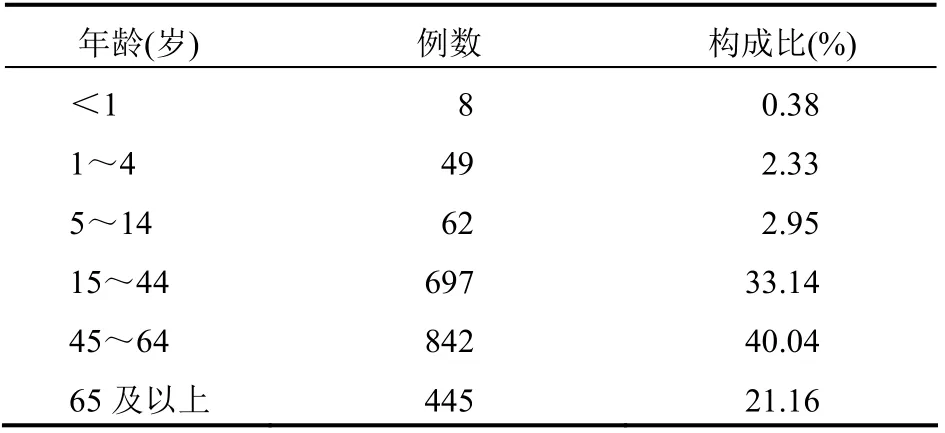
表5 2103份基本药物目录内药品报告涉及患者年龄分布情况
2.9.3 涉及药品情况 2103份基本药物药品不良反应/事件报告中,西药报告数占76.37%(1606例);中药占23.54%(495例);生物制品占0.10%(2例)。
2.10 不良反应结果 统计7224份药品不良反应/事件报告结果情况,其中痊愈占 55.34%(3998例),好转占44.06%(3183例),未好转占0.33%(24例),不详占0.25%(18例),死亡占0.01%(1例)。
3 讨论
3.1 报告来源变化 2016年的药品不良反应/事件报告总体情况与2015年相比,从药品报告来源上来看,医疗机构的上报比例提高了15.16个百分点,而生产企业报告比例没有太大变化,与国外相比仍然要低很多[3-4]。应加强宣传和督导,提高生产企业对该项工作的认识程度,促进生产企业主动收集药物不良反应报告。
3.2 报告人主体变化 报告人主体也随之发生变化,与2015年的报告人相比医师和护士的上报比例都有所提高,已经基本稳定在医护人员等医疗专业人士中,这不仅保证了报告的真实性,也大大提高了药品的报告质量,报告信息更加趋于完整,不良反应过程描述更为详细,报告用语更加专业,有利于更进一步的统计分析和风险信号提取[5]。
3.3 新的和严重的报告比例变化 新的和严重的药品不良反应/事件报告比例相比2015年提高了5.79个百分点,但仍处于较低比例,尤其是严重的报告比例远低于全国平均水平[1,6]。由于新的和严重的报告对于药物警戒信号的收集更有实际意义,所以应当加大对基层上报单位的宣传培训力度,消除上报人员不敢上报严重药品不良反应/事件报告的顾虑,大幅提高新的、严重的报告所占比例。
3.4 年龄分布变化 在患者年龄分布中,儿童不良反应报告比例相比2015年有所下降,中老年人的不良反应报告比例有小幅增高趋势,45岁以上中老年人群的不良反应比例达到60.20%,表明中老年人更容易发生不良反应,而如何确保中老年人安全用药值得深入探讨和研究[7],所以在临床用药过程中需要加强重视这一部分人群的合理用药,密切关注用药过程,避免过多的联合用药及长期用药。同时,本研究发现,基本药物目录内药品引起的不良反应年龄分布和新的及严重的报告年龄分布与整体分布没有显示出明显的差异性。
[1]朱磊,黄萍,李颖.我国药品不良反应监测现状及存在问题[J].中国药事,2016,30(7):729-734.
[2]王丹,沈璐.药品不良反应主动监测的方法与我国的应用[J].中国药物评价,2012,29(1):85-87.
[3]张渊,叶小飞.国外制药企业药物警戒数据库建设现状及启示[J].中国药物警戒,2015,12(10):590-592.
[4]邢蓉,鄂眉.中美两国药品不良反应监测状况的比较[J].中国现代药物应用,2010,4(10):230-232.
[5]田春华.促进医疗机构药品不良反应监测工作的思考[J].中国药物警戒,2016,13(5):272-274.
[6]王兰霞,方延学.药品不良反应监测中存在的问题及建议[J].临床合理用药杂志,2012,5(5):164-165.
[7]王丹,程刚.药品不良反应监测数据年度趋势分析[J].药物流行病学杂志,2013,22(5):238-241.
10.12010/j.issn.1673-5846.2017.10.008
长春市食品药品安全监测中心,吉林长春 130000
邵震(1984-),硕士学位,主管药师。研究方向:药械安全警戒。E-mail:szhen1984@163.com

