N-端置换提高木聚糖酶AoXyn11A的耐热性
何 瑶, 吴 芹, 殷 欣, 胡 蝶, 邬敏辰
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 无锡医学院,江苏 无锡 214122)
N-端置换提高木聚糖酶AoXyn11A的耐热性
何 瑶1, 吴 芹1, 殷 欣1, 胡 蝶1, 邬敏辰*2
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 无锡医学院,江苏 无锡 214122)
为提高米曲霉(Aspergillus oryzae)糖苷水解酶家族(GHF)11木聚糖酶AoXyn11A的耐热性,将其N-端置换为来源于嗜热裂孢菌 (Thermobifida fusca)的同一家族耐热木聚糖酶pXYL11的对应区域。基于木聚糖酶耐热性的理性设计,采用大引物PCR技术将AoXyn11A基因(Aoxyn11A)的5′-端DNA片段置换为pXYL11人工合成基因(xyn11PM)的对应片段,构建出杂合木聚糖酶ATX11A基因(ATx11A)。分别将Aoxyn11A和ATx11A在毕赤酵母GS115中进行了表达,并分析了重组表达产物AoXyn11A和ATX11A的温度特性。结果表明:ATX11A的最适温度Topt由AoXyn11A的50℃提升至65℃,在60℃的半衰期t1/260为55 min,较AoXyn11A延长了41.3倍;ATX11A在55℃处理3 h保留60%以上的酶活性,而AoXyn11A处理15 min酶活性完全丧失。本研究通过N-端置换显著改善了AoXyn11A的温度特性。
木聚糖酶;N-端置换;耐热性;分子动力学模拟;理性设计
木 聚 糖 酶 (endo-β -1,4-D-xylanases,EC 3.2.1.8)从木聚糖分子主链的内部水解β-1,4糖苷键产生不同聚合度的木寡糖,是木聚糖降解酶系的关键组分。基于一级结构的同源性比对和疏水簇分析,大多数木聚糖酶归属糖苷水解酶家族(GHF)10和11[1]。GHF11木聚糖酶具有底物特异性高、相对分子质量低 (<30×103)和单一催化结构域等特征,其三维结构呈现右手半握形状,主要由1个短的α-螺旋和2个β-折叠片A和B构成[2]。木聚糖酶尤其是耐热酶应用广泛,如在饲料造粒和纸浆漂白等工艺过程中均需要木聚糖酶具备耐高温的特性[3]。目前,除了从极端环境中筛选产耐热木聚糖酶的微生物菌株外,另一种有效的方法是采用基因工程技术对酶学特性优良的中温酶实施耐热性改造[4]。Zhang等[5]用极端耐热木聚糖酶EvXyn11TS的N-端置换Aspergillus usamii木聚糖酶AuXyn11A的对应区域,构建出最适温度和耐热性均大幅度提高的杂合木聚糖酶AEXynM。
作者所在实验室已从A.oryzae CICC40186中克隆出了中温酶AoXyn11A的基因,并将其在Pichia pastoris GS115中进行了表达,该酶活性高,pH 范围广,但热稳定性较差[6]。 pXYL11(GenBank:AAV64879)是一种源自嗜热裂孢菌(Thermobifida fusca)NTU22的GHF11耐热木聚糖酶[7]。作者所在实验室根据毕赤酵母的密码子偏好性对该酶的编码基因进行优化和人工合成,并命名为xyn11PM(GenBank:KP119614)。为改善中温酶 AoXyn11A 的温度特性,本文作者基于木聚糖酶一级结构比对、三维结构同源建模和分子动力学模拟的理性设计,采用大引物PCR技术将中温酶基因Aoxyn11A的5′-端DNA片段置换为耐热酶基因xyn11PM的对应片段,构建杂合酶基因ATx11A。将Aoxyn11A和ATx11A分别在毕赤酵母GS115中表达,分析和比较重组表达产物AoXyn11A和ATX11A的温度特性。
1 材料与方法
1.1 菌株、质粒和培养基
大肠杆菌(Escherichia coli)DH5α 和 JM109菌株、毕赤酵母(Pichia pastoris)GS115菌株和表达质粒pPIC9K,由作者所在实验室保藏;克隆质粒pUCm-T,购自上海Sangon公司;重组质粒pUCm-T-xyn11PM和pPIC9K-Aoxyn11A,由本实验室构建和保藏;LB、YPD、YPD-G418、MD、BMGY 和 BMMY培养基的配制,参照Multi-Copy Pichia Expression Kit(Invitrogen公司)操作手册。
1.2 主要试剂
限制性内切酶、rTaq DNA聚合酶、T4DNA连接酶、DNA Marker和蛋白质 Marker,均购自大连TaKaRa公司;Geneticin G418和 EZ-10柱式 DNA胶回收试剂盒,购自上海Sangon公司;桦木木聚糖、D-木糖和考马斯亮蓝R-250,Sigma公司产品;Sephadex G-50,Amersham Pharmacia Biotech 公司产品;其它试剂均为国产或进口分析纯。
1.3 木聚糖酶一级和三维结构的分析
采用DNAMAN 6.0软件和NetNGlyc 1.0程序(http://www.cbs.dtu.dk/services/NetNGlyc/) 对 木 聚糖酶一级结构进行同源性比对和N-糖基化位点分析。在PDB数据库(http://www.rcsb/org/)寻找一种与AoXyn11A序列同源性较高的GHF11木聚糖酶晶体结构,作为木聚糖酶同源建模的模板,运用MODELLER 9.9 程 序 (http://salilab.org/modeller/)进行三维结构建模[8]。
采 用 GROMACS 4.5 程 序 包 (http://www.gromacs.org/)对木聚糖酶三维结构进行分子动力学(molecular dynamic,MD)模拟,其模拟体系选用GROMOS 96力场,溶质分子被1.5 nm的SPC/E水分子层包裹。MD模拟之前,分别对受约束和去约束的溶质分子体系进行两次能量优化,即先采用最陡下降法优化800步,再采用共轭梯度法优化1 200步。将模拟温度在300 K,模拟时间为5 ns下的模拟结果导入PDB文件中,利用B-FITTER软件从PDB文件中提取每个氨基酸的B-factor值;另外,在温度为500 K,时间为5 ns条件下进行MD模拟,模拟结束后,用程序包中的g_rms软件计算出均方根偏差(RMSD)值。比较AoXyn11A和pXYL11的B-factor值,选定N-端置换的区域;分析AoXyn11A和ATX11A的根均方偏差 (root mean square deviation,RMSD)值,预测杂合酶ATX11A的耐热性。
1.4 ATx11A重组表达质粒的构建
基于GHF11木聚糖酶序列同源性比对和MD模拟,用pXYL11 N端42个氨基酸残基置换AoXyn11A对应的41个残基。根据xyn11PM和Aoxyn11A核苷酸序列设计PCR引物,由上海Sangon公司合成(表1)。以pUCm-T-xyn11PM为模板、Xyn-F和Tf-R为引物,PCR扩增基因片段Tf;以pPIC9K-Aoxyn11A为模板、Tf和Aox-R为引物,采用大引物PCR技术[9]扩增杂合酶基因ATx11A。将PCR产物与pUCm-T连接,转化E.coli JM109,经蓝白斑筛选、酶切鉴定,阳性转化子送上海Sangon公司测序。将测序正确的重组质粒pUCm-T-ATx11A经EcoRⅠ和NotⅠ双酶切,回收目的条带,与经同样双酶切的表达质粒pPIC9K连接,获重组表达质粒pPIC9K-ATx11A,转化E.coli DH5α,DNA测序验证。

表1 扩增杂合酶基因ATx11A的PCR引物Table 1 PCR primers for the amplification of hybrid enzyme gene ATx11A
1.5 木聚糖酶的表达和纯化
将pPIC9K-Aoxyn11A和pPIC9K-ATx11A分别用SalⅠ线性化,电转化P.pastoris GS115。重组毕赤酵母的鉴定和多拷贝筛选参照Multi-Copy Pichia Expression Kit操作手册。重组子经体积分数1.0%甲醇诱导表达72 h,上清液用75%饱和度的(NH4)2SO4盐析、离心,沉淀溶于20 mmol/L柠檬酸–Na2HPO4缓冲液(pH 5.5)。粗酶液经透析、超滤浓缩(膜截留相对分子质量为10×103,Millipore公司)至1 mL,上样 Sephadex G-50 层析柱(1.6 cm×80 cm)进行纯化。采用SDS-PAGE分析重组表达产物;Bradford法测定蛋白质含量。
1.6 木聚糖酶活性的测定
酶活性测定参见文献[10]并略作改动。2.4 mL质量浓度0.5 g/dL桦木木聚糖溶液(用pH 5.5、50 mmol/L柠檬酸-Na2HPO4缓冲液配制)中加入0.1mL适当稀释的酶液,50℃反应15 min,加入2.5 mL DNS试剂,在沸水浴中显色7 min,测定OD540。在上述反应条件下,每分钟产生1 μmol还原糖(以D-木糖计)所需的酶量定义为1个木聚糖酶活性单位(U)。
1.7 温度对木聚糖酶活性的影响
在40~75℃下,按1.6的方法测定木聚糖酶活性。最适温度Topt定义为最高酶活性(100%相对酶活性)所对应的温度。将酶液置于50~65℃处理不同时间,按1.6的方法测定残余酶活性,未处理酶液的酶活性以100%计。酶的半衰期t1/260定义为经60℃处理残余酶活性为50%时所对应的时间。
1.8 木聚糖酶动力学常数的测定
以不同质量浓度(1.0~10.0 mg/mL)的桦木木聚糖溶液 (用pH 5.5、50 mmol/L柠檬酸-Na2HPO4缓冲液配制)为底物,在木聚糖酶各自的最适温度Topt下按1.6的方法测定酶活性,并采用Origin 8.0软件进行非线性拟合,计算各自的Km和Vmax值。
2 结果与分析
2.1 木聚糖酶一级和三维结构的分析
中温酶AoXyn11A与耐热酶pXYL11一级结构的比对结果表明,两者整体的同源性较高(63.5%),但它们在N-端区域的同源性却较低,其中AoXyn11A N-端41个氨基酸残基与pXYL11对应的42个残基的同源性为50.0%;另外,在耐热酶pXYL11的N-端区域 (A1~T42)内含有2个N-糖基化位点 N5-E-T7和 N34-Y-S36(黄色背景),如图 1(a)所示。上述分析结果在一定程度上说明pXYL11的N-端可能对其耐热性贡献较大。由如图1(b)可见,AoXyn11A三维结构的催化活性中心 (Glu84和Glu175)远离其N-端区域,由此推测N-端置换对AoXyn11A的催化活性影响不大。
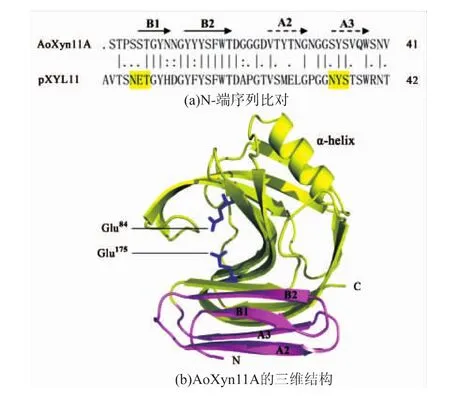
图1 AoXyn11A和pXYL11 N-端序列的同源性比对及AoXyn11A的三维结构Fig.1 N-Terminal sequence alignment of AoXyn11A and pXYL11 and the three-dimensional structure of AoXyn11A
2.2 同源建模及分子动力学模拟
选择与pXYL11序列完全一致、且与AoXyn11A同源性较高的嗜热裂孢菌 (T.fusca)木聚糖酶晶体结构 (PDB:3ZSE)为模板,对AoXyn11A和ATX11A进行同源建模和MD模拟。有研究表明酶蛋白中氨基酸残基的灵活度与其B-factor值成正相关[11]。通过比较 AoXyn11A和pXYL11 的 B-factor值发现,AoXyn11A N-端 (S1~V41)氨基酸的B-factor值大多数大于pXYL11对应区域的B-factor值(图 2),表明 AoXyn11A N-端刚性较弱。因此,拟将AoXyn11A N-端置换为pXYL11的对应区域(A1~T42),获得杂合酶 ATX11A。
RMSD值是指在模拟高温下某一时刻的蛋白质构象与其初始构象之间各个原子的根均方偏差值,可作为评价蛋白质/酶分子耐热性的重要指标。RMSD值越小,则蛋白质/酶分子中各个原子在高温下的运动幅度越小,即蛋白质/酶的耐热性越高[12]。由图3可见,ATX11A的RMSD值较AoXyn11A的小,由此推测ATX11A的耐热性高于AoXyn11A。

图2 AoXyn11A和pXYL11氨基酸残基的B-factor值Fig.2 B-factor values of amino acids of AoXyn11A and pXYL11
2.3 重组表达质粒pPIC9K-ATx11A的构建
将 Aoxyn11A 5′-端的 123 bp置换为 xyn11PM 5′-端的 126 bp。以 pUCm-T-xyn11PM 为模板,第一轮PCR扩增获得长度约为150 bp的基因片段Tf(图4泳道1);再以pPIC9K-Aoxyn11A为模板,第二轮PCR扩增获得长度约为580 bp的杂合酶基因ATx11A(图4泳道2)。测序结果表明,ATx11A全长570 bp, 包含126 bp的xyn11PM 5′-端片段和444 bp Aoxyn11A 3′-端片段,编码 189个氨基酸,与预期的完全一致。将ATx11A克隆至pPIC9K,获重组表达质粒pPIC9K-ATx11A。
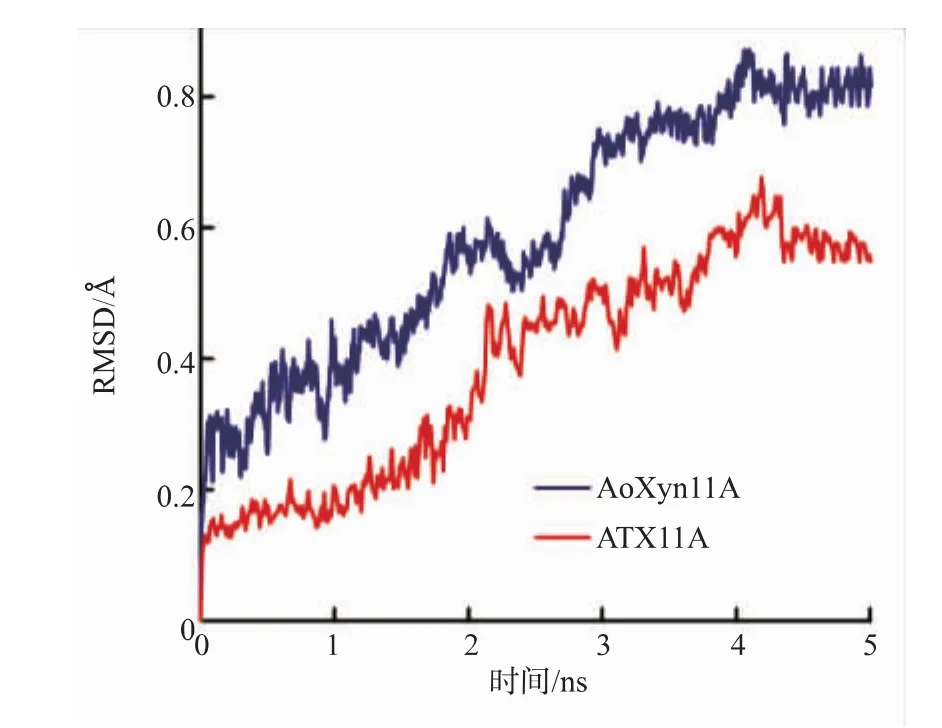
图3 AoXyn11A和ATX11ARMSD值的进程曲线Fig.3Curves of RMSD values of AoXyn11A and ATX11A
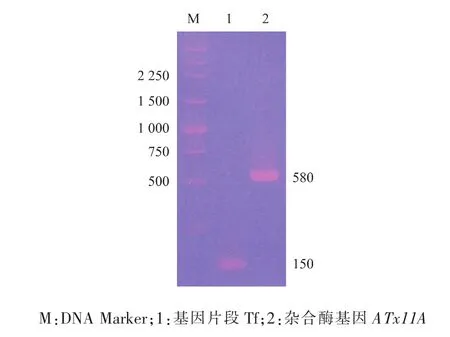
图4 PCR产物的琼脂糖凝胶电泳分析Fig.4 AnalysisofPCR productsby agarose gel electrophoresis
2.4 重组木聚糖酶的表达和纯化
选取若干在YPD-G418(4.0 mg/mL)平板上生长良好的单菌落,按照Multi-Copy Pichia Expression Kit操作手册进行诱导表达 (30℃培养72 h,每隔24 h添加终体积分数为1.0%的甲醇),按1.6的方法测定上清液酶活性,筛选到2个分别产重组AoXyn11A和ATX11A活性最高的重组毕赤酵母GS115/Aoxyn11A和GS115/ATx11A,它们的酶活性分别为210.8 U/mL和148.1 U/mL,而在空白对照GS115/pPIC9K的上清液中未检测到木聚糖酶活性。分别取GS115/Aoxyn11A和GS115/ATx11A的诱导表达上清液,采用 (NH4)2SO4盐析、超滤浓缩和Sephadex G-50凝胶层析进行纯化。SDS-PAGE分析显示,纯化的重组AoXyn11A约在21.2×103(表观相对分子质量)处呈现单一条带 (图5泳道1),与其理论相对分子质量20.0×103接近。由于在ATX11A序列中含有2个N-糖基化位点 (N5-E-T7和N34-Y-S36),使得理论相对分子质量20.2×103的重组ATX11A的表观相对分子质量达到27.4×103(图 5 泳道 2)。
2.5 重组木聚糖酶的温度特性
按1.7的方法分析了温度对重组AoXyn11A和ATX11A的影响 (图 6和图 7)。由图 6可见,ATX11A的最适温度Topt为65℃,较AoXyn11A的50℃提升了15℃。Sun等[13]用褐色热单胞菌(Thermomonospora fusca)耐热木聚糖酶N-端的43个氨基酸残基置换Aspergillus niger木聚糖酶相应的36个残基,所获杂合酶Atx的最适温度提高了10℃,低于本研究的结果。由图7可见,ATX11A在60℃的半衰期t1/260为55 min,较AoXyn11A (t1/260=1.3 min)延长了41.3倍;且ATX11A在55℃处理180 min仍保留60%以上的酶活性,而AoXyn11A在同一温度下处理15 min酶活性完全丧失。上述分析结果表明,通过N-端置换显著提高了AoXyn11A的最适温度和耐热性。
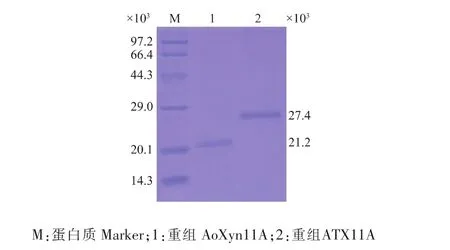
图5 纯化的重组AoXyn11A和ATX11A的SDS-PAGE分析Fig.5 SDS-PAGE analysis of the purified recombinant AoXyn11A and ATX11A

图6 纯化的重组AoXyn11A和ATX11A的最适温度Fig.6 Temperature optima of the purified recombinant AoXyn11A and ATX11A
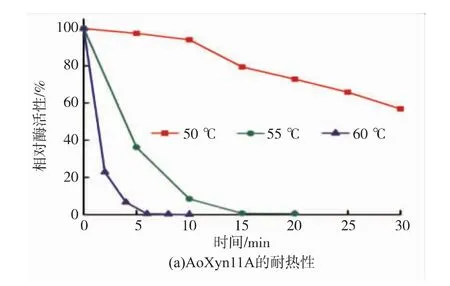
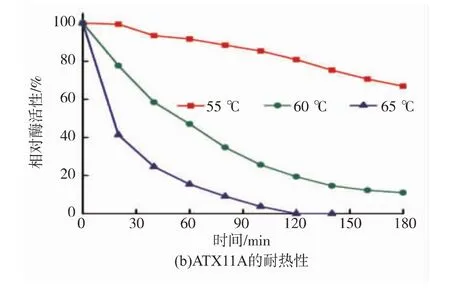
图7 纯化的重组AoXyn11A和ATX11A的耐热性Fig.7 Thermostabilities of the purified recombinant AoXyn11A and ATX11A
运用Protein Interactions Calculator(PIC)软件(http://pic.mbu.iisc.ernet.in/job.html) 分析了ATX11A三维结构中氨基酸残基间的相互作用。结果显示,由于N-端置换,引入了2个离子键His10-Asp11和Asp11-Lys49以及5个主链与支链之间的氢键,由此推测引入的离子键和氢键对重组ATX11A温度特性的改善起到一定的作用[14-15]。此外,重组ATX11A最适温度和耐热性的提高也可能与其在P.pastoris GS115表达的过程中发生了N-糖基化有关[16]。
2.6 酶动力学常数的测定
在重组AoXyn11A和ATX11A各自的最适温度 (Topt=50℃和65℃)下,按 1.8的方法测得AoXyn11A和ATX11A对桦木木聚糖的Km值分别为 2.55 mg/mL和 4.36 mg/mL,Vmax值分别为 3 917 U/mg和 4 168 U/mg。
3 结 语
理性设计是基于数据库和文献中的相关信息和数据,通过计算机模拟和分析,为目的蛋白质/酶分子的定向改造提供可靠的预测模型和结果,生物信息学、数据库和计算机科学的快速发展使其优势日趋明显[4]。本研究以米曲霉AoXyn11A为对象,基于木聚糖酶一级结构比对、三维结构同源建模和分子动力学模拟的理性设计,采用大引物PCR技术将中温酶基因Aoxyn11A的5′-端DNA片段置换为耐热酶基因xyn11PM的对应片段,构建出杂合酶基因ATx11A。分别将Aoxyn11A和ATx11A在毕赤酵母GS115中进行了表达,并分析了重组表达产物AoXyn11A和ATX11A的温度特性。结果表明,通过N-端置换显著提高了AoXyn11A的最适温度和耐热性。ATX11A不仅保留了AoXyn11A优良的酶学性质,而且显著改善了其温度特性,使其在食品、饲料和造纸等工业领域有着巨大的应用前景。
[1]COLLINS T,GERDAY C,FELLER G.Xylanases,xylanase families and extremophilic xylanases[J].FEMS Microbiology Reviews,2005,29(1):3-23.
[2]PASTOR F I J,GALLARDO O,SANZ A J,et al.Xylanases:molecular properties and applications[M].In:Polaina J,MacCabe A P,editors.Industrial Enzymes.The Netherlands:Springer-Verlag Press,2007:65-82.
[3]POLIZELI M L T M,RIZZATTI A C S,MONTI R,et al.Xylanases from fungi:properties and industrial applications[J].Applied Microbiology and Biotechnology,2005,67(5):577-591.
[4]LI Chunxiu,XU Jianhe.The digging and application of industrial enzyme resources in post genome era[J].Biotechnology and Business,2011,1:40-49.(in Chinese)
[5]ZHANG H,LI J,WANG J,et al.Determinants for the improved thermostability of a mesophilic family 11 xylanase predicted by computational methods[J].Biotechnology for Biofuels,2014,7:3.
[6]LI J F,GAO S J,LIU X T,et al.Modified pPIC9K vector-mediated expression of a family 11 xylanase gene,Aoxyn11A,from Aspergillus oryzae in Pichia pastoris[J].Annals of Microbiology,2013,63(3):1109-1120.
[7]CHENG Y F,YANG C H,LIU W H.Cloning and expression of Thermobifida xylanase gene in the methylotrophic yeast Pichia pastoris[J].Enzyme and Microbial Technology,2005,37(5):541-546.
[8]ESWAR N,ERAMIAN D,WEBB B,et al.Protein structure modeling with MODELLER[J].Methods in Molecular Biology,2008,426:145-159.
[9]XIE Z H,SHI X J.Fast and almost 100%efficiency site-directed mutagenesis by the megaprimer PCR method[J].Progress in Biochemistry and Biophysics,2009,36(11):1490-1494.
[10]WANG J,ZHANG H,WU M,et al.Cloning and sequence analysis of a novel xylanase gene,Auxyn10A,from Aspergillus usamii[J].Biotechnology Letters,2011,33(5):1029-1038.
[11]REETZ M T,CARBALLEIRA J D.Iterative saturation mutagenesis (ISM)for rapid directed evolution of functional enzymes[J].Nature Protocols,2007,2(4):891-903.
[12]BADIEYAN S,BEVAN D R,ZHANG C.Study and design of stability in GH5 cellulases[J].Biotechnology and Bioengineering,2012,109(1):31-44.
[13]SUN J Y,LIU M Q,XU Y L,et al.Improvement of the thermostability and catalytic activity of a mesophilic family 11 xylanase by N-terminus replacement[J].Protein Expression and Purification,2005,42(1):122-130.
[14]KUMAR S,TSAI,C J,NUSSINOV R.Factors enhancing protein thermostability[J].Protein Engineering,2000,13(3):179-191.
[15]PATHAK A K.Effect of a buried ion pair in the hydrophobic core of a protein:an insight from constant pH molecular dynamics study[J].Biopolymers,2015,103(3):148-157.
[16]LEE J H,HE S Y,LEE J W,et al.Thermostability and xylan-hydrolyzing property of endoxylanase expressed in yeast Saccharomyces cerevisiae[J].Biotechnology and Bioprocess Engineering,2009,14(5):639-644.
会议名称(中文):第六届全国“跨学科蛋白质研究”学术讨论会
所属学科:生物物理学、生物化学及分子生物学,细胞生物学,生物医学工程学
开始日期:2017-09-22
结束日期:2017-09-24
所在城市:广东省 广州市
具体地点:广州汇华希尔顿逸林酒店
主办单位:中国生物化学与分子生物学会蛋白质专业委员会
承办单位:中国科学院广州生物医药与健康研究院
会议主席:施一公
联系人:凌老师
联系电话:020-32015232
E-MAIL:ling_yixia@gibh.ac.cn
会议网站:http://cps2017.csp.escience.cn/dct/page/1
会议背景介绍:第六届全国“跨学科蛋白质研究”学术讨论会将于2017年9月22日-24日在广东广州召开,此次会议由中国生物化学与分子生物学会蛋白质专业委员会举办,中国科学院广州生物医药与健康研究院承办。本次会议将邀请众多在蛋白质科学领域有重要影响力的科学家参加,不仅为本领域的中青年科学工作者提供学术交流的平台,也为近期回国或进入蛋白质科学领域的同行提供融入国内队伍的机会。此次学术会议的召开,将集中展示过去两年我国在蛋白质科学领域的辉煌成就,展现国内正在开展的令人激动的研究工作,展望未来我国在蛋白质科学领域的美好前景。此次会议将是我国蛋白质科学乃至学术界的又一次盛会。
Enhancement in the Thermotolerance of Xylanase(AoXyn11A)by N-Terminus Replacement
HE Yao1, WU Qin1, YIN Xin1, HU Die1, WU Minchen*2
(1.School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.Wuxi Medical School,Jiangnan University,Wuxi 214122,China)
To enhance the thermotolerance of AoXyn11A,a glycoside hydrolase family (GHF)11 mesophilic xylanase from Aspergillus oryzae,its N-terminal region was substituted with the corresponding one of the same family thermostable xylanase pXYL11 from Thermobifida fusca NTU22.Based on the rational design of xylanase thermotolerance,an ATX11A-encoding gene(ATx11A)was constructed by replacing the 5′-end DNA fragment of AoXyn11A gene(Aoxyn11A)with the corresponding one of the synthesized pXYL11 gene (xyn11PM)using the megaprimer PCR technique.Aoxyn11A and ATx11A were expressed in Pichia pastoris GS115,respectively,and the temperature characteristics of the expressed recombinant products,AoXyn11A and ATX11A,were analyzed.The results indicated that the temperature optimum (Topt) of hybrid xylanase ATX11A was 65 ℃,which was 15 ℃ higher than that of AoXyn11A.Its half-life at 60 ℃(t1/260)was 55 min,whichwas 41.3-fold longer than that of AoXyn11A.When incubated at 55℃,ATX11A retained more than 60%of its original activity for 3 h,while AoXyn11A entirely lost its activity only for 15 min.In this work,the temperature characteristics of AoXyn11A were significantly improved by N-terminus replacement.
xylanase,N-terminus replacement,thermotolerance,molecular dynamic simulation,rational design
Q 936
A
1673—1689(2017)08—0855—07
10.3969/j.issn. 1673-1689.2017.08.011
2015-05-08
国家自然科学基金项目(31271811)。
*通信作者:邬敏辰(1962—),男,江苏无锡人,理学博士,教授,博士研究生导师,主要从事酶工程与基因工程研究。E-mail:bioch@163.com
何瑶,吴芹,殷欣,等.N-端置换提高木聚糖酶AoXyn11A的耐热性[J].食品与生物技术学报,2017,36(08):855-861.

