鲫鱼MBSP的原核表达、纯化及其多克隆抗体制备
李 婷 , 李 欢 , 陈海英 , 杜翠红 *
(1.集美大学 食品与生物工程学院,福建 厦门 361021;2.福建省水产品深加工工程研究中心,福建 厦门361021)
鲫鱼MBSP的原核表达、纯化及其多克隆抗体制备
李 婷1,2, 李 欢1,2, 陈海英1,2, 杜翠红*1,2
(1.集美大学 食品与生物工程学院,福建 厦门 361021;2.福建省水产品深加工工程研究中心,福建 厦门361021)
构建鲫鱼肌原纤维结合型丝氨酸蛋白酶 (MBSP)的原核表达菌株Rosetta(pET28a-MBSP),获得重组MBSP,以制备MBSP多克隆抗体。将鲫鱼MBSP全长基因(MBSP)借助表达载体pET-28a构建重组表达菌株Rosetta(pET28a-MBSP),并进行诱导表达后获得重组MBSP。利用Ni-NTA agarose亲和层析柱纯化重组蛋白并进行质谱鉴定。以纯化后的重组MBSP作为抗原免疫新西兰兔,获得MBSP多克隆抗体。分别采用ELISA和Western blot技术测定其效价和特异性。诱导表达的重组蛋白经SDS-PAGE分析、Western blot检测及质谱鉴定,结果表明该蛋白质为重组MBSP,其相对分子质量约为28×103,与天然MBSP大小一致,主要以包涵体形式存在。将其免疫兔子后,从血清中获得了与MBSP发生特异性反应的高效价多克隆抗体。本研究中成功表达和纯化了重组MBSP蛋白,制备了高效价的特异性MBSP多克隆抗体,为MBSP的相关研究奠定基础。
肌原纤维结合型丝氨酸蛋白酶;原核表达;蛋白纯化;Western blot;多克隆抗体
肌原纤维结合型丝氨酸蛋白酶(MBSP)是一种碱性蛋白酶,属于丝氨酸蛋白酶家族中的一员,因其与肌原纤维蛋白紧密结合而得名。有关鱼类MBSP的报道已经证实,鱼类MBSP可降解肌原纤维蛋白,从而造成鱼糜制品凝胶劣化,降低其商业价值[1-3],因此,有必要对鱼类MBSP进行深入研究,并开发其酶抑制剂。关于鱼类MBSP的分离纯化目前已有报道:如Osatomi等[4]在1997年获得鲤鱼肌肉的MBSP;随后Cao等分别从狗母鱼[5-6]、白鲢鱼[7]、白姑鱼[8]和鲫鱼[9]等鱼类肌肉中也纯化了MBSP。同时文献报道[5-11],鱼类MBSP具有与胰蛋白酶相似的底物特异性,而其热稳定较高,有望开发为一种蛋白质谱鉴定中的新型工具酶。但天然MBSP在有些鱼类中含量很低、不易检测,从而影响对其分离纯化和深入研究,因此,MBSP基因的克隆和重组表达受到研发人员的关注。目前已通过RACE技术克隆到了鲫鱼[9]、鲤鱼[12]和鲢鱼的MBSP基因序列,从而为鱼类MBSP的重组表达及其多克隆抗体的制备提供了前提保证。本文中采用基因重组技术在原核表达系统中获得了重组鲫鱼MBSP蛋白,并用该蛋白质制备了特异性多克隆抗体,为进一步研究MBSP的性质和功能奠定了基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂 限制性内切酶EcoRⅠ和NotⅠ,Taq DNA聚合酶,T4连接酶,λ-HindⅢ DNA Marker,2000 DNA marker,Protein Marker:购自大连宝生物公司;质粒提取试剂盒,DNA片段回收试剂盒:购自上海天根生物有限公司;蛋白胨,酵母提取物,IPTG,丙烯酰胺,氯化钠及过硫酸铵等:购自上海生工生物有限公司;Ni-NTA agarose:购自Pharmacia公司;HRP标记的羊抗兔:购自泰京生物有限公司;NC膜:购自美国Millipore公司;完全佐剂和不完全佐剂:购自德国Sigma公司。其他化学试剂均为分析纯。
1.1.2 实验动物 3只新西兰大白兔,每只体重约2.5 kg,购自松江区松联实验动物场。
1.1.3 菌株与载体 大肠杆菌菌株DH5α和Rosetta、表达载体pET-28a均由本实验室保存,其中菌株DH5α为克隆宿主,菌株Rosetta为表达宿主;重组克隆质粒pMD19-T-MBSP由本实验室构建。
1.2 方法
1.2.1 PCR引物设计及鲫鱼MBSP基因(MBSP)的PCR扩增 参照 GenBank(DQ872434)中报道的鲫鱼MBSP的cDNA序列设计特异性引物,其核苷酸序列分别为:

以上引物交由上海Invitrogen公司合成。
以重组克隆质粒pMD19-T-MBSP为模板,利用以上设计的特异性引物进行PCR扩增,以获得带有限制性内切酶EcoRⅠ和NotⅠ的鲫鱼MBSP基因(MBSP)片段。PCR条件为:95℃预变性5 min,95℃变性 45 s,55℃退火 1 min,72℃延伸 1 min,30个循环,72℃延伸10 min。采用琼脂糖凝胶电泳对PCR产物进行检测,利用DNA片段回收试剂盒对PCR产物进行回收。
1.2.2 重组表达质粒pET-28a-MBSP的构建 将质粒pET-28a和1.2.1中获得的PCR产物 (即:MBSP基因片段)同时进行EcoRⅠ和NotⅠ双酶切,琼脂糖凝胶电泳进行分离,DNA片段回收试剂盒进行回收,使用T4连接酶16℃过夜连接,连接产物转化大肠杆菌DH5α感受态,通过含50 μg/mL卡那霉素的LB平板筛选转化子,于37℃,200 r/min震荡培养后提取质粒,经EcoRⅠ和NotⅠ双酶切验证得到阳性转化子,送至上海Invitrogen公司进行测序,进一步确认重组质粒pET-28a-MBSP中目的基因序列及其阅读框架的正确性。
1.2.3 重组表达菌株Rosetta(pET-28a-MBSP)的构建及其诱导表达 质粒提取试剂盒提取测序正确的重组质粒pET28a-MBSP,42℃热激转化Rosetta感受态细胞,挑取LB(含50 μg/mL卡那霉素)平板筛选的阳性转化子进行扩大培养,提取质粒进行PCR验证(反应条件:95℃预变性5 min,95℃变性45 s,55℃退火 1 min,72℃延伸 1 min,30个循环,72℃延伸10 min),从而获得重组表达菌株Rosetta(pET-28a-MBSP)。
将重组表达菌株Rosetta(pET-28a-MBSP)接种至10 mL LB培养基中进行活化,按体积分数1%接种量转接50 mL LB培养基中,37℃,200 r/min震荡培养至OD600为1.5,加入乳糖至终质量浓度为4 mg/L,诱导表达8 h,以未加诱导剂的细菌培养物为阴性对照,重复3次。
1.2.4 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)检测及Western blot鉴定 收集诱导表达的菌体进行超声波破碎,冷冻离心,分别收集上清和沉淀,进行SDS-PAGE检测,并用 (His)6标签的多克隆抗体(稀释倍数 1∶2 000)进行 Western blot鉴定,二抗为HRP标记的羊抗兔IgG(稀释倍数 1∶20 000),以确定重组蛋白的相对分子质量及其表达方式,具体步骤参照刘西之等[13]报道的方法。
1.2.5 重组MBSP的纯化和质谱鉴定 对重组表达菌株Rosetta(pET-28a-MBSP)进行大量诱导表达,离心收集菌体,用破菌缓冲液(0.02 mol/L Tris-HCl(pH 8.0),0.15 mol/L NaCl)重悬菌体,超声波破菌,离心收集包涵体沉淀,用溶菌缓冲液(0.01 mol/L Tris-HCl (pH 8.0),0.1 mol/L NaH2PO4,8 mol/L 尿素)搅拌使之充分溶解,离心收集上清液。将上清液与经平衡缓冲液 A1(0.05 mol/L Na2HPO4,0.015 mol/L咪唑,0.5 mol/L NaCl,8 mol/L尿素)处理过的Ni-NTA agarose充分结合,缓冲液A2(0.05 mol/L Na2HPO4,0.03 mol/L 咪 唑 ,0.5 mol/L NaCl,8 mol/L尿素)洗去杂蛋白质,洗脱液(0.05 mol/L Na2HPO4,0.3 mol/L 咪唑,0.5 mol/L NaCl,8 mol/L 尿素) 洗脱目的蛋白质,即获得纯化的含(His)6标签的重组蛋白,分别进行SDS-PAGE分析和Western blot鉴定。将SDS-PAGE电泳分离的MBSP目的条带切下,送至上海中科新生命生物科技有限公司进行MALDITOF-MS质谱鉴定。
1.2.6 MBSP多克隆抗体的制备及其检测 将纯化后的重组MBSP(质量浓度为1.0 mg/mL)与等体积弗氏完全佐剂混匀并充分乳化后,分散15个点对新西兰兔脊柱两侧进行皮下免疫注射(每次200 μg的重组MBSP)。初次免疫后,每间隔两周加强免疫,剂量如前,共免疫4次。第1次用弗氏完全佐剂,其余用弗氏不完全佐剂。免疫完成后取血测效价,效价达到理想值后再进行兔颈动脉取血,5 000 r/min离心10 min,分离血清,于-80℃保存。采用ELISA法,以纯化的重组MBSP作为包被抗原,一抗为免疫兔血清,二抗为HRP标记的羊抗兔IgG,一抗的稀 释 梯 度 分 别 :1/50、1/502、1/503、1/504、1/505、1/506,1/507,TMB 显色后,在 λ=450 nm 处测定光密度值。确定抗体效价后,采用Western blot的方法检测免疫兔血清的特异性,具体步骤参考1.2.4。
2 实验结果
2.1 重组表达质粒pET-28a-MBSP的构建
以重组克隆质粒pMD19-T-MBSP为模板,采用PCR技术扩增鲫鱼MBSP基因片段,PCR产物为700 bp左右(图1),与预期大小相符。将表达载体pET-28a和MBSP基因片段进行双酶切,采用T4连接酶将二者连接后成功转入感受态DH5α,提取重组质粒,双酶切获得约700 bp的目的基因片段和5 000 bp左右的载体pET-28a线性片段 (图 2),DNA测序结果证实目的基因大小为669 bp,其基因序列和阅读框架均正确,重组表达质粒pET-28a-MBSP构建成功。
2.2 重组表达菌株Rosetta(pET-28a-MBSP)的构建及其诱导表达
重组表达质粒pET-28a-MBSP转入到大肠杆菌Rosetta感受态细胞后,进行菌落PCR验证 (图3),结果显示表达菌株 Rosetta(pET-28a-MBSP)构建成功。

图1 MBSP基因的PCR产物的琼脂糖凝胶电泳检测结果Fig.1 AgarosegelelectrophoresisanalysisofPCR product of MBSP
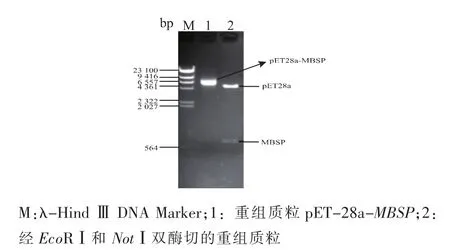
图2 重组质粒pET-28a-MBSP的双酶切鉴定结果Fig.2 Identification of the recombinant plasmid pET-28a-MBSP( EcoRⅠand NotⅠ)

图3 重组质粒pET-28a-MBSP的PCR鉴定Fig.3 Identification of the recombinant plasmid pET-28a-MBSP
表达菌株Rosetta(pET-28a-MBSP)经乳糖诱导表达,超声波破碎,分别取全菌、上清液及沉淀进行SDS-PAGE检测及Western bolt鉴定(图4)。结果显示,诱导表达的菌液中出现一条相对分子质量为28×103左右的蛋白质条带,该条带可以与(His)6标签的多克隆抗体进行免疫杂交反应,说明该蛋白质为重组蛋白。该重组蛋白与天然鲫鱼MBSP的相对分子质量一致,且以包涵体形式存在。

图4 MBSP重组蛋白的SDS-PAGE检测及Western blot鉴定结果Fig.4 SDS-PAGE and Western blotanalysisof recombinant MBSP
2.3 重组MBSP的纯化和质谱鉴定
将诱导表达后得到的包涵体用8 mol/L尿素溶解后,采用Ni-NTA agarose亲和层析对其进行纯化,通过SDS-PAGE检测和Western blot鉴定 (图5),得到电泳级纯度为85% 以上的重组MBSP。将纯化后的MBSP进行MALDI-TOF-MS质谱鉴定(图6),结果显示纯化后的产物确定为鲫鱼MBSP,可用来制备多克隆抗体。
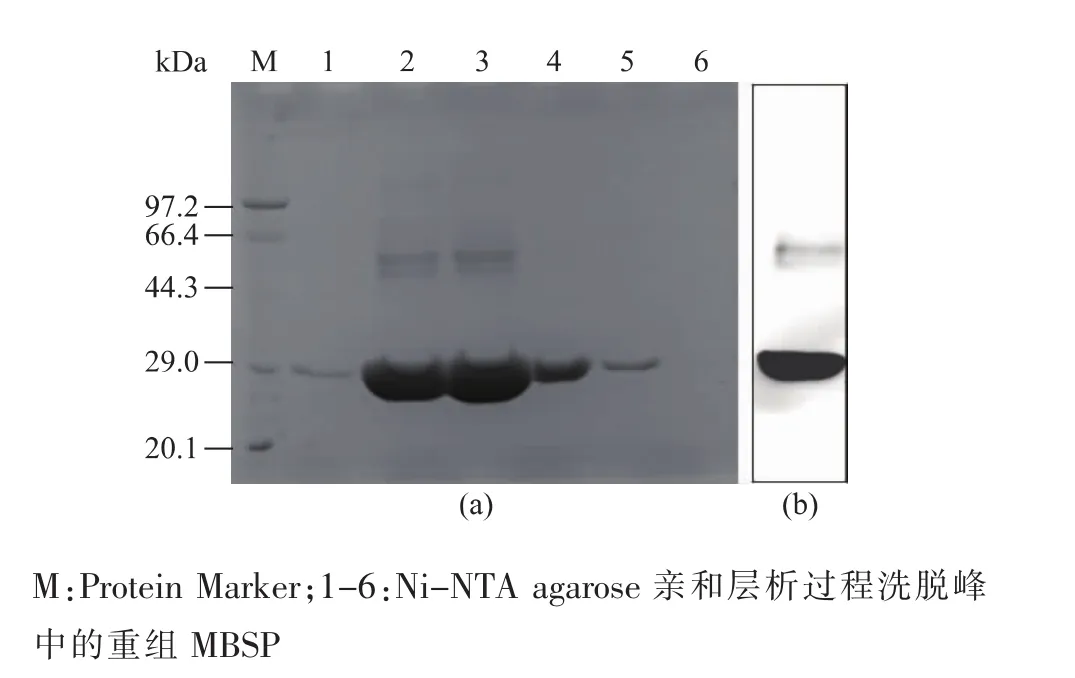
图5 纯化的重组MBSP的SDS-PAGE检测和Western blot鉴定结果Fig.5 SDS-PAGE and Western blot analysis of purified recombinant MBSP

图6 鲫鱼MBSP的氨基酸序列及重组MBSP质谱鉴定肽段序列覆盖图Fig.6 Amino acid sequence of crucian carp MBSP and fragments of recombinant MBSP mature peptides digested by trypsin
2.4 多克隆抗体的制备及检测
用纯化的重组MBSP免疫新西兰兔获得血清,采用ELISA法检测其效价,结果显示其抗体效价达到 1∶503倍(图 7)。
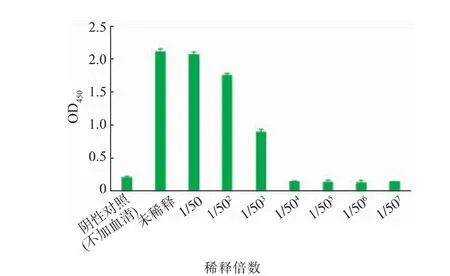
图7 ELISA检测MBSP多克隆抗体效价Fig.7 ELISA detection of the MBSP polyclonal antibody titer
以MBSP的多克隆抗体为一抗,带HRP标记的羊抗兔IgG为二抗进行Western blot验证(图8),结果表明,阴性对照(未经诱导的菌液)没有特异性条带(图 8(b),lane 2B),而大肠杆菌表达的重组MBSP(图8(b),lane 1B)和毕赤酵母表达的重组MBSP(图 8(b),lane 3B)均出现特异性条带,表明 MBSP的多克隆抗体制备成功。其中,毕赤酵母表达的重组MBSP由本研究室提供,实验结果有待发表。
3 讨论
鱼类的MBSP在鱼糜制品生产过程中被认为是导致凝胶劣化的主要因素[1]。因此,有必要对不同鱼类MBSP的进行分离纯化及其酶学性质研究,以开发其酶抑制剂。另一方面,MBSP是一种与胰蛋白酶性质相似的丝氨酸蛋白酶,但其热稳定性优于哺乳动物的胰蛋白酶[5-11]。而在蛋白质的质谱鉴定中,常用胰蛋白酶或蛋白内切酶Lys-C作为工具酶对蛋白质进行降解以生成小肽[14-15]。但胰蛋白酶的热稳定性差,而内切酶Lys-C价格偏高,影响了其实际使用。因此,将MBSP开发为蛋白质质谱鉴定中的工具酶,具有很好的应用前景和商业价值。然而,天然MBSP在有些鱼类体内含量极低,常常检测不到该酶的存在,从而造成其分离纯化困难,因此,有必要通过基因重组技术获得大量的重组MBSP。一方面通过制备多克隆抗体以提高检测MBSP的灵敏度;另一方面也有利于研究其酶学性质及其应用开发。

图8 MBSP多克隆抗体的Western blot鉴定Fig.8 Western blotting analysis of MBSP polyclonal antibody
本文作者利用GenBank数据库中已报道的鲫鱼MBSP的cDNA序列设计特异性引物,采用RTPCR技术获得编码鲫鱼MBSP成熟蛋白的基因序列,将其与表达载体pET-28a连接,转入大肠杆菌表达宿主Rosetta中进行诱导表达,获得了重组鲫鱼MBSP的包涵体蛋白(图4)。同时本研究室还利用毕赤酵母表达系统对该蛋白质进行重组表达,获得了重组MBSP(实验结果有待发表)。其中,原核系统表达的重组MBSP的主要为包涵体蛋白,虽然其不具有生物学活性,但其表达量较高(图8)、且带有(His)6 标签(图 4(b))便于采用亲和层析技术进行纯化,以获得纯度较高的重组 MBSP,更适合用于多克隆抗体的制备;而真核系统表达的重组MBSP,虽然表达量较低(图8),但其具有生物学活性,可用于研究其酶学性质及其应用开发。
本研究采用Ni-NTA agarose亲和层析技术纯化得到了电泳级为85% 以上的重组蛋白(图5),通过质谱鉴定技术确定该蛋白为重组鲫鱼MBSP(图7)。将重组MBSP免疫新西兰兔,获得了高效价的抗MBSP的特异性多克隆抗体。因免疫印迹具有高灵敏性,能与含量极低的抗原发生特异性结合。因此本文获得的MBSP多克隆抗体可用于MBSP的检测。
亲和层析是利用生物分子间的特异性相互作用,通过将具有亲和力的2个分子中的1个固定在不溶性基质上,利用分子间亲和力的特异性和可逆性对另一个分子进行分离纯化的技术。如本文中采用Ni-NTA agarose亲和层析柱纯化带有 (His)6标签的重组蛋白(图5);另外重组蛋白也常含有GST标签,可采用谷胱甘肽亲和层析树脂进行纯化。这两种亲和层析树脂可成功纯化原核表达的重组蛋白[16-18],但因天然蛋白不含(His)6标签和GST标签,使该层析柱无法应用到天然蛋白的纯化中。而本研究中所获得的MBSP特异性多克隆抗体可制备特异性免疫亲和层析树脂,用来纯化天然MBSP,以解决生物体内MBSP含量低、分离纯化步骤繁琐、回收率低等问题,为MBSP的进一步研究奠定基础。
4 结 语
利用GenBank数据库中已报道的鲫鱼MBSP的cDNA序列设计特异性引物,获得编码鲫鱼MBSP成熟蛋白的基因序列,成功构建重组MBSP的原核表达菌株Rosetta/pET-28a-MBSP,并采用乳糖进行诱导表达,结果表明,重组蛋白在原核表达系统内以包涵体形式成功表达。
采用Ni-NTA agarose亲和层析技术对表达的包涵体蛋白进行纯化,得到了电泳级纯度为85%以上的重组蛋白,通过质谱鉴定技术确定该蛋白质为重组鲫鱼MBSP。
将重组MBSP免疫新西兰兔,获得了高效价的抗MBSP的特异性多克隆抗体,可用于后续毕赤酵母表达重组MBSP的检测。
[1]TOYOHARA H,SAKATA T,YAMASHITA K,et al.Degradation of oval-filefish meat gel caused by myofibrillar proteinase(s)[J].Journal of Food Science,1990,52(2):364-368.
[2]ZHONG C,CAI Q F,LIU G M,et al.Purification and characterisation of cathepsin L from the skeletal muscle of blue scad(Decapterus maruadsi) and comparison of its role with myofibril-bound serine proteinase in the degradation of myofibrillar proteins[J].Food Chemistry,2012,133(4):1560-1568.
[3]QIU C J,XIA W S,JIANG Q X.Effect of high hydrostatic pressure(HHP) on myofibril-bound serine proteinases and myofibrillar protein in silver carp(Hypophthalmichthys molitrix)[J].Food research International,2013,52(1):199-205.
[4]OSATAOMI K,SASAI H,CAI M J,et al.Purification and characterization of myofibril-bound serine proteinase (MBSP) from carp Cyprinus carpio ordinary muscle[J].Comparative Biochemistry and Physiology.Part B:Biochemistry and Molecular Biology,1997,116(2):183-190.
[5]CAO M J,OSATOMI K,HARA K,et al.Identification of a myofibril-bound serine proteinase (MBSP) in the skeletal muscle of lizard fish Saurida wanieso which specifically cleaves the arginine site[J].Comparative Biochemistry and Physiology.Part B:Biochemistry and Molecular Biology,2000,125(2):155-264.
[6]OHKUBO M,MIYAGAWA K,OSATOMI K,et al.Purification and characterization of myofibril-bound serine protease from lizard fish (Saurida undosquamis) muscle[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2004,137:139-150.
[7]CAO M J,WU L L,HARA K,et al.Purification and characterization of myofibril-bound serine proteinase from the skeletal muscle of silver carp[J].Journal of Food Biochemistry,2005,29(5):533-546.
[8]OHKUBO M,OSATOMI K,HARA K,et al.A novel type of myofibril-bound serine protease from white croaker(Argyrosomus argentatus)[J].Comparative Biochemistry and Physiology.Part B:Biochemistry and Molecular Biology,2005,141(2):231-236.
[9]GUO C,CAO M J,LIU G M,et al.Purification,characterization,and cDNA cloning of a myofibril-bound serine proteinase from the skeletal muscle of crucian carp (Carassius auratus) [J].Journal of Agricultural and Food Chemistry,2007,55 (4):1510-1516.
[10]CAO M J,OSATOMI K,PANGKEY H,et al.Cleavage specificity of a myofibril-bound serine proteinase from carp(Cyprinus carpio) muscle[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,1999,123:399-405.
[11]DU Cuihong,CAO Minjie.Progress in research on myofibril-bound serine protease from fish[J].Food Science,2013,34(9):336-339(in Chinese).
[12]GUO C,LIANG Y L,LIU G M,et al.Molecular cloning of a myofibril-bound serine proteinase (MBSP) from common carp(Cyprinus carpio) muscle[J].Journal of Fisheries of China,2007,31(4):423-430.
[13]LIU Xizhi,QIU Xiaoyan,CAI Qiufeng,et al.Purification and characterization of pepsinogens and pepsins from banded grouper(Epinephelus awoara)[J].Journal of Fisheries of China,2011,35(11):1736-1744(in Chinese).
[14]RUAN M M,WU J M.Trypsin immobilized in sol-gel for high-throughput protein peptide mapping[J].Chin J Anal Chem,2006,34(12):1707-1710.
[15]GADGIL H S,BONDARENKO P V,PIPES G D,et al.Identification of cysteinylation of a free cysteine in the Fab region of a recombinant monoclonal IgG1 antibody using Lys-C limited proteolysis coupled with LC/MS analysis[J].Anal Biochem,2006,355(2):165-174.
[16]YE X,ZHANG L L,TIAN Y Y,et al.Identification and expression analysis of the g-type and c-type lysozymes in grass carp Ctenopharyngodon idellus[J].2010,34(5):501-509.
[17]LOO G H,SUTTON D L,SCHULLER K A.Cloning and functional characterisation of a peroxiredoxin 1(NKEF A)cDNA from Atlantic salmon (Salmo salar) and its expression in fish infected with Neoparamoeba perurans[J].Fish and Shellfish Immunology,2012,32(6):1074-1082.
[18]LIU Z Y,WANG Y,LU G D,et al.Cloning,sequencing and prokaryotic expression of cDNAs for antifreeze protein family from beetle Tenebrio molitor[J].Frontiers of Biology in China,2006,28(12):1532-1540.
欧盟拟设定谷氨酸盐食品添加剂限额
2017年7月12日,欧洲食品安全局发表声明说,该机构对谷氨酸和谷氨酸盐的安全性进行了重新评估,认为消费者摄入这类食品添加剂的最大限额为每天每公斤体质量30毫克。
在欧盟,谷氨酸和谷氨酸盐被允许作为食品添加剂使用,以提高食物的鲜味。目前欧盟批准食品中添加谷氨酸盐的质量分数最高水平为10 g/kg。
欧洲食品安全局说,为保护消费者安全,该机构对谷氨酸、谷氨酸钠、谷氨酸钾、谷氨酸钙、谷氨酸铵以及谷氨酸镁这些食品添加剂的每日允许摄入量进行了分析。根据对动物进行的毒性试验,提出了不会产生不良反应的最高剂量标准。谷氨酸盐可能给人带来的不良反应包括头疼、血压增高以及胰岛素水平增加等。
据介绍,欧洲食品安全局提出的这个标准还只是一个建议,将递交给欧盟委员会以及欧盟各成员国负责食品监管的机构和人士。
谷氨酸是一种氨基酸,西红柿、酱油以及某些奶酪等食品中存在天然形式的谷氨酸盐。在食品工业上,谷氨酸及谷氨酸盐常被用作食品添加剂,如味精的主要成分是谷氨酸钠,谷氨酸钙可以保证食物鲜味的同时降低含盐量。
[信息来源]厦门WTO工作站.欧盟拟设定谷氨酸盐食品添加剂限额 [EB/OL].(2017-7-13).http://www.xmtbt-sps.gov.cn/detail.asp?id=54854
Prokaryotic Expression,Purification of Myofibril-Bound Serine Proteinase from Crucian Carp(Carassius auratus) and Preparation of Its Polyclonal Antibody
LI Ting1,2, LI Huan1,2, CHEN Haiying1,2, DU Cuihong*1,2
(1.College ofFood and BiologicalEngineering,JimeiUniversity,Xiamen 361021,China;2.Engineering Research Center for Aquatic Products Processing of Fujian Province,Xiamen,361021,China)
An E.coli expression strain Rosetta (pET-28a-MBSP) of myofibril-bound serine proteinase(MBSP) from crucian carp(Carassius auratus) was constructed.The recombinant MBSP(rMBSP) was expressed and purified in order to prepare its polyclonal antibody,which would lay a foundation for further studies on the MBSP.The MBSP gene was transformed into Rosetta by sub-cloning it into pET-28a vector to construct the strain Rosetta(pET-28a-MBSP).The recombinant strain was induced to express MBSP by lactose.The recombinant protein was purified by Ni-NTA agarose affinity column chromatography,MALDI-TOF-MS identification,and then use as theantigen to immune the rabbits to prepare polyclonal antibody.Antibody titer was assayed by ELISA and specificity was detected by western blot.SDS-PAGE,western blot and MALDI-TOF-MS analysis showed that the recombinant protein was the recombinant MBSP (rMBSP)with molecular weight of approximately 28 ×103,which was similar to native MBSP from the skeletal muscle of crucian carp.And the rMBSP was expressed in prokaryotic expression system in mainly inclusion body.The serum with a high titer and specificity was obtained from immunized rabbit.The recombinant MBSP was expressed and purified successfully.The MBSP's polyclonal antibody with a high titer and specificity was obtained by immunization using the purified MBSP.
myofibril-bound serine proteinase,prokaryotic expression,protein purification,western blot,polyclonal antibody
Q 78
A
1673—1689(2017)08—0877—07
10.3969/j.issn. 1673-1689.2017.08.014
2015-07-03
福建省自然科学基金项目(2010J01212);厦门市海洋渔业局项目(14CZP03HJ04)。
*通信作者:杜翠红(1967—),女,江西临汾人,理学博士,教授,硕士研究生导师,主要从事分子生物学研究。E-mail:cuihongdu@jmu.edu.cn
李婷,李欢,陈海英,等.鲫鱼MBSP的原核表达、纯化及其多克隆抗体制备[J].食品与生物技术学报,2017,36(08):877-883.

