MTH1抑制剂TH588对人乳腺癌细胞增殖及相关蛋白表达的影响
李 璐,张 配,赵素容,李其响,潘 琼,王先知,王仲崑,刘 浩
(蚌埠医学院药学院,安徽省生化药物工程技术研究中心,蚌埠 233030;*通讯作者,E-mail:liuhao6886@foxmail.com)
MTH1抑制剂TH588对人乳腺癌细胞增殖及相关蛋白表达的影响
李 璐,张 配,赵素容,李其响,潘 琼,王先知,王仲崑,刘 浩*
(蚌埠医学院药学院,安徽省生化药物工程技术研究中心,蚌埠 233030;*通讯作者,E-mail:liuhao6886@foxmail.com)
目的 观察MTH1抑制剂TH588对人乳腺癌MCF-7及MDA-MB-231细胞增殖的影响,探讨其作用机制。 方法 MTT法检测不同浓度的TH588(0,8,16,32,64,128 μmol/L)对乳腺癌MCF-7及MDA-MB-231细胞增殖的抑制作用,倒置显微镜观察TH588处理乳腺癌MCF-7及MDA-MB-231细胞后细胞形态学变化。集落克隆形成抑制实验观察不同浓度的TH588(0,3.2,6.4,12.8 μmol/L)对乳腺癌MCF-7及MDA-MB-231细胞增殖的抑制作用。PI单染流式细胞术检测不同浓度TH588(0,32,64,128 μmol/L)对乳腺癌MCF-7及MDA-MB-231细胞死亡的影响,Western blot检测凋亡相关蛋白Bcl-2、Bax的表达。 结果 在128 μmol/L的TH588作用下,MCF-7细胞24,48,72 h的存活率分别为(67.32±4.34)%、(56.81±0.93)%和(30.86±1.46)%,MDA-MB-231细胞24,48,72 h的存活率分别为(63.35±0.49)%、(41.11±0.75)%和(29.15±0.85)%,与对照组(0 μmol/L)比较,细胞的存活率明显降低(P<0.05)。在倒置显微镜下可观察到TH588作用于乳腺癌细胞后,细胞数目明显减少,细胞形态发生改变,细胞皱缩,有细胞碎片及颗粒物质形成,细胞边缘不清晰。集落克隆实验结果表明,TH588对乳腺癌MCF-7和MDA-MB-231细胞有明显的增殖抑制作用。PI结果显示,128 μmol/L TH588处理MCF-7细胞和MDA-MB-231细胞48 h,细胞死亡率分别为52.8%和55.6%,与对照组相比细胞死亡率明显增高(P<0.05)。Western blot结果显示,TH588可下调Bcl-2蛋白的表达,并上调Bax蛋白的表达。 结论 TH588对乳腺癌MCF-7和MDA-MB-231细胞有明显的增殖抑制作用,其机制可能是TH588抑制了MTH1的修复作用,激活Bax和抑制Bcl-2,从而引起乳腺癌细胞的凋亡。
乳腺癌; TH588; MTH1; 活性氧
乳腺癌是威胁女性健康与生活质量最常见的恶性肿瘤之一。肿瘤流行病学数据显示,2012年全球新确诊乳腺癌167万例,死亡52万例[1]。近年来,我国乳腺癌发病增长速度超全球2倍,成为女性发病率最高的癌症[2]。
目前乳腺癌靶向药物治疗主要是针对特定的致癌基因及其相关通路进行治疗的,由于基因的多态性和肿瘤内部高度的异质性,以及基因相互作用网络的复杂性,针对致癌基因以及缺陷基因的治疗效果受到较大的限制。2014年提出了“cancer phenotypic lethality”的概念,即由于肿瘤细胞的共性,某些途径的功能性蛋白成为肿瘤细胞所必需的,并在肿瘤细胞中高表达。而在正常细胞中,由于非必需而表达量低甚至不表达。因此针对此种途径进行的治疗,对肿瘤细胞有效而对正常细胞影响较小,并且与肿瘤的基因型和肿瘤异质性无关,具有广泛的应用前景[3]。
MTH1基因是维持肿瘤增殖、存活以及促进肿瘤转移的关键基因,在多种肿瘤细胞中都有高表达[4-6]。MTH1酶能够保护肿瘤细胞,修复活性氧(reactive oxygen species,ROS)造成的损伤[7],而ROS在多种肿瘤中具有较高的水平[8,9]。而MTH1对于正常细胞是非必需的[10]。MTH1可能是不同类型的癌症细胞存活所必需的,对MTH1途径进行抑制,极有可能是治疗乳腺癌的新方向。本研究旨在观察MTH1抑制剂TH588对不同乳腺癌细胞的增殖抑制作用,探究其作用机制。
1 材料与方法
1.1 细胞株及主要试剂
人乳腺癌细胞株MCF-7和MDA-MB-231,购自中国科院上海生物细胞研究所,蚌埠医学院生化药理研究室冻存。DMEM培养基、胰蛋白酶、胎牛血清购自美国Gibco公司,噻唑蓝(MTT)、二甲基亚砜(DMSO)、碘化丙啶(PI)购自美国Sigma公司,Bcl-2、Bax、β-actin抗体购自英国Abcam公司,TH588购于美国Selleck公司。
1.2 细胞培养
乳腺癌MCF-7和MDA-MB-231细胞培养于含10%胎牛血清、100 U/ml青霉素、100 mg/L链霉素的DMEM培养基中,37 ℃、饱和湿度、5% CO2培养。
1.3 MTT法检测细胞增殖
取对数生长期的MCF-7细胞和MDA-MB-231细胞,用0.25%胰蛋白酶消化,制备成单细胞悬液,每孔加100 μl含有MCF-7(5×103/孔)和MDA-MB-231(1×104/孔)细胞的培养液接种于96孔板,在培养箱培养24 h,待细胞充分贴壁,弃去每孔的培养液,加入含有不同浓度(0,8,16,32,64,128 μmol/L)的TH588的培养液,设置调零孔,每组设5个复孔,分别培养24,48,72 h,每孔加入15 μl MTT溶液,继续培养4 h,弃上清液,每孔加入150 μl DMSO,37 ℃温箱孵育30 min,酶标仪测定490 nm波长下各孔的吸光度(OD)值,计算细胞的存活率:细胞存活率(%)=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。
1.4 倒置显微镜观察细胞形态
将对数生长期的乳腺癌细胞制成单细胞悬液,以5×105/孔的密度接种MCF-7和MDA-MB-231细胞于6孔板中。将细胞放在培养箱中培养24 h,加入不同浓度梯度的TH588,作用48 h用倒置显微镜观察乳腺癌细胞形态。
1.5 集落克隆形成抑制实验

1.6 PI单染检测细胞死亡率

1.7 Western blot检测蛋白表达
将乳腺癌MCF-7和MDA-MB-231细胞接种于60 mm培养皿中,每个培养皿加入3 ml含有7×105个MCF-7和MDA-MB-231细胞的新鲜培养液,在培养箱中培养24 h,更换含有不同浓度(0,32,64,128 μmol/L)TH588的培养液,继续培养24 h,收集细胞。加入适量预冷的RIPA蛋白裂解液,冰上裂解30 min,提取细胞总蛋白。BCA蛋白定量法(参照试剂盒说明书操作)测定各组蛋白浓度。用细胞裂解液将各组蛋白稀释至等浓度,与2×上样缓冲液1 ∶1混合,95 ℃煮沸5 min使蛋白变性。每组取40 μg蛋白进行12% SDS-PAGE电泳,转膜至PVDF膜,5%脱脂牛奶室温封闭2 h,TPBS洗膜3次,一抗4 ℃过夜,TPBS洗膜3次;二抗室温孵育2 h,TPBS洗膜3次,ECL试剂盒显影,Bio-Rad凝胶成像系统对膜进行曝光获取图像。
1.8 统计学分析
采用SPSS16.0软件对实验结果进行分析,实验数据均以均数±标准差表示,各组间差异采用单因素方差分析和LSD检验比较组间差异,P<0.05为差异有统计学意义。
2 结果
2.1 TH588对乳腺癌MCF-7和MDA-MB-231细胞的增殖抑制作用
MTT检测结果表明,随着TH588浓度的增加和作用时间的延长,TH588对人乳腺癌细胞MCF-7和MDA-MB-231细胞的增殖抑制作用增加(见图1)。128 μmol/L的TH588处理乳腺癌细胞24,48,72 h,MCF-7细胞的存活率分别为(67.32±4.34)%,(56.81±0.93)%和(30.86±1.46)%,MDA-MB-231细胞的存活率分别为(63.35±0.49)%,(41.11±0.75)%和(29.15±0.85)%,与对照组比较均具有统计学差异(P<0.05)。

同时点与0 μmol/L比较,*P<0.05图1 TH588对MCF-7和MAD-MB-231细胞存活率的影响Figure 1 Changes of the viability of MCF-7 and MDA-MB-231 cells after treated with TH588 for different time
2.2 TH588对乳腺癌细胞形态的影响
不同浓度的TH588作用于乳腺癌MCF-7和MDA-MB-231细胞48 h,在镜下可见,对照组细胞贴壁生长旺盛,细胞间链接紧密,细胞呈圆形,胞膜清楚,胞质饱满,实验组细胞密度减低,悬浮细胞增多,细胞间隙增宽,细胞皱缩,有细胞碎片及颗粒物质形成,细胞边缘不清晰,失去了正常细胞形态(见图2)。
2.3 TH588对乳腺癌细胞集落克隆形成的抑制作用
为了进一步观察TH588对乳腺癌MCF-7和MDA-MB-231细胞增殖的抑制作用,实验中用3.2,6.4,12.8 μmol/L的TH588作用于两株细胞。结果表明,与对照组比较TH588在较低浓度即可抑制乳腺癌MCF-7(图3A)和MDA-MB-231(图3B)细胞集落克隆的形成,并随着浓度增加克隆数目逐渐减少(见图3)。
2.4 PI单染实验检测细胞的死亡率
PI单染结果显示,32,64,128 μmol/L TH588作用于乳腺癌细胞48 h,与对照组比较,MCF-7和MDA-MB-231细胞的死亡率明显增加(见图4),128 μmol/L的TH588作用于两株细胞,MCF-7的死亡率达到52.8%,MDA-MB-231的死亡率达到55.6%,与对照组(MCF-7 1.9%,MDA-MB-231 2.3%)相比,细胞死亡率明显增加,差异均具有统计学意义(P<0.05)。

图2 TH588对MCF-7和MDA-MB-231细胞形态的影响Figure 2 Effects of TH588 on the morphology of MCF-7 and MDA-MB-231 cells
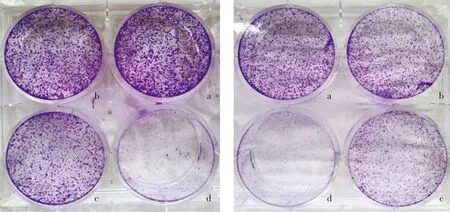
A.MCF-7细胞 B.MDA-MB-231细胞a.0 μmol/L TH588;b.3.2 μmol/L TH588;c.6.4 μmol/L TH588;d.12.8 μmol/L TH588图3 TH588对乳腺癌MCF-7和MDA-MB-231细胞的集落抑制作用Figure 3 TH588 inhibits colony formation in breast cancer MCF-7 and MDA-MB-231 cells
2.5 Western blot检测相关凋亡蛋白的表达
Western blot结果表明,32,64,128 μmol/L TH588作用于乳腺癌MCF-7和MDA-MB-231细胞24 h,Bcl-2蛋白的表达明显下降,而Bax蛋白的表达增加(见图5)。
3 讨论
TH588属于nudix水解酶家族抑制剂,能选择性地参与抑制MTH1的蛋白表达。MTH1基因定位于人第7号染色体p22上[11],可以保护DNA免受氧自由基(ROS)的损伤,对肿瘤细胞的生存是非常重要的[12]。包括乳腺癌在内的多种肿瘤组织的发生发展过程中均出现了MTH1蛋白的异常表达,如胃癌[13]、结肠癌[14]、肺癌[15]及卵巢癌[16]等,MTH1在上述肿瘤组织中均参与了保护肿瘤细胞DNA增殖、凋亡、迁移的过程。
由于肿瘤具有高度的异质性,基因表型不一致,目前临床上适用于靶向药物的人群较少。MTH1基因是维持肿瘤细胞生存所必需的,且对于正常细胞的作用较为局限,所以通过药物抑制MTH1基因的表达既能起到抑制肿瘤细胞增殖的作用,而对正常的细胞损伤很小,对多数肿瘤的治疗具有适用性。故MTH1基因是一个较为理想的治疗靶点。本研究证实,MTH1抑制剂TH588对乳腺癌细胞具有明显的增殖抑制和诱导凋亡的作用,克服了肿瘤基因表型异质性带来的靶向治疗的困境,对“三阴性”乳腺癌MDA-MB-231细胞的增殖抑制作用仍较明显。

图4 TH588对MCF-7和MDA-MB-231细胞死亡的影响Figure 4 Effects of TH588 on death of MCF-7 and MDA-MB-231 cells

图5 TH588对MCF-7和MDA-MB-231细胞蛋白表达的影响Figure 5 Effects of TH588 on protein expression of MCF-7 and MDA-MB-231 cells
细胞凋亡是由基因控制的细胞自主的有序的死亡形式,是多基因严格控制的过程,这些基因包括如抑癌基因p53、caspase家族、Bcl-2家族等。Bcl-2家族有众多成员,如Mcl-1、NR-B、A1、Bcl-w、Bcl-x、Bax、Bak、Bad、Bim等[17]。Bcl-2属于促细胞存活的蛋白,生理功能是能够抑制多种类型的细胞凋亡,延长细胞寿命,其中也包括肿瘤细胞,Bcl-2通过阻止线粒体细胞色素C的释放而发挥抗凋亡作用。Bcl-2家族中被研究最广泛的Bax具有促进细胞凋亡的作用,当诱导凋亡时,Bax从胞液迁移到线粒体和核膜。Bax激活也可直接或间接地钝化抑制凋亡的Bcl-2蛋白[18]。本研究通过Western blot法检测Bcl-2和Bax蛋白的表达,随着TH588浓度的增加,乳腺癌MCF-7和MDA-MB-231细胞Bax的表达增多,Bcl-2蛋白表达减少,推测可能当MTH1被TH588抑制后,ROS在肿瘤细胞内积聚,ROS激活Bax蛋白的表达,下调Bcl-2蛋白,参与促进乳腺癌细胞凋亡的过程,从而导致肿瘤细胞的增殖抑制和死亡。
综上所述,本实验证明了MTH1的抑制剂TH588可以明显地抑制乳腺癌MCF-7和MDA-MB-231细胞的生长,具有抗肿瘤作用,其机制可能是TH588抑制MTH1后,肿瘤细胞内异常的能量代谢产生的ROS激活Bax蛋白和抑制Bcl-2蛋白的表达,从而导致肿瘤细胞的增殖抑制和死亡。
[1] Ferlay J, Soerjomataram I, Dikshit R,etal. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5):E359-386.
[2] Fan L, Strasserweippl K, Li JJ,etal. Breast cancer in China[J]. Lancet Oncol, 2014, 15(7):e279-289.
[3] Wang JY, Jin L, Yan XG,etal. Reactive oxygen species dictate the apoptotic response of melanoma cells to TH588[J]. J Invest Dermatol, 2016, 136(11):2277-2286.
[4] Patel A, Burton DG, Halvorsen K,etal. MutT Homolog 1 (MTH1) maintains multiple KRAS-driven pro-malignant pathways[J]. Oncogene, 2015, 34(20):2586-2596.
[5] Speina E, Arczewska KD, Gackowski D,etal. Contribution of hMTH1 to the maintenance of 8-oxoguanine levels in lung DNA of non-small-cell lung cancer patients[J]. J Natl Cancer Inst, 2005, 97(5):384-395.
[6] Borrego S, Vazquez A, Dasí F,etal. Oxidative stress and DNA damage in human gastric carcinoma: 8-Oxo-7′8-dihydro-2′-deoxyguanosine (8-oxo-dG) as a possible tumor marker[J]. Int J Mol Sci, 2013, 14(2):3467-3486.
[7] Gad H, Koolmeister T, Jemth AS,etal. Corrigendum: MTH1 inhibition eradicates cancer by preventing sanitation of the dNTP pool[J]. Nature, 2017, 544(7651):508.
[8] Kim HS, Jung G. Notch1 increases Snail expression under high reactive oxygen species conditions in hepatocellular carcinoma cells[J]. Free Radic Res, 2014, 48(7):806-813.
[9] Yiping Q, Siwen D, Peng H. Gene methylation in gastric cancer[J]. Clin Chim Acta, 2013, 424:53-65.
[10] Tsuzuki T, Egashira A, Kura S. Analysis of MTH1, gene function in mice with targeted mutagenesis[J]. Mutat Res, 2001, 477(1-2):71-78.
[11] Sakai Y, Oda H, Yoshimura D,etal. The GT to GC single nucleotide polymorphism at the beginning of an alternative exon2C of human MTH1 gene confers an amino terminal extension that functions as a mitochondrial targeting signal[J]. J Mol Med (Berl), 2006, 84(8):660-670.
[12] Rai P. Oxidation in the nucleotide pool, the DNA damage responseand cellular senescence: Defective bricks build adefectivehouse[J]. Mutat Res, 2010, 703(1):71-81.
[13] Borrego S, Vazquez A, Dasi F,etal. Oxidative stress and DNA damage in human gastric carcinoma: 8-Oxo-7′8-dihydro-2′-deoxyguanosine (8-oxo-dG) as a possible tumor marker[J]. Int J Mol Sci, 2013, 14(2)3467-3486.
[14] Qiu Y, Zhang H, Sun LH,etal. Hypoxia-inducible factor-1modulates upregulation of mutT homolog-1 in colorectalcancer[J]. World J Gastroenterol, 2015, 21(48):13447-13456.
[15] Niu Y, Pan D, Shi D,etal. Influence of chirality of crizotinib onIts MTH1 protein inhibitory activity: insight from molecular dynamics simulations and binding free energy calculations[J]. PLoS One, 2015, 10(12):e0145219.
[16] Tao G, Gu S, Liu F,etal. Investigation of MTH1 activity via, mismatch-based DNA chain elongation[J]. Analytica Chimica Acta, 2016, 905:66-71..
[17] Jung JI, Chung E, Mi RS,etal. Isoliquiritigenin (ISL) inhibits ErbB3 signaling in prostate cancer cells[J]. Biofactors, 2006, 28(3-4):159-168.
[18] Rosse T, Olivier R, Monney L,etal. Bcl-2 prolongs cell survival after Bax-induced release of cytochrome c.[J]. Nature, 1998, 391(6666):496-499.
LI Lu, ZHANG Pei, ZHAO Surong, LI Qixiang, PAN Qiong, WANG Xianzhi, WANG Zhongkun, LIU Hao*
(SchoolofPharmacy,BengbuMedicalCollege,AnhuiEngineeringTechnologyResearchCenterofBiochemicalPharmaceuticals,Bengbu233030,China;*Correspondingauthor,E-mail:liuhao6886@foxmail.com)
ObjectiveTo investigate the effect of MTH1 inhibitor TH588 on the proliferation of human breast cancer cells and explore its possible mechanism.MethodsMTT assay was used to detect the viability of breast cancer MCF-7 cells and MDA-MB-231 cells after exposed to different concentrations(0, 8, 16, 32, 64, 128 μmol/L) of TH588, and the morphological changes of MCF-7 and MDA-MB-231 cells were observed under inverted microscope. The colony formation assay was used to detect the viability of breast cancer MCF-7 cells and MDA-MB-231 cells after exposed to different concentrations(0, 3.2, 6.4, 12.8 μmol/L) of TH588. After the breast cancer MCF-7 cells and MDA-MB-231 cells were treated with different concentrations of TH588(0, 32, 64, 128 μmol/L), the cell death rate was analyzed by flow cytometry with PI staining, and the expression of Bcl-2 and Bax protein was analyzed by Western blot.ResultsThe MCF-7 cells survival rates were (67.32±4.34)%,(56.81±0.93)% and(30.86±1.46)% after exposed to 128 μmol/L TH588 for 24, 48, 72 h,respectively, and the MDA-MB-231 cells survival rates were (63.35 ± 0.49)%, (41.11 ± 0.75)% and (29.15 ± 0.85)%, respectively. Compared with control group(0 μmol/L), the survival rates of MCF-7 cells and MDA-MB-231 cells were significantly decreased(P<0.05). Under inverted microscope, the numbers of breast cancer MCF-7 cells and MDA-MB-231 cells were significantly reduced after treated with TH588, cell morphology changed, cells were shrinked, cells debris and particulate matter formation appeared, and the cell edges were not clear. PI staining results showed that the mortalities of MCF-7 cells and MDA-MB-231 cells treated with 128 μmol/L TH588 for 48 h were 52.8% and 55.6%, which were significantly higher than those treated with 0 μmol/L TH588(P<0.05). The results of Western blot showed that TH588 down-regulated the expression of anti-apoptotic protein Bcl-2, and up-regulated the expression of proapoptotic protein Bax in MCF-7 cells and MDA-MB-231 cells.ConclusionTH588 may cause apoptosis of breast cancer cells by inhibiting the repair of MTH1,activating Bax and inhibiting Bcl-2.
breast cancer; TH588; MTH1; reactive oxygen species
R737.9
A
1007-6611(2017)10-1013-06
10.13753/j.issn.1007-6611.2017.10.008
国家自然科学基金资助项目(81372899,81603155);安徽省高等学校省级自然科学研究项目重大项目(KJ2016SD39);安徽省国际合作交流项目(1503062024);安徽省高校自然科学研究重点项目(KJ2016A486)
李璐,女,1986-09生,在读硕士,E-mail:408988394@qq.com
2017-07-18
EffectsofMTH1inhibitorTH588onproliferationandrelatedproteinsexpressioninhumanbreastcancercells

