苯选择性加氢Ru/TiO2催化剂载体晶型效应研究
王磊济,费兆阳,陈 献,汤吉海,崔咪芬,乔 旭
1.南京工业大学材料化学工程国家重点实验室,江苏 南京 210009;2.南京工业大学化工学院,江苏 南京 210009
苯选择性加氢Ru/TiO2催化剂载体晶型效应研究
王磊济1,2,费兆阳1,2,陈 献2,汤吉海2,崔咪芬2,乔 旭1,2
1.南京工业大学材料化学工程国家重点实验室,江苏 南京 210009;2.南京工业大学化工学院,江苏 南京 210009
以不同晶型的TiO2为载体采用化学还原浸渍法制备了三种Ru/TiO2催化剂,并利用X射线衍射(XRD)、N2吸附-脱附、透射电镜(TEM)、NH3程序升温脱附(NH3-TPD)和傅里叶变换红外光谱(FTIR)等表征手段研究了催化剂的物理化学性质,考察了其在苯选择性加氢反应中的催化性能。结果表明:苯选择性加氢活性与Ru/TiO2催化剂的Ru粒子分散度有关,Ru粒子分散度越高,催化活性越高;而环己烯选择性与Ru/TiO2催化剂的酸量呈负相关,Ru/TiO2-P催化剂的酸量最低,对环己烯的吸附量最低,在相同转化率下苯加氢生成环己烯的选择性最高。动力学分析表明,苯加氢生成环己烯的反应速率常数(k1)与环己烯加氢生成环己烷的反应速率常数(k2)的比值与环己烯收率呈近似正相关。
二氧化钛 晶型效应 酸性质 苯选择性加氢 环己烯
环己烯是一种重要的化工原料,相较于传统的环己醇脱水[1]、环己烷脱氢[2]和Birch还原[3]等环己烯生产路线,苯选择性加氢制环己烯具有原料价格便宜、原子经济以及操作简便等优势。然而从热力学角度,该路线难以获得高的环己烯收率[4]。为了获得高环己烯收率,需从动力学条件及催化剂角度考虑[5]。目前主要形成了以Ru为活性组分的“气相-有机相-水相-固相”四相反应体系[6-8]。在高速搅拌下,水是连续相,Ru基催化剂和苯液滴均匀混合于整个反应体系中。利用苯和环己烯在水中溶解度的差异性,可相对提高催化剂表面苯的浓度,降低催化剂表面环己烯的浓度。另外,苯和环己烯分子可吸附在催化剂的酸性位,通过与溢流氢反应生成最终产品[9,10]。Appay等[11]发现在 Pt/ZrO2-SO4催化剂的酸性位上,环己烯加氢速度比苯的加氢速度快,这表明酸性位更有利于环己烯的加氢。Zhou等[12]已对不同晶型ZrO2为载体的Ru/ZrO2催化剂进行研究,结果表明较低的Ru/ZrO2催化剂酸量有利于提高环己烯选择性。
本研究将采用化学还原浸渍法制备以不同晶型的 TiO2为载体的 Ru/TiO2催化剂,并对所制备的Ru/TiO2催化剂的物理化学性质进行表征,同时考察其在苯选择性加氢反应中的催化性能。将结合动力学,以阐述影响环己烯选择性和收率关键所在。
1 实验部分
1.1 催化剂制备
采用化学还原浸渍法制备Ru/TiO2催化剂。称取1.0 g载体TiO2并加入20.0 mL去离子水,超声0.5 h,搅拌0.5 h,随后滴加3.0 mL RuCl3(0.40 mol/L)水溶液,于室温条件下搅拌3.5 h,滴加5.0 mLNaBH4(1.58 mol/L)和NaOH(0.158 mol/L)的混合溶液,室温静置1 h,用去离子水充分洗涤并储存于去离子水中。采用TiO2-R、TiO2-A和TiO2-P作为载体所得到的Ru/TiO2催化剂分别记为Ru/TiO2-R、Ru/TiO2-A和Ru/TiO2-P。
1.2 催化剂表征
利用日本Rigaku公司SarmtLab衍射仪进行X射线衍射(XRD)检测。在日本BEL公司BELSORP-II型吸附仪进行N2吸附-脱附测定催化剂的比表面积。在日本JEOL公司JEM-100型透射电子显微镜上进行透射电镜(TEM)测定。程序升温脱附(TPD)均是在美国Micomeritics公司AutoChem 2920仪器上进行检测的。环己烯-TPD的测试步骤如下:先将催化剂浸入环己烯中以饱和吸附,然后在N2气氛中50 ℃干燥过夜,将150 mg上述样品装入样品管中,以He为载气进行程序升温脱附,升温速率为10 ℃/min。傅里叶变换红外光谱(FTIR)是在ThemoNicolet公司iSO 50红外光谱仪上测试。
1.3 催化剂性能评价
在容积为50 mL的磁力搅拌式高压反应釜中进行苯选择性加氢反应,并在典型的反应条件下考察催化剂的性能。在反应釜中加入0.15 g催化剂,1.2 g的ZnSO4·7H2O,12.0 mL去离子水,6.0 mL苯。密闭后,用氮气置换两次以除去釜内空气,再用氢气置换五次,于3.0 MPa压力下加热。升温至140 ℃后,调节釜内压力至5.0 MPa,于1 200 r/min转速下搅拌,以消除扩散效应并开始计时。反应结束后快速降温,并采用气相色谱进行分析。
2 结果与讨论
2.1 载体及催化剂的表征
如图 1为各种 Ru/TiO2催化剂以及其载体的XRD 谱图。由图 1 可知,TiO2-A 在 25.3,38.6,48.0,55.1 °处出现对应锐钛矿相(101)、(112)、(200)及(211)晶面的衍射峰(JCPD 65-5714),TiO2-R 在 27.5,36.1,41.2,44.1,54.4,56.7 °处出现金红石相(110)、(101)、(111)、(210)、(211)及(220)晶面的衍射峰(JCPD 65-1118),而TiO2-P中同时出现两种晶相对应的衍射峰,这说明在TiO2-P中同时存在锐钛矿相和金红石相的TiO2,且金红石相所占的质量分数为7%(根据文献报道方法计算[13])。与载体相比,相应催化剂峰位置没有发生明显变化,且没有检测到Ru所对应的衍射峰,这表明各催化剂保持载体原有的晶型,且可以认为Ru晶粒尺寸很小,并高度分散在载体的表面。Ru/TiO2催化剂的物化参数见表1。

图1 催化剂及载体的XRD图谱Fig.1 XRD patterns of the catalysts and the supports

表1 Ru/TiO2催化剂的物理化学性质Table 1 Physicochemical property of the Ru/TiO2 catalysts

2.2 苯选择性加氢催化性能评价
图5为Ru/TiO2催化剂催化苯加氢反应结果。从图5可以看出,随着反应时间增加,产物环己烷的含量呈线性增加,而环己烯的含量则在某一个反应时间存在一个最大值。根据图5结果计算得到:对于Ru/TiO2-P催化剂,反应时间为42 min时,环己烯最高得率40%,所对应的苯转化率和环己烯选择性分别为75%和53%;对于Ru/TiO2-R催化剂,反应时间为27 min时,环己烯最高得率40%,所对应的转化率和选择性分别为86%和47%;对于Ru/TiO2-A催化剂,反应时间为26 min时,环己烯有最高的得率35%,所对应的转化率和选择性分别为83%和42%。
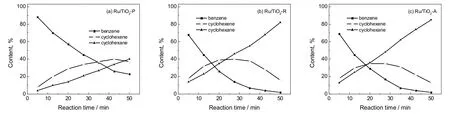
图5 Ru/TiO2催化剂催化苯加氢反应过程各物质浓度变化Fig.5 Concentration change of components in benzene hydrogenation over Ru/TiO2 catalysts
在此实验条件下,Ru/TiO2-R和Ru/TiO2-A催化剂的初始反应速率分别为29和28 mmol/(minˑg),而Ru/TiO2-P催化剂的初始反应速率较低,仅为11 mmol/(minˑg)。根据不同催化剂上Ru粒子分散度和初始反应速率计算得到相应苯转换频率(TOF),三组Ru/TiO2催化剂的TOF值相近(2.1~2.2),这表明不同的Ru/TiO2催化剂Ru活性位活化能力相近,Ru粒子尺寸对其催化活性影响不大。而Ru/TiO2-P催化剂的初始反应速率较低的原因是Ru粒子分散度较低,暴露的Ru原子量较少。
尽管Ru/TiO2-P催化剂的初始反应速率较低,但是其在相同转化率时选择性最高。Zhou等[12]考察了 ZrO2载体的晶型对苯选择性加氢催化性能的影响,发现较低的催化剂酸量有利于提高环己烯的选择性。Appay等[11]发现在Pt/ZrO2-SO4催化剂的酸性位上,环己烯加氢反应速率比苯加氢反应速率更高,这表明酸性位更有利于环己烯的加氢。Aboul-Gheit等[17]发现对于Pt/H-ZSM-5催化剂而言,增加催化剂表面酸量,将增强环己烯加氢活性。
将环己烯的选择性与催化剂的酸量进行关联,发现它们之间呈负相关,催化剂酸量越低,环己烯选择性越高。为了进一步理解其相关性,测试了催化剂的环己烯-程序升温脱附,如图 6所示。三组Ru/TiO2催化剂在 170 ℃处均有一个宽的脱附峰,表明环己烯在催化剂表面存在化学吸附。且Ru/TiO2-A、Ru/TiO2-R和 Ru/TiO2-P催化剂的吸附量分别为2.23,1.67,0.88 mmol C6H10/g-cat。这表明酸量越高,催化剂表面环己烯的吸附量越高。在反应过程中,较高的环己烯吸附量将增大其发生加氢的概率,所以环己烯的选择性较低。因此,较低的酸量有利于提高环己烯选择性。

图6 Ru/TiO2催化剂的环己烯-TPD图谱Fig.6 Cyclohexene temperature programmed desorption spectra of the Ru/TiO2 catalysts
由于苯选择性加氢是由苯加氢生成环己烯和环己烯加氢生成环己烷的串连反应,将实验数据拟合可得到如图7所示的结果。发现,苯浓度自然对数与反应时间呈线性相关,表明苯加氢生成环己烯为一级反应,而环己烯浓度与反应时间呈线性相关,表明环己烯加氢生成环己烷为零级反应。

由图7中直线的斜率得到:Ru/TiO2-P的k1和k2值分别为3.26×10-2min-1和0.74 mol/(Lˑmin),Ru/TiO2-A 为 7.32×10-2min-1和 1.76 mol/(Lˑmin),Ru/TiO2-R 为 7.41×10-2min-1和 1.67 mol/(Lˑmin)。
可见环己烯的收率由k1/k2值决定,Ru/TiO2-P的k1/k2值为4.41×10-2L/mol,Ru/TiO2-R的k1/k2值为4.43×10-2L/mol,Ru/TiO2-A的k1/k2值为4.16×10-2L/mol。由表3可知,Ru/TiO2-P、Ru/TiO2-R和Ru/TiO2-A催化剂的收率分别为40 %、40%和35%,将k1/k2值与环己烯的收率进行关联,得到了近似正相关关系。
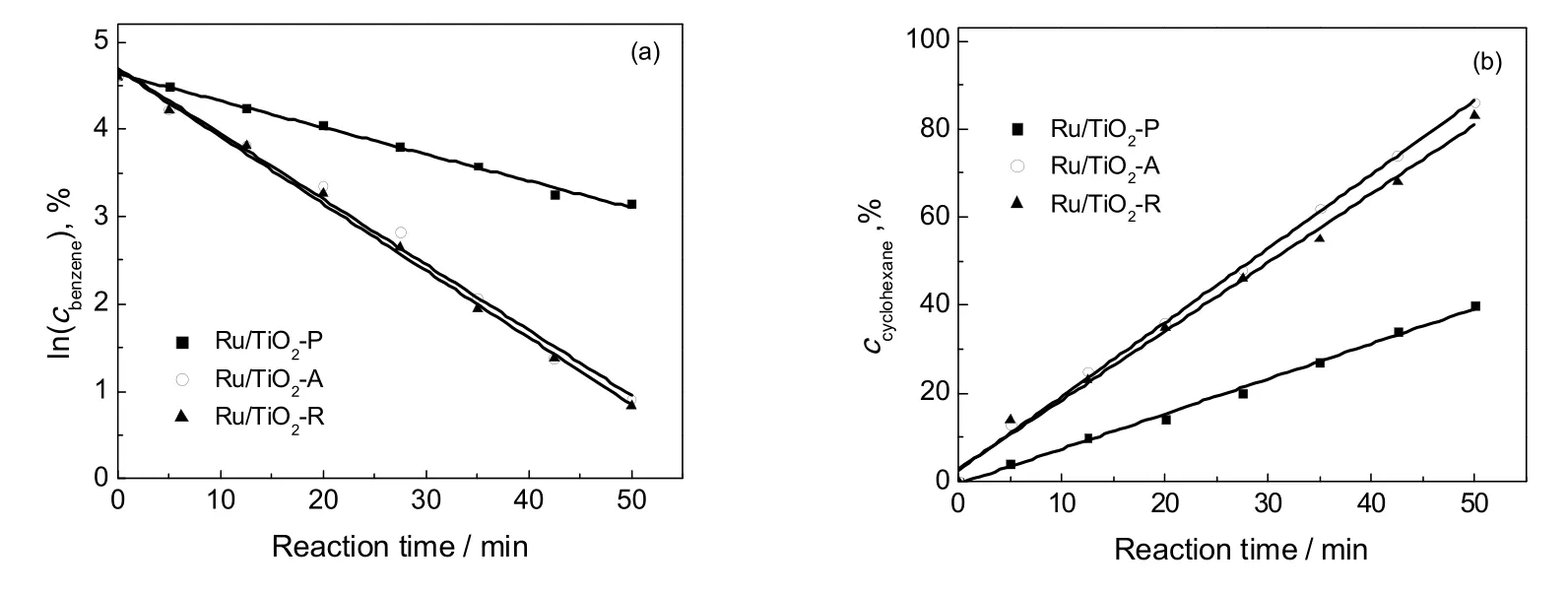
图7 苯浓度的自然对数(a)和环己烷浓度(b)分别与反应时间之间的关系Fig.7 The relationship between the concentration of benzene(a) cyclohexane(b) and the reaction time
3 结 论
载体的晶型对 Ru/TiO2催化苯选择性加氢性能有显著影响,Ru/TiO2催化剂在苯选择性加氢中的活性与其Ru粒子分散度有关,Ru粒子分散度越高,催化活性越高,但是不同Ru/TiO2催化剂具有相近的苯转换频率TOF值,这说明Ru活性位的活化能力相近,Ru粒子尺寸对其催化活性影响不大。而环己烯的选择性则与催化剂酸量呈负相关。动力学研究表明苯加氢生成环己烯为一级反应,环己烯加氢生成环己烷为零级反应。
[1]And N A, Savage P E. Kinetics and mechanism of cyclohexanol dehydration in high-temperature water [J]. Ind Eng Chem Res, 2001,40(8):1822-1831.
[2]Tavoularis G, Keane M A. Direct formation of cyclohexene via the gas phase catalytic dehydrohalogenation of cyclohexyl halides [J].App Catal A: Gen, 1999, 182(2):309-316.
[3]Feng H, Elam J W, Libera J A, et al. Oxidative dehydrogenation of cyclohexane over alumina-supported vanadium oxide nanoliths [J]. J Catal, 2010, 269(2):421-431.
[4]Suryawanshi P T, Mahajani V V. Liquid phase hydrogenation of benzene to cyclohexene using ruthenium-based heterogeneous catalyst[J]. J Chem Technol Biotechnol, 2015, 69(2):154-160.
[5]Foppa L, Dupont J. Benzene partial hydrogenation: advances and perspectives [J]. Chem Soc Rev, 2015, 44(7):1886-1897.
[6]孙海杰, 郭 伟, 周小莉, 等. 非晶态合金Ru基催化剂在苯选择加氢中的应用进展 [J]. 催化学报, 2011, 32(1):1-16.Sun Haijie, Guo Wei, Zhou Xiaoli, et al. Progress in Ru-based amorphous alloy catalysts for selective hydrogenation of benzene to cyclohexene [J]. Chinese Journal of Catalysis, 2011, 32(1):1-16.
[7]Liu J, Xu S, Bing W, et al. Cu-decorated Ru catalysts supported on layered double hydroxides for selective benzene hydrogenation to cyclohexene [J]. Chem Cat Chem, 2015, 7(5):846-855.
[8]何婷婷, 付庆涛, 刘晨光. ZrO2改性Ru-Zn-B/Al2O3催化剂的苯选择性加氢性能 [J]. 化学反应工程与工艺, 2014, 30(2):128-132.He Tingting, Fu Qingtao, Liu Chenguang. Performance of Ru-Zn-B/Al2O3catalyst modified with ZrO2for selective hydrogenation of benzene [J]. Chemical Reaction Engineering And Technology, 2014, 30(2):128-132.
[9]Simon L J, Ommen J G, Jentys A, et al. Sulfur tolerance of Pt/mordenites for benzene hydrogenation: Do Brønsted acid sites participate in hydrogenation [J]. Catal Today, 2002, 73(1-2):105-112.
[10]Lin S D, Vannice M A. Hydrogenation of aromatic hydrocarbons over supported Pt catalysts. I. benzene hydrogenation [J]. J Catal, 1993,143(2):539-553.
[11]Appay M D, Manoli J M, Potvin C, et al. High-resolution electron microscopic, spectroscopic, and catalytic studies of intentionally sulfided Pt/ZrO2–SO4catalysts [J]. J Catal, 2004, 222(2):419-428.
[12]Zhou G, Liu J, Tan X, et al. Effect of support acidity on liquid-phase hydrogenation of benzene to cyclohexene over Ru–B/ZrO2catalysts[J]. Ind Eng Chem Res, 2012, 51(38):12205-12213.
[13]And H Z, Banfield J F. Understanding polymorphic phase transformation behavior during growth of nanocrystalline aggregates: insights from TiO2[J]. J Phys Chem B, 2000, 104(15):3481-3487.
[14]Jie L, Xu S, Bing W, et al. Cu-Decorated Ru catalysts supported on layered double hydroxides for selective benzene hydrogenation to cyclohexene [J]. Chem Cat Chem, 2015, 7(5):846-855.
[15]Zhou G, Tan X, Pei Y, et al. Structural and catalytic properties of alkaline post-treated Ru/ZrO2catalysts for partial hydrogenation of benzene to cyclohexene [J]. Chem Cat Chem, 2013, 5(8):2425-2435.
[16]Chen C C, Hu S H, Fu Y P. Effects of surface hydroxyl group density on the photocatalytic activity of Fe3+-doped TiO2[J]. J Alloys Compd, 2015, 632:326-334.
[17]Aboul-Gheit A K, Aboul-Fotouh S M, Abdel-Hamid S M, et al. Hydroconversion of cyclohexene using H-ZSM-5 zeolite catalysts promoted via hydrochlorination and/or platinum incorporation [J]. J Mol Catal A: Chem, 2006, 245(1):167-177.
Study on the Crystalline of Ru/TiO2Catalyst for Selective Hydrogenation of Benzene
Wang Leiji1,2, Fei Zhaoyang1,2, Chen Xian2, Tang Jihai2, Cui Mifen2, Qiao Xu1,2
1. State Key Laboratory of Materials-Oriented Chemical Engineering, Nanjing Tech University, Nanjing 210009, China;2. College of Chemical Engineering, Nanjing Tech University, Nanjing 210009, China
Three types of Ru/TiO2catalysts were prepared by chemical reduction impregnation method with different crystal forms of TiO2. The catalysts were characterized by X-ray diffraction (XRD), N2adsorption-desorption, transmission electron microscopy (TEM), NH3-temperature programmed desorption(NH3-TPD) and Fourier transform infrared spectroscopy (FTIR) were used to study the physicochemical properties of the catalysts. The catalytic performances of Ru/TiO2catalysts in the selective hydrogenation of benzene to cyclohexene were also investigated. The results showed that the activity of benzene hydrogenation was related to the dispersion of Ru in the Ru/TiO2catalysts. The higher the dispersion of Ru was, the higher the catalytic activity was and the selectivity of cyclohexene was negatively correlated with the acid amounts of Ru/TiO2catalysts. The Ru/TiO2-P catalyst had the lowest acid content, the adsorption capacity of cyclohexene was the lowest, and the selectivity of cyclohexene was the highest at the same conversion rate. The kinetic analysis showed that the resultingk1/k2ratio of the rate constants of the benzene to cyclohexene step (k1) and the cyclohexene to cyclohexane step (k2) was approximately positively correlated with the yield of cyclohexene.
titania; effect of crystal phase; acid properties; selective hydrogenation of benzene; cyclohexene
O643.32
A
1001—7631 ( 2017 ) 03—0255—06
10.11730/j.issn.1001-7631.2017.03.0255.06
2017-04-27;
2017-06-06。
王磊济(1991—),男,硕士研究生;乔 旭(1962—),男,教授,通讯联系人。E-mail:qct@njtech.edu.cn。
国家自然科学基金(21306089);江苏高校优势学科建设工程资助项目(PAPD)。

