高精料日粮对奶牛瘤胃发酵和生物胺生成的影响
王东升,张露露
(1.上海光明荷斯坦牧业有限公司,上海 200436;2.北京中农榜样蛋鸡育种有限责任公司,北京 102100)
高精料日粮对奶牛瘤胃发酵和生物胺生成的影响
王东升1,张露露2
(1.上海光明荷斯坦牧业有限公司,上海 200436;2.北京中农榜样蛋鸡育种有限责任公司,北京 102100)
为研究饲喂高精料日粮条件下奶牛瘤胃发酵情况,选取4头初产的健康荷斯坦牛进行试验。试验结果显示,饲喂高精料日粮显著提高了奶牛瘤胃液中乳酸、总VFA、丁酸、戊酸和总支链VFA的含量,同时乙丙比显著降低,但未能显著降低乙酸和NH3-N水平;同时,与饲喂低精料日粮相比,饲喂高精料的奶牛瘤胃液中的生物胺含量显著增加(P<0.05)。相关性分析结果表明,瘤胃液pH与瘤胃液中生物胺含量呈显著负相关(P<0.05)。高精料日粮显著提高了瘤胃液中的乳酸杆菌数量(P<0.05),但对牛链球菌数量无显著影响(P>0.05)。结果表明,饲喂高精料改变了奶牛瘤胃的微生物菌群,进而影响了瘤胃的发酵参数,并促进消化道内异常代谢产物——生物胺的生成与转移,进而影响奶牛的健康。
精粗比;奶牛;瘤胃液;生物胺
瘤胃酸中毒是现代规模集约化养殖条件下的主要营养代谢疾病之一。虽然现在的普遍看法是,高精料日粮导致瘤胃pH过低是引起瘤胃酸中毒的主要因素,但其他微生物源的毒性因子,如乙醇、胺类和内毒素也在酸中毒发展过程中起着重要的作用[1,2]。在这些毒性因子中,生物胺如组胺、酪胺和色胺是由瘤胃中相应氨基酸的脱羧作用产生的。在这三种生物胺中,组胺由于其在蹄叶炎中的特殊作用而备受关注[3,4]。但目前人们对瘤胃液中酪胺、色胺、腐胺和甲胺的来源、产量和代谢的了解仍不充分。因此,本试验研究了高精料条件下奶牛瘤胃发酵参数、微生物菌群情况、生物胺变化情况,同时也评价了瘤胃液pH与生物胺含量的相关性。
1 材料与方法
1.1 试验设计
选用4头装有永久性瘘管的健康初产奶牛(初始体重为473.75±49.56kg,泌乳期60~140d),并随机进行2×2交叉试验设计,每个试验期21d。日粮满足或超过奶牛每天产20kg牛奶的能量要求(NRC, 2001),日饲喂2次(07:00,18:00),日粮组成见表1。在整个试验期,奶牛分栏饲养(剩料量在5%左右),并自由饮水。
1.2 瘤胃液样品及其分析
每期试验的第12、15、17天在采食前0h和采食后4h,第21天在采食前0h和采食后2、4、6、8、10、12h采集瘤胃内容物,经过4层纱布过滤后,立即测定pH。滤液保存在-20℃,以测定挥发性脂肪酸(VFA)、氨态氮(NH3-N)、乳酸和生物胺的含量。VFA采用Qin[5]建立的毛细管柱气相色谱法测定;NH3-N采用Weatherburn[6]建立的比色法进行测定;乳酸采用Barker等[7]建立的比色法测定;生物胺采用反相高效液相色谱法进行测定[8]。

表1 日粮原料组成和营养水平(干物质基础)
1.3 饲料样的化学分析
在试验期收集饲料原料,利用国标法测定DM、Ash、EE、NDF和ADF的含量。其中NFC的计算公式为:NFC=100-(%NDF+%CP+%Ash+%EE)。CP采用Krishnamoorthy等[9]建立的方法测定。
1.4 DNA的提取和乳酸菌、链球菌的测定
解冻的样品,利用吴惠芬等[10]建立的方法提取DNA,然后将得到的DNA样品保存在-20℃备用。
利用Real time PCR法测定乳酸菌和链球菌,引物见表2。Real Time PCR测定使用AB 7300系统和序列测定软件(version 1.3)。扩增反应程序:95℃ 10min、40个循环的95℃变性和60℃复性/延伸,而其溶解曲线的程序是:95℃ 15s、60℃ 1min、95℃ 15s、60℃15s。为评价每种引物的扩增效率,DNA模板(每个混合体系中50ng)被混合和序列稀释8倍。

表2 定量PCR所用引物
1.5 数据统计分析
利用SPSS18.0混合模型中的重复度量来分析瘤胃液pH、生物胺、NH3-N 和VFA的含量。
瘤胃液pH与瘤胃内、外周血液中和粪中生物胺浓度的相关性分析利用GraphPad Prism version 5.00的Pearson进行。P<0.05表示差异显著;P>0.05表示差异不显著。
2 结果
2.1 饲料的营养成分
与低精料日粮相比,高精料日粮的非纤维性碳水化合物含量更高,中性洗涤纤维含量更低(表1)。本研究中,高、低精料日粮的干物质、净能及可降解蛋白含量均可满足试验牛营养需要。
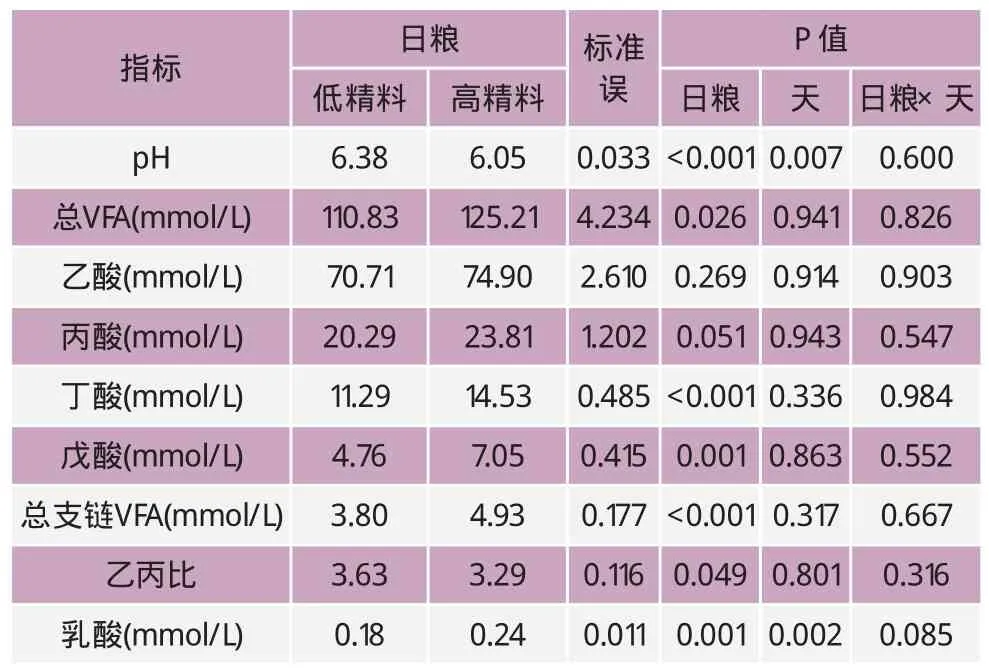
表3 瘤胃液中pH和VFA平均浓度
2.2 瘤胃液中pH和VFA的变化

图1 两个处理组pH、乙酸、丙酸、丁酸、戊酸、总VFA、乙丙比、总支链VFA和乳酸的浓度变化
在本研究中,饲喂低精料日粮奶牛的瘤胃pH与饲喂高精料的奶牛相比显著升高(P<0.05),而且瘤胃pH受采样时间点的影响显著(P<0.05)。在低精料组,瘤胃pH在饲喂后4h一直延续到采样结束都保持在5.8以上。另外,采样各天之间的数据表明:瘤胃pH受日粮和测量天的影响十分明显。而天内的数据表明:饲喂高精料和饲喂低精料日粮的奶牛相比,瘤胃中乳酸、丁酸、戊酸、总支链VFA和总VFA的含量明显增加(P<0.05),丙酸有增加的趋势(P=0.051),而乙酸没有显著性差异(P>0.05)。丙酸和丁酸在采食后4h和8h有显著性增加(P<0.05)。不仅总VFA,包括乙酸、丙酸、丁酸、戊酸和总支链VFA含量均不受采样天的影响,而且也不受采样天与日粮处理的相互作用的影响(表3)。
2.3 瘤胃液中生物胺和NH3-N浓度的变化
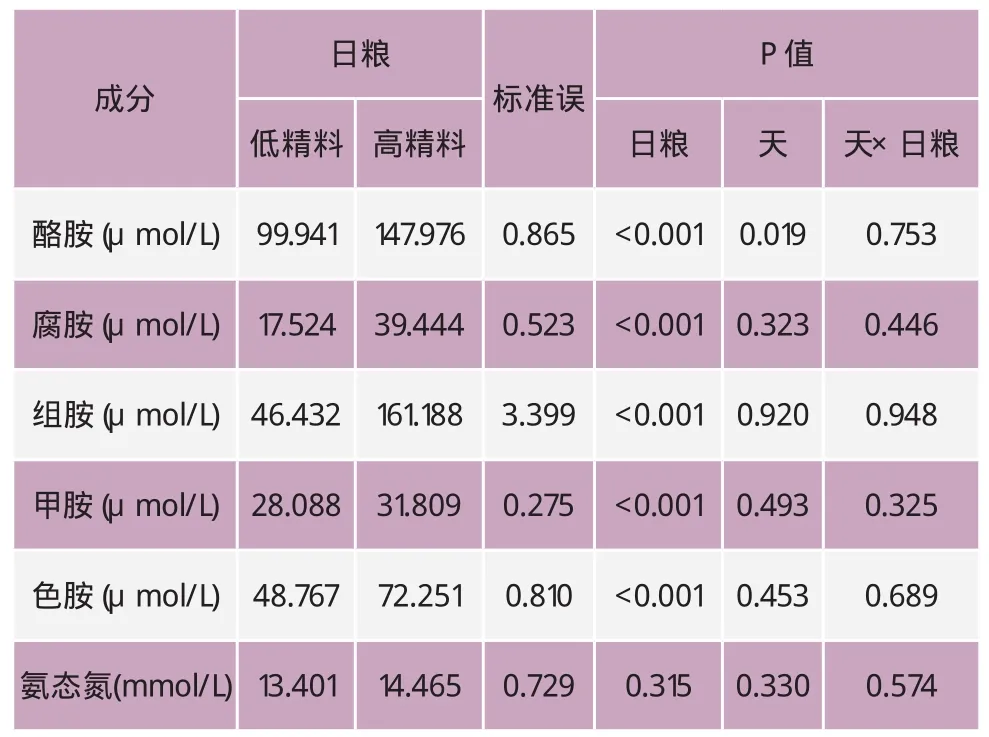
表4 瘤胃液中生物胺和NH3-N浓度
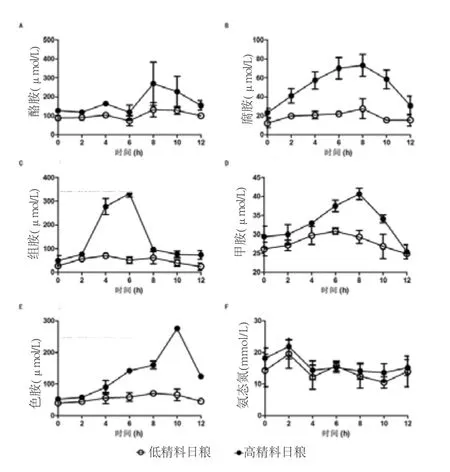
图2 两个处理组酪胺、腐胺、组胺、甲胺、色胺和氨态氮浓度变化
表4表明,瘤胃液中生物胺与NH3-N浓度的天内变化为:与饲喂低精料相比,饲喂高精料奶牛瘤胃液的酪胺、腐胺、组胺、甲胺、色胺浓度有显著性增加(P<0.05),NH3-N浓度差异不大(P>0.05)。其中,酪胺、腐胺、甲胺和色胺在采食后8h和10h有显著性增加,而组胺是在采食后4h和6h有显著性增加。
2.4 相关性分析
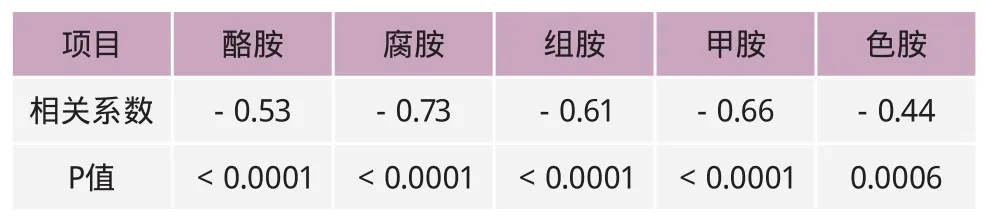
表5 瘤胃液pH与瘤胃液中生物胺含量的相关性
表5的结果表明:瘤胃pH与瘤胃中生物胺的浓度呈显著的负相关性(P<0.05)。
2.5 Real Time PCR 结果
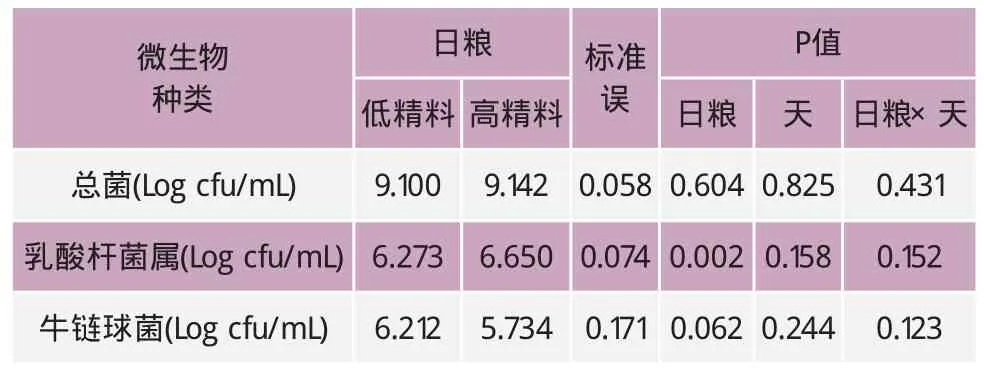
表6 瘤胃液中主要产胺微生物的数量变化
由表6产胺微生物的相对数量的天间变化的数据可知:总菌和牛链球菌的相对数量不受饲喂的日粮精粗比、采样天以及其交互作用的影响(P>0.05)。然而,乳酸杆菌的相对数量受饲喂日粮精粗比的影响显著(P<0.05),但是不受采样天和采样天与饲喂日粮精粗比的交互作用的影响(P>0.05)。
3 讨论
3.1 瘤胃液pH、VFA和乳酸
本研究显示,瘤胃pH随着精料的增加而降低,其与先前Mould等[11]的报道一致。在高精料条件下,可发酵碳水化合物对瘤胃pH的影响是由于其含有较少的中性洗涤纤维,另外,当以玉米籽粒替代玉米青贮后,高精料中的非纤维性碳水化合物增加。由于玉米的消化率相对较高,因此,其发酵后会产生更多的VFA,最终导致瘤胃pH下降。本研究还显示,饲喂高精料日粮增加了瘤胃液中VFA含量,该结果与Calsamiglia等[12]和Simmons等[13]的报道相一致。然而,尽管奶牛在亚急性酸中毒状态下也能产生乳酸,但是由于乳酸发酵菌仍然具有活力[14],能够迅速代谢乳酸生成VFA,使其不能大量聚集。一般认为,当瘤胃中乳酸浓度超过40mmol/L时,奶牛处于急性酸中毒状态[5],然而在亚急性酸中毒状态下其乳酸浓度并不超过5mmol/L[15,16]。而在本试验中,当给奶牛饲喂高精料时,虽高精料组瘤胃液中的乳酸含量显著性增加,但其浓度仍保持在正常浓度范围内(<5mmol/L),该结果说明瘤胃pH的下降主要源于VFA的累积,而非乳酸累积所致。
3.2 瘤胃液中的生物胺及微生物
过去的研究表明,汉普母羊的瘤胃液中含有较高浓度的血管活性胺;当提供含有大量可发酵碳水化合物的日粮时,瘤胃液中的色胺和酪胺的浓度会迅速增加[17]。因此,可以假设发酵碳水化合物的细菌(链球菌属和乳酸菌属)至少部分与它们的产生有关。本试验的研究表明:乳酸菌属的细菌数量随着可发酵碳水化合物的添加而显著增加,然而牛链球菌属细菌的数目却有降低趋势,这与前人研究结果不一致[18]。可能的原因如下:给奶牛饲喂含大量可发酵碳水化合物的高精料时,牛链球菌的快速增殖仅仅出现在开始饲喂和不适应高精料日粮的阶段。当牛适应高精料日粮后,瘤胃液中牛链球菌的数量降低,且其数量的下降不完全归因于瘤胃液pH的下降[19]。因此,与牛链球菌相比,高精料下瘤胃生物胺数量的增加更可能与乳酸菌数量的增多有关。
高精料组瘤胃中的酪胺、腐胺、组胺、甲胺和色胺浓度与低精料组相比有显著性增加,但是这5种生物胺的浓度与先前Sjaasted[20]、Bailey等[18]、Krause等[21]和Engelmann等[22]报道的并不一致。目前试验测得的生物胺浓度(酪胺 20.76μg/L,腐胺 55.1μmol/L,组胺>70μg/L,甲胺 9.2mg/100mL,色胺 6.31μg/L)相比先前报道的生物胺浓度(酪胺未测得,腐胺 12.37μmol/L,组胺 8.29mol/L,色胺 7.0μmol/L)有显著性增加,但比另外的研究报道低[8,23,24]。这些结果表明,饲喂高精料增加了瘤胃的生物胺含量,而其反应速度取决于饲喂精料水平和该日粮饲喂的持续时间。
3.3 瘤胃液pH与瘤胃液中生物胺浓度的相关性
瘤胃中酪胺、腐胺、组胺、甲胺和色胺含量受日粮组成、瘤胃微生物区系和瘤胃内环境的影响[25~27]。前人研究表明,瘤胃pH与瘤胃液中的酪胺、腐胺、组胺、甲胺和色胺的浓度有相关性[28,29]。本试验得出的结论是,瘤胃液中酪胺、腐胺、组胺、甲胺和色胺浓度与瘤胃pH呈负相关。
综上所述,高精料日粮能显著提高奶牛瘤胃发酵参数、生物胺浓度以及产胺微生物的数量,并降低瘤胃pH,但对瘤胃中乙酸无显著影响。瘤胃液pH与瘤胃液中的生物胺浓度呈显著负相关。
[1]Dunlop R H. Phthogenesis of ruminant lactic acidosis[J]. Adv Vet Comp Med, 1972, 16:259-302.
[2]Owen F N, Secrist D S, Hill W J, et al. Acidosis in cattle: a review[J]. J Anim Sci, 1998, 76:275-286.
[3]Brent B E. Relationship of acidosis to other feedlot ailments[J]. J Anim Sci, 1976, 43:930-935.
[4]Nocek J E. Bovine acidosis:implications on laminitis[J]. J Dairy Sci, 1997, 80:1005-1028.
[5]Qin W L. Determination of rumen volatile fatty acids by means of gas chromatography (in Chinese, with English abstract)[J]. Journal of Nanjing Agricultural University, 1983, 3:82-89.
[6]Weatherburn M W. Phenol-hypochlorite reaction for determination of ammonia[J]. Anal Chem, 1967, 39:971-974.
[7]Barker S B, Summerson W H. The colorimetric determination of lactic acid in biological material[J]. J Biol Chem, 1941, 138:535.
[8]王东升,霍文婕,朱伟云,等.反相高效液相色谱法测定瘤胃液中的生物胺[J].动物营养学报,2011,23(12):2165-2169.
[9]Krishnamoorthy U, Muscato T V, Sniffen C J, et al. Nitrogen fractions of selected feedstuffs[J]. J Dairy Sci, 1982, 65:217-225.
[10]吴惠芬,毛胜勇,姚文,等. 猪源乳酸菌产乳酸及其抑菌特性研究[J].微生物学报,2005,32(1):79-84.
[11]Mould F L, Orskov E R.Manipulation of rumen fluid pH and its influence on cellulolysis in sacco, dry matter degradation and the rumen microflora of sheep offered either hay or concentrate[J].Animal Feed Science & Technology,1983,10(1):1-14.
[12]Calsamiglia S, Cardozo P W, Ferret A, et al. Changes in rumen microbial fermentation are due to a combined effect of type of diet and pH[J]. J Anim Sci, 2008, 86:702-711.
[13]Simmons N L, Chaudhry A S, Graham C, et al. Dietary regulation of ruminal bovine UT-B urea transporter expression and localization[J]. J Anim Sci, 2009, 87:3288-3299.
[14]Goad D W, Goad C L, Nagaraja T G. Ruminal microbial and fermentative changes associated with experimentally induced subacute acidosis in steers[J]. J Anim Sci, 1998, 76:234-241.
[15]Bramley E, Lean I J, Fulkerson W J, et al. The definition of acidosis in dairy herds predominantly fed on pasture and concentrates[J]. J Dairy Sci, 2008, 91:308-321.
[16]Lean I J, Rabiee A. Effect of feeding grain on ruminal acidosis in cattle: Acidosis indices. Pages 258-259 in Ruminant Physiology:Digestion, Metabolism, and Effects of Nutrition on Reproduction and Welfare[C].Wageningen Academic Publishers, Wageningen,the Netherlands, 2009.
[17]Irwin L N, Mitchell G E, Tucker R E, et al. Histamine, tyramine,tryptamine and electrolytes during glucose induced lactic acidosis[J]. J Anim Sci, 1979, 48:367-374.
[18]Bailey S R, Rycroft A, Elliott J. Production of amines in equine cecal contents in an in vitro model of carbohydrate overload[J]. J Anim Sci, 2002, 80:2656-2662.
[19]Wells J E, Krause D O, Callaway T R, et al. A bacteriocinmediated antagonism by ruminal lactobacilli against Streptococcus bovis[J]. FEMS Microbiol Ecol, 1997, 22:237-243.
[20]Sjaasted Ø V. Determination and occurrence of histamine in rumen liquor of sheep[J]. Acta Vet Scand, 1967, 8:50-70.
[21]Krause K M, Oetzel G R. Understanding and preventing subacute ruminal acidosis in dairy herds: a review[J]. Anim Feed Sci Tech,2006, 126:215-236.
[22]Engelmann W, Zeyner A, Markuske K D, et al. LC analysis of histamine and other biogenic amines in digesta cultures[J].Chromatographia, 2009, 70:1207-1213.
[23]Hill K J, Mangan J L. The Formation and distribution of methylamine in the ruminant digestive tract[J]. Biochem J, 1964, 93:39-45.
[24]Sanford J. Formation of histamine in ruminal fluid[J]. Nature,1963, 119:829.
[25]Cohen S S. A Guide to the Polyamines[M]. Oxford University Press, New York, 1998.
[26]Garner M R, Gronquist M R, Russell J B. Nutritional requirements of Allisonella histaminiformans, a ruminal bacterium that decarboxylates histidine and produces histamine[J]. Curr Microbiol, 2004, 49:295-299.
[27]Connil N, Breton Y L, Dousset X, et al. Identification of the Enterococcus faecalis tyrosine decarboxylase operon involved in tyramine production[J]. Appl Environ Microbiol, 2002,68(7):3537-3544.
[28]Krizsan S J, Randby Å T. The effect of fermentation quality on the voluntary intake of grass silage by growing cattle fed silage as the sole feed[J]. J Anim Sci, 2007, 85:984-996.
[29]Linares D M, Fernandez M, del Rio B, et al. The tyrosyl-tRNA synthetase like gene located in the tyramine biosynthesis cluster of Enterococcus durans is transcriptionally regulated by tyrosine concentration and extracellular pH[J]. BMC Microbiol, 2012,12:23-47.
Effects of High Concentrate Diet on Rumen Fermentation and Biogenic Amines in the Rumen of Dairy Cows
WANG Dong-sheng1, ZHANG Lu-lu2
(1.Shanghai Bright Holstan Co., Ltd., Shanghai 200436; 2.Beijing Middle Example Laying Hens Breeding Co.,Ltd., Beijing 102100)
This study was conducted to investigate the effect of high concentrate diet feeding on rumen fermentation characteristics. Four cannulated primiparous (60 to 140d in milk period) Holstein dairy cows were assigned to 2 diets in a 2×2 crossover experimental design. Results showed that HighC feeding increased the averages of total volatile fatty acids, butyrate, valerate, total branched-chain VFA and decreased the acetate to propionate ratio in the rumen.HighC feeding did not signi fi cantly increased the daily average of acetate and NH3-N (P<0.05), and has an increase trend for propionate (0.05<P<0.10). The average concentration of tyramine, putrescine, histamine, methylamine and tryptamine were higher in the rumen of HighC group compared with the LowC (P<0.05). Correlation analysis showed that there was a signi fi cant negative relationship between ruminal pH and biogenic amines in the rumen fl uid (P<0.05). In addition, the relative quantitation of Lactobacillus spp. were affected by the diet fed (P<0.05).In conclusion, results suggest that HighC feeding caused translocation of biogenic amine from the digestive tract and increase of predominant ruminal biogenic amine-forming Lactobacillus spp. Further research is warranted to explore the role of amine and the concrete biogenic amine-forming microorganism in animal physiologic activities,especially in in fl ammation response during HighC feeding.
Concentrate-to-forage ratio; Dairy cow; Ruminal fl uid; Biogenic amine
S823.4
A
1004-4264(2017)10-0011-05
10.19305/j.cnki.11-3009/s.2017.10.003
2017-02-13
王东升(1987-),男,山东潍坊人,硕士,主要从事奶牛研发项目管理工作。
张露露(1989-),女,汉,河北石家庄人,硕士,主要从事饲料检测、畜禽疾病控制等研究工作。

