头孢曲松和阿奇霉素体外抗淋球菌联合作用研究
于瑞星 尹跃平 戴秀芹 陈绍椿 韩燕 张振国 陈祥生
100029北京,中日友好医院皮肤病与性病科(于瑞星);中国医学科学院 北京协和医学院 皮肤病研究所参比实验室(尹跃平、戴秀芹、陈绍椿、韩燕、陈祥生);大连市皮肤病医院(张振国)
·研究报道·
头孢曲松和阿奇霉素体外抗淋球菌联合作用研究
于瑞星 尹跃平 戴秀芹 陈绍椿 韩燕 张振国 陈祥生
100029北京,中日友好医院皮肤病与性病科(于瑞星);中国医学科学院 北京协和医学院 皮肤病研究所参比实验室(尹跃平、戴秀芹、陈绍椿、韩燕、陈祥生);大连市皮肤病医院(张振国)
目的评估头孢曲松和阿奇霉素体外对淋球菌临床分离株的联合作用。方法2012年在大连市皮肤病医院性病门诊收集淋球菌临床分离株25株,Etest法检测头孢曲松和阿奇霉素体外对淋球菌的最小抑菌浓度(MIC)。计算部分抑菌浓度指数(FICI),判断头孢曲松和阿奇霉素体外对淋球菌的联合作用。结果头孢曲松MIC均值为0.032 mg/L,MIC值范围为0.008~0.064 mg/L;阿奇霉素MIC均值为0.834 mg/L,范围为0.064~4.000 mg/L。FICI在0.724~2.696之间,头孢曲松和阿奇霉素对所检测的淋球菌临床分离菌株均表现为相加作用。结论头孢曲松和阿奇霉素在体外对淋球菌表现为相加作用,尚需大样本进一步证实。
淋病奈瑟球菌;头孢曲松;阿奇霉素;药物相互作用
淋病在男性可引起尿道炎、附睾炎、前列腺炎等,在女性可引起宫颈炎、子宫内膜炎、附件炎等。世界每年新发病例约1.06亿[1]。有效的抗生素治疗是预防控制淋病的有效手段之一,但近年来淋球菌已对一线药物头孢克肟和头孢曲松等广谱头孢菌素类药物产生耐药,并出现头孢克肟和头孢曲松治疗失败病例[2-3]。因此,美国、英国、加拿大等国家推荐使用头孢曲松联合阿奇霉素治疗淋病[4-6]。但在国内未见头孢曲松和阿奇霉素对淋球菌联合作用的相关研究。我们检测大连淋球菌对头孢曲松和阿奇霉素的敏感性,初步探讨二者体外对淋球菌的联合作用。
一、材料与方法
(一)实验菌株:2012年在大连皮肤病医院性病门诊收集淋球菌临床分离菌株25株,其中64%(16/25)来自男性,36%(9/25)来自女性。患者年龄16~50岁,平均30.75岁,男性和女性患者标本分别取自尿道和宫颈。其中40%(10/25)患者曾患淋病,32%(8/25)患者1个月内有抗生素使用史。收集淋球菌临床分离菌株,经初步鉴定后传代1次,洗脱于脱脂牛奶管中,-70℃冰箱保存备用。质控菌株为世界卫生组织(WHO)P菌株。
(二)主要试剂:GC琼脂粉、脱脂牛奶来自英国Oxiod公司,革兰染液来自珠海贝索生物技术有限公司,头孢曲松、阿奇霉素Etest条与精制生长添加剂(Iso VitaleXTM)来自瑞典AB Biodisc公司。
(三)抗生素敏感性检测:
1.MIC测定:按照美国临床实验室标准化协会(clinical laboratory standard institute,CLSI)操作步骤,将保存在-70 ℃冰箱中的标本室温冻溶,接种在含1%(体积分数)精制生长添加剂的GC培养基上,36℃、5%CO2中培养20~24 h,挑取单个菌落接种培养20~24 h,研磨至装有1 ml无菌生理氯化钠溶液的试管中,用比浊仪将菌悬液浓度调整至0.5麦氏单位(MFC)。无菌拭子蘸取适量菌悬液,均匀涂布于培养基表面。接种15 min后将Etest条置于培养基表面,36℃、5%CO2培养20~24 h后观察结果。淋球菌对阿奇霉素的MIC值≥2 mg/L为耐药,对头孢曲松的MIC值≥0.125 mg/L为低敏。
2.联合作用测定:按照上述步骤,先将淋球菌临床分离株菌悬液均匀涂布于含1%精制生长添加剂的GC培养基上,再将头孢曲松和阿奇霉素Etest条在MICA(头孢曲松MIC值)和MICB(阿奇霉素MIC值)处垂直交叉平铺于含1%精制生长添加剂的GC培养基上,按上述条件培养20~24 h,观察头孢曲松和阿奇霉素对淋球菌的MICAB(头孢曲松与阿奇霉素Etest条联合作用时头孢曲松对淋球菌的MIC值)和MICBA(为阿奇霉素与头孢曲松Etest条联合作用时阿奇霉素对淋球菌的MIC值)。
(四)统计学分析:根据部分抑菌浓度指数(fractional inhibitory concentration index,FICI)判断头孢曲松和阿奇霉素体外抗淋球菌的联合作用。FICI=MICA/MICAB+MICB/MICBA。FICI≤ 0.5为协同,0.5<FICI≤ 4为相加,FICI>4为拮抗。MIC与FICI进行Spearman秩相关分析。计量资料比较采用t检验,P<0.05为差异有统计学意义。
二、结果
1.淋球菌对头孢曲松和阿奇霉素的敏感性:头孢曲松对25株淋球菌临床分离株的MIC值为(0.032±0.039)mg/L,MIC值范围为0.008~ 0.064 mg/L,MIC50为0.023 mg/L,MIC90为0.064 mg/L,所有菌株对头孢曲松敏感;阿奇霉素MIC值为(0.834±0.256)mg/L,MIC值范围为0.064~4.000 mg/L,MIC50为0.250 mg/L,MIC90为4.000 mg/L,其中16%(4/25)的菌株对阿奇霉素耐药。
如表1所示,头孢曲松对分离自既往有淋病患者的淋球菌的MIC均值为(0.042±0.019)mg/L,与来自无淋病患者的淋球菌的MIC均值[(0.025±0.017)mg/L]差异有统计学意义(t=2.256,P=0.034);头孢曲松和阿奇霉素对其他不同人群临床分离菌株的MIC值差异无统计学意义。
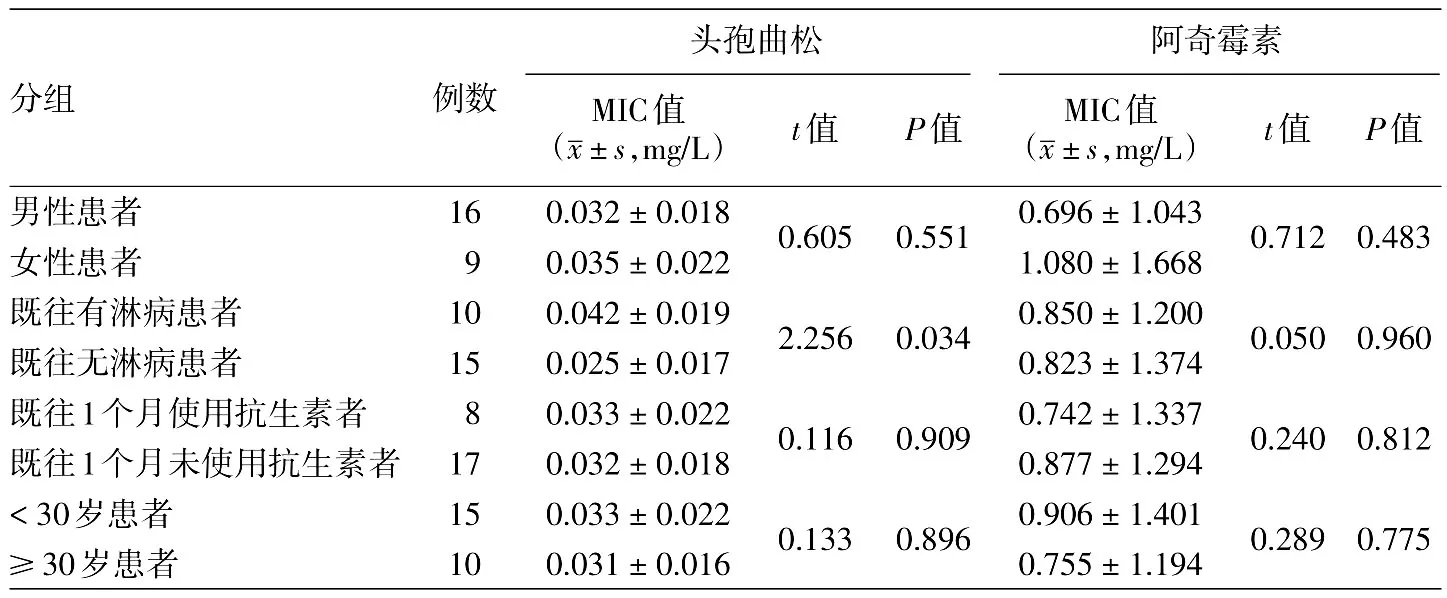
表1 不同人群淋球菌分离株体外对头孢曲松和阿奇霉素的敏感性比较
2.头孢曲松和阿奇霉素在体外对淋球菌的联合作用:头孢曲松MICA值和FICI之间的相关系数r为-0.133,P=0.525,差异无统计学意义。阿奇霉素MICB值和FICI之间的相关系数r为-0.255,P=0.280,差异无统计学意义。共检测25株大连地区淋球菌临床分离菌株,FICI值在0.724~2.696之间,头孢曲松和阿奇霉素对所有淋球菌临床分离菌株都表现为相加作用,无协同作用,也无拮抗作用。
三、讨论
淋球菌是一种易对抗生素产生耐药的革兰阴性双球菌,近年来国外报道淋球菌对一线治疗药物头孢曲松敏感性逐渐下降,并且出现治疗失败的病例[2-3,7]。在中国淋球菌对头孢曲松的敏感性也逐渐下降[8],但在中国知网、万方数据库(检索词:淋球菌、头孢曲松;起止时间:2000年2月至2015年10月)中未检索到头孢曲松耐药淋球菌株,亦无头孢曲松治疗失败病例报道,我们亦未发现头孢曲松耐药菌株。研究报道[9-11]中国淋球菌对阿奇霉素的耐药率在0~16.5%之间,本研究中淋球菌对阿奇霉素耐药率为16%,与之前报道相似。按照WHO规定抗生素对微生物耐药率>5%不宜作为治疗该微生物感染的一线用药,因此阿奇霉素不宜单独作为治疗淋病的一线用药。另外,本研究发现头孢曲松MIC值在曾患淋病患者中更高,提示既往感染淋病患者的淋球菌临床分离株对头孢曲松更容易产生耐药。
我们应用Etest法检测发现头孢曲松和阿奇霉素体外抗淋球菌有相加作用,无协同或拮抗作用,这与既往报道一致[12-13]。本研究存在一定的局限性,样本量较小仅在大连皮肤病医院性病门诊收集标本,不能代表中国淋球菌对头孢曲松和阿奇霉素在体外联合作用的敏感性。另外不同研究采用的FICI计算方法不同,不同计算方法对实验结果可能也有影响。
[1]World Health Organization (WHO).Global prevalence and incidence of selected curable sexually transmitted infection-2008[EB/OL].[2013-01-30].http://www.who.int/reproductivehealth/publications/rtis/stisestimates/en/.
[2]Tapsall J,Read P,Carmody C,et al.Two cases of failed ceftriaxone treatment in pharyngeal gonorrhoea verified by molecular microbiological methods[J].J Med Microbiol,2009,58(Pt 5):683-687.DOI:10.1099/jmm.0.007641-0.
[3]Unemo M,Golparian D,Hestner A.Ceftriaxone treatment failure of pharyngeal gonorrhoea verified by international recommendations,Sweden,July 2010[J].Euro Surveill,2011,16(6):429-435.
[4]Centers for Disease Control and Prevention(CDC).Update to CDC′s sexually transmitted diseases treatment guidelines,2010:oral cephalosporins no longer a recommended treatment for gonococcal infections[J].MMWR Morb Mortal Wkly Rep,2012,61(31):590-594.DOI:10.1001/2012.jama.11292.
[5]Bignell C,Fitzgerald M,Guideline Development Group.UK national guideline for the management of gonorrhoea in adults,2011[J].Int J STD AIDS,2011,22(10):541-547.DOI:10.1258/ijsa.2011.011267.
[6]Public Health Agency of Canada.2011.Important notice-public health information update on the treatmentofgonococcal infection[EB/OL].[2013-1-30].http://www.phac-aspc.gc.ca/stdmts/sti-its/alert/2011/alert-gono-eng.php.
[7]Goire N,Ohnishi M,Limnios AE,et al.Enhanced gonococcal antimicrobial surveillance in the era of ceftriaxone resistance:a real-time PCR assay for direct detection of theNeisseriagonorrhoeaeH041 strain[J].J Antimicrob Chemother,2012,67(4):902-905.DOI:10.1093/jac/dkr549.
[8]Zhu BY,Yu RX,Yin Y,et al.Surveillance of antimicrobial susceptibilities ofNeisseria gonorrhoeaein Nanning,China,2000 to 2012[J].Sex Transm Dis,2014,41(8):501-506.DOI:10.1097/OLQ.0000000000000157.
[9]张铁军,周晓明,张颖华,等.上海地区淋球菌临床分离株对不同抗生素的敏感性分析[J].中国皮肤性病学杂志,2008,22(4):226-228.
[10]李中伟,于美玲,彭玉臣,等.淋球菌对10种抗生素的敏感性测定[J].中国性病艾滋病防治,1999,5(1):29-30.
[11]袁柳凤,尹跃平,戴秀芹,等.南京地区淋球菌分离株对阿奇霉素的敏感性研究[J].中国麻风皮肤病杂志,2010,26(2):110-111.DOI:10.3969/j.issn.1009-1157.2010.02.013.
[12]Barbee LA,Soge OO,Holmes KK,et al.In vitrosynergy testing of novelantimicrobialcombination therapiesagainstNeisseria gonorrhoeae[J].J Antimicrob Chemother,2014,69(6):1572-1578.DOI:10.1093/jac/dkt540.
[13]Pereira R,Cole MJ,Ison CA.Combination therapy for gonorrhoea:in vitrosynergy testing[J].J Antimicrob Chemother,2013,68(3):640-643.DOI:10.1093/jac/dks449.
In vitro combined effect of ceftriaxone and azithromycin against Neisseria gonorrhoeae
Yu Ruixing,Yin Yueping,Dai Xiuqin,Chen Shaochun,Han Yan,Zhang Zhenguo,Chen Xiangsheng
Department of Dermatology and Venereology,China-Japan Friendship Hospital,Beijing 100029,China(Yu RX);Reference Laboratory of STD,Institute of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College,Nanjing 210042,China(Yin YP,Dai XQ,Chen SC,Han Y,Chen XS);Dalian Dermatosis Hospital(Zhang ZG)
Yin Yueping,Email:yinyp@ncstdlc.org
ObjectiveTo investigatein vitrocombined effect of ceftriaxone and azithromycin against clinical isolates ofNeisseria gonorrhoeae(NG).MethodsA total of 25 NG clinical isolates were collected from the STD clinic of Dalian Dermatosis Hospital in 2012.Epsilometer test(Etest)method was used to determine the minimum inhibitory concentrations(MICs)of ceftriaxone and azithromycin against NG isolates.Fractional inhibitory concentration index(FICI)was calculated to evaluate thein vitrocombined effect of ceftriaxone and azithromycin against NG isolates.ResultsThe mean MICs of ceftriaxone and azithromycin were 0.032 mg/L(range,0.008-0.064 mg/L)and 0.834 mg/L(range,0.064-4.000 mg/L),respectively.The FICI ranged from 0.724 to 2.696,and ceftriaxone and azithromycin showed an additive effect against the above NG isolates.ConclusionCeftriaxone and azithromycin show an additive effect against NGin vitro,but further studies with large sample size are needed to confirm their effects.
Neisseria gonorrhoeae;Ceftriaxone;Azithromycin;Drug interactions
尹跃平,Email:yinyp@ncstdlc.org
10.3760/cma.j.issn.0412-4030.2017.05.012
中国医学科学院医学与健康科技创新工程项目(2016-I2M-3-021)
Fund program:CAMS Medical and Health Science and Technology Innovation Program(2016-I2M-3-021)
2016-08-29)
(本文编辑:尚淑贤)

