卵孢小奥德蘑固体培养特性及营养成分分析*
欧胜平,程显好,高兴喜,李维焕,杨 涛,孙 磊
(鲁东大学农学院,山东 烟台 264025)
〈生理生化〉
卵孢小奥德蘑固体培养特性及营养成分分析*
欧胜平,程显好**,高兴喜,李维焕,杨 涛,孙 磊
(鲁东大学农学院,山东 烟台 264025)
为了研究卵孢小奥德蘑固体培养特性和营养成分,通过对卵孢小奥德蘑固体培养特性研究得出,采用菌落直径法,菌丝生长最适培养基和初始pH为麦麸培养基,pH6.5,采用菌丝干重法,菌丝生长最适培养基和初始pH为GPY培养基,pH6.5;最适生长温度为31℃,2种方法结果一致。同时对卵孢小奥德蘑成分分析研究得出,其子实体中蛋白质、可溶性总糖和水解氨基酸的含量分别为32.12%、24.25%和18.14%;每克氮中氨基酸评分标准模式,与全鸡蛋蛋白质氨基酸模式和FAO/WHO模式进行比较,氨基酸评分(AAS)、化学评分(CS)、必需氨基酸指数(EAAI)和营养指数(NI)分别为90、85、92和29,证明卵孢小奥德蘑是营养价值很高的食用菌。
卵孢小奥德蘑;培养特性;成分分析
野生卵孢小奥德蘑广泛分布在赤道及南部非洲、东亚、南亚及南太平洋岛屿等热带和亚热带地区,在我国主要分布在云南、贵州、四川、广西、广东等省。2007年孙思国等[3]在山东省济宁市金乡县人工栽培卵孢小奥德蘑获得成功,这是国内外首次人工驯化成功卵孢小奥德蘑,相继在2010年金乡县实现了卵孢小奥德蘑的周年化生产[4]。2016年孙凯[5]以及吴素蕊等[6]分别对卵孢小奥德蘑菌多糖提取工艺进行研究;2017年徐兵等[7]对卵孢小奥德蘑菌丝体液体发酵条件进行研究。对营养成分和药用价值的研究文献甚少。
本研究采用菌落直径法和菌丝干重法,优化卵孢小奥德蘑菌种固体斜面培养条件,系统地筛选出适宜卵孢小奥德蘑菌丝生长的培养基配方、培养温度和培养基pH。卵孢小奥德蘑周年化生产需要大量优良菌种,但菌种存在成本高和退化快等问题,菌种退化的快慢与培养条件密切相关。本研究旨在为卵孢小奥德蘑生产提供优良且廉价的菌种。目前国内外关于卵孢小奥德蘑营养成分及活性物质研究的相关报道甚少,利用方面仅停留在子实体的直接食用。本研究通过对卵孢小奥德蘑营养成分的分析,测定子实体中矿物质、可溶性总糖、蛋白质和氨基酸含量,为未来卵孢小奥德蘑的综合利用开辟新的道路,延长产业链,促进卵孢小奥德蘑高效利用。
1 材料与方法
1.1 材料与设备
1.1.1 实验材料
人工栽培卵孢小奥德蘑新鲜子实体由山东远洋农业开发有限公司提供,经组织分离后得到纯培养试管菌种并放于4℃的冰箱中保藏。
1.1.2 主要仪器设备
LDZX-50KB立式压力蒸汽灭菌器,上海福玛实验设备有限公司;氨基酸自动分析仪,科普研发集团;K9840自动凯式定氮仪,苏州江东精密仪器有限公司;Anton Paar安东帕微波消解仪,苏州赛恩斯仪器有限公司;932B原子吸收分光光度计,澳大利
亚GBC公司。
1.1.3 六种基本固体培养基配方
PDA培养基:马铃薯200 g·L-1(煮汁)、蛋白胨6 g·L-1、酵母膏和琼脂各 10 g·L-1。
GPC 培养基:葡萄糖 20 g·L-1、蛋白胨 6 g·L-1、玉米浆和琼脂各10 g·L-1。
GPY 培养基:葡萄糖 20 g·L-1、蛋白胨 6 g·L-1、酵母膏和琼脂各10 g·L-1。
麦芽汁培养基:50 g·L-1、琼脂 10 g·L-1。
胡萝卜培养基:胡萝卜200 g·L-1(煮汁)、葡萄糖 20 g·L-1、琼脂 10 g·L-1。
麦麸培养基:麦麸 30 g·L-1、葡萄糖 20 g·L-1、K2HPO43 g·L-1、MgSO41.5 g·L-1、琼脂 10 g·L-1。1.1.4 主要试剂
氨基酸的检测:盐酸(分析纯)、氧氧化钠(分析纯)、17种氨基酸标准溶液、柠檬酸钠缓冲液。
粗多糖含量的检测:葡萄糖(分析纯)、浓硫酸(分析纯)、苯酚(分析纯)。
粗蛋白含量的检测:浓硫酸(分析纯)、氢氧化钠、甲基红、次甲基蓝、硼酸、硫酸、盐酸、过氧化氢。
1.2 试验方法
1.2.1 菌落直径法
在超净工作台中,使用经高温蒸汽灭菌并酒精火焰灼烧冷却后的5 mm的打孔器,沿着已培养好的平板菌种的外圈打孔,用经酒精火焰灼烧冷却后的接种针将菌块放于已经铺好玻璃纸的平板培养中央,并用封口膜封口,防止杂菌感染,置于恒温培养箱避光观察培养。待菌落的直径达到2 cm左右,采用十字交叉法每隔24 h测量1次菌落直径,直到菌落长满平板为止。
1.2.2 生物量测定法(菌丝干重法)
前期操作同1.2.1。待菌丝长满平板停止培养,用小型镊子将平板中的玻璃纸和菌丝一同取出,并用小型镊子轻轻刮取玻璃纸上的菌丝,将收集到的菌丝置于铺有称量纸的平板中,移至60℃的烘箱中烘干至恒重,电子天平称量菌丝干重。
1.2.3 pH优化
将菌种接于6种不同pH的固体培平板培养基中,pH梯度分别为 4.5、5.0、5.5、6.0、6.5和7.0,25℃下避光培养,分别采用菌落直径法和生物量法对菌丝的生长情况进行比较和分析,每个试验设置3个重复。
1.2.4 培养基优化
将菌种接于6种不同的固体培平板培养基(PDA、GPC、GPY、麦芽汁、胡萝卜、麦麸) 中,25℃下避光培养,分别采用菌落直径法和生物量法对菌丝的生长情况进行比较和分析,每个试验设置3个重复[8]。
1.2.5 温度优化
将菌种接种于固体培养基平板中,分别在19℃、22℃、25℃、28℃和31℃五种不同温度下避光培养,分别采用菌落直径法和生物量法对菌丝的生长情况进行比较和分析,每个试验设置3个重复。
1.2.6 可溶性总糖含量的测定
采用苯酚-硫酸法测定[9]。
(1)标准曲线溶液的配置
电子天平精确称取干燥国产分析纯葡萄糖100 mg,蒸馏水定容至1 000 mL,完全溶解后备用;将试管分别编号为0、1、2、3、4、5,移液枪分别吸取之前配制好的葡萄糖溶液0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL于5支试管中,并用蒸馏水补至1.0 mL;每支试管中各加入1 mL5%苯酚溶液,最后滴加5 mL浓硫酸;摇匀后加塞,室温下放置至冷却。以0号管作为调零管,于490 nm处测定吸光值,每支试管设置3个重复,取平均值。
(2) 标准曲线的绘制
以吸光值为纵坐标,葡萄糖浓度为横坐标,根据测定结果绘制标准曲线,见图1。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
(3) 葡萄糖溶液的制备
精确称取0.1000 g子实体粉末加入50 mL离心管中,再加入10 mL蒸馏水,摇匀后在微波炉中用中高火(P80) 处理1.5 min。将得到的微波提取液于4 000 r·min-1下离心10 min,然后用移液枪取5 mL上清液加入50 mL离心管中,再加入15 mL95%乙醇,摇匀后放入4℃冰箱内静置12 h,醇沉完成后即12 h后,取出于4 000 r·min-1下离心20 min,弃上清液,沉淀晾干后得到可溶性总糖。加少量热水溶解可溶性总糖,定容至10 mL待测。
(4)样品中可溶性总糖含量的测定
0号管内加入1 mL蒸馏水作为调零管,以1号~4号管作为样品管,分别加入1 mL可溶性总糖提取液,之后每管中依次加入1 mL5%苯酚和5 mL浓硫酸,室温下放置冷却后在490 nm下测定吸光值。取多个重复的平均值,最后经过计算,在标准曲线上得到可溶性总糖溶液相对应的葡萄糖浓度。
1.2.7 粗蛋白含量测定
采用凯氏定氮法[10]。将新鲜样品于烘箱中60℃烘干至恒重,然后粉碎过筛,孔径为0.9 mm。
样品消化:各称取0.5000 g样品于消煮管中,加入10 mL浓硫酸后,再加入1 mL的过氧化氢,轻轻摇晃使样液完全浸湿,将消煮管置于石墨消解仪上进行消解,待烧瓶中消化液变为澄清透明的淡蓝色后继续消化2 h左右。消化结束后,将烧瓶放于通风处冷却。
蒸馏:采用半自动凯式定氮仪进行蒸馏,将消煮管放在装置上,设置硼酸和氢氧化钠的加入量分别为20 mL和40 mL,在冷凝管末端放置250 mL的锥形瓶,开始蒸馏。
滴定:用标定好的0.1 mol·L-1盐酸滴定蒸馏液,使蓝绿色变为灰紫色。
蛋白质含量(M)计算公式为:M(%)=[CHCl× (V-V0) ×0.014×100×10×6.25]/m样品式中:CHCl表示盐酸标准溶液的浓度 (mol·L-1);V表示样品用盐酸量(mL);V0表示空白用盐酸量(mL);6.25为氮换算为蛋白的系数;m样品表示样品质量(g)。
1.2.8 氨基酸含量测定
预处理:将卵孢小奥德蘑子实体样品用蒸馏水洗净置60℃烘干至恒重,然后用陶瓷乳钵研碎成粉状备用[11]。
酸水解步:称取80 mg样品,加10 mL酸解剂(6 mol·L-1HCl),置液氮中冷冻,然后抽真空封口。将水解管放在110℃恒温干燥箱中,水解24 h,冷却、混匀、开管、过滤,用移液管吸取适量的滤液,减压抽真空蒸发至干,加入5 mL pH2.2稀释上机用柠檬酸钠缓冲液,使样液中氨基酸浓度达到100 mmol·L-1,摇匀,过滤后离心,取上清液上机测定。
1.2.9 营养价值的评价方法
根据每克氮中氨基酸评分标准模式,与全鸡蛋蛋白质氨基酸模式和FAO/WHO模式(1973年) 进行比较[12],氨基酸评分(AAS)、化学评分(CS)、必需氨基酸指数(EAAI)和营养指数(NI)[13]按以下公式计算:

式中:m1表示实验室蛋白质氨基酸含量(mg·g-1);m2表示FAO/WHO评分标准中相应氨基酸含量(mg·g-1)。

式中:m3表示样品必需氨基酸含量(mg·g-1);m4表示样品必需氨基酸总含量(mg·g-1);m5表示鸡蛋必需氨基酸总含量(mg·g-1);m6表示鸡蛋相应氨基酸含量(mg·g-1)。

式中:n表示比较氨基酸数;t表示样品氨基酸含量;s表示鸡蛋中相应氨基酸的含量。
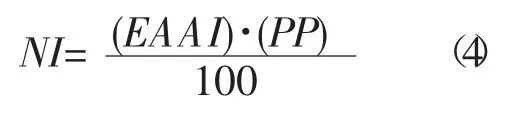
式中:PP为样品蛋白质百分比。
2 结果
2.1 卵孢小奥德蘑固体培养特性
数据采用 Excel2010和 DPS(Data Processing System)7.05版软件进行统计分析。
2.1.1 两种菌丝生长测定方法比较pH对菌丝生长情况的影响
比较培养至第8天不同初始pH对菌丝生长情况的影响,结果见图2和图3。

图2 不同初始pH值对不同培养基菌丝直径的影响Fig.2 Effect of initial pH on mycelium diameter in several different medium
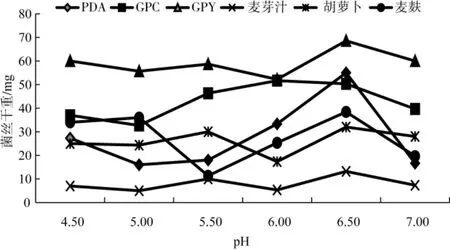
图3 不同初始pH对不同培养基菌丝干重的影响Fig.3 Effect of initial pH on mycelium dry weight in several different medium
由图2可知,不同初始pH对不同培养基中菌丝生长速度的影响不大,其中对麦芽汁培养基和PDA培养基的影响较为明显,初始pH为6.5时菌丝的生长速度最快,初始pH为5.0和7.0时菌丝生长较慢;初始pH对其余4种培养基中菌丝生长速度的影响较不明显,6种培养基均在初始pH为6.5时菌丝的生长速度最快。6种培养基中麦麸培养基中菌丝生长速度最快,PDA和麦芽汁培养基中菌丝生长速度较慢。
由图3可知,不同培养基的初始pH对菌丝干重都有一定的影响,其中不同初始pH对PDA、GPC、GPY、胡萝卜和麦麸培养基中菌丝干重的影响较明显,而对麦芽汁培养基的影响较为不明显;在6种不同初始pH中,初始pH为6.5时其菌丝干重表现最好,初始pH为5.0和7.0时菌丝干重表现较差;GPY培养基中菌丝干重表现最好,而麦芽汁培养基中表现最差。从图3中点的分布情况可以得出,初始pH为4.5、5.0、7.0时,不同培养基对菌丝干重的影响较小,初始pH为5.5、6.0和6.5时,不同培养基对菌丝干重的影响较大。菌丝干重除了受菌丝生长速度的影响,同时还受菌丝致密度的影响,综合图2和图3可以初步判定,GPY培养基、麦麸培养基和GPC培养基的综合表现较好,麦麸培养基中菌丝稀疏,而GPY培养基中菌丝致密;麦芽汁、胡萝卜和PDA培养基综合表现较差。不同初始pH对菌丝干重影响的显著性分析见表1。
由表1可知,除了初始pH4.5和pH7.0的培养基中菌丝干重比较达到显著差异,其余不同初始pH培养基中菌丝干重比较都达到了极显著差异。在不考虑培养基影响的情况下,结合均值大小可以得出当培养基初始pH为6.5时,菌丝的生长情况最好,而pH为5.0时菌丝生长情况最差。不同初始pH对菌丝生长速度影响的显著性分析见表2。
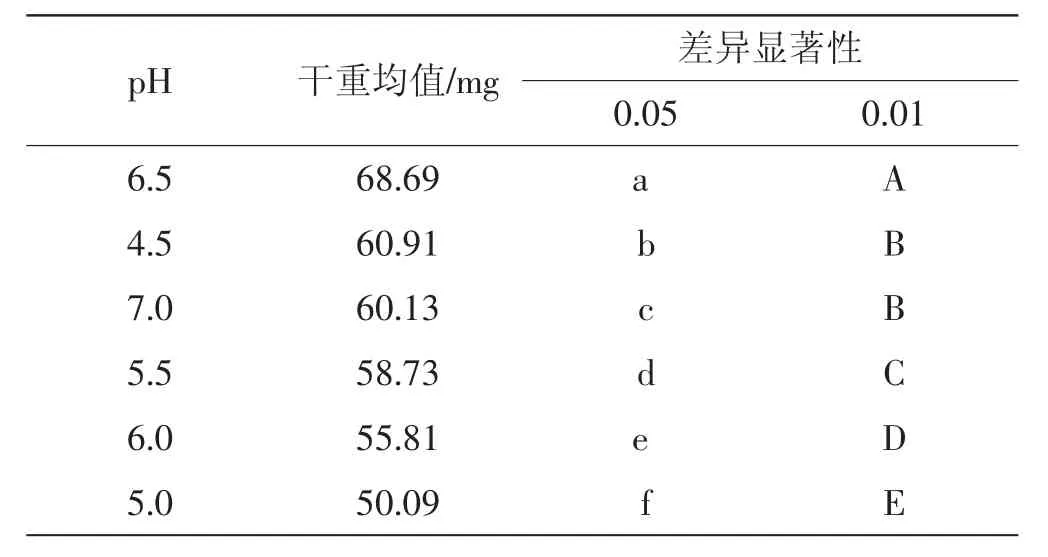
表1 不同初始pH对菌丝干重影响的显著性分析(生物量法)Tab.1 Analysis on significant difference of several different initial pH
由表2可以看出,不同初始pH对菌落生长速度的影响不大,初始pH6.5和pH7.0的培养基中菌丝生长速度比较达到了极显著差异,其他不同初始pH培养基中菌丝生长速度比较未达到显著差异,这和图2的结果相符合,不同初始pH对卵孢小奥德蘑菌丝生长速度的影响不明显。不同初始pH对菌丝生长速度影响的显著性分析见表2。

表2 不同初始pH对菌丝生长速度影响的显著性分析(菌落直径法)Tab.2 Analysis on significant difference of several different initial pH
2.1.2 两种菌丝生长测定方法比较培养基对菌丝生长情况的影响
比较第8天6种不同培养基对菌丝生长情况的影响,结果见图4。

图4 不同培养基中菌丝的生长情况Fig.4 Mycelial growth in different media
由图4可知,菌落大小差异不明显,依次为麦麸培养基、胡萝卜培养基、GPY培养基、GPC培养基、麦芽汁培养基和PDA培养基;6种不同培养基中菌丝致密度有很大的差异,致密度大小依次为GPY培养基、GPC培养基、PDA培养基、胡萝卜培养基、麦麸培养基和麦芽汁培养基。不同培养基对菌丝生长情况影响的显著性分析见表3。

表3 不同培养基对菌丝生长情况影响的显著性分析Tab.3 Analysis on significant difference of mycelium growthstatus in different culture medium
由表3可知,采用菌落直径法,不同培养基对菌丝生长情况显著性分析结果得出,只有麦麸培养基和PDA培养基之间达到极显著差异,说明不同培养基对菌丝生长速度影响不明显,结合均值分析得出卵孢小奥德蘑在麦麸培养基中生长速度最快,PAD培养基中最慢,与图4显示的结果相对应。采用菌丝干重法,不同培养基中菌丝生长速度情况显著性分析结果得出,GPY培养基与除了GPC培养基以外的4种培养基相比均达到极显著性差异,结合均值分析不同培养基中菌丝干重表现最好的为GPY培养基,而麦芽汁培养基表现最差。2种不同的测定法显著性分析结果不一样,大型真菌的菌丝类型可分为气生菌丝和基内菌丝,前者一般往上长,而后者往四周长,所以造成分析结果的不同。
2.1.3 两种菌丝生长测定方法比较温度对菌丝生长情况的影响
比较不同温度对菌丝生长情况的影响,结果如图5和图6所示。

图5 不同培养温度对菌丝生长速度的影响Fig.5 Effect of temperature on mycelium growth with the colony diameter diffusion method

图6 不同培养温度对菌丝干重的影响Fig.6 Effect of temperature on mycelium growth with dry weight method
由图5可知,不同培养温度对菌丝的影响较明显,不同温度中菌丝生长速度快慢依次为31℃、25℃、28℃、22℃和19℃,温度对菌丝生长速度的影响也是先上升后下降再上升的趋势。由图6可知,不同温度对菌丝干重的影响较为明显,结果得出在31℃中培养菌丝生长情况较好。综合图5和图6得出,在19℃到31℃的温度范围内,卵孢小奥德蘑菌丝体的生长情况基本上随着温度的上升而加快,上限温度和下限温度在本实验中没有体现出来,有待进一步的研究。不同培养温度对菌丝生长差异显著性分析见表4。

表4 不同培养温度对菌丝生长差异显著性分析Tab.4 Analysis on significant difference of mycelium growthstatus in different temperature
由表4可知,31℃中培养菌丝的生长与除25℃外其他温度中菌丝生长差异达到极显著水平,与25℃中培养菌丝生长差异也达到了显著水平,结合均值分析可以得出卵孢小奥德蘑菌丝的31℃中生长较快,25℃次之,与图5和图6所显示的结果相符合。培养温度可能是通过对菌丝体中各种酶活性的调控来对菌丝生长的影响,具体有待进一步研究。
2.2 卵孢小奥德蘑营养成份分析
2.2.1 主要营养成份
采用以上方法对卵孢小奥德蘑子实体成分进行测定,结果见表5。

表5 卵孢小奥德蘑有效成分的测定结果Tab.5 Determination results of effective components ofOudemansiella raphanipes
从表5可以看出卵孢小奥德蘑子实体蛋白质和可溶性总糖含量分别为32.12%和24.25%,蛋白质含量比一般蔬菜高,接近于豆制品[14-15]。根据查找可以得出卵孢小奥德蘑子实体中蛋白质的含量比香菇、平菇和金针菇的含量高,而可溶性总糖只比金针菇低[16-18]。由此可以得出卵孢小奥德蘑是1种高蛋白的食用菌,可以丰富主要的氮源物质,改善人们的饮食结构。
2.2.2 氨基酸种类、含量及分析
卵孢小奥德蘑子实体具有味美、脆嫩和鲜香的特点,氨基酸对卵孢小奥德蘑的独特风味起着很大的作用,同时氨基酸的含量是生物蛋白质营养评价的主要因素。氨基酸组成与含量情况见表6、图7。

表6 氨基酸组成与含量Tab.6 Composition and content of amino acids
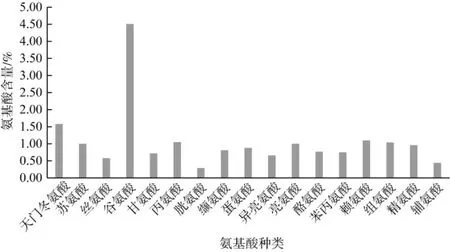
图7 氨基酸含量Fig.7 Composition and content of amino acids
由表6可知,卵孢小奥德蘑中17种水解氨基酸的总含量为18 153.29 mg/100g,占干物质的18.14%,其中7种必需氨基酸(除去色氨酸) 总含量为6 202.40 mg/100g,占总氨基酸总量的34.17%,与FAO/WHO模式提出的理想必需氨基酸含量为40%接近,表明卵孢小奥德蘑是一种较为理想的氨基酸食物源。
由图7可以很清楚地看出,卵孢小奥德蘑子实体17种水解氨基酸中谷氨酸的含量最高,天冬氨酸、丙氨酸和赖氨酸含量次之。呈鲜味的氨基酸主要有天冬氨酸、谷氨酸、丙氨酸和甘氨酸,含量高,其总量为7 960.94 mg/100g,占总氨基酸的43.33%,这也是卵孢小奥德蘑子菌实体具有独特风味的原因。精氨酸含量为960.63 mg/100g,精氨酸虽不是人体必需氨基酸,但是研究表明对母体中胚胎、胎儿生长发育和婴幼儿都有促进作用[19],van Vught等[20]在一项对6岁左右的儿童随访3年的研究得出,每天摄入量为2.8 g到3.2 g对身体生长速度促进作用最佳。必需氨基酸与FAO/WHO模式和鸡蛋模式的比较见表7。
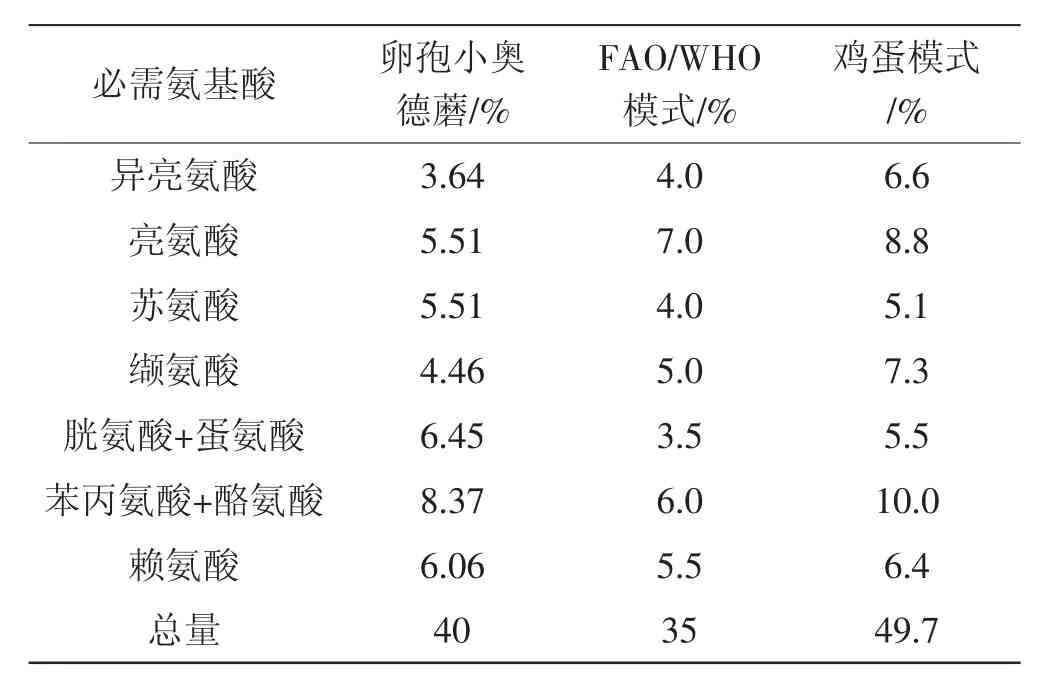
表7 必需氨基酸与FAO/WHO模式和鸡蛋模式的比较Tab.7 Comparison of essential amino acids in the FAO/WHO mode and the mode of egg
从表7中可以看出,卵孢小奥德蘑子实体中含有人体必需氨基酸高达40%,低于标准鸡蛋模式中的含量49.7%,但比标准鸡蛋模式更接近于FAO/WHO模式提出35%的理想值,表明卵孢小奥德蘑的营养价值比鸡蛋高。人体必需氨基酸评分与化学评分见表8。

表8 人体必需氨基酸评分与化学评分Tab.8 Essential amino acid score and chemical score
由表8可知,在必需氨基酸评分中,亮氨酸的评分值最低,这表明亮氨酸是卵孢小奥德蘑中第一限制性氨基酸,缬氨酸是第二限制性氨基酸,整体上看各必需氨基酸评分平均值都大于90,与标准蛋白的100接近;在化学评分中异亮氨基酸的评分值最低,其为第一限制性氨基酸,缬氨酸为第二限制性氨基酸,其总体评分在85左右;必需氨基酸指数(EAAI) 为92,与标准蛋白氨基酸组成特别接近;营养指数(NI) 为29,比彭智华、龚敏方报道的香菇、双孢蘑菇和草菇都高[21]。由此可以得出卵孢小奥德蘑是1种营养价值高,优质的蛋白质食物。
3 讨论
随着我国食用菌产业地快速发展,人们对食用菌的研究也越来越重视,大部分研究都集中在中间栽培环节对常规食用菌栽培配方的筛选,而对上游的菌种选育和下游的深加工产品研发相对较少,目前食用菌产业发展现状犹如梭子型,大量的栽培生产,大部分食用菌发生滞销现象。卵孢小奥德蘑是一种珍惜食用菌,2007年人工驯化栽培首次取得成功,2010年实现周年化的生产,目前已有多家企业实现了规模的半人工半工厂化栽培。
菌种培养条件优化的研究对食用菌产业的发展有着极其重要的作用,菌种的优劣决定着食用菌的产量。在菌种生产过程中,对菌种的生长速度、生物量、菌丝活力和抗逆性都有着严格的要求。菌落直径法是根据菌落向四周蔓延速度的测定来判断菌丝生长速度,有些食用菌菌丝属于气生菌丝,主要是不断地向上生长,很少向四周生长,这样就会给研究带来一定的误差;同时菌丝的致密度也很大程度地影响研究的结果,单凭菌丝的生长速度是无法真正反映菌种的生长情况。生物量法是依据在规定时间内对菌丝产量大小的测定来判断菌丝的生长情况,能准确地反映菌丝生长的致密度。采用菌落直径法和生物量法对菌种培养条件进行优化,可以准确地反映菌丝的生长速度、生物量、菌丝活力和抗逆性,筛选出菌种生产和保存的最佳培养条件。
卵孢小奥德蘑固体培养特性研究表明,采用菌落直径法得出菌丝在麦麸培养基中表现最佳,胡萝卜培养基和GPY培养基次之;培养温度31℃菌丝表现最佳,25℃次之;培养基初始pH为6.5时菌丝表现最佳,4.5次之。生物量法得出培养温度、培养基初始值的结果和菌落直径法相同,而最佳培养基结果不同,最佳培养基是GPY培养基,GPC培养基和麦麸培养基次之。根据实际生产要求选择适合的培养条件,菌种保藏建议选择GPY培养基,初始pH6.5和培养温度25℃,生长速度虽较慢,但菌丝抗逆性好,活力强;菌种生产建议选择麦麸培养基,其它相同,该培养条件具有成本低,菌丝生长速度快,可在短时间内给企业提供大量菌种。
卵孢小奥德蘑营养成分分析研究结果得出,其子实体中蛋白质、可溶性总糖和水解氨基酸的含量分别为32.12%、24.25%和18.14%;其中17种水解氨基酸的总含量为18 153.29 mg/100g,必需氨基酸总含量为6 202.40 mg/100g,占总氨基酸总量的34%,4种鲜味氨基酸总量为7 960.94 mg/100g,占总氨基酸含量的43.33%;氨基酸评分(AAS)、化学评分(CS)、必需氨基酸指数(EAAI) 和营养指数(NI)分别为90、85、92和29。从营养评价结果可以看出,卵孢小奥德蘑是1种高蛋白且营养丰富的食用菌,尤其鲜味氨基酸的含量特别高,可以作为天然健康调味品的原料,增加卵孢小奥德蘑的深加工产品,延伸其产业链,促进卵孢小奥德蘑产业的发展。
[2]郝艳佳.小奥德蘑属的系统学及中国该属的分类 [C]//中国菌物学会2015年学术年会论文摘要集.北京:中国菌物学会,2015:1.
[3]孙思国.卵孢小奥德蘑菌生产方法[P].山东:CN101218876,2008-07-16.
[4]连静.“菌中之侯”——卵孢小奥德蘑菌在山东金乡县人工规模化周年栽培成功[J].食用菌,2013(4):71-72.
[5]孙凯,郭晓萌,牟德华,等.双正交法优化醇洗-水提卵孢小奥德蘑菌多糖的研究[J].食品工程,2016(2):35-38,41.
[6]吴素蕊,严明,张鑫,等.响应面法优化水提卵孢小奥德蘑菌多糖工艺[J].食品工业,2016(5):169-172.
[7]徐兵,张雅君,冀宏.卵孢小奥德蘑菌丝体液体发酵条件优化[J].常熟理工学院学报,2017(2):104-108.
[8]孙磊,程显好,李维焕,等.菌落直径法和菌丝干重法在优化真姬菇菌种固体斜面培养条件的比较[J].中国食用菌,2015 (3):28-32.
[9]NY/T1676-2008,食用菌中粗多糖含量的测定[S].
[10]GB/T15673-2009,食用菌中粗蛋白含量的测定[S].
[11]董丹丹.浙江省主栽食用菌营养成分分析及其多糖品质与结构研究[D].杭州:浙江工业大学,2012.
[12]彭智华,龚敏方.蛋白质的营养评价及其在食用菌营养评价上的应用[J].食用菌学报,1996(3):56-64.
[14]王芳,冯冲,简在荣,等.大豆蛋白含量多样性分析[J].安徽农业科学,2012(11):6403-6405.
[15]李英丽,果秀敏,方正,等.15种蔬菜营养成分评价[J].中国农学通报,2007(4):98-100.
[16]况丹.七种食用菌营养成分分析比较[J].食用菌,2011(4):57-59.
[17]白岚,樊金献.三种食用菌营养成分分析(简报)[J].河北科技师范学院学报,2008(1):78-80.
[18]史琦云,邵威平.八种食用菌营养成分的测定与分析[J].甘肃农业大学学报,2003(3):336-339,345.
[19]黄珍茹,蔡美琴.精氨酸在人早期生长发育过程中的作用[J].上海交通大学学报:医学版,2016(3):451-454.
[20]van Vught AJAH,Dagnelie PC,Arts ICW,et al.Dietary arginine and linear growth:the Copenhagen school child in tervention study[J].Copenhagen British Journal of Nutrition,2012(6):1031-1039.
[21]彭智华,龚敏方.蛋白质的营养评价及其在食用菌营养评价上的应用[J].食用菌学报,1996(3):56-64.
Analysis on Characteristics and Nutritional Components of Oudemansiella raphanipes by Solid Culture
OU Sheng-ping,CHENG Xian-hao,GAO Xing-xi,LI Wei-huan,YANG Tao,SUN Lei
(College of Agricultural,Ludong University,Yaitai 264025,China)
In order to study the characteristics and nutritional components of Oudemansiella raphanipes by solid culture,according to the study on characteristics of O.raphanipes by solid culture,taking the colony diameter method,the optimum medium and the initial pH value of mycelium growth was wheat bran(pH6.5),using the mycelium dry weight method,the optimum medium and the initial pH value of mycelium growth was GPY(pH6.5),the optimum growth temperature was 31℃,and the results of the two methods were consistent.At the same time,component analysis results of O.raphanipes showed that the content of protein,soluble sugar and amino acids in the fruiting body were 32.12%,24.25%and 18.14%,and the total content of 17 kinds of amino acid were 18 153.29 mg/100g.Amino acid per gram of nitrogen according to the standard for evaluation model were compared with the whole egg protein amino acid and FAO/WHO model.The amino acid score(AAS),chemical score(CS),essential amino acid index(EAAI)and nutritional index(NI)were 90,85,92 and 29,and O.raphanipes was high nutritional value of edible fungi.
Oudemansiella raphanipes;culture characteristics;component analysis
S646.9
A
1003-8310(2017)05-0052-08
10.13629/j.cnki.53-1054.2017.05.013
山东省现代农业技术体系食用菌产业创新团队(SDAIT-11-011-11);山东省自然科学基金(ZR2010CL020)。
欧胜平(1992-),男,在读本科生,研究方向为农学。E-mail:980146788@qq.com
**通信作者:程显好(1966-),男,博士,教授,主要从事菌物生态学和食药用菌产品研发。E-mail:chengxianhao@sohu.com
2017-07-10

