藏药余甘子鞣质部位主要药效成分在人工胃肠液中的稳定性研究*
吴玲芳,叶婷,梁林金,梁文仪,陈文静,李 师,崔亚萍,亓 旗,张兰珍
(北京中医药大学中药学院 北京 100102)
藏药余甘子鞣质部位主要药效成分在人工胃肠液中的稳定性研究*
吴玲芳,叶婷,梁林金,梁文仪,陈文静,李 师,崔亚萍,亓 旗,张兰珍**
(北京中医药大学中药学院 北京 100102)
目的:研究余甘子鞣质部位主要药效成分在人工模拟胃、肠液中的稳定性,为余甘子体内代谢研究提供依据。方法:采用人工模拟胃液、肠液,体外温孵,HPLC-UV法测定余甘子鞣质部位中主要药效成分的含量变化情况;分别考察余甘子鞣质部位主要药效成分在人工胃肠液中的稳定性。结果:余甘子鞣质部位中主要药效成分没食子酸、柯里拉京、鞣花酸在人工胃液中比较稳定,含量变化不明显,降解剩余量在100%左右波动,半衰期大于90 h;在人工肠液中不稳定,含量先增加后减少,降解剩余量在100-300%之间波动,半衰期大于10 h。结论:余甘子鞣质部位主要药效成分在人工胃液中比较稳定,各成分含量变化不明显;余甘子鞣质部位主要药效成分在人工肠液中不稳定,主要成分含量先增加后减少,推测大分子可水解鞣质可以转化成小分子成分,但是随着时间延长所有成分均在降解。
余甘子 鞣质部位 人工胃 肠液 稳定性
余甘子PhyllanthusemblicaL.为大戟科Euphorbiaceae叶下珠属植物余甘子的干燥成熟果实为藏族习用药材[1]。余甘子鲜果酸甜酥脆而微涩,回味甘甜,故名余甘。《唐本草》称之为庵摩勒,《本草纲目》称之为庵摩落迦果。余甘子味甘、酸、涩、凉,归肺、胃经,具有清热凉血,消食健胃,生津止咳的功效。在传统藏药中,余甘子主治培根病、赤巴病、血病、高血压病等。研究药理学研究表明,余甘子具有抗炎,抗氧化,抗衰老,保肝等作用[2]。藏药多富含鞣质,组成“大三果”的余甘子、诃子、毛诃子均以鞣质为主要成分。余甘子中富含鞣质类、酚酸类、黄酮类和生物碱类等成分,其中鞣质类和酚酸类成分具有较强的抗肿瘤作用[3-8]。本课题组前期研究并报道了余甘子鞣质部位的提取纯化工艺、总鞣质含量测定、主要单体成分含量测定以及余甘子药材及指纹图谱评价研究[9-14],对余甘子鞣质部位体外部分进行了系统研究。
中药最常见的给药方式是口服,余甘子多以散剂服用,而中药及其复方要发挥临床疗效,必须经人体吸收入血,到达靶器官,发生一系列的体内代谢过程,最后经粪便或者尿液排出体外,即药物的ADME过程。口服药物第一步是进入胃肠,即药物发生体内代谢的第一个过程。从胃肠道吸收层面,研究中药指标成分吸收动力学特征,有利于进一步阐明其体内药动学基础[15]。目前未见文献报道余甘子药效成分在人工胃、肠共孵液中的稳定性研究,故本实验重点对影响口服药物吸收的胃肠道环境下药物主要药效成分的稳定性开展研究,为后期开展其吸收动力学研究提供基础。
1 实验材料
1.1 仪器
高效液相色谱仪:Waters 1525型;DAD检测器;分析软件:Empower;手动进样器;十万分之一电子分析天平:(Sartorious,BT 25S,北京赛多利斯仪器有限公司);超声波清洗器(KQ-500DE昆山超声仪器有限公司);恒温水浴锅(国华电器有限公司);具塞玻璃管(北京汇海科仪有限责任公司);涡旋混合器(北京北德科学器材有限公司);微孔滤膜(津腾);1 mL注射器(国药集团);移液枪(eppendorf Research plus);枪头(北京汇海科仪有限公司)。
1.2 材料
余甘子药材购自北京藏医院(产地为尼泊尔)、经北京中医药大学生药系阎玉凝教授鉴定为大戟科植物余甘子Phyllanthus emblicaL.的干燥果实。没食子酸、柯里拉京、鞣花酸对照品,均购自成都曼斯特生物科技有限公司,中国科学院成都生物研究所,纯度为98%,符合含量测定的要求。
1.3 试剂
甲醇(Fisher,色谱纯);蒸馏水(屈臣氏);其他试剂均为分析纯
2 方法
2.1 高效液相色谱条件
Diamonsil C18色谱柱(250×4.6 mm,5 μm);柱温:30℃;流动相为A(甲醇):(B)0.2%冰醋酸水;流速为1 mL·min-1;检测波长:270 nm。
2.2 没食子酸、柯里拉京、鞣花酸供试品溶液配制
余甘子鞣质部位的制备:取一定量余甘子药材,粉碎,过筛,一定量乙醇提取,过大孔树脂纯化,回收至小体积,减压干燥。
没食子酸:精密称取没食子酸对照品2.34 mg,转移至25 mL棕色容量瓶中,用50%甲醇水溶解并稀释至刻度线,摇匀,放置,作为没食子酸储备液,浓度为0.093 6 mg·mL-1。
柯里拉京:精密称取柯里拉京对照品5.50 mg,转移至10 mL棕色容量瓶中,用50%甲醇水溶解并稀释至刻度线,摇匀,放置,作为柯里拉京储备液,浓度为0.55 mg·mL-1。
鞣花酸:精密称取鞣花酸对照品4.50 mg,转移至25 mL棕色容量瓶中,用50%甲醇水溶解并稀释至刻度线,摇匀作为鞣花酸储备液,浓度为0.18 mg·mL-1。
2.3 人工胃肠液的配制:
人工胃液:精密吸取稀盐酸16.4 mL,置于1 000 mL量瓶,加蒸馏水约800 mL,胃蛋白酶约10 g,摇匀后加蒸馏水稀释至1 000 mL,摇匀,即得,PH约为1.5。
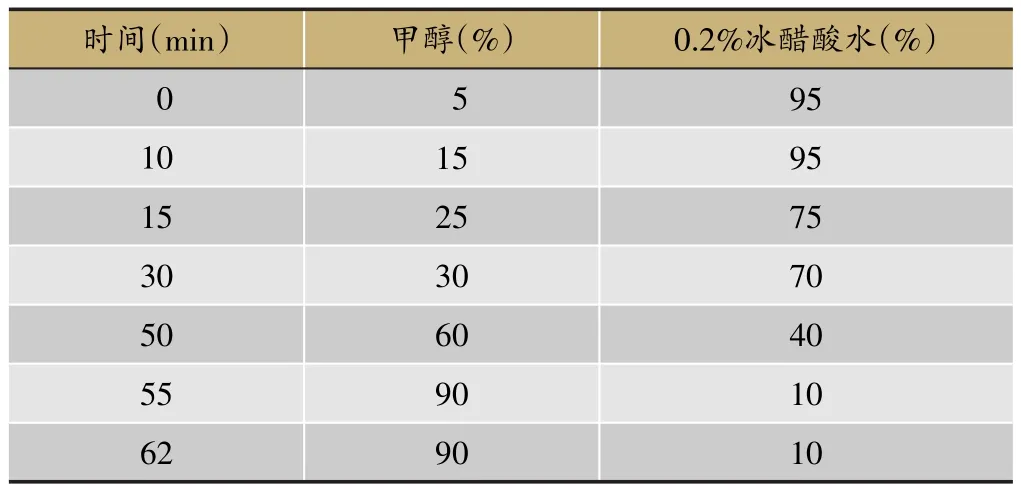
表1 流动相梯度
人工肠液:称取氯化钠7.8 g,氯化钾0.35 g、氯化钙0.37 g、碳酸氢钠1.37 g,磷酸二氢钠0.32 g、氯化镁0.02 g、葡萄糖1.4 g,置于1 000 mL量瓶,加蒸馏水定容至1 000 mL,摇匀即得,PH约为6.8。
2.4 余甘子鞣质部位中主要药效成分在人工胃液中稳定性考察:
精密称取实验室前期制备的余甘子鞣质部位5.05mg,转移至10mL棕色容量瓶中,用2.3项下制备的人工胃液溶解至刻度,得到溶液浓度浓度为0.505 mg·mL-1。将上述溶液转移至具塞试管中,平行5管,(37±1)℃避光孵育,于0、2、4、6、8、10、12 h,取样0.5 mL ,0.45 μm滤膜过滤,进高效液相色谱仪分析。
2.3 余甘子鞣质部位中主要药效成分在人工肠液中稳定性考察:
精密称取实验室前期制备的余甘子鞣质部位5.00 mg,转移至10 mL棕色容量瓶中,用2.3项下制备的人工肠液溶解并定容至刻度,得到溶液浓度为0.500 mg·mL-1。将上述溶液转移至具塞试管中,平行5管,(37±1)℃避光孵育,于0、2、4、6、8、10、12 h,分别取样0.5 mL,0.45 μm滤膜过滤,进液相色谱分析。
3 结果和分析
3.1 线性范围的考察
精密吸取没食子酸储备液50、150、300、600、900、1 200、1 600、2 000 μL于2 mL容量瓶中,加50%的甲醇水溶液稀释至刻度线,既得没食子酸标准系列对照品溶液。0.45 μm滤膜过滤,按照2.1项下色谱条件进高效液相色谱仪测定,以对照品浓度为横坐标,以峰面积为纵坐标,得到:没食子酸标准曲线Y=2*106X-48 504,r=0.999 9,线性范围为0.046 8~1.872 μg。
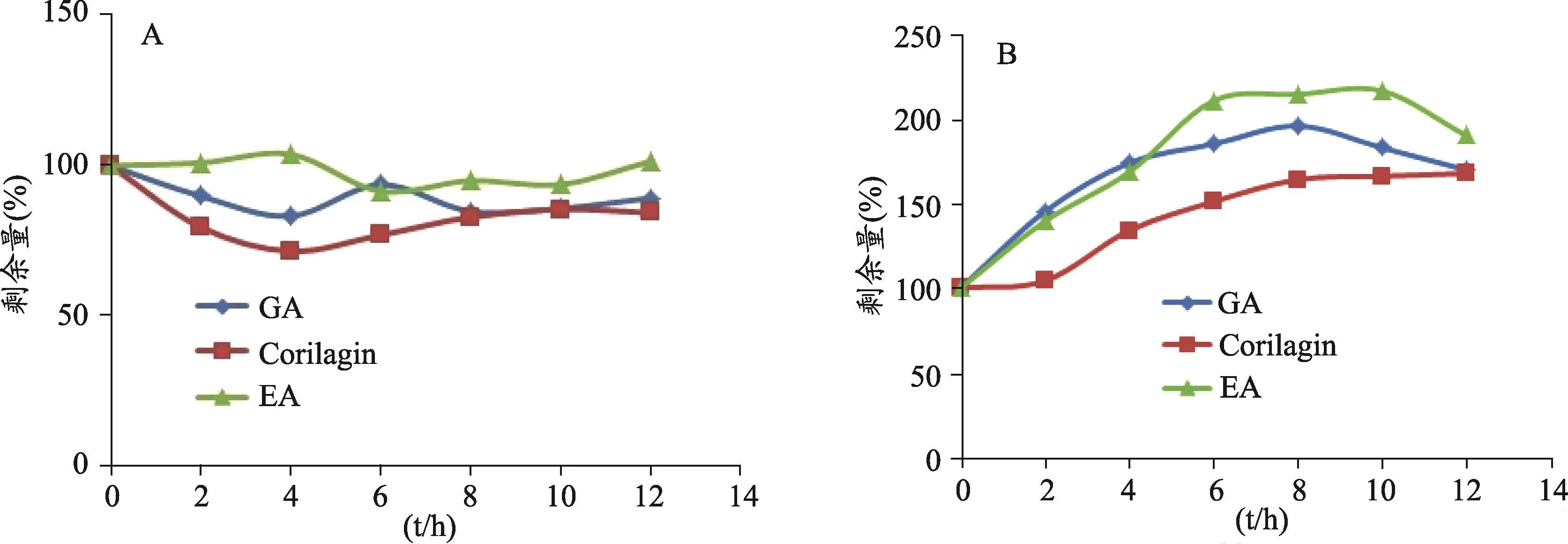
图1 余甘子鞣质部位中主要成分在人工胃(A)、肠(B)液中剩余含量曲线
精密吸取柯里拉京储备液50、150、300、600、900、1 200 μL于2 mL容量瓶中,加50%的甲醇水溶液稀释至刻度,既得柯里拉京标准系列对照品溶液。0.45 μm滤膜过滤,按照2.1项下色谱条件进高效液相色谱仪测定,以对照品浓度为横坐标,以峰面积为纵坐标,得到:柯里拉京标准曲线Y=85 883X-13 156,r=0.999 9,线性范围为0.275~11.00 μg。
精密吸取鞣花酸储备液 20、50、150、300、600、1 200、1 600、2 000 μL于2 mL容量瓶,加50%的甲醇水溶液稀释至刻度,既得鞣花酸标准系列对照品溶液。0.45 μm滤膜过滤,按照2.1项下色谱条件进高效液相色谱仪测定,以对照品浓度为横坐标,以峰面积为纵坐标,得到:鞣花酸标准曲线Y=1E+06X-552.2,r=0.999 9,线性范围为0.036~3.68 μg。
3.2 精密度考察
取2.2项下供试品溶液,按照2.1项下方法,取没食子酸、柯里拉京、鞣花酸对照品高、中、低浓度样品各3份,重复进样6次,测定没食子酸、柯里拉京、鞣花酸峰面积,其中高浓度三者的RSD值分别为1.30%、0.90%、1.12%,中浓度三者的RSD值分别为1.60%、0.71%、1.42%,低浓度三者的RSD值分别为1.80%、1.01%、0.99%,表明仪器精密度良好。
3.3 稳定性考察
取2.2项下供试品溶液,按照2.1项下方法,分别于制备后0,2,4,6,8,12,24 h进样,测定没食子酸、柯里拉京、鞣花酸峰面积,计算RSD值分别为1.85%、0.57%、1.98%,表明对照品溶液在24 h基本稳定。
3.4 重复性考察
精密称取同一批余甘子鞣质部位粉末,按照2.2项下制备成6份供试品溶液进行含量测定,计算出没食子酸、柯里拉京、鞣花酸含量的RSD值分别为1.58%、2.53%、2.00%,表明该方法重复性良好。
3.5 回收率
取已知含量的余甘子鞣质部位样品9份,每份约5 mg,精密称定,分别加入一定体积的没食子酸、柯里拉京、鞣花酸对照品溶液,加50%甲醇分别定容至10 mL,25 mL,50 mL容量瓶,得到高、中、低浓度余甘子鞣质部位样品各3份,按照2.1项下方法测定并计算高、中、低浓度下三者平均回收率分别为:高浓度100.20%,100.60%,101.20%,RSD值分别为,2.58%、1.53%、1.20%,中浓度100.40%,101.40%,101.10%,RSD值分别为,1.20%、1.33%、1.24%,低浓101.03%,101.90%,101.48%,RSD值分别为,1.90%、1.42%、1.67%。
3.6 余甘子鞣质部位在人工胃肠液中稳定性
余甘子鞣质部位在人工胃、肠液平均剩余含量(%)随时间(h)变化曲线如图1所示,结果显示,余甘子鞣质部位中没食子酸(GA)、柯里拉京(Corilagin)、鞣花酸(EA)在人工胃液中比较稳定,剩余量在100%左右波动,变化不明显。经强制一级速率降解方程模拟,其半衰期均大于90 h,故未给出相应的降解参数;而余甘子鞣质部位中没食子酸(GA)、柯里拉京(Corilagin)、鞣花酸(EA)在人工肠液里含量均先增加后减少,推测由其他成分分解而来,剩余量在100-300%之间波动,经强制一级速率降解方程模拟,其半衰期均大于10 h,故在此也未给出相应的的降解参数。
4 总结与讨论
可水解鞣质是由酚酸与多元醇通过苷键和酯键形成的化合物,其组成的基本单位是没食子酸,具有酯键或甙键,易被酸、碱、酶催化水解。水解后的产物又分为没食子酸和鞣花酸。余甘子富含鞣质,且主要为可水解鞣质,并具有多种药理活性。在传统藏医药理论中余甘子均为口服给药,胃肠道吸收是研究药物代谢的第一个环节,其在胃肠道中存在形式研究将为体内ADME奠定基础。
本研究发现余甘子鞣质部位在人工胃液中比较稳定,由于鞣质部位中各成分均为酸性成分,故其在酸性环境中比较稳定,存在可逆的酸水解,故各成分的含量在100%左右波动。余甘子鞣质部位在人工肠液中不太稳定,大分子的可水解鞣质可以水解产生没食子酸、鞣花酸以及柯里拉京,故三者含量均呈现先增加的趋势,随着时间延长,所有成分在碱性环境中均会逐渐减少,故呈现后减少的趋势。于是我们推测,在人工胃液中,余甘子鞣质部位并未发生显著地酸水解,各成分几乎处于动态平衡中;而在人工肠液中,余甘子鞣质部位在人工肠液里面不稳定。
1 贾敏如,李星炜.中国民族药志要.北京:中国医药科技出版社,2005:456-457.
2 杨顺楷,杨亚力,杨维力.余甘子资源植物的研究与开发进展.应用与环境生物学报,2008,14(6):846-854.
3 Yahayo W,Supabphol A,Supabphol R.Suppression of Human Fibrosarcoma Cell Metastasis byPhyllanthus emblicaExtract in Vitro.Asian Pac J Cancer Prev,2013,14(11):6863-6870.
4 Zhao T J,Sun Q,Marques M,et al.Anticancer Properties ofPhyllanthus emblica(Indian Gooseberry).Oxid Med Cell Longev.2015.
5 Mahata S,Pandey A,Shukla S,et al.Anticancer Activity ofPhyllanthus emblicaLinn.(Indian Gooseberry):Inhibition of Transcription Factor AP-1 and HPV Gene Expression in Cervical Cancer Cells.Nutr Cancer,2013,65:88-97.
6 Jayathilake C,Rizliya V,Liyanage R..Antioxidant and Free Radical Scavenging Capacity of Extensively Used Medicinal Plants in Sri Lanka.International Conference of Sabaragamuwa University of Sri Lanka,2016,6(6):123-126.
7 Purushothaman A,Nandhakumar E,Sachdanandam P.Phytochemical analysis and anticancer capacity of Shemamruthaa,a herbal formulation against DMBA-induced mammary carcinoma in rats.Asian Pac J Trop Me.2013,6(12):925-933.
8 Leelawat.Molecular mechanisms of cholangiocarcinoma cell inhibition by medicinal plants.Oncology Letters.2017,13(2):961-966.
9 冯光远,李登科,吴玲芳,等.藏药余甘子鞣质部位对小鼠移植性肿瘤的抑制作用.中国药物警戒,2015,12(4):193-196.
10 赵海娟,龚曼,常青,等.藏药余甘子鞣质部位对HT1080细胞迁移与侵袭能力的影响研究.2014,11(5):264-267.
11 徐仪霞.余甘子化学成分及总酚提取工艺研究.北京中医药大学硕士学位论文,2009:1-93.
12 吴玲芳,张鸿雁,张兰珍,等.不同产地藏药余甘子总鞣质含量测定.中国实验方剂学杂志,2013,19(15):61-63.
13 张鸿雁,沙磊,石任兵,等.RP-HPLC法测定不同产地余甘子药材和鞣质有效部位中3种成分的含量.中华中医药杂志,2012,27(11):2834-2837.
14 孙雪飞,张鸿雁,张兰珍,等.藏药余甘子药材及其鞣质部位的指纹图谱评价研究.中国中药杂志.2014,39(7):1773-1778.
15 毛茜,傅超美,胡慧玲,等.川木香煨制前后主要药效成分在人工胃、肠液及大鼠离体胃肠共孵液中的稳定性研究.中国中药杂志,2012,37(6):785-789.
Research on Stability of Tannin Part in Phyllanthus Emblica L.inArtificial GastricAnd Intestinal Juice
Wu Lingfang,Ye Ting,Liang Linjin,Liang Wenyi,Chen Wenjing,Li Shi,Cui Yaping,Qi Qi,Zhang Lanzhen
(School of Chinese Materia Medica,Beijing University of Chinese Medicine,Beijing 100102,China)
This article was aimed to study the stability of tannin parts inPhyllanthus emblicaL.in artificial gastric and intestinal juice,in order to provide a foundation for in vivo studies ofPhyllanthus emblicaL.HPLC-UV was used to determine the contents of main ingredients.The results showed that stability of main ingredients of tannin parts inPhyllanthus emblicaL.,including gallic acid(GA),corilagin and ellagic acid(EA),in the artificial gastric juice.The content change was not obvious.The residual content was within 100%.The half-life was above 90 h.They were unstable in the artificial intestinal juice.The content was first increased and then decreased.The residual content was 100-300%.The half-life was above 10 h.It was concluded that the tannin parts inPhyllanthus emblicaL.was stable in artificial gastric juice.And content changes of main components were not obvious.The tannin parts inPhyllanthus emblicaL.were unstable in artificial intestinal juice.The main ingredients were first increased and then decreased.It was speculated that macromolecule can hydrolyze tannin part into small molecules.However,as time increases,all components may be decomposed.
Phyllanthus emblica L.,tannin part,artificial gastric and intestinal juice,stability
10.11842/wst.2017.08.023
R33
A
2017-03-21
修回日期:2017-07-11
* 国家自然科学基金面上项目(81274187):基于藏药余甘子酚酸类成分体内动态变化的的抗癌药效物质与质量控制,负责人:张兰珍。
** 通讯作者:张兰珍,研究员,博士生导师,主要研究方向:中药药效物质和质量控制研究。
(责任编辑:张娜娜,责任译审:王 晶)

