维药阿里红多糖对运动性免疫抑制改善的作用机制研究*
王凤华,孔海军,黄 玲
(1.新疆师范大学体育学院运动生物化学实验室 乌鲁木齐 830054;2.济南艾迪康医学检验中心 济南 250013)
维药阿里红多糖对运动性免疫抑制改善的作用机制研究*
王凤华1**,孔海军1,黄 玲2
(1.新疆师范大学体育学院运动生物化学实验室 乌鲁木齐 830054;2.济南艾迪康医学检验中心 济南 250013)
目的:探讨维药阿里红多糖(FoP)的抗运动疲劳及运动免疫抑制作用,为维药阿里红作为天然抗氧化剂及免疫调节剂的开发利用提供实验依据。方法:通过递增负荷跑台运动建立长期运动疲劳及运动免疫抑制模型,不同剂量FoP作用于实验动物,将实验动物随机分为阳性对照组、阴性对照组、低剂量FoP(20 mg·kg-1)+运动组、中剂量FoP(40 mg·kg-1)+运动组、高剂量FoP(80 mg·kg-1)+运动组,每周灌胃6天,共8周,灌胃期间进行递增负荷跑台运动。8周后处死取材,试剂盒检测丙二醛(MDA)、超氧化物歧化酶(SOD)、血红蛋白(HB)、肌酸激酶(CK)水平,RT-PCR检测IL-4mRNA、INF-γ mRNA相对表达量。结果:与阳性对照组比较,FoP可以显著提高小鼠HB水平,FoP各剂量组血清CK水平出现显著下降;与阳性对照组比较,FoP组可显著消除MDA,FoP各剂量组间无显著差异;FoP各剂量组及阴性对照组血清SOD含量显著高于阳性对照组;FoP各剂量组IL-4 mRNA/INF-γmRNA比值基本处于平衡状态。结论:维药阿里红多糖可以有效促进机体疲劳恢复,加快自由基的清除,并显著改善机体的抗氧化能力及免疫状态。
维药阿里红多糖 运动疲劳 自由基 抗氧化 运动免疫抑制
长期大强度运动可以诱发机体的免疫系统功能失衡,导致机体运动能力下降,如何有效改善运动免疫抑制现象已经成为运动医学范畴的研究热点[1]。在运动应激状态下,免疫抑制因子大量增殖,可严重抑制淋巴细胞生成白介素(IL)-2,从而抑制T、B淋巴细胞的生成,同时,运动过程中产生的大量自由基可诱导淋巴细胞的大量凋亡。因此,通过改善机体抗氧化能力,是纠正运动免疫抑制状态的有效途径。近年来,中草药及其提取物的抗免疫抑制作用受到国内外研究者的广泛关注。
阿里红(Fomes officinalisAmes,FoA),为担子菌纲(Basidiomycetes)多孔菌目(Polyporales)多孔菌科(Polyporaceace)层孔菌属(Fomes Fr.)之多年生真菌[2]。研究表明,阿里红具有温胃祛痰、降气平喘、祛风除湿和消肿利尿之功用,常用于治疗慢性支气管炎与各种癌症[3-4]。维药阿里红多糖(FoP)是维药阿里红中的主要有效成分,可显著提高机体的抗氧化能力,但目前国内外鲜有将FoP应用于运动性免疫调理的研究。
研究在运动应激过程中,机体免疫细胞功能及增殖的特性,对于我们了解运动影响机体免疫功能这样一个生物过程是非常重要的。机体抗氧化能力及免疫细胞增殖被视为评价免疫机能重要的指标。鉴于此,本研究基于造成运动性免疫抑制和发展的递增负荷运动模型,研究了FoP作用于运动疲劳及运动免疫失衡小鼠,分析补充FoP对小鼠抗氧化功能的改善,进而了解其对运动性免疫抑制改善的效果及机制,为维药阿里红作为天然抗氧化剂及免疫调节剂的开发利用提供实验依据。

表1 引物列表
1 材料与方法
1.1 材料
1.1.1 主要仪器与试药
高速冷冻离心机(Eppendorf);酶标仪(北京普天新桥技术有限公司);ZH-PT型动物实验跑台(淮北正华);PCR扩增仪(德国Biometra);水平电泳仪(北京六一);EP凝胶成像仪(美国Alpha);GDS8000型全自动图像分析系统(美国UVP);ABI 7300实时荧光定量PCR仪(美国ABI);恒温水浴锅(北京六一);分光光度计(德国Eppendorf)。
丙二醛(MDA)、超氧化物歧化酶(SOD)、血红蛋白(HB)、肌酸激酶(CK)测试试剂盒(南京建成生物公司);动物组织总RNA提取试剂盒(天根生化科技有限公司);基因扩增引物(上海生工);反转录试剂盒(天根生化科技有限公司);FoP提取物(乌鲁木齐市中医院)。
1.1.2 实验动物
8周龄SPF级昆明小鼠50只,雄性,体重21.6±1.9 g,(购自新疆医科大学动物实验中心,许可证号:SCXX(新)2011-0003),动物统一使用营养饲料饲喂,鼠笼置于24±2℃室温条件下,湿度50%-55%,光照12/12 h光照/黑暗。
1.2 方法
1.2.1 动物训练方法
小鼠在实验室动物房适应性饲养2天后进行3天的适应性跑台训练,每天1次,每次15-30 min,待小鼠能以20 m·min-1的速度持续运动30 min,正式开始建模。本实验采用刘晓莉、乔德才[5]等的小鼠跑台运动模型进行训练,动物运动过程中,采用声、光、电刺激鼠尾部,使其持续运动。在持续运动中,个别动物不能维持规定的运动强度时,中间可休息1-2 min,但总休息时间不能超过5 min。连续刺激或休息时间超过5 min仍不能维持原强度工作的动物,视为力竭。实验周期为8周,动物实验每周训练6天(周一至周六训练,周日休息),前4周每天进行1次训练,其余各周为每天早晚各1次;饲养条件相同。
1.2.2 给药方法及分组情况
每次运动实验后E1、E2、E3组分别人工灌胃灌注0.2 mL低剂量FoP稀释液(20 mg·kg-1)、中剂量FoP稀释液(40 mg·kg-1)、高剂量FoP稀释液(80 mg·kg-1);阳性对照组即运动后不给药的小鼠;阴性对照组即正常饲养的小鼠。
1.2.3 样本采集与测试
第8周最后一次跑台运动后,即刻摘眼球取血,血液立即离心,取血清,低温保存备用,另保存抗凝全血备用。取小鼠血清,使用丙二醛(MDA)、超氧化物歧化酶(SOD)、肌酸激酶(CK)测试试剂盒检测上述指标;使用血红蛋白(HB)试剂盒检测全血血红蛋白。将小鼠全血0.1 mL加1 mL TRNzol,将样品在15-30℃放置5 min,4℃ 12 000 rpm离心10 min,取上清,加0.2 mL氯仿,剧烈震荡15 s,室温放置3 min。4℃12 000 rpm离心10 min,取上清,加入等体积异丙醇,混匀,室温放置20 min。4℃12 000 rpm离心10 min,取上清,使用75%乙醇洗涤沉淀,室温晾干,备用。使用30 ul ddH2O溶解沉淀,选择GAPDH作为内参,进行RT-PCR反应,GAPDH、IL-4、INF-γ引物5′-3′序列见表1。使用ABI系统完成qRT-PCR过程,95℃30 s(1 cycle);随后进行40个循环,每一循环包括94℃ 20 s,55℃ 20 s,72℃ 30 s,收集荧光信号。根据相对标准曲线法(Ct目的基因-Ct内参基因=ΔCt),计算IFN-γmRNA、IL-4 mRNA 的表达值。
1.3 统计方法
实验数据使用xˉ±s表示,数据分析使用SPSS22.0数据包进行显著性差异分析,P<0.05表示有显著性差异,P<0.01表示有非常显著差异,通过Graph Pad 5软件包进行图表绘制。
2 结果
2.1 FoP对运动疲劳小鼠的抗运动疲劳作用
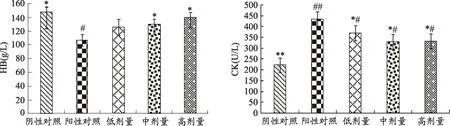
图1 FoP对小鼠全血HB、血清CK水平的影响
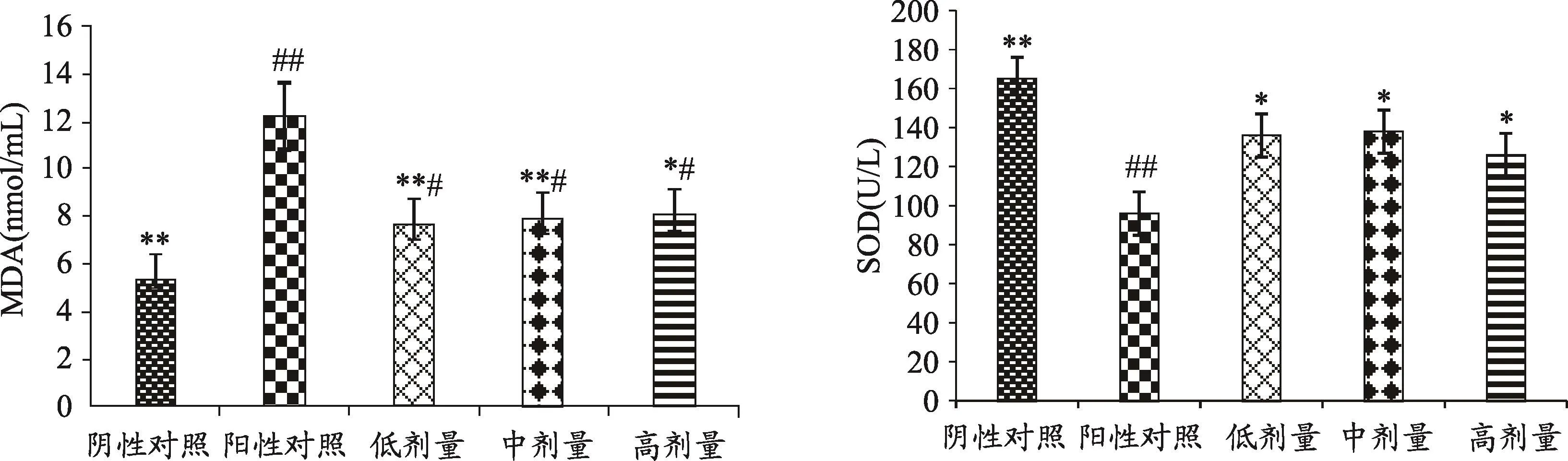
图2 FoP对小鼠血清MDA、SOD水平的影响
由图1可知,经过8周递增负荷运动实验,阳性对照组HB水平明显低于阴性对照组(P<0.05),FoP中高剂量组小鼠全血血红蛋白水平显著高于阳性对照组(P<0.05),低剂量组HB水平高于阳性对照组,但差异不显著(P>0.05);与阳性对照组比较,各剂量组血清CK水平出现显著下降(P<0.05),同时,各剂量组血清CK水平显著高于阴性对照组(P<0.05)。
2.2 FoP对运动疲劳小鼠的抗氧化作用
研究证明,机体的抗氧化系统是一个可与免疫系统相比拟的、具有完善和复杂功能的系统,运动疲劳状态下,机体内自由基大量生成,同时自由基清除机制却呈抑制状态,结果造成体内自由基大量积聚,造成组织细胞的损伤[6,7]。由图2可知,就小鼠血清MDA水平而言,FoP各剂量组显著低于阳性对照组(P<0.05),且显著高于阴性对照组(P<0.01),阴性对照组显著低于阳性对照组(P<0.01);FoP各组间比较无显著差异(P>0.05)。
FoP各剂量组及阴性对照组血清SOD含量显著高于阳性对照组(P<0.05),与阴性对照组比较,FoP各组提升酶活性能力无显著差异(P>0.05)。
2.3 FoP对小鼠IL-4、TNF-α mRNA表达水平的影响
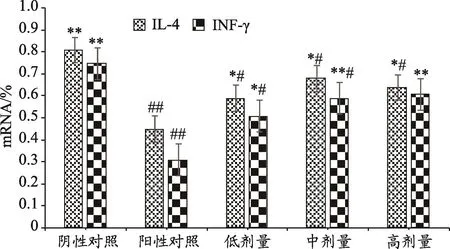
图3 FoP对运动疲劳小鼠IL-4mRNA、INF-γ mRNA相对表达量的影响
通过对8周运动实验后小鼠IL-4 mRNA、INF-γ mRNA表达水平的变化情况,可以观察到阳性对照组IL-4 mRNA、INF-γ mRNA表达水平相对阴性对照组显著下降(P<0.01),说明小鼠经递增负荷跑台训练处于运动免疫抑制状态。FoP各剂量组IL-4 mRNA表达水平显著高于阳性对照组;INF-γ mRNA表达水平相对阳性对照组显著上升,其中中、高剂量组与阳性对照组比较出现极显著上升(P<0.01)。FoP各剂量组IL-4 mRNA/INF-γ mRNA比值基本处于平衡状态,说明FoP各剂量组Th1/Th2免疫水平处于相对平衡状态。
3 讨论
国内外研究表明,运动疲劳尤其是长期疲劳积累状态下,机体的抗氧化能力及机能水平会发生适应性变化,运动过程中氧自由基的增加是导致运动性疲劳发生的一个重要因素[8-9]。HB(血红蛋白)是运动强度和运动量常用测试指标,血红蛋白主要生理功能是运输氧和二氧化碳,能综合反映在运动过程中血液携带氧的能力[10];肌酸激酶(Creatine Kinase,CK)通常存在于动物的心脏、肌肉以及脑等组织的细胞浆和线粒体中,是一个与细胞内能量运转、肌肉收缩、TP再生有直接关系的重要激酶,能够可逆地催化肌酸与ATP之间的转磷酰基反应[11-12]。实验结果表明,FoP可以显著提高运动疲劳小鼠的HB水平,并显著降低运动疲劳小鼠血清CK浓度,说明FoP具有较好的抗疲劳作用。
机体通过酶系统与非酶系统产生氧自由基,后者可以攻击生物膜中的不饱和脂肪酸(Poiyunstaturated Fatty Acid,PUFA),引发脂质过氧化作用,并因此形成脂质过氧化物。MDA水平常常可以反映机体内脂质过氧化的程度,间接反映机体细胞损伤的程度[13]。机体在运动疲劳状态下,产生大量氧自由基,虽然机体的自由基清除途径被激活,但仍然很难彻底清除氧自由基,残存的氧自由基诱导大量脂质过氧化物的产生,从而干扰生物膜的正常功能,继而引发机体的代谢紊乱[14,15]。本实验结果显示,FoP可有效降低运动疲劳小鼠血清MDA水平。
SOD能催化清除超氧阴离子自由基的反应,在防御生物体免受超氧阴离子自由基损伤、抗辐射、抗肿瘤及延缓机体衰老等方面具有重要的作用[16,17]。本次实验结果表明,FoP可明显提高运动疲劳小鼠血清SOD浓度。
在运动应激状态下,机体下丘脑-垂体-肾上腺皮质激素系统(HPA)失衡,皮质醇等激素含量异常升高,通过抗原递呈细胞胞浆及核内受体抑制IL-12产生,从而导致IFN-γ和IL-2含量降低,且NK细胞数量的减少致使其分泌的IFN-γ含量减少,导致Th1型免疫抑制,Th2型免疫优势[18]。研究结果表明,FoP作用于运动疲劳小鼠可诱导机体IL-4mRNA、TNF-α mRNA相对表达量的上升,逆转了运动疲劳状态下的运动免疫抑制。
维药阿里红多糖是一类真菌多糖,其研究价值在近年来得到了广泛关注。研究表明,FoP具有改善机体免疫水平、抗运动疲劳和增强免疫活性等作用[19]。本实验通过递增负荷跑台运动得到小鼠长期运动疲劳模型,并通过不同剂量FoP干预,实验结果显示,FoP可以显著改善长期运动疲劳小鼠抗氧化能力及免疫水平,并诱导运动疲劳小鼠IL-4mRNA、INF-γ mRNA相对表达量的上升,从而逆转运动疲劳状态下的运动免疫抑制。
1 宋博雅,郝选明.外源性补充Tα1对运动性免疫抑制发展过程中胸腺组织细胞的抗凋亡效应.陕西师范大学学报(自科版),2017,45(1):118-124.
2 帕丽达·阿不力孜,如斯塔木·托合尼牙孜,丛媛媛,米仁沙·牙库甫.阿里红多糖抗衰老作用研究.中华中医药杂志,2013,28(2):340-342.
3 帕丽达·阿不力孜,丛媛媛,王勇.阿里红多糖中糖醛酸的含量测定.食品科技,2010,35(3):284-286.
4 丛媛媛,阿地力·阿不力孜,帕丽达·阿不力孜,等.维药阿里红多糖的提取及免疫活性研究.中国现代应用药学,2010,27(7):569-571.
5 刘晓莉,苏美华,乔德才.运动疲劳诱导小鼠心肌细胞氧化应激与DNA损伤[.中国运动医学杂志,2008,27(5):621-623.
6 Zefang L,Zhang Z,Hongmei W U,et al.Phenolic Composition and Antioxidant Capacities of Chinese Local Pummelo Cultivars'Peel.Horticultural Plant Journal,2016,2(3):133-140.
7 Machu L,Misurcova L,Ambrozova J V,et al.Phenolic content and antioxidant capacity in algal food products.Molecules,2015,20(1):11-18.
8 Kaewseejan N,Sutthikhum V,Siriamornpun S.Potential of Gynura procumbens,leaves as source of flavonoid-enriched fractions with enhanced antioxidant capacity.J Func Foods,2015,12(4):120-128.
9 Alaphilippe A,Mandigout S,Ratel S,et al.Longitudinal follow-up of biochemical markers of fatigue throughout a sporting season in young elite rugby players.J Strength cond res,2012,26(12):3376.
10 张学军,禹娟红.复方中药营养补剂与运动能力研究进展中国药事,2016,30(9):903-911.
11 Mackinnon L T,Hooper S L,Jones S,et al.Hormonal,immunological,and hematological responses to intensified training in elite swimmers.Med Sci Sports Exerc,1997,29(12):1637-45.
12 Kaewseejan N,Sutthikhum V,Siriamornpun S.Potential of Gynura procumbens,leaves as source of flavonoid-enriched fractions with enhanced antioxidant capacity.J Funct Foods,2015,12(4):120-128.
13 Twist C,Eston R.Twist C,et al.The effects of exercise-induced muscle damage on maximal intensity intermittent exercise performance.Arbeitsphysiologie,2005,94(5-6):652-658.
14 张陵,万宁.氧自由基脂质过氧化反应所致运动性疲劳产生机制研究进展.中国实验诊断学,2006,10(9):1104-1108.
15 Li M H,Tang C F,Ouyang J Q.Influence of salidroside from Rhodiola Sachalinensis A.Bor on some related indexes of free radical and energy metabolism after exercise in mice..Zhongguo Ying Yong Sheng LI Xue Za Zhi,2012,28(28):53-56.
16 Olsvik P A,Kristensen T,Waagbø R,et al.mRNA expression of antioxidant enzymes(SOD,CAT and GSH-Px)and lipid peroxidative stress in liver of Atlantic salmon(Salmo salar)exposed to hyperoxic water during smoltification..Comp Biochem Phys Part C,2005,141(3):314-323.
17 Demir I,Kiymaz N,Gudu B O,et al.Study of the neuroprotective effect of ginseng on superoxide dismutase(SOD)and glutathione peroxidase(GSH-Px)levels in experimental diffuse head trauma.Acta Neurochirurgica,2013,155(5):913-922.
18 Gamil N M,Maklad Y A,Ahmed M A E,et al.Modulatory effect of cilostazol on tramadol-induced behavioral and neurochemical alterations in rats challenged across the forced swim despair test.Beni-Suef University Journal of Basic and Applied Sciences,2016,5(2):193-201.
19 陈永杰,吕小川,高剑,等.阿里红多糖对卡氏肺孢子菌肺炎大鼠外周血TNF-α、sICAM-1和IL-8和脾脏T细胞亚群的影响.医学动物防制,2016,32(2):179-182.
Effect of Inhibition of Uygur Fomes Officinalis Polysaccharides onAntioxidant Capacity and Exercise Immunity
Wang Fenghua1,Kong Haijun1,Huang Ling2
(1.Laboratory of Sports Biochemistry,School of Physical Education,Xinjiang Normal University,Urumqi 830054,China;2.Ji'nan ADICON Clinical Center,Jinan 250013,China)
This study was aimed to investigate the effects ofFomes officinalispolysaccharides(FoP)on exercise-induced fatigue and exercise immune suppression in mice with FoP induced by exercise fatigue and unbalanced exercise immunity.Through treadmill exercise,the long-term exercise immune suppression model fatigue was established.Different doses of FoP were used in the animal experiment.The experimental animal were randomly divided into the positive control group,negative control group,low dose FoP(20 mg·kg-1)+exercise group,middle dose FoP(40 mg·kg-1)+exercise group,and the high dose FoP(80 mg·kg-1)+exercise group.The intragastric administration was given 6 days per week for 8 weeks.Treadmill exercise was administered during these 8 weeks.After 8 weeks,the samples were sacrificed.The levels of malondialdehyde(MDA),superoxide dismutase(SOD),hemoglobin(HB)and creatine kinase(CK)were detected by kit.And the relative expression of IL-4mRNA,INF-γ mRNA was detected by RT-PCR.The results showed that compared with the positive control group,FoP can significantly improve the level of HB in mice,the level of serum CK in each FoP dose group was significantly decreased;compared with the positive control group,FoP group can significantly eliminate MDA with no significant difference among different FoP dose groups.The contents of SOD in serum of different dose FoP group and the negative control group were significantly higher than that of the positive control group.The IL-4 mRNA/INF-γ mRNA ratio of different dose FoP group were in basic equilibrium.It was concluded that Uygur FoP can effectively promote the body fatigue recovery,accelerate the clearance of free radicals,and improve the antioxidant ability and immune status.
UygurFomes officinalispolysaccharides,sports fatigue,free radical,antioxidant,exercise immune suppression
10.11842/wst.2017.08.022
R285
A
2017-03-15
修回日期:2017-06-23
* 国家自然科学基金地区科学基金项目(31660736):三倍体虹鳟不育相关miRNA的鉴定与表达调控研究,负责人:王凤华;2016年新疆维吾尔自治区研究生科研创新项目(XJGRI2016106):茶多酚+维药阿里红对运动疲劳恢复及血清TH1/TH2平衡干预研究,负责人:孔海军。
** 通讯作者:王凤华,博士,副教授,主要研究方向:主要从事运动生物化学研究。
(责任编辑:张 静,责任译审:王 晶)

