耐高温β-甘露聚糖酶毕赤酵母菌M27-8发酵条件优化
熊 进,黄魁英,夏枫耿,陈舒洁,胡海艳
(广州市微生物研究所,广东广州 510663)
耐高温β-甘露聚糖酶毕赤酵母菌M27-8发酵条件优化
熊 进,黄魁英,夏枫耿,陈舒洁,胡海艳*
(广州市微生物研究所,广东广州 510663)
为获得产β-甘露聚糖酶发酵最佳条件,本研究以克隆筛选获得的产耐高温β-甘露聚糖酶的毕赤酵母菌M27-8菌株为研究对象,对不同氮源含量、葡萄糖含量、pH、发酵时间、接种量、温度和转速进行优化。结果表明:最佳产酶条件为6%玉米浆、3%葡萄糖、pH 5.5、发酵60 h、2%接种量、28℃、225 r/min,最大酶活达到452.7 U/mL,是优化前酶活138 U/mL的3.3倍。综上,此发酵培养基可用较廉价的玉米浆取代YPD培养基,从而节省成本,为工业生产奠定基础。
β-甘露聚糖酶;毕赤酵母;发酵条件;优化
甘露聚糖作为半纤维素的第二大组分(Scheller等,2010;St。albrand等,1993),广泛存在于木材和各种植物组织中(Kansoh等,2004)。β-甘露聚糖酶能够水解含有甘露聚糖的有机物,已经广泛应用于饲料、造纸、医药、食品、精细化工等领域(Kansoh 等,2004;Bhat等,2000)。 甘露聚糖酶因在饲料应用中对酶的纯度要求不高,无需精制纯化,通过简单的发酵生产并喷雾干燥获得酶粉,一般就可作为饲料添加物混合使用(Chen等,2005)。在常用饲料原料中半纤维素含量丰富,因其在单胃动物消化道内会形成凝胶状,从而影响畜禽吸收和饲料利用率(Nunes等,1992)。β-甘露聚糖酶可添至饲料中,消除其中甘露聚糖的抗营养作用,提高饲料利用率,并且可促进肠道内有益菌群的增殖,增强畜禽免疫力(Cerqueira等2011;Zou 等,2006)。
目前许多工业用酶,要求具有高活性酶的同时,还需要耐热和耐酸性条件,因此,获得耐热性、耐酸性的β-甘露聚糖酶菌株的研究成为热点。目前,表达耐高温、耐酸性β-甘露聚糖酶的菌株应用到工业化生产中的不多。本研究对构建组成型β-甘露聚糖酶毕赤酵母高效表达体系,筛选的高酶活、耐热性和耐酸性较强的β-甘露聚糖酶菌株M27-8为研究对象,对培养基成分及培养条件进行优化,提高该菌株的产酶水平,为进一步扩大生产奠定良好基础。
1 材料与方法
1.1 材料与仪器 蛋白胨(贵州新华生化科技发展有限公司)、玉米浆干粉(山东康源生物科技有限公司)、酵母提取物(湖北安琪酵母股份有限公司);葡萄糖、磷酸氢钠、磷酸氢二钾、琼脂等试剂为国产分析纯。毕赤酵母菌M27-8(Pichia pastoris M27-8),由广东省种质资源库提供。
DHZ-DA大容量全温振荡器(江苏省太仓市实验设备厂);752N紫外可见分光光度计(上海精科仪器有限公司);HR/T20M台式高速冷冻离心机(湖南赫西仪器装备有限公司);XW-80旋涡混合仪 (海门市其林贝尔仪器制造有限公司);PHS-3C pH计(上海仪电科学仪器股份有限公司)。
1.2 试验方法
1.2.1 试剂 PTM1微量元素:CuSO4·5H2O 6.0 g/L、NaI 0.08 g/L、MnSO4·H2O 3.0 g/L、Na2MoO4·2H2O 0.2 g/L、H3BO30.02 g/L、CoCl20.5 g/L、ZnCl220.0 g/L、FeSO4·7H2O 65.0 g/L、 生物素 0.2 g/L、 浓 H2SO45.0 ml/L,过滤除菌。发酵培养基发酵前按照4.0 mL/L比例补充PTM1。
0.5%甘露聚糖溶液(pH5.0):用pH 5.0磷酸二氢钾—磷酸氢二钠缓冲液配制0.5%甘露聚糖底物液。DNS溶液的配置参照农业部标准DNS试剂的配制。
YPD培养基:酵母提取物10 g/L、蛋白胨20 g/L、葡萄糖10 g/L。
YPDS培养基:酵母提取物10g/L、蛋白胨20g/L、葡萄糖10 g/L、琼脂20 g/L。
BSM培养基:葡萄糖 20 g/L、85%H3PO426.7 mL/L、KOH 4.13 g/L、(NH4)2SO44 g/L、CaCl20.38 g/L、K2SO418.2 g/L、MgSO4·2H2O 14.9 g/L、CaSO4·2H2O 0.93 g/L、PTM1 4.0 mL/L。
1.2.2 种子液的制备 实验室保存的毕赤酵母菌M27-8,转接入含 200 μg/mL Zeocin的 YPDS平板培养基中,28℃培养3 d,涂板。将平板培养基活化好的菌种,挑选单菌落接种到50 mL YPD液态培养基中,28℃、200 r/min振荡培养20~24 h,OD600达到6.0~8.0,镜检,视野中酵母菌饱满、均匀、单个或两个成串的培养液作为发酵种子液。
1.2.3 培养基成分优化
1.2.3.1 不同氮源对产β-甘露聚糖酶的影响。分别采用2%、4%、6% 浓度的BSM、棉籽粉、中温豆粉、玉米浆作为氮源,添加20 g/L的葡萄糖为碳源,以YPD培养基为对照。接种量2%、装液量50 mL/250 mL,转速200 r/min,用八层无菌纱布封口培养,28℃培养,72 h取样,测定β-甘露聚糖酶酶活。
1.2.3.2 不同玉米浆干粉含量对产β-甘露聚糖酶的影响。按照上述最佳条件,采用3%、4%、5%、6%、7%、8%、10%不同玉米浆含量的培养基进行发酵试验,5 moL/L氢氧化钠调节pH 5.0,其他条件同上。
1.2.3.3不同葡萄糖含量对产β-甘露聚糖酶的影响。按照上述最佳条件,采用1%、2%、3%、4%、5%不同葡萄糖含量的培养基进行发酵试验,5 moL/L氢氧化钠调节pH 5.0,其他条件同上。
1.2.4 培养条件优化
1.2.4.1 不同发酵液pH对产β-甘露聚糖酶的影响。按照上述最佳条件,用5 moL/L的氢氧化钠和10%磷酸调节初始pH,调节pH为4.0、4.5、5.0、5.5、6.0,以不调节 pH 为对照,每 12 h调节发酵液pH,其他条件同上。
1.2.4.2 不同接种量对产β-甘露聚糖酶的影响。按照上述最佳条件,采用1%、2%、5%、7.5%、10%接种量进行发酵试验,其他条件同上。
1.2.4.3 不同温度对产β-甘露聚糖酶的影响。按照上述最佳条件,设置两组分别在28℃和30℃下培养24 h,最后每组分别在24、28、32℃继续培养至72 h,其他条件同上。
1.2.4.4 不同转速对产β-甘露聚糖酶的影响。按照上述最佳条件,采用 150、175、200、225、250 r/min,其他条件同上。
1.2.5 胞外粗酶液的制备 取发酵物2~4 mL至离心管中,9000 r/min离心5 min,上清液为粗酶液。
1.2.6 β-甘露聚糖酶酶活测定 取直径15 mm的15 mL的洁净刻度试管分别标记空白组、对照组、测试组,分别加入1.5 mL pH 5.0的0.5%甘露聚糖溶液作为底物,45℃水浴预热5 min;测试组加入稀释适当倍数的预热酶液0.5 mL,在45℃水浴10 min,每隔2 min轻轻摇晃均匀;10 min后立即加入2 mL DNS溶液终止反应;然后仅在对照组中加入0.5 mL酶液,立即至于沸水中煮沸15 min,显色反应后,冷却至室温后用蒸馏水定容至15 mL,颠倒混匀;以空白管调零,在分光光度计540 nm波长处测吸光度。
酶活力单位(U):在45℃、pH 5.0的条件下,每分钟水解底物产生1 μmol甘露糖所需的酶量为一个酶活单位。
1.2.7 甘露糖标准曲线 用pH 5.0磷酸二氢钾—磷酸氢二钠缓冲液配制 0、0.4、0.8、1.2、1.6、2.0 mg/mL不同浓度梯度,以甘露糖浓度为横坐标,吸光度为纵坐标线性拟合得到线性回归方程:Y=0.15502X-0.039,R2=0.99845。
2 结果与分析
2.1 不同氮源对产β-甘露聚糖酶的影响 在培养基中分别添加玉米浆干粉、棉籽饼粉、中温豆饼粉、BSM、YPD发酵72 h测定酶活。结果见图1。
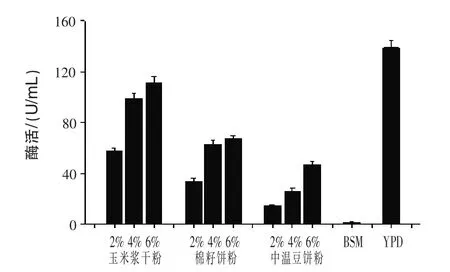
图1 不同氮源对产β-甘露聚糖酶的影响
由图1可知,发酵最佳产β-甘露聚糖酶培养基是添加氮源YPD,酶活达到138.9 U/mL;其次是玉米浆干粉,6%含量的玉米浆干粉培养基发酵酶活达到111 U/mL,为YPD培养基发酵产酶的80%。棉籽饼粉和中温豆饼粉浓度也影响菌株产酶,当培养基中添加BSM时,几乎检测不到酶活;试验结果和Jia等(2012)报道的采用玉米浆干粉作为替代氮源时最佳结果相符。因玉米浆干粉相对蛋白胨和酵母膏作为氮源时廉价,故在上大型发酵罐时可以将其作为YPD培养基的取代物,节约生产成本。
2.2 不同玉米浆干粉含量对产β-甘露聚糖酶的影响 通过发酵72 h,测定发酵液中的酶活,结果见图2。随着玉米浆干粉含量增加,β-甘露聚糖酶产量先增后减;且玉米浆含量在6%~8%时,产酶相对平稳。这可能是玉米浆成分复杂,显酸性,含量过高时会抑制微生物产酶。最佳的玉米浆干粉含量在6%左右。
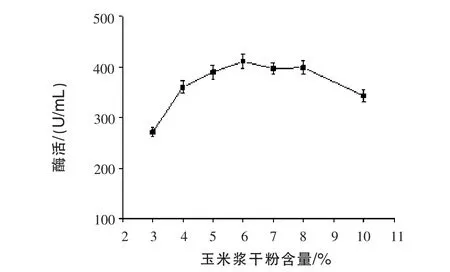
图2 不同玉米浆干粉含量对产β-甘露聚糖酶的影响
2.3 不同葡萄糖含量对产β-甘露聚糖酶的影响通过发酵72 h,测定发酵液中的酶活,结果见图3。随着葡萄糖含量增加,β-甘露聚糖酶酶活逐渐升高,且在3%后不再增加。这可能是葡萄糖含量过高,会产生葡萄糖抑制效应,从而抑制微生物的生长(Olaniyi等,2015)。最佳的葡萄糖含量为3%。
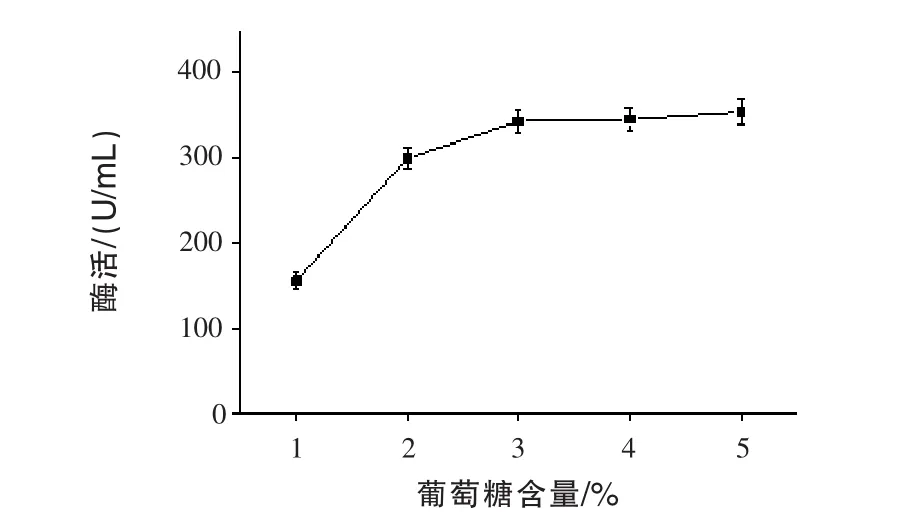
图3 不同葡萄糖含量对产β-甘露聚糖酶的影响
2.4 不同发酵液pH对产β-甘露聚糖酶的影响通过调节0~72 h发酵液中的pH,每12 h调pH一次,以不调pH作为对照,测定发酵液中β-甘露聚糖酶酶活,结果见图4。随着发酵时间的延长,β-甘露聚糖酶酶活基本保持增长的趋势。通过发酵过程中控制不同发酵pH,只有发酵pH 4.0较自然发酵效果差,其余效果都较对照好,其中pH为5.0、5.5、6.0效果最优,且三者之间酶活差别不大,说明发酵液pH值为5.0~6.0为产酶的适宜浓度,是不调pH产酶的2.5倍左右。
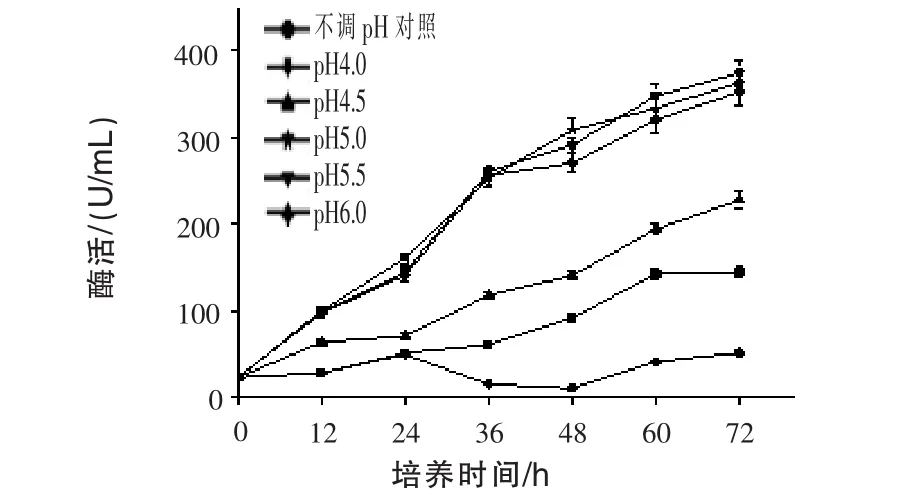
图4 不同发酵液pH对产β-甘露聚糖酶的影响
2.5 不同接种量对产β-甘露聚糖酶的影响 通过发酵96 h,测定发酵液中的酶活,结果见图5。随着发酵时间的增加,产酶基本保持较快增长的趋势;接种量不同,产酶差异不明显。在发酵过程中,只有接种量为1%时,前60 h和其他接种量有较大差异,说明接种量最少要控制在2%,才不会因为菌体浓度而影响产酶。
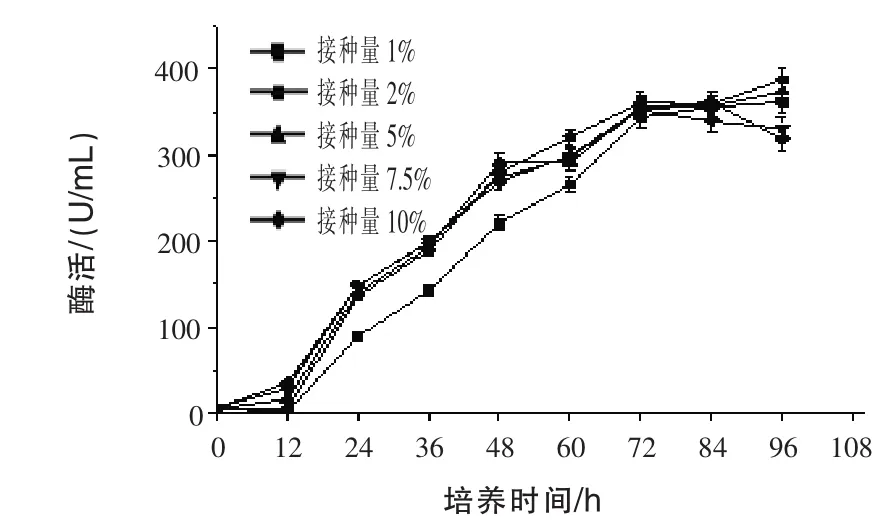
图5 不同接种量对产β-甘露聚糖酶的影响
2.6 不同温度对产β-甘露聚糖酶的影响 通过发酵72 h,测定发酵液中的酶活,结果见图6。前期两组分别在28℃和30℃培养24 h测定酶活,即图中28℃培养起始值和30℃培养起始值,30℃培养起始值曲线较28℃培养起始值曲线高,这可能是30℃培养更适合微生物前期生长,较利于产酶,故前期采用30℃培养较适宜。两组在28℃和30℃培养24 h后,后期分别至于24、28℃和30℃培养72 h测定酶活,发现后期培养温度越高越不利于产酶,且前期24 h在30℃培养后转入32℃培养至72 h时,酶活相较于其他条件下降得更快,可能是由于后期发酵温度过高,不利于微生物生长,导致蛋白质降解,对外源蛋白质的表达不利(Ye等,2008)。故后期采用不超过28℃培养较适宜。
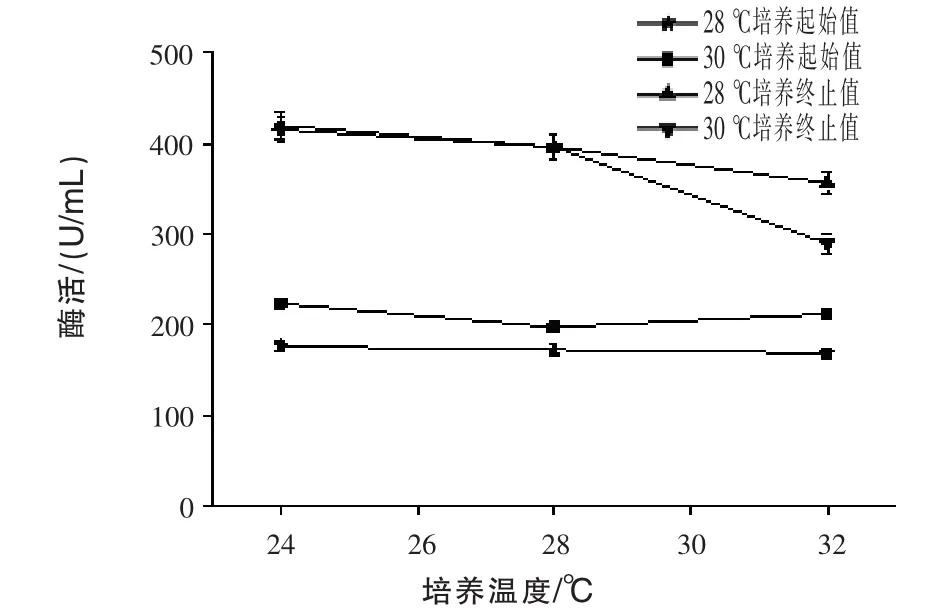
图6 不同温度对产β-甘露聚糖酶的影响
2.7 不同转速对产β-甘露聚糖酶的影响 通过发酵72 h,测定发酵液中的酶活,结果见图7。随着时间的推移,酶活逐渐增加,且在发酵60 h之后,酶活保持稳定;随着转速增加,产酶前期48 h内保持增加趋势,后期逐渐平稳。发酵过程中转速越大,有利于促进溶氧,促进物质间的传递转化,有利于产酶。225 r/min和250 r/min在60 h后差异较小,且发酵周期缩短能够减少生产成本,如果采用225 r/min,发酵60 h和72 h产酶并无明显差异。故采用60 h发酵,转速225 r/min较适宜。
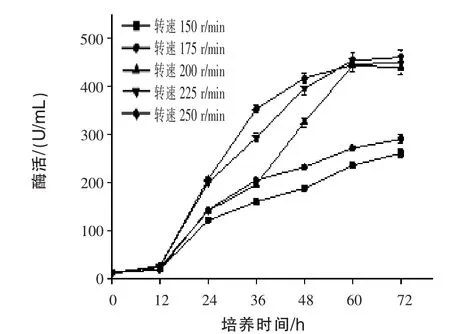
图7 不同转速对产β-甘露聚糖酶的影响
3 结论
本文采用毕赤酵母组成型工程菌株M27-8进行高密度发酵,优化培养基配比及培养条件,得出最佳产酶条件。优化后基本培养基组成为6%的玉米浆干粉作为氮源,3%的葡萄糖作为碳源,较采用优化前的YPD培养基价格低廉,适宜规模化生产;优化后基本培养参数采用发酵pH为5.5,培养时间60 h,接种量2%,发酵温度不超过28℃,转速225 r/min,能够达到最佳的产酶条件,最大酶活达到452.7 U/mL,是优化前酶活138 U/mL的3.3倍。
[1]Bhat MK.Cellulases and related enzymes in biotechnology[J].Biotechnology Advances,2000,18(5):355 ~ 383.
[2]Chen HL,Fan YH,Chen ME,et al.Unhydrolyzed and hydrolyzed konjac glucomannans modulated cecal and fecal microflora in Balb/c mice[J].Nutrition,2005,21(10):1059 ~ 1064.
[3]Cerqueira M A,Bourbon A I,Pinheiro A C,et al.Galactomannans use in the development of edible films/coatings for food applications[J].Trends in Food Science&Technology,2011,22(1):662 ~ 671.
[4]Jia Zheng,Wei Zhao,Ning Guo,et al.Development of an industrial medium and a novel fed-batch strategy for high-level expression of recombinant b-mananase by Pichia pastoris[J].Bioresource Technology,2012,118(1):257 ~ 264.
[5]Ghose TK.Measurement of cellulose activities[J].Pure and Applied Chemistry,1987,59(2):257 ~ 268.
[6]Kansoh AL,Nagieb ZA.Xylanase and Mannanase enzymes from Streptomyces galbus NR and their use in biobleaching of softwood kraft pulp[J].Antonie Van Leeuwonhoek,2004,85(2):103 ~ 114.
[7]Nunes C S,Malmlo..f K.Effects of guar gum and cellulose on glucose absorption,hormonal release and hepatic metabolism in the pig[J].British Journal of Nutrition,1992,68(3):693 ~ 700.
[8]Olaniyi O O,Ekundayo T C,Igbe O F,et al.Influence of Cultural and Nutritional Factors on β-Mannanase Production by Penicillium italicum under Submerged State Fermentation[J].British Microbiology Research Journal,2015,5(6):481 ~ 489.
[9]Scheller H V,Ulvskov P.Hemicelluloses[J].Annual Review of Plant Biology ,2010,61(1):263 ~ 289.
[10]St。albrand H,Siikaaho M,Tenkanen M,et al.Purification and characterization of two β -Mannanase from Trichoderma reesei[J].Biotechnology,1993,29(3):229 ~ 242.
[11]Wu D,Hao Y,Chu J,et al.Inhibition of degradation and aggregation of recombinant human comsensus interferon-a mutant expressed in Pichia pastoris with complex medium in bioreactor [J].Appl Microbiol Biotechnol,2008,80(1):1063 ~ 1071.
[12]Ye D O U,Qing-lu W,Qiao-qiao L I.Optimization of the fermentation conditions of Pichia Pastoris[J].Science and Technology of Food Industry,2008,29(6):168 ~ 171.
[13]Zou X T,Xiao X J,Xu Z R.Effect of β-Mannanase (Hemicell) on growth performance and immunity of broilers[J].Poultry Science,2006,85(12):2176 ~ 2179.■
The optimal conditions for the production of β-manganese were obtained by using Pichia pastors engineering strain M27-8.The content nitrogen sources,glucose content,pH,fermentation time,inoculum size,temperature and speed were optimized.The results showed that the optimum conditions for enzyme production were as follows:6%corn steep liquor,3%glucose,pH 5.5,fermentation 60 h,2%inoculation amount,28 ℃,225 r/min,the maximum activity reached 452.7 U/mL,which was 3.3 times of that of the optimized enzyme activity of 138 U/mL.In conclusion,substitution of YPD medium with cheaper corn pulp medium could save costs and lay the foundations for industrial production.
β-mannanase;Pichia pastoris;fermentation conditions;optimization
S816.3
A
1004-3314(2017)19-0013-04
10.15906/j.cnki.cn11-2975/s.20171903
广州市科技计划项目(201710010154)
*通讯作者

