研究图形 理解能量
张新中
(江苏省邗江中学,江苏 邗江 225009)
研究图形理解能量
张新中
(江苏省邗江中学,江苏 邗江 225009)
将图形与能量相结合,可以快速考查化学反应与能量变化和考生的识图能力,通过对图形的识别,可以掌握化学反应中的能量变化知识.文章通过对图形在化学反应与能量变化中的应用,教给学生识图和将基本知识与图形相联系的能力,以便学生能轻松应对高考.
图形;能量;热化学方程式;盖斯定律
图形题因其简明直观,倍受命题者青睐,近年来在各地模拟试题经常出现,化学反应中与能量变化中也如此.
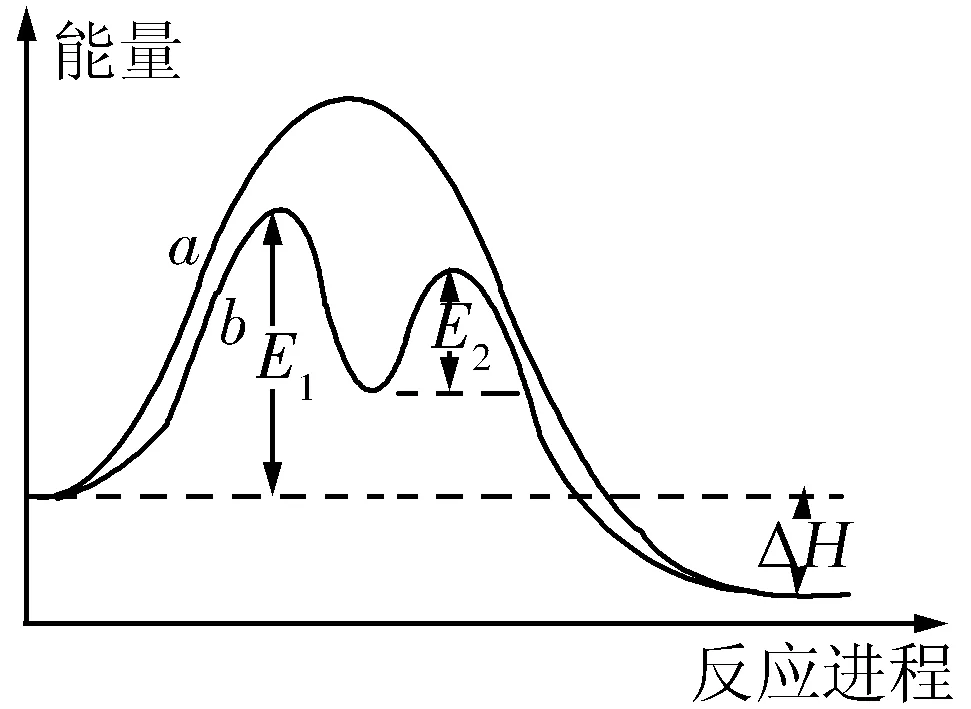
一、根据图形判断活化能与焓变的关系
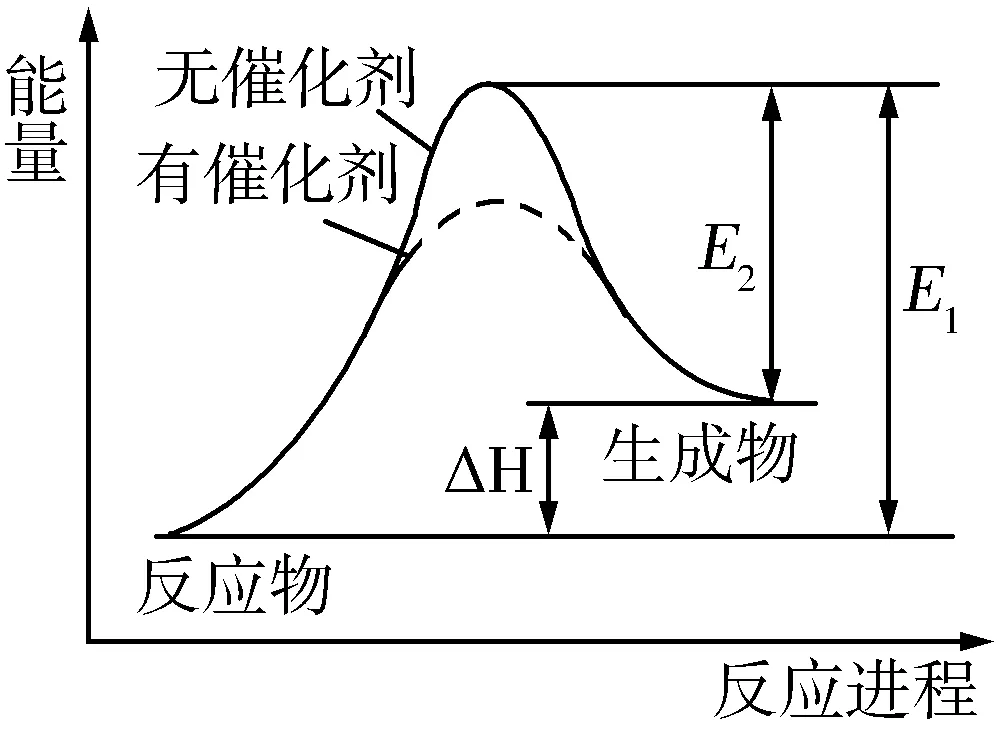
图1
例1 某反应的反应过程中能量变化如图1所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( ).
A.该反应为放热反应
B.催化剂能改变该反应的焓变
C.催化剂能降低该反应的活化能
D.该反应逆反应的活化能大于其正反应的活化能
解析从图中看,反应物的总能量低于生成物的总能量,故该反应为吸热反应,A项错误;焓变是指反应物与生成物之间的能量差值,与反应过程无关,B项错误;加入催化剂之后,E1、E2变小,说明活化能减小了,C项正确;由图可知,逆反应的活化能小于正反应的活化能,D项错误.答案:C.
延伸拓展ΔH=E1-E2,催化剂能同等程度地降低正、逆反应的活化能,但不改变化学反应始态和终态的物质的能量,故催化剂对化学反应的焓变无影响.
二、根据图形理解吸、放热反应
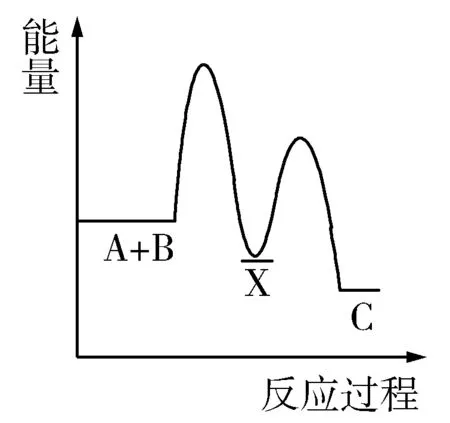
例2 下列物质间的反应,其能量变化符合图2的是( ).
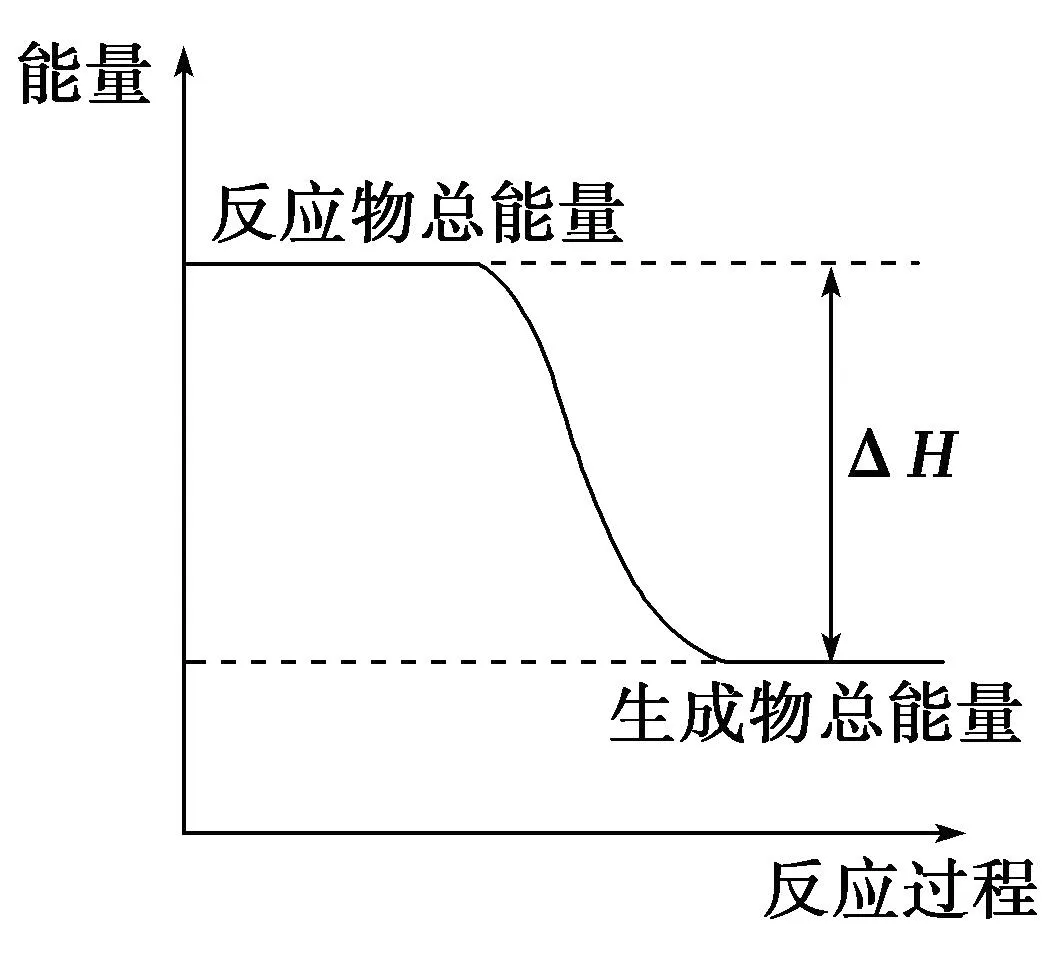
图2
A.锌粒与稀硫酸的反应
B.灼热的炭与二氧化碳反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.碳酸钙的分解
解析如图2所示为放热反应能量图,A为放热反应,B、C是吸热反应;D是吸热反应.答案:A
延伸拓展反应物的总能量高于生成物的总能量时,放热反应;当反应物的总能量低于生成物的总能量时,吸热反应.一般来说,常见的放热反应有:大多数化合反应、金属与酸的反应、物质的燃烧反应、中和反应、铝热反应等;常见的吸热反应有:大多数分解反应、氢氧化钡晶体与氯化铵的反应、炭与水及CO2的反应等.
三、根据图形确定反应过程中能量的变化
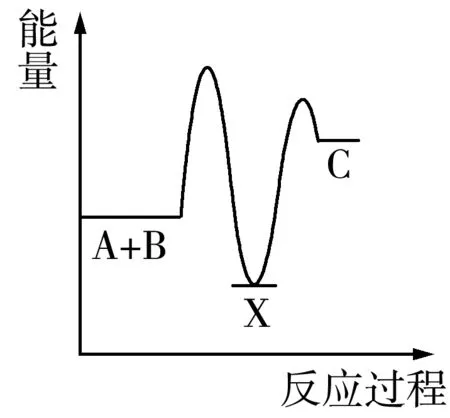
例3 化学反应A2+B2=2AB的能量变化如图3所示,则下列说法正确的是( ).
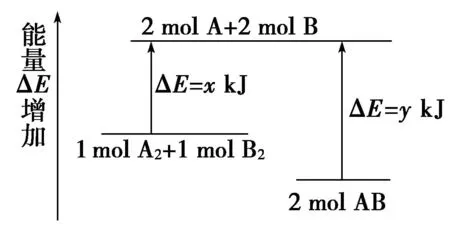
图3
A.该反应是吸热反应
B.断裂1molA-A键和1molB-B键能放出xkJ能量
C.断裂2molA-B键需要吸收ykJ的能量
D.2molAB的总能量高于1molA2和1molB2的总能量
解析从能量变化图上可以看出,反应物总能量高于生成物总能量,该反应是放热反应,A、D错误;断键时要吸收能量,B项错误,C项正确.答案:C
延伸拓展化学反应的本质是旧化学键的断裂和新化学键的形成,前者吸收能量,后者放出能量,它们之间的差值即为该反应的能量变化.
四、根据图形书写热化学方程式或判断正误
例4SF6被国际上称为“气体绝缘开关设备”,80%用于高中压电力设备.S与F2反应制备SF6的能量变化图像如图4所示.化学上,常用生成热(ΔH)表示物质的相对能量(kJ·mol-1),单质的相对能量为0.
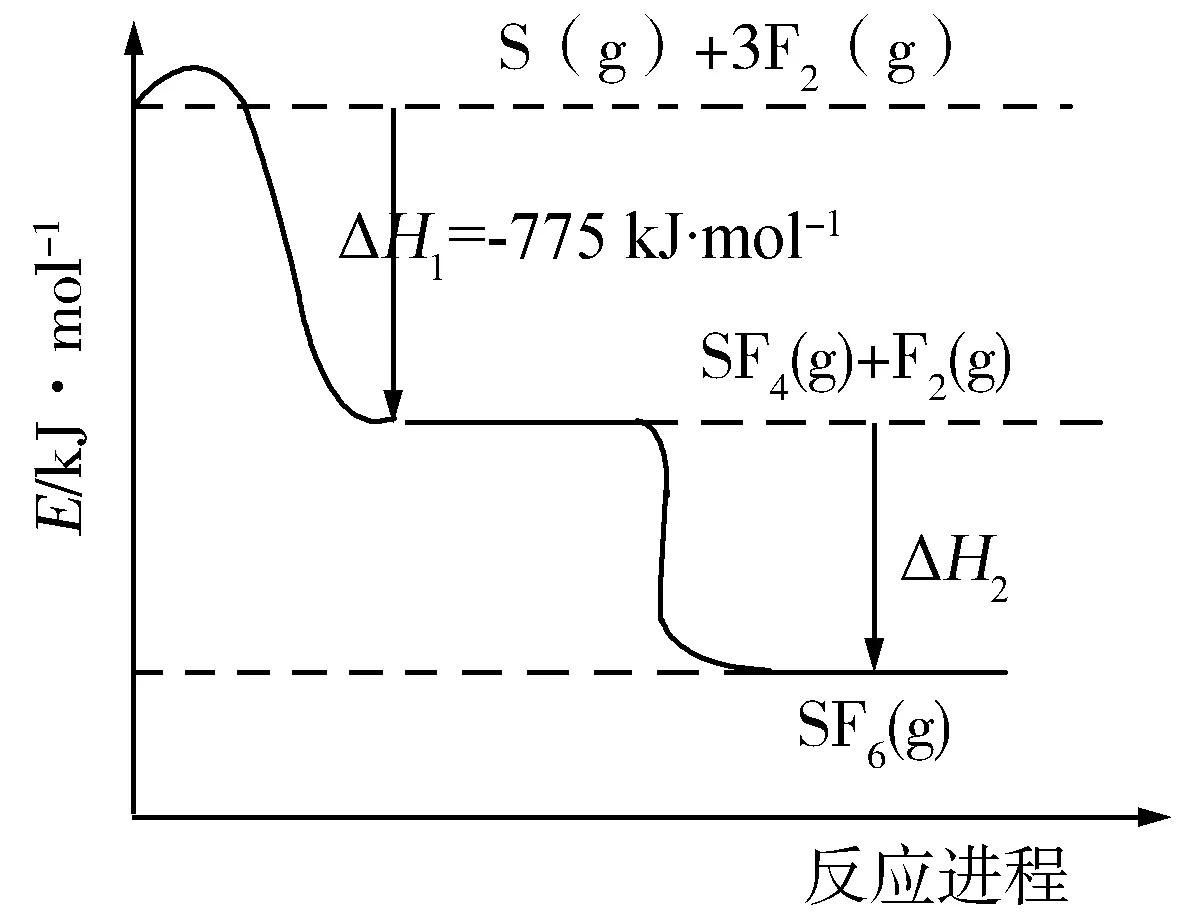
图4
已知SF6(g)的生成热为-1209kJ·mol-1.
下列说法或表示正确的是( )
A.图像中ΔH2=-344kJ·mol-1
B.断裂SF6(g)分子中化学键要放出能量
C.S(g)+3F2(g)=SF6(g)ΔH=-1209kJ·mol-1
D.SF4(g)的化学性质比SF6(g)化学性质稳定
解析根据物质相对能量计算反应热:ΔH2=(-1209kJ·mol-1)-(-775kJ·mol-1+0)=-434kJ·mol-1,A项错误;断裂化学键要吸收能量,B项错误;根据盖斯定律知:
S(g)+3F2(g)=SF6(g)
ΔH=ΔH1+ΔH2=-1209kJ·mol-1
C项正确;生成时放出的能量越多,物质越稳定,故SF6(g)的化学性质比SF4(g)化学性质稳定,D项错误.答案:C
延伸拓展热化学方程式的书写和正误判断,一般要注意以下几个方面:(1)各物质的聚集状态是否符合题目给出的信息;(2)ΔH的单位和符号(“+、-”)是否正确;(3)热化学方程式的计量数与ΔH的数值是否对应;(4)反应是否可逆;(5)燃烧热和中和热的问题要紧扣燃烧热和中和热的基本概念.对于燃烧热,可燃物必须为1mol,生成物要稳定;对于中和热,溶液要稀,生成物水必须为1mol.
五、根据图形理解盖斯定律
例5 已知化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,如图5(Ⅰ)所示:ΔH1=ΔH2+ΔH3.根据上述原理和图(Ⅱ)所示,判断各对应的反应热关系中不正确的是( ).
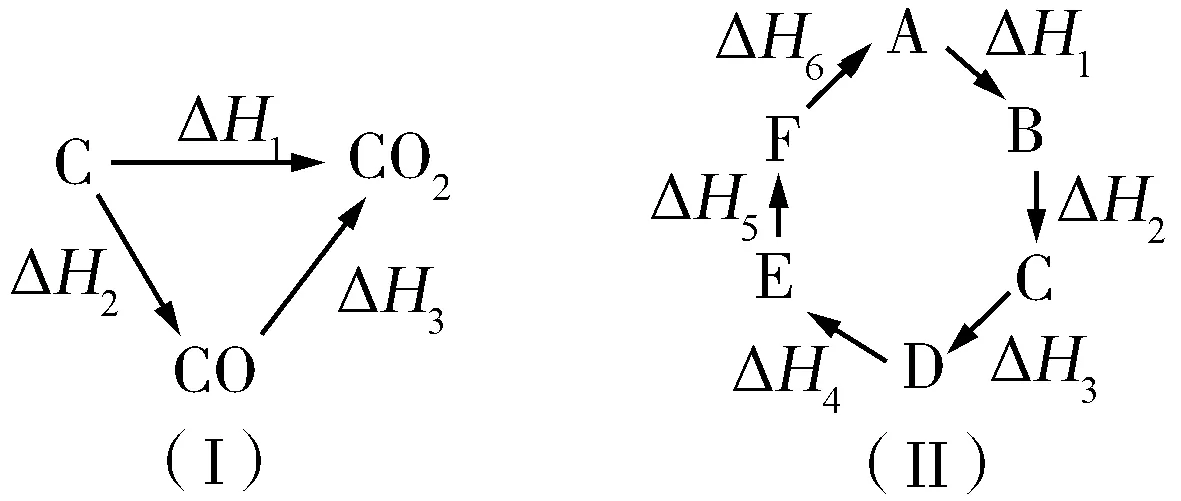
图5
A.A→F:ΔH=-ΔH6
B.A→D:ΔH=ΔH1+ΔH2+ΔH3
C.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0
D.ΔH1+ΔH6=ΔH2+ΔH3+ΔH4+ΔH5
解析A→F与F→A始态与终态换位,数值不变但符号相反,A项正确;由图5(Ⅱ)知,A→D经历了A→B、B→C、C→D三个阶段,故可知ΔH=ΔH1+ΔH2+ΔH3,B项正确;图5(Ⅱ)是头尾相连型,经过一个循环,体系处于始态能量的变化为0,C项正确.答案:D
延伸拓展盖斯定律的两种图示如下:
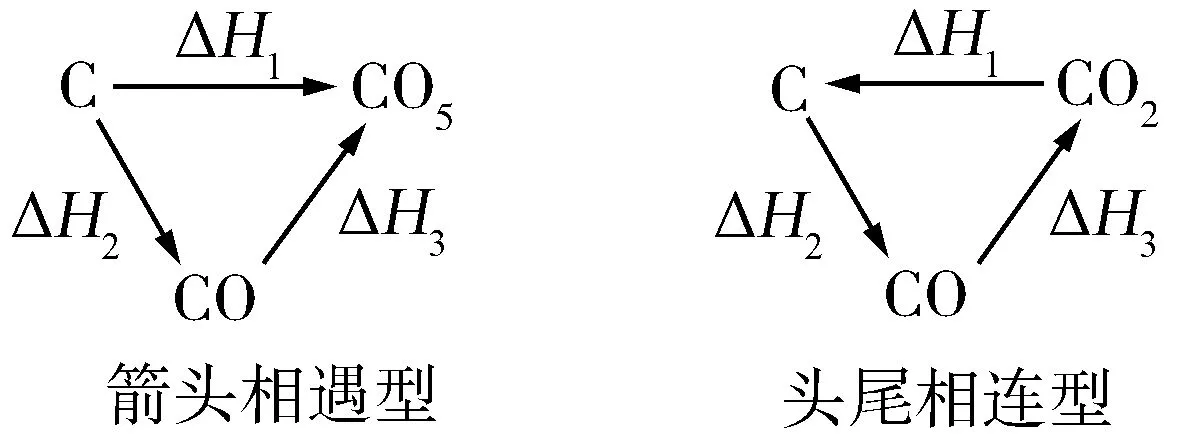
箭头相遇型可理解为一步完成与几步完成,其反应热相同,表达式为ΔH1=ΔH2+ΔH3.头尾相连型可理解为反应热只与反应体系的始态与终态有关,与反应途径无关,表达式为ΔH1+ΔH2+ΔH3=0.
六、根据比较物质的稳定性
例6 单斜硫和正交硫转化为二氧化硫的能量变化如图6所示,下列说法正确的是( ).
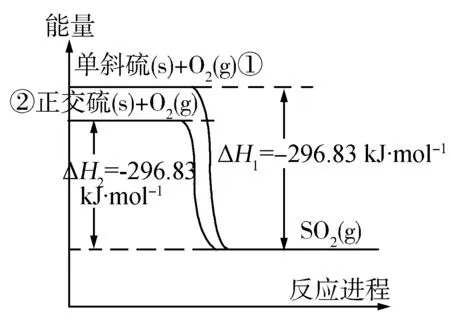
图6
A.S(s,单斜)=S(s,正交)
ΔH=+0.33kJ·mol-1
B.相同物质的量的正交硫比单斜硫所含有的能量高
C.正交硫比单斜硫稳定
D.①式表示断裂1molO2中的共价键所吸收的能量比形成1molSO2中的共价键所放出的能量少297.16kJ
解析单斜硫的能量比正交硫的能量高,S(s,单斜)=S(s,正交)ΔH=-0.33kJ·mol-1,为放热反应,A项错误;由图象可以看出,单斜硫的能量比正交硫的能量高,B项错误;物质的能量越高越不稳定,则正交硫比单斜硫稳定,C项正确;①式反应需断裂单斜硫中S-S键和O=O键,不仅仅是断裂1molO2中的共价键所吸收的能量,D项错误.答案:C
延伸拓展物质稳定性的判断方法:一是看能量,能量越低越稳定;二是看键能,键能越大越稳定.
链接高考
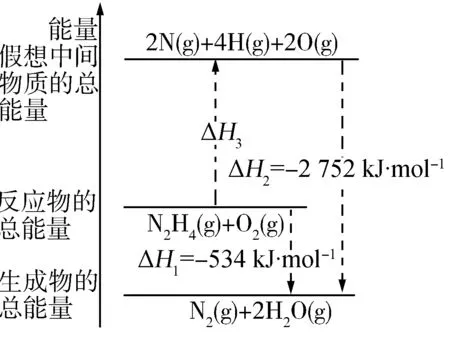
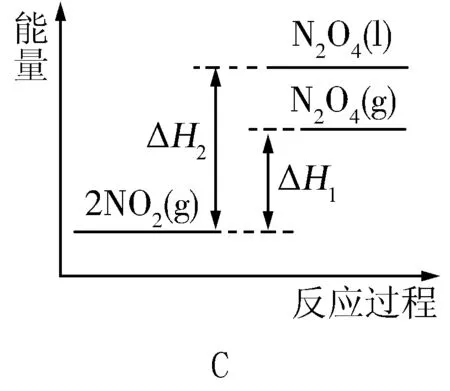
1.(2011·海南卷)图7是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).
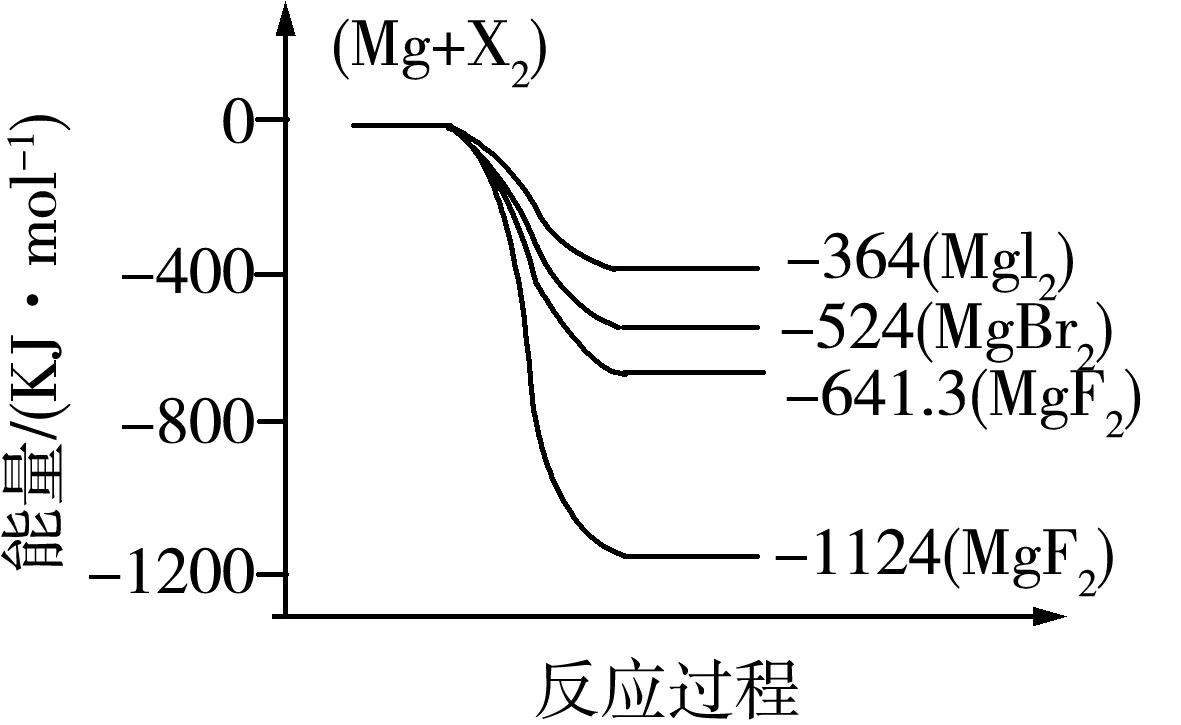
图7
下列选项中正确的是( ).
A.Mg与F2的反应是放热反应
B.MgBr2与Cl2反应的ΔH<0
C.化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2

ΔH=+600kJ·mol-1
解析依据图象分析判断,Mg与F2的能量高于MgF2,依据能量守恒判断,反应是放热反应,A项正确;依据图象分析,MgBr2能量高于MgCl2,依据活泼性判断,Cl2能量高于Br2,所以反应是放热反应,B项正确;物质的能量越低越稳定,易图象数据分析,化合物的热稳定性顺序为:MgI2 答案:C 2.(2012·大纲卷)反应A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0),②X→C(ΔH<0).图8示意图中,能正确表示总反应过程中能量变化的是( ). 解析由反应A+B→C(ΔH <0)分两步进行①A+B→X (ΔH>0) ② X→C(ΔH <0)可以看出,A+B→C(ΔH<0)是放热反应,A和B的能量之和C,由①A+B→X(ΔH>0)可知这步反应是吸热反应,X→C(ΔH<0)是放热反应,故X的能量大于A+B;A+B的能量大于C,X的能量大于C. 答案:D 3.(2012·重庆卷)肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图9所示,已知断裂1mol化学键所需的能量(kJ):N=N为942、O=O为500、N-N为154,则断裂1molN-H键所需的能量(kJ)是( ). 图9 A.194B.391C.516D.658 解析由图知 ΔH=-534KJ/mol 可设断裂1molN-H键所需能量为xkJ,154kJ+4xkJ+500kJ-2752kJ=-534kJ,可求得x=391.答案:B 图10 4.(2014·海南卷)某反应过程能量变化如图10所示,下列说法正确的是( ). A.反应过程a有催化剂参与 B.该反应为放热反应,热效应等于ΔH C.改变催化剂,可改变该反应的活化能 D.有催化剂条件下,反应的活化能等于E1+E2 解析由图示可知反应过程a需要的活化能较高,没有催化剂参与,A项错误;由于反应物的能量高于生成物的能量,多余的能量就以热能的形式释放出来.所以该反应为放热反应,热效应等于反应物与生成物能量的差值ΔH,B项正确;改变催化剂,改变了反应途径,降低了反应的活化能,但是反应热不变,C项正确;无论是否存在催化剂,反应的活化能等于反应物与生成物的能量的差值,等于ΔH,D项错误.答案:BC 5.(2014·北京卷)已知: 图11所示能量变化示意图中,正确的是(选填字母)________. 图11 解析降低温度,NO2(g)转变为N2O4(l),则ΔH2<0,反应物能量高于生成物能量,C项错误;N2O4(g)转变为N2O4(l)需要放出热量,所以NO2(g)转变为N2O4(g)比NO2(g)转变为N2O4(l)放出的热量少,B项错误. 答案:A [1]人民教育出版社,课程教材研究所,化学课程教材研究开发中心.化学必修[M].北京:人民教育出版社,2004. G632 A 1008-0333(2017)22-0089-04 2017-08-01 张新中(1970.9-),男,江苏扬州人,高级教师,本科,从事教学研究. 责任编辑:季春阳]