直肠癌低位前切除术后吻合口瘘发生相关因素分析
徐 谊 赵晓牧 孙武青 马 健 王岳月 王 今
(首都医科大学附属北京友谊医院普外科 国家消化系统疾病临床医学研究中心,北京 100050)
·临床研究·
直肠癌低位前切除术后吻合口瘘发生相关因素分析
徐 谊 赵晓牧 孙武青 马 健 王岳月 王 今*
(首都医科大学附属北京友谊医院普外科 国家消化系统疾病临床医学研究中心,北京 100050)
目的探究直肠癌低位前切除术后发生吻合口瘘的危险因素,为临床上吻合口瘘的防治提供依据,从而降低瘘的发生率。方法回顾性分析2013年1月1日至2017年3月31日首都医科大学附属北京友谊医院261例行直肠癌低位前切除术(low anterior resection,LAR)病人的临床资料。分别行单因素和Logistic多因素回归分析吻合口瘘的相关危险因素。结果吻合口瘘发生率为6.89%(18/261)。多因素分析显示,新辅助放射治疗联合化学药物治疗(以下简称放化疗)(OR=3.498,P=0.024)、联合其他器官手术(OR=10.834,P=0.003)与术后吻合口瘘相关。结论新辅助放化疗、联合其他器官手术为直肠癌低位前切除术后吻合口瘘的独立危险因素。针对相关危险因素,可以采取积极有效的防治措施,从而降低吻合口瘘的发生。
直肠癌;低位前切除;吻合口瘘;危险因素
结直肠癌是世界上最常见的恶性肿瘤之一,占男性恶性肿瘤发病率的第3位,女性恶性肿瘤发病率的第2位[1]。在我国,直肠癌占结直肠癌发病率的70%左右[2],其防治一直是外科医生所关注的问题。以全直肠系膜切除(total mesorectal excision,TME)为原则的低位前切除术(low anterior resection,LAR)已经彻底改变了低位直肠癌的治疗方式,明显提高了低位直肠癌的治疗效果[3]。低位前切除术是指吻合口位于腹膜反折以下的切除,这种低位吻合通常会有较高的风险发生吻合口瘘,发生率为 2.6%~26.2%[4]。吻合口瘘会引起腹盆腔严重感染,极易造成肠黏连、肠梗阻、吻合口
狭窄及直肠阴道瘘等合并症,严重者会导致病人围手术期死亡,增加了肿瘤术后复发的机会,使直肠癌5年总体生存率降低约20%[5],因此对吻合口瘘的防治尤为重要。本研究对近年来首都医科大学附属北京友谊医院直肠癌低位前切除术病人的资料进行回顾性分析,探究发生吻合口瘘的危险因素,为临床提供诊疗依据。
1 资料与方法
1.1一般资料
1)行直肠癌TME和LAR的治疗指征:参考文献[6]并结合首都医科大学附属北京友谊医院实际,根据TME原则,直肠癌远端切缘的最低安全线划定为2 cm,以保证切口下缘肿瘤无残余,同时对于肿瘤根治性切除后,肛提肌上方残余直肠>2 cm的病人,应用LAR为首选。对于距离肛缘<5 cm的肿瘤,须注意远切缘是否足够,如切除在齿状线以下时往往不能常规吻合,可选用其他吻合技术,如Parks术、Bacon术和内括约肌切除术。首都医科大学附属北京友谊医院新辅助放射治疗联合化学药物治疗(以下简称放化疗)指征是中低位局部进展期直肠癌。放射治疗(以下简称放疗)剂量:总剂量45~50 Gy/25~28次( 1.8~2.0 Gy/次,每周5次,共5周),同步口服卡培他滨[825 mg/m3,每天2次,每周5 d,共5周]化学药物治疗(以下简称化疗)。且均在放化疗全部结束后等待5~12周的间歇期再行手术,术前1周行直肠MRI评估新辅助治疗的治疗效果。
2)病例纳入标准:手术方式按TME原则行直肠癌低位前切除术,吻合口周围常规放置引流管,术后保证引流管通畅;术中证实吻合口机械对合完整,吻合口无张力,局部血供良好,行充气试验排除术中吻合口瘘;术后病理确诊为原发性直肠癌,且切缘两端均无肿瘤残留。
3)排除标准:Miles术、Hartmann术,经肛门直肠肿物切除术,病历资料记录不完整者。根据纳入和排除标准,首都医科大学附属北京友谊医院2013年1月至2017年3月共有261例病人符合,其中,男性152例,女性109例。年龄32~90岁,平均年龄(63.8±11.7)岁。病理学采用由国际抗癌联盟(Union for International Cancer Control, UICC)和美国癌症联合会(American Joint Committee on Cancer,AJCC)联合制定的TNM分期,Ⅰ期48例,Ⅱ期122例,Ⅲ期74例,Ⅳ期17例。所有手术均由2名及以上经验丰富的普外科专家组成员完成。
1.2吻合口瘘判断标准
吻合口瘘的定义目前尚无统一的标准,参阅国内外文献[5,7-8],吻合口瘘主要通过以下几点诊断:①局部症状及体征,突发性的下腹及肛门附近阵发性或持续性疼痛、肛门坠胀感,进而出现局部腹膜炎体征;②不明原因的发热、白细胞升高,急性心肺功能不全的症状;③粪渣样物质及气体从引流管流出,出现败血症甚至感染中毒性休克的症状;④行CT检查肠壁和吻合口附近出现积气或者行消化道造影发现消化道引流管漏出造影剂;⑤直肠指检触及瘘口。
1.3相关可疑因素判断标准
发生吻合口瘘的原因众多且复杂,本研究主要从病人、病理、手术3个方面,对可能发生吻合口瘘的相关因素进行整理分析。其中,病人相关因素中包括病人的基本情况(年龄、性别),不良嗜好(吸烟、酗酒),伴随疾病(术前肠梗阻、高血压、糖尿病、术后早期腹泻),术前/后体质状况美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级,血清白蛋白浓度,血红蛋白浓度,白细胞浓度),肿瘤标志物癌胚抗原(carcinoembryonic antigen, CEA)浓度,新辅助治疗;病理相关因素包括病理类型、癌结节、远处转移、临床分期、脉管侵犯;手术相关因素包括手术方式(腹腔镜/开腹、预防性造瘘),手术过程(手术时间、出血量、联合其他器官手术、肠系膜下动脉离断水平),吻合情况(吻合口水平、缝合加固),吻合器使用情况(数量、类型)。
1.4统计学方法
应用SPSS22.0软件行统计学分析。采用χ2检验对发生吻合口瘘的影响因素行单因素分析,对单因素分析P<0.05的差异有统计学意义的影响因素采用Logistic回归方法进行多因素分析,以P<0.05为差异有统计学意义。
2 结果
261例行直肠癌低位前切除术的病人中,有18例发生吻合口瘘,发生率6.89%,发生时间为术后1~11 d,平均发生时间为术后(4.7±2.5)d。10例保守治疗,8例再次手术治疗,行末端回肠造瘘术,再次手术时间距吻合口瘘发生时的天数为0~7 d,平均发生时间(1.2±2.4)d。18例发生吻合口瘘的病人中有3例死亡,均为行再次手术治疗后死亡,最后死因皆为严重感染所致的多器官衰竭,死亡病例中再次手术时间距吻合口瘘发现时间为1~7 d,平均(3.0±3.5)d。
2.1直肠癌低位前切除术后吻合口瘘影响因素的单因素分析
病人相关情况行单因素分析结果见表1,吻合口瘘与新辅助放化疗、术后血清白蛋白(<25 g/L)有关,差异有统计学意义(P<0.05);病理相关情况行单因素分析结果见表2,无差异有统计学意义因素;手术相关情况行单因素分析结果见表3,吻合口瘘与手术时间(≥120 min)、术中出血量(≥300 mL)、联合其他器官手术有关,差异有统计学意义(P<0.05)。
表1病人相关情况行单因素分析

Tab.1 Univariate analysis of patient-related factorsn(%)
ASA:American Society of Anesthesiologists;CEA:carcinoembryonic antigen.
表2病理相关情况行单因素分析
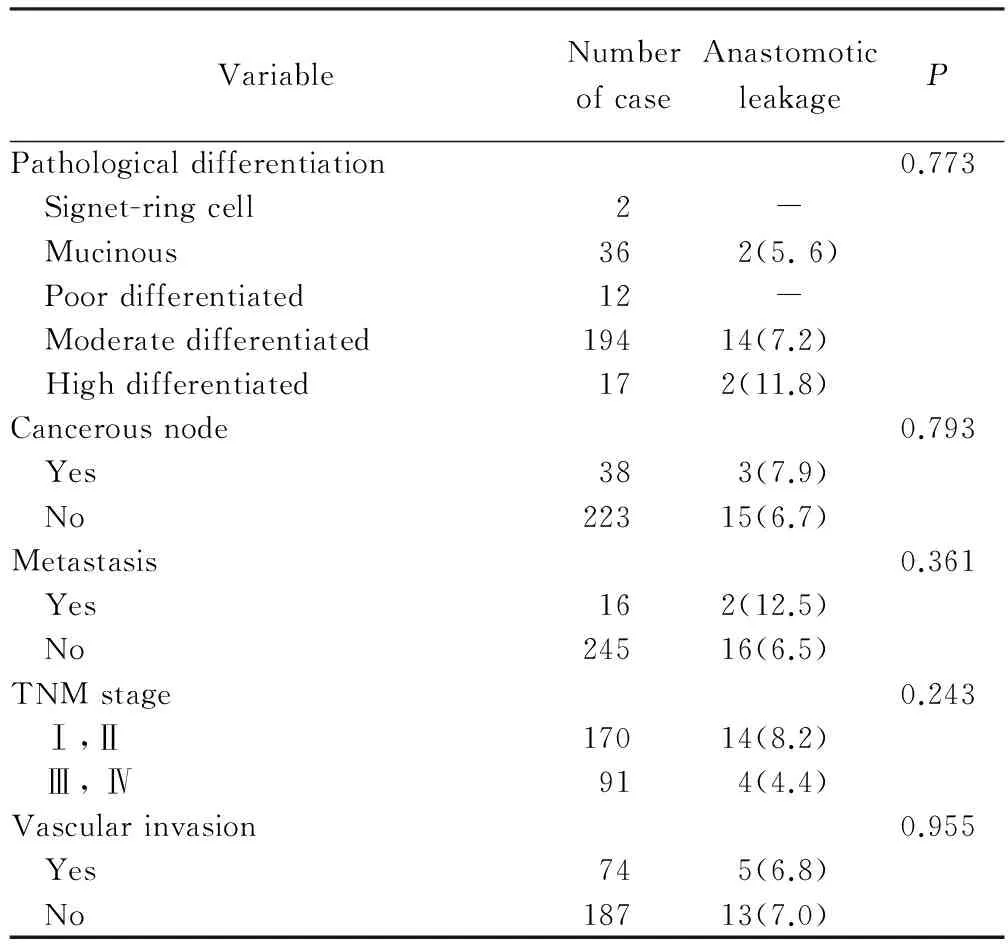
Tab.2 Univariate analysis of tumor-related factorsn(%)
TNM: tumor lymph nodes metastasis.
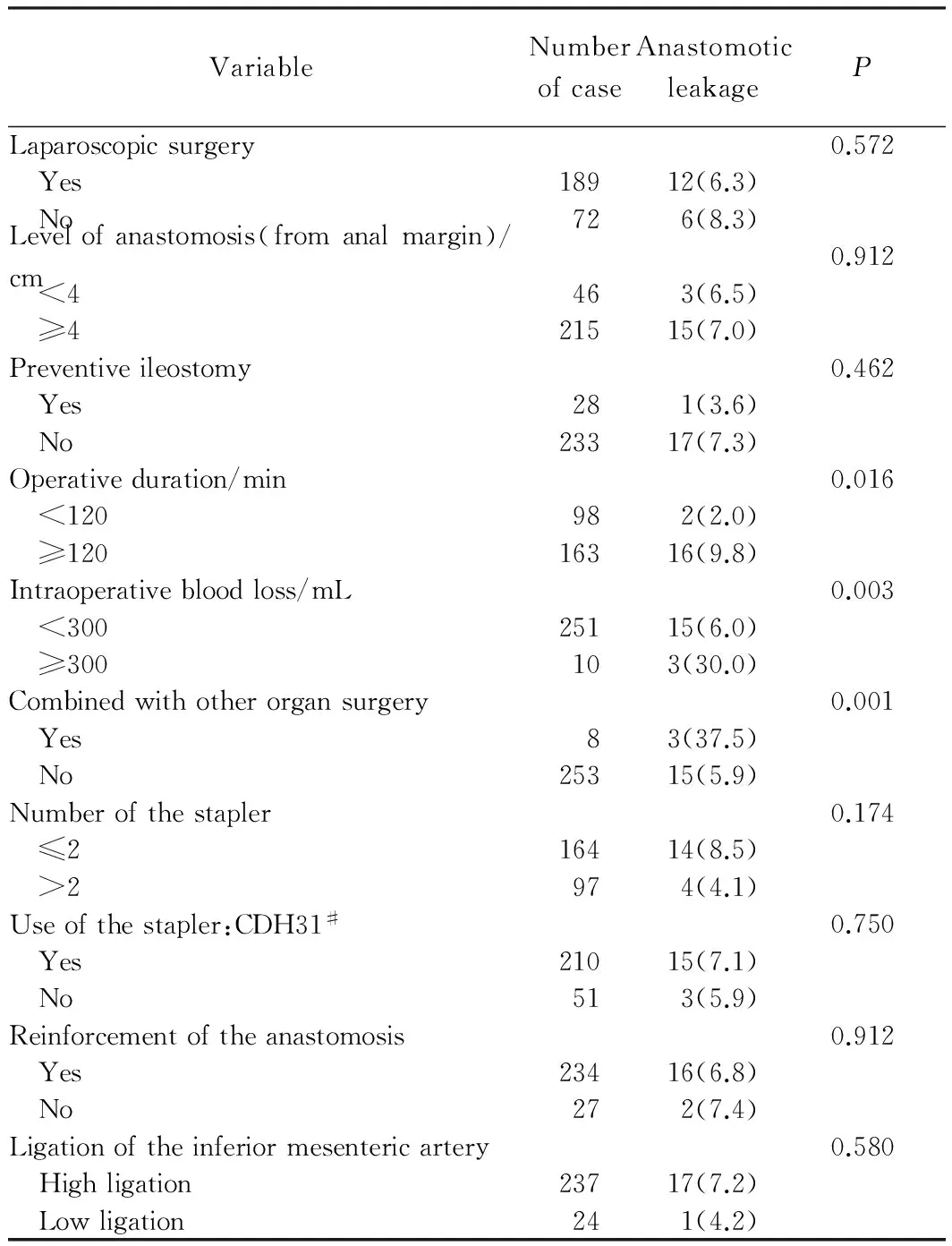
表3 手术相关情况行单因素分析Tab.3 Univariate analysis of surgery-related factors n(%)
2.2直肠癌低位前切除术后吻合口瘘影响因素的多因素分析
多因素分析结果见表4,新辅助放化疗、联合其他脏器手术是直肠癌低位前切除术后吻合口瘘发生的独立危险因素,差异有统计学意义(P<0.05)。
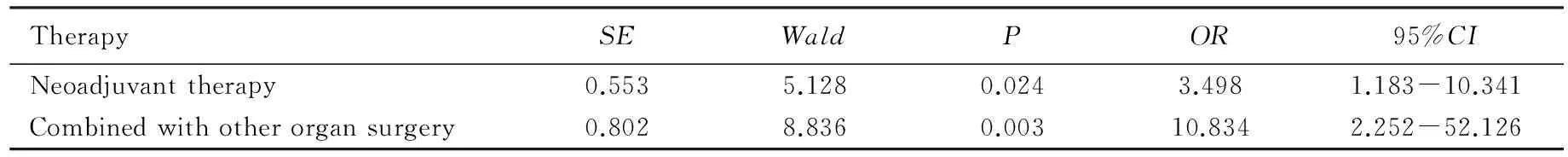
表4 直肠癌病人术后吻合口瘘的多因素分析Tab.2 Multivariate analysis of postoperative anastomotic leakage in rectal cancer patients
3 讨论
吻合口瘘作为直肠癌术后最严重的合并症之一,会造成一系列不良后果:轻则延长病人住院时间、影响术后的放化疗,重则增加病人再手术风险甚至导致病人围手术期死亡[9]。因此,掌握直肠癌术后吻合口瘘的影响因素,并对可能存在的影响因素采取积极有效的防范措施,对临床工作有着非常重要的意义。
本组研究结果显示新辅助放化疗和联合其他器官手术是直肠癌低位前切除术后吻合口瘘发生的独立危险因素。本组中行新辅助放放化疗病人吻合口瘘的发生率为15.38%(6/39),远高于没有行新辅助放化疗病人的5.41%(12/222),差异有统计学意义(P<0.05);联合其他器官手术病人吻合口瘘的发生率为37.5%(3/8),远高于不伴其他器官手术病人的5.92%(15/253),差异有统计学意义(P<0.05)。
全直肠系膜切除术被许多临床试验证实在降低直肠癌复发率方面有着显著的作用,已经成为中低位直肠癌外科手术治疗的金标准。然而,新辅助放化疗的治疗作用仍是一个争论的焦点。Lim等[10]认为新辅助化疗能够降低肿瘤分期、提高低位直肠癌的保肛率、减低肿瘤局部复发率,并分析认为新辅助放化疗与低位直肠癌术后较高的合并症没有必然联系。同样Hu等[11]做的Meta分析指出:吻合口瘘与新辅助放化疗之间没有明确的关系。而Park等[12]认为新辅助放化疗会增加直肠癌术后吻合口瘘的发生率,与本研究结果一致。其发生机制有研究[13]显示多数术前新辅助放化疗病人往往处于疾病的更晚期,局部浸润粘连明显,术中系膜血管损伤也较大,且放化疗会引起病人组织纤维化、少血管化及免疫功能低下等,从而增加术后吻合口瘘发生的风险。
本研究8例联合其他器官手术的病人,手术时间为140~480 min,平均手术时间(297.8±106.5)min,远高于没有联合其他器官手术的病人(手术时间为60~400 min,平均手术时间(142.6±56.9)min;该8例病人术中出血量为200~1 500 mL,平均术中出血量(700±501.4)mL,远高于没有联合其他器官手术的病人(出血量为20~800 mL,平均术中出血量(77.7±77.9)mL;术后血清白蛋白为24.8~36.0 g/L,平均血清白蛋白(28.6±4.4)g/L,远低于没有联合其他器官手术的病人[术后白蛋白为22.5~44.0 g/L,平均术后白蛋白(33.6±3.6)g/L]。由此可见,行直肠癌低位前切除术联合其他器官手术的病人通常手术时间较长,术中出血量较多,手术操作难度较大,结合这些病人术后营养状况差,愈合慢,容易成为吻合口瘘的独立危险因素之一。因此,针对术中需要联合其他器官手术的病例,该做好充分的术前准备和评估,必要时请相关科室行多科综合治疗(multidisciplinary team,MDT)。本文研究结果显示术后血清白蛋白(<25 g/L)、手术时间(≥120 min)、术中出血量(≥300 mL)是吻合口瘘发生的影响因素,但不是独立危险因素。有文献[14-16]指出吻合口瘘与术中出血量较多、手术时间较长和低蛋白血症有关。Lohsiriwat等[16]认为,低蛋白血症会使组织愈合不良,减少伤口和吻合口胶原蛋白的合成,并且损伤像巨噬细胞活化和肉芽肿形成这样的免疫反应。因此,合并有低蛋白血症的病人更容易造成伤口感染、肺炎和吻合口瘘。
另外,有文献[12-13,17-18]报道,糖尿病、术后早期腹泻和吻合口水平与吻合口瘘的发生有密切关系,本研究结果未提示其对吻合口瘘差异有统计学意义,可能与术前有效调整血糖、腹泻及早处理和及时预防性造瘘有关。最近Qiu等[19]指出行直肠癌低位前切除术的肥胖病人吻合口瘘发生率是非肥胖病人的两倍以上,原因是肥胖病人的盆腔受肥大内脏的影响而变得更加狭窄,使得吻合器在远端直肠吻合时较难插入,从而加大了其吻合的难度,但由于笔者科室既往病历书写时未将体质量指数(body mass index,BMI)纳入,故本研究未对肥胖与吻合口瘘的关系进行分析,在这方面以后需要进一步完善。
近几年,关于直肠癌术后吻合口瘘防治方面的研究[20-23]有很多,Moslemi等[20]通过动物实验证实人羊膜对接受过新辅助放疗的结直肠癌病人可以预防吻合口瘘的发生;Mik等[21]认为充分的肠道准备和预防性应用抗生素可以降低吻合口瘘的发生率,本研究261例病人术前均行机械性肠道准备,故未将其纳入统计分析中;Rutegard等[22]指出通过近红外光技术,在术中应用增强荧光剂来评估吻合口血流灌注情况,进而提示外科医生吻合是否存在风险。但遗憾的是,以上实验样本数都很少,结果有待进一步证实。
本研究有如下几处不足:①为单中心研究,纳入的病例数较少;②纳入的病例距今时限较短,不能明确吻合口瘘对直肠癌术后5年生存率的影响。
总之,本研究结果得出,新辅助放化疗和联合其他器官手术是吻合口瘘发生的独立危险因素。对于伴有高危因素的病人应该及时制定预防和治疗措施,严于术前、精于术中、勤于术后,才能有效减少吻合口瘘的发生。
[1] Yang L, Huang X E, Zhou J N. Risk assessment on anastomotic leakage after rectal cancer surgery: an analysis of 753 patients[J]. Asian Pac J Cancer Prev, 2013,14(7):4447-4453.
[2] 李道娟, 李倩, 贺宇彤. 结直肠癌流行病学趋势[J]. 肿瘤防治研究, 2015,42(3):305-310.
[3] Buchs N C, Penna M, Bloemendaal A L, et al. Transanal total mesorectal excision: Myths and reality[J]. World J Clin Oncol, 2016,7(5):337-339.
[4] Tan W S, Tang C L, Shi L, et al. Meta-analysis of defunctioning stomas in low anterior resection for rectal cancer[J]. Br J Surg, 2009,96(5):462-472.
[5] Kanellos I, Vasiliadis K, Angelopoulos S, et al. Anastomotic leakage following anterior resection for rectal cancer[J]. Tech Coloproctol, 2004,8(Suppl 1):79-81.
[6] 许剑民, 冯青阳. 低位直肠癌保肛手术术式选择及评价[J]. 中国实用外科杂志, 2014,34(9):827-831.
[7] Giaccaglia V, Salvi P F, Cunsolo G V, et al. Procalcitonin, as an early biomarker of colorectal anastomotic leak, facilitates enhanced recovery after surgery[J]. J Crit Care, 2014,29(4):528-532.
[8] 曾祥岳, 孙振强, 王海江. 734例直肠癌术后吻合口瘘的影响因素分析[J]. 中华肿瘤防治杂志, 2016,23(5):322-325.
[9] Eckmann C, Kujath P, Schiedeck T H, et al. Anastomotic leakage following low anterior resection: results of a standardized diagnostic and therapeutic approach[J]. Int J Colorectal Dis, 2004,19(2):128-133.
[10] Lim Y K, Law W L, Liu R, et al. Impact of neoadjuvant treatment on total mesorectal excision for ultra-low rectal cancers[J]. World J Surg Oncol, 2010,8:23.
[11] Hu M H, Huang R K, Zhao R S, et al. Does neoadjuvant therapy increase the incidence of anastomotic leakage after anterior resection for mid and low rectal cancer? A systematic review and meta-analysis[J]. Colorectal Dis, 2017,19(1):16-26.
[12] Park J S, Choi G S, Kim S H, et al. Multicenter analysis of risk factors for anastomotic leakage after laparoscopic rectal cancer excision: the Korean laparoscopic colorectal surgery study group[J]. Ann Surg, 2013,257(4):665-671.
[13] 张展志, 肖萌萌, 李雁, 等. 腹腔镜直肠癌保肛手术后吻合口瘘的危险因素与对策[J]. 中华肿瘤防治杂志, 2016,23(1):40-44.
[14] Leichtle S W, Mouawad N J, Welch K B, et al. Risk factors for anastomotic leakage after colectomy[J]. Dis Colon Rectum, 2012,55(5):569-575.
[15] Konishi T, Watanabe T, Kishimoto J, et al. Risk factors for anastomotic leakage after surgery for colorectal cancer: results of prospective surveillance[J]. J Am Coll Surg, 2006,202(3):439-444.
[16] Lohsiriwat V, Lohsiriwat D, Boonnuch W, et al. Pre-operative hypoalbuminemia is a major risk factor for postoperative complications following rectal cancer surgery[J]. World J Gastroenterol, 2008,14(8):1248-1251.
[17] Parthasarathy M, Greensmith M, Bowers D, et al. Risk factors for anastomotic leakage after colorectal resection: a retrospective analysis of 17 518 patients[J]. Colorectal Dis, 2017,19(3):288-298.
[18] Li J, Han G S, Xu Y C, et al. Association of early diarrhea after the low anterior resection of rectal cancer and anastomotic leakage[J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2012,15(4):357-359.
[19] Qiu Y, Liu Q, Chen G, et al. Outcome of rectal cancer surgery in obese and nonobese patients: a meta-analysis[J]. World J Surg Oncol, 2016,14(1):23.
[20] Moslemi S M, Joraghi S M, Roshanravan R M, et al. Effect of human amniotic membrane on prevention of colorectal anastomosis leakage in cases with neoadjuvant radiotherapy: an experimental animal study[J]. Iran J Med Sci, 2016,41(6):501-506.
[21] Mik M, Berut M, Trzcinski R, et al. Preoperative oral antibiotics reduce infections after colorectal cancer surgery[J]. Langenbecks Arch Surg, 2016,401(8):1153-1162.
[22] Rutegard M, Rutegard J. Anastomotic leakage in rectal cancer surgery: The role of blood perfusion[J]. World J Gastrointest Surg, 2015,7(11):289-292.
[23] 师阳,常乐,周旭坤,等.腹腔镜与开腹全直肠系膜切除术治疗中低位直肠癌的近期疗效比较[J].中华肿瘤防治杂志,2016,23(S1):145-146.
Riskfactorsonanastomoticleakageafterlowanteriorresectionofrectalcancer
Xu Yi, Zhao Xiaomu, Sun Wuqing, Ma Jian, Wang Yueyue, Wang Jin*
(DepartmentofSurgery,BeijingFriendshipHospital,CapitalMedicalUniversity,NationalClinicalResearchCenterForDigestiveDiseases,Beijing100050,China)
ObjectiveTo investigate the risk factors on anastomotic leakage after low anterior resection of rectal cancer so as to provide a basis for the prevention and treatment of anastomotic leakage, thus reducing the incidence of leakage.MethodsThe data of 261 rectal cancer patients undergoing low anterior resection from January 1st 2013 to March 31st 2017 were recruited. All patients experienced a total mesorectal excision (TME) operation.χ2test was performed for univariate analysis, and Logistic regression test was carried out for multivariate correlation analysis.ResultsThe incidence of anastomotic leakage was 6.89% (18/261). Multivariate analysis showed that the occurrence of anastomotic leakage was closely correlated to neoadjuvant chemoradiation (OR= 3.498,P= 0.024) and combined with other organ surgery (OR= 10.834,P= 0.003).ConclusionNeoadjuvant chemoradiation and combined with other organ surgery were considered as independent risk factors for anastomotic leakage after anterior resection of rectal cancer. According to the relevant risk factors, the effective measures should be taken to reduce the incidence of anastomotic leakage.
rectal cancer;low anterior resection;anastomotic leakage;risk factors
首都卫生发展科研专项项目(2014-2-2022)。This study was supported by Capital Health Research and Development of Special (2014-2-2022) .
*Corresponding author, E-mail: iamwang_jin@ sina.com
时间:2017-10-14 16∶06
http://kns.cnki.net/kcms/detail/11.3662.R.20171014.1606.002.html
10.3969/j.issn.1006-7795.2017.05.018]
R753.3
2017-05-12)
编辑 慕 萌

