白介素4、10、12、13、IFN-γ、TGF-β在不同时期特应性皮炎病人血清中的变化
李 妍 徐 薇 程海艳 孙晓丽 李邻峰
(首都医科大学附属北京友谊医院皮肤性病科,北京 100050)
·皮肤病性病诊疗与研究·
白介素4、10、12、13、IFN-γ、TGF-β在不同时期特应性皮炎病人血清中的变化
李 妍 徐 薇 程海艳 孙晓丽 李邻峰*
(首都医科大学附属北京友谊医院皮肤性病科,北京 100050)
目的研究疾病发作期和缓解期特应性皮炎(atopic dermatitis,AD)病人血清中白细胞介素-4(interleukin-4,IL-4)、IL-10、IL-12、IL-13、干扰素-γ(interferon-γ,IFN-γ)、转化生长因子-β(transforming growth factor-β,TGF-β)等细胞因子的变化,探讨其在AD发病机制中的作用。方法收集疾病发作期AD病人79例,其中经治疗皮损缓解的AD病人(缓解组)40例,未缓解的AD病人(未缓解组)39例。采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)测定病人治疗前后血清中IL-4、IL-10、IL-12、IL-13、IFN-γ、TGF-β的浓度。结果缓解组AD病人治疗后血清中IL-4、IL-12、IL-13、IFN-γ与治疗前相比,差异均有统计学意义(均P<0.05)。缓解组AD病人治疗后血清中IL-10、TGF-β与治疗前相比,差异无统计学意义(P>0.05)。未缓解组AD病人治疗后血清中IL-4、IL-10、IL-12、IL-13、IFN-γ、TGF-β与治疗前相比,差异均无统计学意义(P>0.05)。结论AD病人病情缓解时血清中IL-4、IL-13表达显著下调,IFN-γ和IL-12表达显著升高。
特应性皮炎;辅助性T淋巴细胞;白细胞介素;干扰素-γ;转化生长因子-β
特应性皮炎(atopic dermatitis, AD)又名特应性湿疹等,是一种与遗传相关的慢性复发性瘙痒性皮肤病。约有1/3的AD病人为中重度病情[1]。因为缺乏有效的治疗方法,研究者纷纷转向发病机制的研究,试图探索出新的治疗手段[2]。AD发病机制复杂,目前的研究已从Th1/Th2失调的宽泛研究转向了更加有针对性的免疫和皮肤屏障异常的研究[3]。辅助性T细胞亚群及其细胞因子在AD的发病中起着非常重要的作用。为了探讨细胞因子与AD的关系,笔者收集了AD病人发病期和缓解期的血清标本,观察了不同细胞因子的变化,以求对AD的发病机制进行更深入的研究。
1 对象和方法
1.1研究对象
选择在首都医科大学附属北京友谊医院皮肤科门诊就诊并同意接受诊治的疾病发作期AD病人共79例,全部病人均口服西替利嗪片(商品名:仙特明,比利时联合化工集团医药部,国药准字H20100740),外用糠酸莫米松乳膏(商品名:艾洛松,上海先灵葆雅制药有限公司,国药准字H19991418)。同时口服复方甘草酸苷胶囊(商品名:凯因甘乐,北京凯因科技股份有限公司,国药准字H20080006)或润燥止痒胶囊(国药集团同济堂贵州制药有限公司,国药准字Z20025030)。疗程4周。其中经治疗,皮损缓解的AD病人(缓解组)40例,未缓解的AD病人(未缓解组)39例。两种中成药在每组病人中使用的比例在两组间差异无统计学意义,具有可比性。入选标准均符合Williams诊断标准[4]。并用Rajka和Langeland标准[5]判断为中到重度,至少10%体表面积受累(手掌法)。根据湿疹面积与严重度指数(eczema area and severity index, EASI)判断总体改善率。总体改善率=(治疗前EASI评分-治疗后EASI评分)/治疗前EASI评分×100%。痊愈:疗效指数≥90%;显效:60%≤疗效指数<90%;好转:20%≤疗效指数<60%;无效:疗效指数<20%[6-9]。痊愈和显效判定为病人进入缓解期,好转和无效判定为未缓解。本研究获得医院伦理委员会讨论通过,并签署知情同意书。
1.2方法
病人在治疗前、后常规采取静脉血,离心收集血清,-80 ℃冰箱冻存备用。试剂及仪器:采用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测病人血清干扰素-γ(interferon-γ,IFN-γ)、白细胞介素-4(interleukin-4,IL-4)、IL-10、IL-12、IL-13、转化生长因子-β(transforming growth factor-β,TGF-β)。试剂盒购自美国Life Technologies 公司,操作步骤按照说明书进行。采用美国Molecular Devices公司SpectraMax M3多功能酶标仪检测。
1.3统计学方法

2 结果
2.1一般情况
全部AD病人共79例,年龄19~40岁,平均年龄(25.06±5.20)岁。其中男性33例,女性46例。缓解组病人年龄20~38岁,平均年龄(25.25±5.19)岁,其中男性13例,女性27例。未缓解组病人年龄19~40岁,平均年龄(24.87±5.27)岁,其中男性20例,女性19例。
2.2两组病人治疗前后血清中不同细胞因子的浓度
缓解组AD病人治疗后血清中IL-4、IL-13浓度与治疗前相比显著下降,IFN-γ、IL-12浓度与治疗前相比显著增高(均P<0.05)。而缓解组AD病人治疗后血清中IL-10、TGF-β与治疗前相比,差异无统计学意义(P>0.05)。未缓解组AD病人治疗后血清中IL-4、IL-10、IL-12、IL-13、IFN-γ、TGF-β与治疗前相比,差异均无统计学意义(P>0.05)。详见表1。
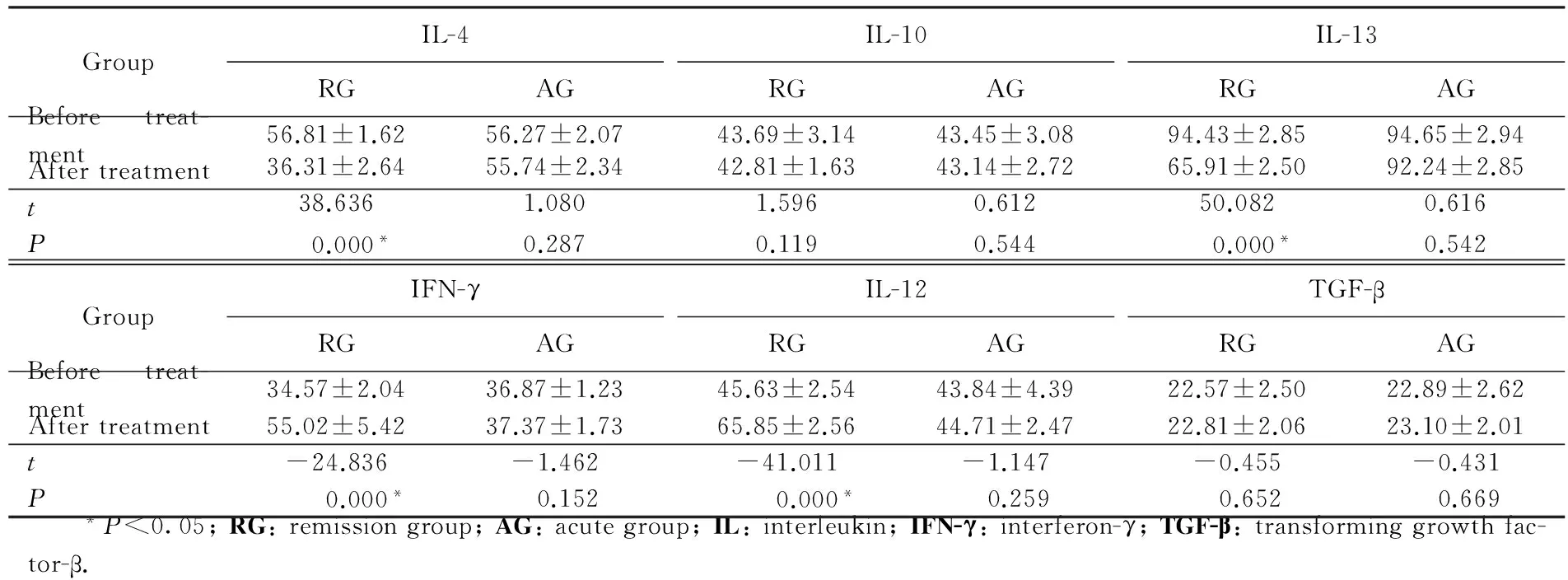
表1 两组病人治疗前后不同炎性反应因子浓度比较Tab.1 Values of different cytokines before and after treatment (pg/mL)
分别采用独立样本t检验和Mann-Whitney检验,两组AD病人治疗前后血清中IL-4、IL-10、IL-12、IL-13、IFN-γ、TGF-β浓度变化量的比较见表2和表3。两种检验方法得到相同的统计结果,两组AD病人治疗前后血清中IL-4、IL-12、IL-13、IFN-γ差值差异具有统计学意义(均P<0.05)。而两组AD病人治疗前后血清中IL-10、TGF-β 差值差异无统计学意义(P>0.05)。
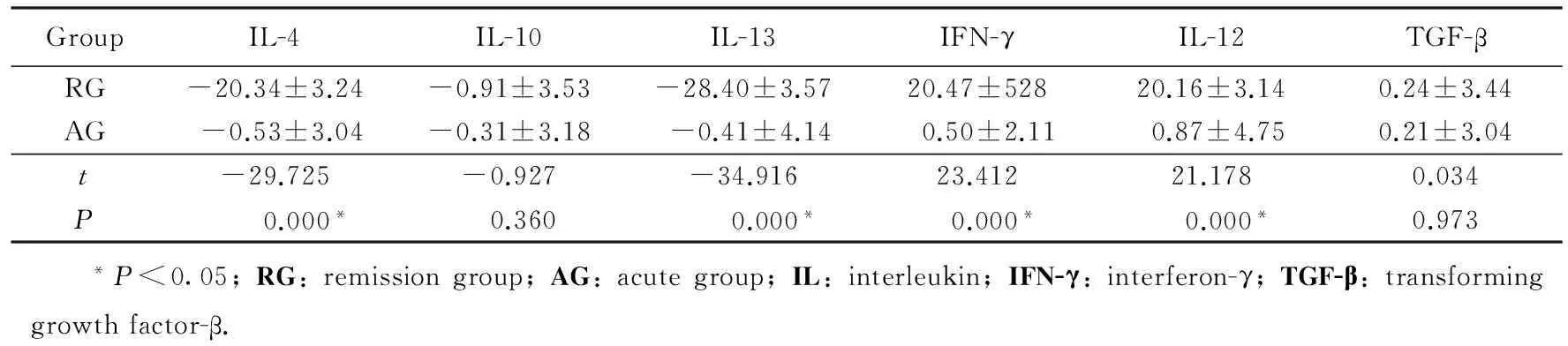
表2 两组病人治疗前后血清中不同炎性反应因子浓度差值的比较Tab.2 Changes of different cytokines’ values before and after treatment (pg/mL)
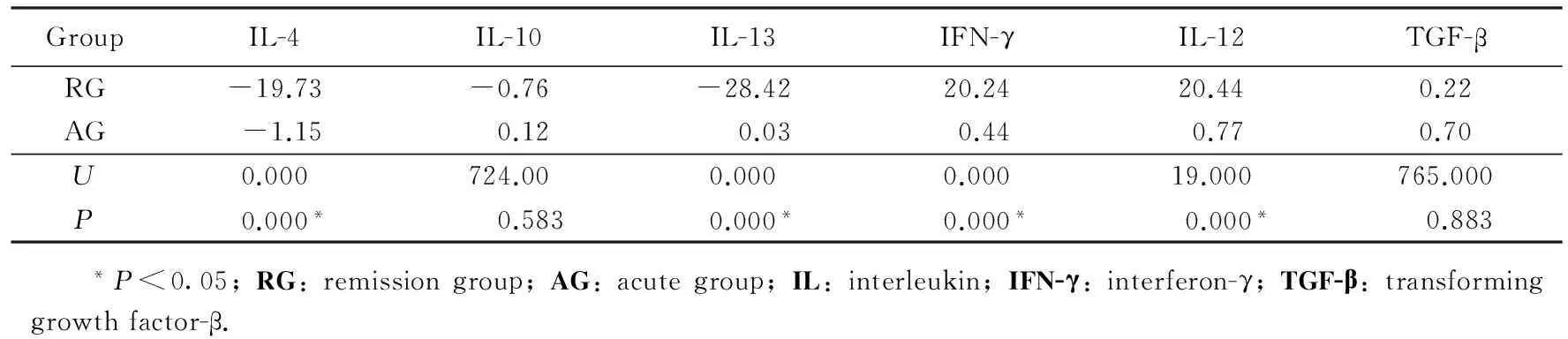
表3 两组病人治疗前后血清中不同炎性反应因子差值中位数的比较Tab.3 Changes of different cytokines’ median values before and after treatment (pg/mL)
3 讨论
AD是世界范围内最常见的炎性皮肤病,全球约有15%~30%的儿童和2%~10%的成人发病[2,10]。AD的发病机制复杂,免疫病理学揭示本病是由可引起皮肤屏障功能缺陷的先天性和获得性免疫细胞间相互作用产生[11]。因其临床表现与皮肤中免疫紊乱相互印证且息息相关,目前公认免疫功能紊乱和调节失衡是AD发病的中心环节。研究[12]显示在AD病人外周血和皮肤组织中,调节性T细胞的功能和数量都受到一定程度的损害,从而对Th2细胞的抑制作用减弱,导致Th2细胞功能亢进引发一系列变态反应性炎性反应,期间有多种细胞因子参与。Th2细胞主要分泌IL-4、IL-10、IL-13等,称为Th2型细胞因子,而Th1细胞主要分泌IFN-γ、IL-12、TGF-β等,称为Th1型细胞因子[13-14]。Gittler等[15]的研究显示,AD病人急性皮损中Th2型细胞因子呈优势表达,慢性皮损中Th1型细胞因子呈优势表达。AD病人外周血中具有Th1/Th2型细胞因子双重表达模式[16]。
IL-4和IL-13均能够刺激B细胞增生并合成IgE,促进T细胞增生并向Th2分化,抑制Th1分化。表皮中IL-4过表达将会导致AD典型的临床表现[17-18]。AD病人皮损处外用含神经酰胺的润肤乳在修复皮肤屏障的同时,可引起IL-4浓度的下降[18]。IL-13+CD4+T细胞比例与AD病情严重程度、外周血IgE浓度及嗜酸性粒细胞计数呈正相关[19]。本研究中经治疗缓解的AD病人血清中IL-4、IL-13浓度较疾病发作期显著下降,而未缓解的病人与治疗前相比差异无统计学意义。经治疗缓解的AD病人血清中IL-4、IL-13浓度下降幅度较未缓解组更为显著。多数研究[18,20]显示AD病人外周血单核细胞产生IL-4的浓度显著增高。Metwally等[21]显示,在AD病人外周血中IL-13浓度较正常对照组明显增高,且与病情的严重程度和血清IgE浓度呈正相关。本研究与国内外研究[18,20-21]结果相一致。IL-4和IL-13是关键的Th2细胞因子,可能在启动AD发病中起着关键作用[10,17],并在AD急性期和慢性期的发病机制中扮演重要角色[1]。
IFN-γ和IL-12主要由Th1细胞和抗原递呈细胞分泌,它能促进NK细胞和T细胞的增生,诱导T细胞和NK细胞所介导的细胞毒活性,可刺激Th0细胞向Th1分化,共同调控Th1细胞生殖发育,抑制IgE的合成和Th2淋巴细胞的功能。较多的研究[19,22]显示AD病人外周血单核细胞产生IFN-γ的水平低下。有研究[23]显示AD病人皮损中IFN-γ的浓度与病人病情严重程度呈负相关,皮损越重,IFN-γ浓度越低。AD病人IL-12浓度与IgE浓度呈明显负相关[24]。本研究中,经治疗缓解的AD病人血清中IFN-γ和IL-12浓度较疾病发作期显著升高,而未缓解的病人与治疗前相比差异无统计学意义。经治疗缓解的AD病人血清中IFN-γ和IL-12浓度升高幅度较未缓解组更为显著。Katsunuma等[25]的研究显示,将AD病人按病情的轻重和对治疗反应进行分级,测其外周血单核细胞所分泌的IFN-γ浓度,发现病情重,治疗效果不佳的病人,其IFN-γ的分泌明显减低。本研究与国内外研究[23-25]结果相一致。
IL-10主要由CD4+T细胞的Th2亚群产生,某些活化的B细胞、Th1细胞、活化的巨噬细胞及角质形成细胞等均可产生IL-10。TGF-β对细胞的生长、分化和免疫功能都有重要的调节作用,可抑制免疫活性细胞的增生、抗原递呈细胞的功能和淋巴细胞的分化,抑制细胞因子产生,进而减轻炎性反应[23]。IL-10和TGF-β在AD发病中的作用均存在争议。研究[26]显示AD病人血清中IL-10高表达,但Hussein等[27]的研究显示,特应性体质病人血清中IL-10浓度并无明显异常。Zhang等[28]的研究显示,严重AD病人外周血培养上清中IL-10和TGF-β浓度均低于正常对照。赵宏丽等[29]的研究显示,AD病人外周血TGF-β浓度与健康对照者差异无统计学意义。本研究中,经治疗缓解和未缓解的AD病人血清中IL-10和TGF-β浓度与治疗前相比差异均无统计学意义,且两组病人血清中IL-10和TGF-β浓度变化幅度差异亦无统计学意义。
AD最有效的治疗策略包括尽快将急性期病程缩短和预防急性期出现的长期维持治疗[10]。通过得到这些细胞因子在疾病不同时期的作用,就可以研发出治疗AD的有效治疗方法和药物。随着细胞因子在AD免疫病理过程中重要作用的发现,研究者试图通过调整细胞因子来达到治疗AD的目的,并逐步取得了成功。某些生物制剂已进入临床试验阶段。例如磷酸二酯酶 (phosphodiesterase, PDE)-4 抑制剂通过降低IL-4、IL-5、IL-13浓度,减轻炎性反应,从而阻止AD病情进展[30]。托法替尼(Tofacitinib)是一种小分子Janus激酶(Janus kinase,JAK)抑制剂,通过直接抑制IL-4、IL-13、IL-31减轻炎性反应[31]。生物制剂在AD治疗中获得的巨大成功,反证了本研究的价值。本研究中,AD病人病情缓解时血清中IL-4、IL-13表达显著下调,IFN-γ和IL-12表达显著升高。这些因子浓度的变化使Th2细胞受到抑制,Th1细胞增生发育,IgE合成受到抑制,病人病情缓解。T淋巴细胞向Th1还是向Th2优势转换决定了AD的改善还是恶化,而这些细胞因子就像是AD发展的内在驱动力[10]。因此,应积极寻找有效调控细胞因子的治疗方法[20]。细胞因子在AD发病中作用机制的深入研究必将为AD的治疗提供更多选择。
[1] Renert-Yuval Y, Guttman-Yassky E. Systemic therapies in atopic dermatitis: The pipeline[J]. Clin Dermatol, 2017,35(4):387-397.
[2] Weiss D, Schaschinger M, Ristl R,et al. Ustekinumab treatment in severe atopic dermatitis: Down-regulation of T-helper 2/22 expression[J]. J Am Acad Dermatol, 2017,76(1):91-97.
[3] Sullivan M, Silverberg N B. Current and emerging concepts in atopic dermatitis pathogenesis[J]. Clin Dermatol, 2017,35(4):349-353.
[4] Vakharia P P, Chopra R, Silverberg J I. Systematic Review of Diagnostic Criteria Used in Atopic Dermatitis Randomized Controlled Trials[J]. Am J Clin Dermatol, 2017, Jun 17.[Epub ahead of print]
[5] Gånemo A, Svensson Å, Svedman C, et al. Usefulness of Rajka & Langeland Eczema Severity Score in Clinical Practice[J]. Acta Derm Venereol,2016, 96(4): 521-524.
[6] 赵辨. 湿疹面积及严重度指数评分法[J]. 中华皮肤科杂志,2004,37(1): 3-4.
[7] 李妍,徐薇,钟珊,等. 青鹏软膏治疗乏脂性湿疹疗效和皮肤屏障功能影响的自身对照研究[J]. 中华皮肤科杂志,2016,49(2):128-130.
[8] 李妍,徐薇,李邻峰. 外用糖皮质激素联合含抗菌肽保湿剂对湿疹的疗效观察[J]. 中华皮肤科杂志,2016,49(10):733-736.
[9] 李妍,徐薇,杨宝琦,等. 青鹏软膏治疗儿童局限性湿疹的多中心随机对照研究[J]. 中华皮肤科杂志,2017,50(6):412-416.
[10] Udkoff J, Waldman A, Ahluwalia J,et al. Current and emerging topical therapies for atopic dermatitis[J]. Clin Dermatol, 2017,35(4):375-382.
[11] Mashiko S, Mehta H, Bissonnette R,et al. Increased frequencies of basophils, type 2 innate lymphoid cells and Th2 cells in skin of patients with atopic dermatitis but not psoriasis[J]. J Dermatol Sci, 2017, pii: S0923-1811(17)30701-30706.
[12] Nomura T, Kabashima K. Advances in atopic dermatitis in 2015[J]. J Allergy Clin Immunol,2016,138(6):1548-1555.
[13] Lee H S, Choi E J, Lee K S,et al. Oral administration of p-Hydroxycinnamic acid attenuates atopic dermatitis by downregulating Th1 and Th2 cytokine production and keratinocyte activation[J]. PLoS One, 2016,11(3):e0150952.
[14] 崔东源,王晓非. CCL17在类风湿关节炎患者外周血清中的表达及意义[J].中国医科大学学报,2015,44(10):913-916,920.
[15] Gittler J K, Shemer A, Suárez-Farias M,et al. Progressive activation of T(H)2/T(H)22 cytokines and selective epidermal proteins characterizes acute and chronic atopic dermatitis[J]. J Allergy Clin Immunol, 2012,130(6):1344-1354.
[16] Hijnen D, Knol E F, Gent Y Y, et al. CD8+T cells in the lesional skin of atopic dermatitis and psoriasis patients are an important source of IFN-γ, IL-13, IL-17, and IL-22[J]. J Invest Dermatol, 2013,133(4):973-979.
[17] Paul W E. History of interleukin-4[J]. Cytokine, 2015,75(1):3-7.
[18] Nada H A, Gomaa N I, Elakhras A, et al. Skin colonization by superantigen-producing staphylococcus aureus in egyptian patients with atopic dermatitis and its relation to disease severity and serum interleukin-4 level[J]. Int J Infect Dis, 2012,16(1):e29-e33.
[19] Kaminishi K, Soma Y, Kawa Y,et al. Flow cytometric analysis of IL-4, IL-13 and IFN-γ expression in peripheral blood mononuclear cells and detection of circulating IL-13 in patients with atopic dermatitis provide evidence for the involvement of type 2 cytokines in the disease[J]. J Dermatol Sci,2002,29(1):19-25.
[20] Wang A X, Xu Landén N. New insights into T cells and their signature cytokines in atopic dermatitis[J]. IUBMB Life, 2015,67(8):601-610.
[21] Metwally S S, Mosaad Y M, Abdel-Samee E R, et al.IL-13 gene expression in patients with atopic dematitis:relation to IgE level and to disease severity[J].Egypt J Immunol, 2004,11(2):171-177.
[22] Yu Y, Zhang Y, Zhang J, et al. Impaired Toll-like receptor 2-mediated Th1 and Th17/22 cytokines secretion in human peripheral blood mononuclear cells from patients with atopic dermatitis[J]. J Transl Med, 2015,13:384.
[23] 陈浩, 郭在培.特应性皮炎中细胞因子的研究进展[J]. 中国麻风皮肤病杂志,2008,24(6):460-463.
[24] Shida K, Koizumi H, Shiratori I, et al. High serum levels of additional IL-18 forms may be reciprocally correlated with IgE levels in patients with atopic dermatitis[J]. Immunol Lett, 2001,79(3):169-175.
[25] Katsunuma T,Kawahara H,Yuki K,et al.Impaired interferon-gamma production in a subset population of severe atopic dermatitis[J].Int Arch Allergy Immunol,2004,134(3):240-247.
[26] Lesiak A, Zakrzewski M, Przybyowska K, et al. Atopic dermatitis patients carrying G allele in -1082 G/A IL-10 polymorphism are predisposed to higher serum concentration of IL-10[J]. Arch Med Sci, 2014,10(6):1239-1243.
[27] Hussein P Y, Zahran F, Ashour Wahba A,et al. Interleukin 10 receptor alpha subunit (IL-10RA) gene polymorphism and IL-10 serum levels in Egyptian atopic patients[J]. J Investig Allergol Clin Immunol, 2010,20(1):20-26.
[28] Zhang Y Y, Wang A X, Xu L,et al. Characteristics of peripheral blood CD4+CD25+regulatory T cells and related cytokines in severe atopic dermatitis[J]. Eur J Dermatol, 2016,26(3):240-246.
[29] 赵宏丽,赵俊芳,李孟娟. CD4+IL-10+调节性T细胞在特应性皮炎病人中的改变[J].天津医药,2012,40(8):821-822.
[30] Dong C, Virtucio C, Zemska O,et al. Treatment of skin inflammation with benzoxaborole phosphodiesterase Inhibitors: selectivity, cellular activity, and effect on cytokines associated with skin inflammation and skin architecture changes[J]. J Pharmacol Exp Ther, 2016,358(3):413-422.
[31] Bissonnette R, Papp K A, Poulin Y,et al. Topical tofacitinib for atopic dermatitis: a phase Ⅱa randomized trial[J]. Br J Dermatol, 2016,175(5):902-911.
ChangesofIL-4,IL-10,IL-12,IL-13,IFN-γandTGF-βintheserumofatopicdermatitispatientsatdifferentstagesofthedisease
Li Yan, Xu Wei, Cheng Haiyan, Sun Xiaoli, Li Linfeng*
(DepartmentofDermatologyandVenereology,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050,China)
ObjectiveTo investigate the changes of interleukin-4(IL-4),IL-10,IL-12,IL-13, interferon-γ (IFN-γ) and transforming growth factor-β (TGF-β) in the serum of atopic dermatitis patients at different stages of the disease, and explore their significance.MethodsSeventy-nine atopic dermatitis patients at acute stage were enrolled. There were 40 cases at remission stage(remission group, RG), and 39 cases were still at acute stage after treatment(acute group, AG). The serum levels of IL-4,IL-10,IL-12,IL-13, IFN-γ and TGF-β were detected by enzyme-linked immunosorbent assay(ELISA) before and after treatment.ResultsThere were significant differences in the serum levels of IL-4,IL-12,IL-13 and IFN-γ before and after treatment in the remission group(P<0.05). There were no significant differences in the serum levels of IL-10, TGF-β before and after treatment in the remission group(P>0.05). There were no significant differences in the serum levels of IL-4,IL-10,IL-12,IL-13, IFN-γ and TGF-β before and after treatment in the acute group(P>0.05).ConclusionLower expression of IL-4, IL-13, and higher expression of IFN-γ, IL-12 in serum at remission stage of atopic dermatitis.
atopic dermatitis; helper T lymphocytes; interleukin; interferon-γ; transforming growth factor-β
国家自然科学基金(81541162)。This study was supported by National Natural Science Foundation of China(81541162).
*Corresponding author, E-mail:zoonli@sina.com
时间:2017-10-14 16∶19
http://kns.cnki.net/kcms/detail/11.3662.R.20171014.1619.036.html
10.3969/j.issn.1006-7795.2017.05.001]
R758.23
2017-05-09)
编辑 陈瑞芳

