重组人促红细胞生成素对脓毒症小鼠肝脏的保护作用
玄春月 肖 芳 杨舒楠 王晓群 刘庆阳 徐凯智
华北理工大学研究生学院 河北唐山 063000;①保定市妇幼保健院;②唐山工人医院;③煤炭总医院
重组人促红细胞生成素对脓毒症小鼠肝脏的保护作用
玄春月*肖 芳①杨舒楠 王晓群②刘庆阳③徐凯智②
华北理工大学研究生学院 河北唐山 063000;①保定市妇幼保健院;②唐山工人医院;③煤炭总医院
①目的 探讨促红细胞生成素对脓毒症小鼠受损肝脏的保护作用。②方法 在体实验:取雄性C57BL/6小鼠50只,分为5组,每组10只,分别为对照组(C组),脓毒症组(CLP组),重组人促红细胞生成素低、中、高浓度组(E1、E2、E3),其中E1、E2、E3的剂量分别为10IU/kg、100IU/kg、1000IU/kg,除了C组外的小鼠均进行盲肠结扎穿孔(CLP)造模,造模后分别注射对应剂量的生理盐水及药物,共观察5天,记录各组小鼠的死亡率。离体实验:再取50只雄性C57BL/6小鼠,处理方法同上,在建模后的第24小时将小鼠处死,检测血清中的谷草转氨酶(AST)、谷丙转氨酶(ALT)浓度,将肝脏取下处理后,在样本中加入7AAD,用流式细胞仪检测肝脏细胞的凋亡率。③结果 在体实验:E2、E3组小鼠死亡率明显低于CLP组和E1组差异有统计学意义(P<0.05)。离体实验:E2、E3组小鼠肝脏的AST、ALT浓度以及其肝脏的凋亡率明显低于CLP组和E1组差异有统计学意义(P<0.05)。④结论 促红细胞生成素对脓毒症受损肝细胞能起到一定的保护作用,并可改善脓毒症小鼠的预后,降低死亡率。
促红细胞生成素 脓毒症 小鼠 肝损伤 保护作用
脓毒症是严重创伤、烧伤及休克性感染等临床急危重症患者的严重并发症之一,可由感染或有高度可疑感染灶引起[1]。也是重症监护室患者死亡最常见的原因之一[2,3]。脓毒症时引起多脏器衰竭[4],尤其是肝功能衰竭、肾功能衰竭、肺功能衰竭等对脓毒症的预后影响尤其严重[5,6],并且肝脏是脓毒症状态下最易受累的器官之一,肝功能不全是脓毒症发展为多器官衰竭的早期表现之一。肝脏不仅是脓毒症中最易受损的器官之一,还对脓毒症的发生、发展起重要作用。人体中的促红细胞生成素(Erythropoietin,EPO)是由肾脏和肝脏分泌的一种激素样物质,主要功能是通过增加红细胞数量来提高氧输送。但近年来,它的多种非造血功能也已被很多学者证实。重组人促红细胞生成素(Recombinant Human Erythropoietin,简称rHuEPO)是应用基因工程技术,从含人红细胞生成素基因的中国仓鼠卵巢细胞(CHO)培养液中提取得到的,它是含有165个氨基酸的糖蛋白,具有与正常人体内存在的天然红细胞生成素相同的生理功能。基于以上研究背景及研究现状,我们假设,若给予脓毒症小鼠rHuEPO,极可能有效地促进脓毒症肝脏损伤修复,进而延缓脓毒症的发生、发展,为临床上rHuEPO对脓毒症患者的使用提供强有力的依据。
1 材料与方法
1.1实验材料
1.1.1实验动物 雄性C57BL/6小鼠100只,6~8周龄,体质量19~21克,清洁级,购自于(北京华阜康生物科技股份有限公司),动物许可证号:SCXK(京) 2015-0004;
1.1.2实验仪器 高速低温离心机,流式细胞仪,全自动生化分析仪,眼科器械,移液枪,枪头,枪盒,EP管,电子天平,离心管等。
1.1.3实验药物及试剂 益比奥(重组人促红细胞生成素(CHO细胞)),沈阳三生制药有限责任公司;Annexin-V-PE/7-AAD细胞凋亡检测试剂盒:北京诺博莱德科技有限公司。
1.2实验方法
1.2.1在体实验
1.2.1.1实验分组 共50只 C57BL/6小鼠,每组10只,C组为对照组;CLP组为脓毒症组;E1组为CLP+rHuEPO(10IU/kg);E2组为CLP+rHuEPO(100IU/kg);E3组为CLP+rHuEPO(1000IU/kg)。
1.2.1.2实验过程 盲肠结扎穿孔建模(Cecal ligation puncture,CLP),各组术前禁食12小时,2.5%戊巴比妥钠按2mL/kg腹腔注射麻醉。对照组:仅做开腹分离盲肠远端与大肠的系膜及关腹手术。脓毒症组(CLP组):常规消毒腹部,皮肤正中切开长约2cm,打开腹腔后找到盲肠,分离其远端与大肠的系膜,切记避免碰伤肠系膜血管。盲肠内如有粪便,则轻轻将其挤向与其相连的大肠,在盲肠远端2/3处用无菌丝线紧紧结扎,在结扎处近心端用16号针头穿刺末端盲肠4次,挤压可见肠内容物外漏,形成盲肠漏,然后再将盲肠回纳腹腔,依腹壁层次分两层缝合腹壁切口,再次经腹腔注入生理盐水1mL补液。E1、E2、E3组手术过程同CLP组。手术后分别给予rHuEPO10IU/kg、100IU/kg、1000IU/kg。每12小时昼夜节律变换,自由进食水。每24小时观察一次,共观察5天,记录各组存活率情况。
1.2.2离体实验 实验分组及小鼠处理情况同在体实验,在第24小时,眼球取血,将小鼠脱颈处死,用全自动生化分析仪检测血清中的谷丙转氨酶(Glutamic pyruvic transaminase AST)、谷草转氨酶(Glutamic-oxalacetic transaminase,ALT)浓度。将肝脏剖腹取下,研磨、离心等处理后,将样本加入Annexin-V-PE/7-AAD,用流式细胞仪器检测肝脏细胞的凋亡。

2 结果
2.1各组中脓毒症小鼠死亡率比较 通过5天的观察与记录,E2、E3组与CLP和E1组相比死亡率差异具有统计学意义(P<0.05)。E1与CLP组相比差异无统计学意义(P>0.05),E2组与E3组相比,其死亡率差异具有统计学意义(P<0.05),见表1。由此可见rHuEPO能降低脓毒症小鼠的死亡率。
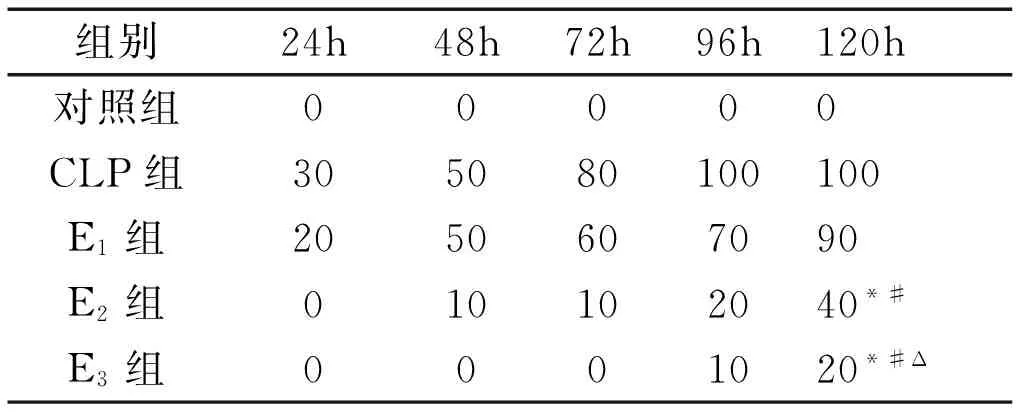
表1 各组小鼠死亡率比较(%,n=10)
注:与CLP组相比,*P<0.05;与E1组相比,#P<0.05;与E2组相比,ΔP<0.05

表2 各组小鼠血清中AST、ALT浓度变化比较
注:与CLP组相比,*P<0.05;与E1相比,#P<0.05;与E2组相比,ΔP<0.05
2.2各组小鼠血清中AST、ALT浓度变化 E2组、E3组血清中AST、ALT浓度较E1组和CLP组显著降低,差异具有统计学意义(P<0.05)。E2组与E3组相比,其浓度变化具有统计学意义(P<0.05),见表2。
2.3各组脓毒症小鼠肝脏细胞的凋亡率比较 E2组、E3组肝脏细胞的凋亡率较E1组和CLP组显著降低的,差异具有统计学意义(P<0.05),E2组与E3组相比,其凋亡率变化具有统计学意义(P<0.05),见表3。

表3 各组小鼠肝脏细胞的凋亡率
注:与CLP组相比,*P<0.05;与E1相比,#P<0.05;与E2组相比,ΔP<0.05
3 讨论
脓毒症是重症监护室患者死亡最常见的原因之一。目前脓毒症的发病机制尚未明确,通常认为,其发生、发展与感染、过度炎症反应、免疫功能抑制、凝血功能障碍及组织损伤等病理过程有关,可影响心、肺、肝及肾等多个重要器官的生理功能。脓毒症的发病率很高,是发达国家非冠心病重症监护病房中最常见的死因[7]。脓毒症已经成为人类健康的严重威胁、经济发展的巨大负担,所以如何早期识别、及时诊断、有效防治脓毒症的形成与发展,防止多脏器功能衰竭,是提高急危重症救治成功率的关键所在。本实验表明,给予脓毒症小鼠一定剂量的rHuEPO,可使其死亡率降低,说明rHuEPO对脓毒症小鼠有一定的保护作用。
脓毒症常导致脓毒症休克甚至多器官功能障碍综合征,随着病情发展,机体各脏器会受到不同的损伤, 肝脏是脓毒症状态下最易受累的器官之一,现代免疫学研究证实,脓毒症患者继发性脏器损伤与免疫应答反应失衡关系密切[8,9]。急性肝损伤可发生在脓毒症的任何阶段,在多器官功能障碍综合征的发生、发展中起着不可小觑作用[10]。本实验通过对血清AST、ALT浓度测定,也证实了脓毒症时发生的肝损伤,并且当给予相应剂量的rHuEPO,AST、ALT的浓度下降,随着肝功能的好转,脓毒症小鼠的死亡率也降低,因此早改善肝功能对于脓毒症患者的预后起着举足轻重的作用。
人体中的EPO是由肾脏和肝脏分泌的一种激素样物质,能够促进红细胞生成,是细胞因子的一种,在骨髓造血微环境下促进红细胞的生成,分类上是属于集落刺激因子[11]。EPO 主要功能是通过增加红细胞数量来提高氧输送。但近年来,它的多种非造血功能也已被很多学者证实。EPO不但能抑制造血祖细胞的凋亡[12],还具有抗炎、抗氧化、抗凋亡和促进组织血管生成的影响[13],还能减少缺氧或缺血后心脏、肾脏和脑细胞的凋亡[14,15],并且EPO是一种组织保护性细胞因子[16]。EPO可以通过与肺泡表面上皮细胞的受体结合,抑制肺泡上皮细胞凋亡,从而实现对肺保护作用[13]。EPO还能通过与肝脏表面EPO受体结合对肝衰竭起到保护作用[17]。本实验表明,脓毒症小鼠应用rHuEPO后,通过对其肝功能的测定,证实了rHuEPO能改善肝功能,从而也改善了脓毒症小鼠的预后。
本实验通过盲肠结扎穿孔实验来模拟脓毒症,收集各组小鼠的血清,测定各组AST、ALT浓度,通过数据分析,与CLP组相比中、高剂量的rHuEPO能降低小鼠血清AST、ALT浓度。同时,将各组小鼠肝脏处理测定其凋亡率,通过分析比较脓毒症小鼠应用中、高剂量的rHuEPO能降低小鼠肝脏细胞的凋亡率,rHuEPO能对脓毒症小鼠受损肝脏起到一定的保护作用,与小鼠死亡率实验结果共同分析,提示rHuEPO能够通过对脓毒症小鼠受损的肝脏起保护作用进而提高脓毒症小鼠的生存率、改善其预后。本实验数据可以为临床上脓毒症的治疗提供新的视野和思路,对临床脓毒症的治疗提供新的理论基础。
[1] Martinod K,Fuchs T A,Zitomersky N L,et al.PAD4-deficiency does not affect bacteremia in polymicrobial sepsis and ameliorates endotoxemic shock[J].Blood,2015,125(12):1948-1956
[2] Jaramillo-Bustamante JC,Marin-Agudelo A,Fernandez-Laverde M,et al.Epidemiology of sepsis in pediatric intensive care units:first Colombian multicenter study[J].Pediatr Crit Care Med,2012,13:501-508
[3] Moore LJ,Moore FA.Epidemiology of sepsis in surgical patients[J].Surg Clin North Am,2012,92:1425-1443
[4] Sileshi B,Shaw A.Sepsis:Protocolized care for critically ill patients with AKI[J].Nature Reviews Nephrology,2015,11(1):10-11
[5] Carcillo J A,Simon DW,Podd BS. How We manage hyperferritinemic sepsis-related multiple organ dysfunction syndrome/macrophage activation syndrome/secondary hemophagocytic lymphohistiocytosis histiocytosis[J].Pediatr Crit Care Me,2015,16(6):598-600
[6] Bataille A,Galichon P,Ziliotis M J,et al.Epigenetic changes during sepsis:on your marks[J].Critical Care,2015,19(1):358
[7] Mayr FB,Yende S,Angus DC.Epidemiology of severe sepsis[J].Virulence,2014,5:4-11
[8] Bermejo-Martin J F,Andaluz-Ojeda D,Almansa R,et al.Defining immunological dysfunction in sepsis:A requisite tool for precision medicine[J].J Infect,2016,72(5):525
[9] Hotchkiss R S,Sherwood E R.Immunology.Getting sepsis therapy right[J].Science,2015,347(6227):1201
[10] Iketani M,Ohshiro J,Urushibara T,et al.Preadministration of Hydrogen-Rich Water Protects Against Lipopolysaccharide-Induced Sepsis and Attenuates Liver injury[J].Shock,2016,1
[11] Loomis WP,Delaney MA,Johnson ML,et al.Hypersplenism,EPO resistance and chronic Salmonella infection[J].The Journal of Immunology,2016,196(1):131-131
[12] Kumar M,Bhoi S.Cytokines, granulocyte-monocyte colony stimulating factor,interleukin-3 and erythropoietin:Can be a therapeutic option for the stimulation of hematopoietic progenitor cells in trauma-hemorrhagic shock[J].IJCCM,2016,20(4):207
[13] Heitrich M,García D M,Stoyanoff T R,et al.Erythropoietin attenuates renal and pulmonary injury in polymicrobial induced-sepsis through EPO-R,VEGF and VEGF-R2 modulation[J].Biomedicine & pharmacotherapy Biomedecine & pharmacotherapie,2016,82:606
[14] Tamadon M R,Khatibinezhad A,Ghorbani R,et al.The impact of human recombinant erythropoietin on renal function in patients with chronic kidney disease[J].Nephro-Urology Monthly,2016,3(2):114-117
[15] Ehrenreich H,Hasselblatt M,Knerlich F,et al.A Hematopoietic Growth Factor,Thrombopoietin,Has a Proapoptotic Role in the Brain[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(3):862-867
[16] Tögel F E,Ahlstrom J D,Yang Y,et al.Carbamylated erythropoietin outperforms erythropoietin in the treatment of AKI-on-CKD and other AKI models[J].Journal of the American Society of Nephrology,2016,27(11):3394-3404
[17] Alempijevic T,Zec S,Nikolic V,et al.Erythropoietin in predicting prognosis in patients with acute-on-chronic liver failure[J].Journal of gastrointestinal and liver diseases:JGLD,2016,25(4):473
(2017-02-15 收稿)(库雪飞 编辑)
Protectiveeffectsoferythropoietinonliverinjuryinsepticmice
XUAN Chunyue,XIAO Fang,YANG Shunan,et al
(North China University of Science and Technology.Tangshan 063000,China)
ObjectiveTo investigate protective effects of erythropoietin(rHuEPO) on on liver injury induceded by sepsis in vitro and vivo.MethodsIn vivo:Fifty male C57BL/6 mice were divided into 5 groups,n=10 in each group.They were blank control group (C group),sepsis group(CLP group),Recombinant human erythropoietin was low,medium and high concentration group(E1,E2and E3).The dosage of E1,E2and E3were 10IU/kg,100IU/kg,1000IU/kg,respectively.Except for C group mice were subjected to cecal ligation and puncture (CLP) model.After modeling,the corresponding doses of saline and drugs were injected respectively.A total of 5 days,the mortality of each group was recorded.In virto:Another fifty male C57BL/6 mice.Their treatment method was the same as above,the mice were killed at 24h after modeling,The serum aspartate aminotransferase (AST),alanine aminotransferase (ALT) concentration were detected.After the liver was removed and treated,we added 7AAD to the samples,flow cytometry was used to detect the apoptosis rate of liver cells.ResultsIn vivo,the mortality rate of mice in E2group and E3group was significantly lower than that in CLP group E1and group.In vitro,the concentration of AST,ALT and the apoptosis rate of liver in E2group and E3group were significantly lower than those in CLP groupand E1group.ConclusionErythropoietin can protect the liver cells from sepsis,improve the prognosis of septic mice and reduce the mortality rate.
Erythropoietin.Sepsis.Mice.Liver injury.Protective effect
R 515;R 631
A
2095-2694(2017)05-347-05
国家自然科学基金(编号:81272140);中国博士后面上项目(编号:201150M1530); 中国博士后第五批特别资助项目(编号:2012T50863)。
玄春月(1989-),女,硕士研究生。研究方向:脓毒症的基础与临床研究。
刘庆阳 徐凯智。
*现在河北省秦皇岛市海港医院工作。

