不同浓度米诺环素刺激骨髓细胞对小鼠体外肝细胞损伤的影响
文 翠 肖 芳 徐凯智 赵 昕 王晓群 陈 楠 刘庆阳
华北理工大学附属唐山工人医院麻醉科 河北唐山 063000;①保定市妇幼保健院,②煤炭总医院
不同浓度米诺环素刺激骨髓细胞对小鼠体外肝细胞损伤的影响
文 翠 肖 芳①徐凯智 赵 昕 王晓群 陈 楠 刘庆阳②
华北理工大学附属唐山工人医院麻醉科 河北唐山 063000;①保定市妇幼保健院,②煤炭总医院
①目的 探讨不同浓度米诺环素刺激的骨髓细胞对体外培养的小鼠肝细胞损伤的保护作用。②方法 获取C57BL/6小鼠同基因背景下绿色荧光骨髓细胞,分为6组:对照组(b0组)、不同浓度米诺环素刺激组(b1~5组)。b0组为单纯骨髓细胞培养组,b1~5组分别加入不同浓度(5、10、20、50、100μg/mL)米诺环素;将b0~5组置于37℃、5%CO2培养箱培养培养24小时后,各取出一部分骨髓细胞用MTT法检测其增生率;获取C57BL/6小鼠肝细胞,分为8组(a、aL、a0~5组),除对照组(a组,为单纯肝细胞培养组)外,其余各组加入终浓度100μg/mL的脂多糖(LPS),建立肝细胞损伤模型。a0~5组分别相应加入b0~5组培养的骨髓细胞2×106个,a、aL组加入等容积的PBS液,置于37℃、5%CO2培养箱培养,1~2天换液,动态观察肝细胞生长情况并检测肝细胞的凋亡率。③结果 与b0组相比,不同浓度米诺环素刺激24小时后骨髓细胞的增生率有所不同,b1组(5μg/mL)最高,b5组(100μg/mL)最低。与a组相比较,aL肝细胞受损严重,凋亡率增加;a0~5组肝细胞有不同程度的增殖,其凋亡率有所降低,以低浓度5μg/mL效果最优。④结论 本次实验显示5μg/mL的米诺环素刺激的骨髓细胞对体外受损肝细胞有保护作用,其机制可能为米诺环素提高骨髓细胞增生率,增加骨髓细胞活性,从而降低肝细胞凋亡和促进肝细胞增殖。
米诺环素 脓毒症 肝细胞 骨髓细胞
脓毒症(sepsis)是由多种原因引起伴随感染的全身炎性反应综合征,常导致脓毒症休克(septic shock)和多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS ),甚至死亡。肝脏在人体代谢和免疫平衡中起着重要的作用。在脓毒症中,肝脏代谢障碍和凝血因子合成障碍等会进一步造成多器官功能障碍从而导致临床死亡[1],改善及维持肝功能能够有效降低器官功能障碍死亡率[2]。骨髓细胞具有多向分化潜能,能够分化为多种组织细胞,例如肝细胞、胆管细胞等,是肝细胞的重要肝外来源[3],骨髓细胞移植治疗肝损伤也备受人们关注,但骨髓细胞移植不是一个单纯的治疗过程,受到诸如时效性、原发病治疗效果欠佳等的限制。如何为移植骨髓细胞提供一个有利的环境,使其达到更佳的治疗效果成为学者们的关注点。本研究的目的是探讨不同浓度米诺环素刺激的骨髓细胞对小鼠肝损伤的保护作用。
1 材料与方法
1.1实验动物和试剂
1.1.1实验动物 健康成年雄性C57BL/6小鼠,清洁级,6~8周龄,体质量(20±1)g,由北京华阜康生物科技股份有限公司提供,动物许可证号:SCXK(京) 2015-0004。食用标准饲料,术前禁食12小时,自由饮水。饲养环境温度保持在22℃左右, 湿度保持在60%~70%。
1.1.2主要药物和试剂 米诺环素(Minocycline Hydrochloride,阿拉丁公司);RPMI-1640培养基、DMEM培养基:美国Gibco 公司;胎牛血清:杭州四季青生物材料有限公司;AnnexinV/7-AAD:美国ebioscience公司;MTT试剂盒:碧云天生物技术研究所;磷酸盐缓冲液(PBS)粉剂:北京索莱宝生物科技有限公司。米诺环素粉剂用生理盐水配制, 37℃水浴使其完全溶解,MTT粉剂用生理盐水配成5mg/mL的无菌储存液,4℃避光保存。
1.2实验方法
1.2.1细胞的制备 ①骨髓细胞:C57BL/6小鼠,颈椎脱臼处死,75%酒精浸泡消毒15分钟。无菌条件下取出双侧股骨干,PBS 10mL冲洗骨髓腔,冲洗干净后弃股骨干,将冲出的骨髓吹打混匀,1500r/min离心5分钟,弃上清,加入无菌PBS 1mL重悬,台盼蓝检测细胞活力,要求在95%以上,计数后调整细胞浓度为1×107cell/mL。②肝脏细胞:获取C57BL/6小鼠,用0.5%戊巴比妥钠15mg/kg麻醉,于75%酒精中浸洗消毒,仰卧位固定,无菌操作下开腹,在远离肝脏处结扎门静脉,导管插入下腔静脉胸段,用丝线固定,近肝脏处剪破门静脉,结扎肝动脉、脾静脉、下腔静脉与肾静脉汇合处,以9mL/min速度灌注PBS 15分钟,以6mL/min速度灌注I 型胶原酶,循环灌注10分钟后取下肝脏放入DMEM中,依次经100、150、180、280、400目不锈钢滤网过滤,以1500r/min离心2分钟,弃上清,反复离心3次,下沉的细胞用含10%胎牛血清的DMEM培养液重悬,调整细胞密度为1×107cell/mL,台盼蓝染色测细胞活力95%以上。
1.2.2实验细胞分组
1.2.2.1骨髓细胞分组 取96孔板,分为6组,每组设3个复空。分别为对照组(b0组,为单纯骨髓细胞组)和不同浓度米诺环素刺激组(b1~5组)。无菌条件下将准备好的荧光骨髓细胞加入孔板内,每孔内5×106个细胞,分别加入终浓度为5μg/mL(b1组)、10μg/mL(b2组)、20μg/mL(b3组)、50μg/mL(b4组)、100μg/mL(b5组)的米诺环素,b0组加入等容积的PBS液,吹打混匀,放于37℃、5%CO2培养箱中,每12小时吹打混匀一次,培养24小时。
1.2.2.2肝细胞分组 取准备好的正常肝细胞,无菌条件下将1×107个正常肝细胞分别加入8个细胞培养瓶中,对照组(a组,为单纯肝细胞组),其余7组(aL、a0-5组)加入终浓度为100μg/mL的脂多糖(LPS)混匀,模拟体外脓毒症肝损伤。取出b0~5组骨髓细胞2×106个,1500r/min离心5分钟,弃上清,加入PBS液重悬,分别相应加入a0~5组肝细胞内混匀,用加胎牛血清的RPMI-1640培养液调整培养瓶内容积到5mL,置于37℃、5% CO2培养箱,1~2天换液。
1.2.3检测指标 ①骨髓细胞增殖情况:取b0-5组骨髓细胞2×106个,去掉各组上层培养液,加入 DMEM培养基100μL,再加入20μL MTT溶液(5mg/mL),放回培养箱继续培养4小时后加入100μL 二甲基亚砜(DMSO)溶液,常温下震荡1分钟,待Formanzan结晶充分溶解后用酶标仪在570nm处测定其OD值。调零孔加入等量的DMEM、MTT和DMSO。②肝细胞生长情况:分别在肝细胞培养的第1、3、5、7天无菌操作取出培养瓶,倒置显微镜下观察肝细胞的生长情况并照相记录。③肝细胞凋亡情况:培养第7天用0.25%胰蛋白酶消化后,用含胎牛血清的DMEM 培养基终止消化,轻轻吹打取出各组细胞,1500r/min离心5分钟,弃上清,加入PBS液重悬,调节细胞浓度为106Cell/mL。取400μL重悬液,分别加入5μLAnnexinV和7-AAD混匀,室温暗处染色15分钟,流式细胞仪检测细胞凋亡率,试验重复5次,结果取平均值。

2 结果
2.1不同浓度米诺环素对骨髓细胞的影响 与b0组相比,b1~4组骨髓细胞增生率增加,差异均有统计学意义(b1~3组P<0.01,b4组P<0.05),其中以b1组增生最为明显;而b5组骨髓细胞增生率降低,差异有统计学意义(P<0.05);b2组与b3组比较,差异无统计学意义(P>0.05),见表1。

表1 骨髓细胞增生率变化
注:与b0组比较,*P<0.05,**P<0.01;与b2组比较,#P>0.05
2.2体外培养肝细胞动态观察 与a组相比,aL组肝细胞严重受损,破裂、悬浮细胞增多;a1~3组肝细胞生长情况较好,其中a1、a2组在培养第5天可见肝细胞聚团,细胞岛形成,a4、a5组界面稍浑浊,见不成形、破裂肝细胞,见图1。
2.3体外培养肝细胞凋亡率 培养7天后,与a组比较,a1~5组肝细胞凋亡率均有不同程度的降低。与a组比较,a5组差异无统计学意义(P>0.05);a1~4差异均有统计学意义(P<0.05)。a0组与a5组比较差异无统计学意义(P>0.05),见表2。
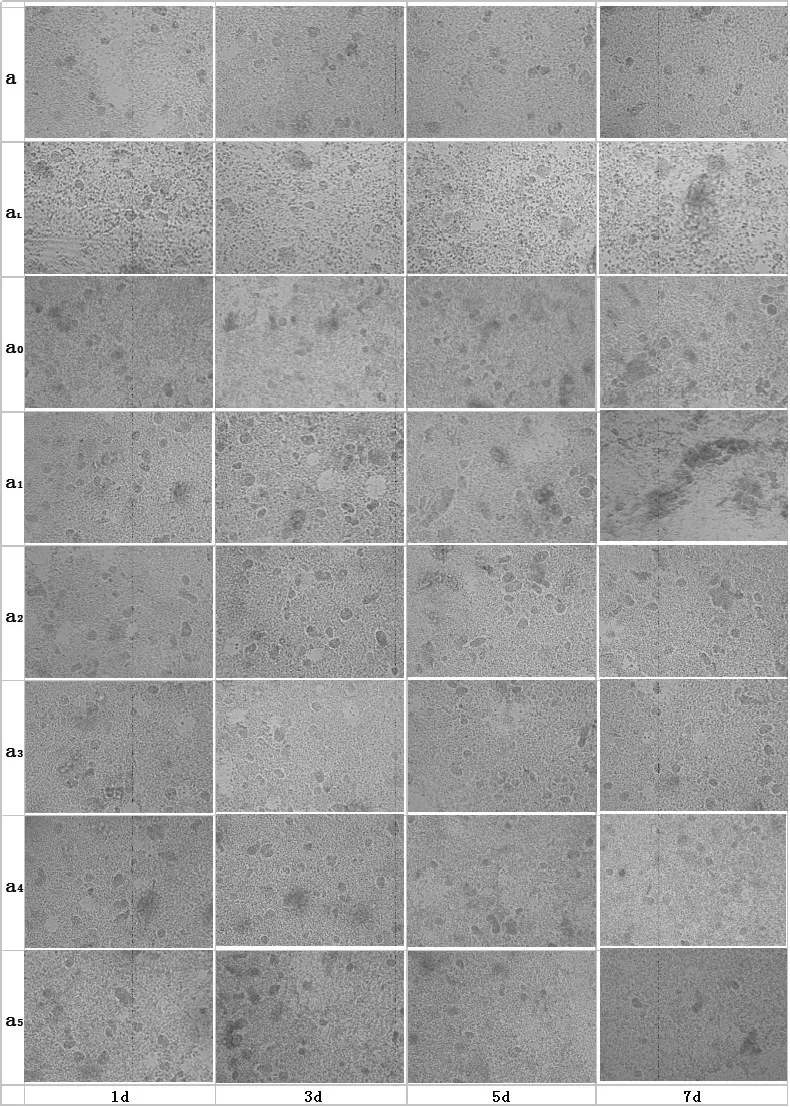
图1 体外培养肝细胞动态观察(×200)

组别n细胞凋亡率(%)a345.23±0.77aL357.23±0.76a0343.52±0.49a1324.35±0.48*a2331.17±0.59*a3339.30±0.59*a4341.94±0.73*a5344.42±0.55#
注:a:单纯肝细胞;aL:肝细胞+LPS;a0:肝细胞+LPS+骨髓细胞;a1~5分别为(肝细胞+LPS)+5、10、20、50、100μg/mL米诺环素刺激24小时后的骨髓细胞。与a组比较,*P<0.05;与a0组比较,#P>0.05。
3 讨论
脓毒症发生率高,病情凶险,医疗资源消耗大,已经严重影响人类的生活质量。临床医师在治疗脓毒症的同时也关注脓毒症时器官保护。肝脏是脓毒症时受损最严重的器官之一,它对脓毒症的发生、发展有着举足轻重的作用,其结构、功能和代谢的变化影响着脓毒症病情的发展。所以,脓毒症时如何减轻肝脏的受损程度对于脓毒症的治疗和预后有着重大意义。
骨髓细胞是骨髓的主要组成单位,包括骨髓基质细胞和造血干细胞。骨髓细胞对肝脏保护作用的研究可以追溯到1999年,Petersen等将骨髓间充质干细胞回输到急性肝损伤大鼠体内,在第9天和第13天后检测出了供体鼠来源的肝卵圆细胞和肝细胞[4]。近年来,有学者研究发现骨髓细胞能够改善肝脏线粒体功能,从而保护梗阻性黄疸时肝脏细胞[5]。骨髓细胞移植技术是再生医学研究领域的前沿技术之一,但是无论在体内或者体外,骨髓细胞的增生能力有限,且其进入增生和衰老凋亡的过程都有严格的调控机制[6]。因此,对于如何为移植骨髓细胞提供一个积极的环境,加强骨髓细胞功能成为亟待解决的问题。本实验通过体外实验来观察米诺环素刺激的骨髓细胞对受损肝脏的影响,以探讨脓毒症急性肝损伤积极的治疗方法,为临床抗生素的应用提出了全新的见解。
米诺环素是第二代半合成的四环素类广谱抗生素,具有良好的抑制炎性反应的作用[7],除此之外,它对神经系统的多种疾病如神经退化性疾病、急性缺血性脑卒中等也具有一定的保护作用[8,9]。已有研究发现米诺环素对肝脏和肾脏都有一定的保护作用[10~12],此外,米诺环素还可以降低Caspase-3的活性从而抑制细胞凋亡[13]。功能良好的骨髓细胞对移植成功与否有重要的意义,因为只有良好功能状态的骨髓细胞才有增殖活性,骨髓细胞增殖活性的高低能反映骨髓细胞的数量和功能状态,陈凌波等研究发现将黄芪和当归 1:1配伍能促进骨髓细胞增殖和分化[14],黄丽萍等[15]发现当归补血汤含药血清能促进骨髓粒系、红系造血祖细胞的增殖,促进骨髓有核细胞DNA的合成。在本实验中,5、10、20、50μg/mL米诺环素刺激骨髓细胞24小时后,骨髓细胞有不同的增生率,其中5μg/mL米诺环素组最高,这与张达等[16]研究结果(6μg/mL)大致一致;100μg/mL组增生率降低,这说明低浓度的米诺环素可以增加体外骨髓细胞增生率,使其发挥更好的细胞功能状态,而高浓度米诺环素反而会抑制骨髓细胞增殖,10、20μg/mL米诺环素组差异无统计学意义,这可能与实验操作或小鼠例数有一定关系,有待进一步探讨。
肝细胞凋亡是脓毒症肝损伤的重要机制之一。脓毒症时激活Fas/Apo-1、TNF-α受体、转化生长因子受体等,启动线粒体凋亡信号,激活具有自我摧毁功能的mtPTP活化,通过凋亡途径使细胞凋亡[17],另外当Bcl-2家族的两个重要蛋白Bcl-2表达量减少,而Bax表达量增加导致两者间的比率失衡时,也可引起细胞凋亡[18]。细胞凋亡严重影响组织器官功能,有报道称骨髓细胞对降低细胞凋亡有一定作用,Cai等[19]研究发现,骨髓细胞可通过抑制肝细胞凋亡,促进其增殖,从而对急性肝损伤起到保护作用。
本实验采用LPS刺激肝脏细胞来模拟脓毒症肝损伤模型,造模后肝脏细胞明显受损,悬浮、破裂细胞增多。通过对肝细胞生长情况的观察,a1 ~3组肝细胞在数目、形态上不同程度优于a0组和aL组,可见肝细胞分裂、聚团和细胞岛的形成,其中a1组效果最好,a2组次之;各组肝细胞凋亡率方面,aL组凋亡率明显高于a组,说明LPS对肝细胞造成了严重损伤,这与肝细胞生长情况相一致。a0 ~4组肝细胞体外培养凋亡不同程度低于a组。a5组肝细胞凋亡率虽低于a组,但差异无统计学意义。表2显示随着米诺环素浓度的增加,肝细胞凋亡率上升,但仍低于对照组,其中a1组米诺环素组最低,与肝细胞培养结果相符。这表明在本实验中低浓度的米诺环素能促进的骨髓增生,进而能降低体外培养肝细胞的凋亡率,促进肝细胞增殖,对保护受损肝脏有积极作用。
综上所述,低浓度(5μg/mL)的米诺环素刺激的骨髓细胞对体外受损肝细胞有一定的保护作用,其可能机制为米诺环素促进骨髓细胞增生,而更好功能状态的骨髓细胞降低肝细胞凋亡和促进肝细胞增殖;在体外实验中,米诺环素能够增加骨髓细胞增生率的最佳浓度为5μg/mL。
[1] Fujihara M, Muroi M, Tanamoto K, et al. Molecular mechanisms of macrophage activation and deactivation by lipopolysaccharide: roles of the receptor complex[J]. Pharmacol Ther, 2003, 100(2): 171-194
[2] Bauer M, Press AT, Trauner M. The liver in sepsis: patterns of response and injury[J]. Curr Opin Crit Care, 2013, 19(2): 123-127
[3] 中华医学会感染病分会肝衰竭与人工肝学组, 中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊断指南[J]. 中华肝脏病杂志, 2006, 14( 9) : 643-646.
[4] Petersen B E, Bowen W C, Patrene K D, et al. Bone marrow as a potential source of hepatic oval cells[J]. Science, 1999, 284(5417): 1168-1170.
[5] De Andrade D C, De Carvalho S N, Pinheiro D, et al. Bone marrow mononuclear cell transplantation improves mitochondrial bioenergetics in the liver of cholestatic rats[J]. Exp Cell Res, 2015, 336: 15-22
[6] 王 芳,王 旸,张 愚,等.Bmi-1基因对于人胚骨髓间充质干细胞增生和衰老的作用[J].首都医科大学学报,2011,32(1):61-65
[7] Kim H S,Suh Y H.Minocycline and neurodegenerative diseases[J].Behav Brain Res,2009,96(2):168-179
[8] Fagan S C,Cronic L E,Hess D C.Minocycline development for acute ischemic stroke[J].Transl Stroke Res,2011,2(2):202-208
[9] Li C,Yuan K,Schluesener H.Impact of minocycline on neurodegenerative diseases in rodents:a meta-analysis[J].Rev Neurosc,2013,24(5):553-562
[10] Li Y,Li T,Qi H,et al.Minocycline protects against hepatic ischemia/reperfusion injury in a rat model[J].Biomed Rep,2015,3(1):19-24
[11] Dhein S,Grassl M,Gerdom M,et al.Organ-protective effects on the liver and kidney by minocycline in small piglets undergoing cardiopulonary bypass[J].Naunyn Schmiedebergs Arch Pharmacol,2015,388(6):663-676
[12] Sutton T A,Kelly K J,Mang H E,et al.Minocycline reduces renal microvascular leakage in a rat model of ischemic renal injury[J].Am J Physiol-Renal,2005,288(1):F91-F97
[13] 熊海波,刘 苏,沈 洁,等.米诺环素对大鼠视网膜缺血再灌注的保护作用探讨[J].眼科研究,2008,26(6):429-432
[14] 陈凌波,张珂胜,黄小平,等.黄芪当归配伍对骨髓造血功能抑制小鼠造血祖细胞增殖的影响[J].中草药,2016,47(24):4395-4400
[15] 黄丽萍,陈耀辉,吴素芬,等.当归补血汤含药血清对血虚小鼠骨髓造血功能的影响[J].中药药理与临床,2014,30(2):18-20
[16] 张 达,屠冠军,韩亚新,等.米诺环素微环境对体内外骨髓间充质干细胞的影响[J].中国医科大学学报,2013,63(1):1-3
[17] Harjai M,Bogra J,Kohli M,et al.Is suppression of apoptosis a new therapeutic target in sepsis?[J].Anaesth Intens Care,2013,41(2):175-183
[18] Ramalingam M,Kim SJ.Insulin involved Akt ERK and Bcl-2 Bax pathways against oxidative damage in C6 glial cells[J].Rec Signal Transduce Res,2016,36(1):14-20
[19] Cai Y,Zou Z,Liu L,et al.Bone marrow-derived mesenchymal stem cells inhibits hepatocyte apoptosis after acute liver injury[J].Int J Clin Exp Patho,2015,8(1):107-116
(2017-02-15 收稿)(张爱国 编辑)
Effectofdifferentconcentrationsminocyclinecombinedwithbonemarrowcellsonlivercellinsepticmice
WEN Cui,XIAO Fang,XU Kaizhi,et al
(North China University of Science and Technology,Affiliated to Tangshan Gongren Hospital,Tangshan 063000,China)
ObjectiveTo explore protective effect of different concentrations minocycline combined with bone marrow cells on liver cell in septic mice.MethodsGFP+bone marrow cells were divided into 6 groups:control group(b0group)、minocycline groups(b1~5groups). b1~5groups which were added at different concentrations(5、10、20、50、100μg/mL) of minocycline respectively,All groups were placed in 37℃ 5% CO2saturated humidity to be cultured for 24h,Then some of the cells were took out for the proliferation rate of bone marrow cells by MTT methods.Hepatocytes were divided into 8 groups:control group (a group)、hepatocytes injury groups(aL、a0~5groups) which were used LPS at the concentration of 100μg/mL to induce injury.GFP+ bone marrow cells from group b0~5were added to group a0~5while a、aLgroups were
equal volume of PBS instead.All groups were placed in 37℃,5% CO2saturated humidity to be cultured for 24h,the growth of hepatocytes was observed and the apoptosis were detected.ResultsCompared with the b0group,different concentrations of minocycline stimulated 24 hours after the proliferation rate of bone marrow was different,The proliferation rate of bone marrow cells was the highest in b1group (5μg/mL),and the proliferation rate of bone marrow cells in b5group (100μg/mL) was the lowest.Compared with the a group,aL hepatocytes were damaged and the apoptosis rate was increased.The hepatocytes of group a0~5had different degrees of proliferation,and the apoptotic rate was decreased with the lowest concentration of 5μg/mL.ConclusionIn this experiment,5μg/mL minocycline combined with bone marrow cells in vitro damage to liver cells have protective effect,the mechanism may be minocycline to improve bone marrow cell proliferation rate,increase bone marrow cell activity,thereby reducing liver cell apoptosis death and promote hepatocyte proliferation.
Minocycline.Sepsis.Liver cell.Marrow cells
R 631
A
2095-2694(2017)05-337-06
国家自然科学基金(编号:81272140,81000847);中国博士后面上项目(201150M1530)。
文 翠(1989-),女,硕士研究生,医师。研究方向:器官保护。
徐凯智 刘庆阳。

