柳生金针菇发酵培养条件优化及菌丝体多糖提取工艺
彭 璐 杨健华 王 巍 王 琦
(吉林农业大学食药用菌教育部工程研究中心,吉林长春130118)
柳生金针菇(Flammulina rossica)隶属担子菌门、伞菌纲、伞菌目、金针菇属,是一种食用菌[1],首次发现在俄罗斯东部[2]。研究组利用形态和分子系统发育方法,对世界上现知的冬菇属种类进行了研究,发现我国有4种,柳生金针菇为我国的新记录种[3]。朱宴妍等研究发现,柳生金针菇胞外粗多糖具有免疫及抗肿瘤活性,其胞外多糖对肝癌小鼠的免疫网络有广泛的影响,但发挥药理作用的机制尚不明确[4]。笔者对柳生金针菇深层发酵培养条件进行优化及对菌丝体多糖提取工艺进行研究,以期筛选出能提高柳生金针菇多糖产量的液体培养条件,为柳生金针菇深层发酵的进一步研究提供实验数据,同时也为后续研究菌丝体多糖结构及其生物活性提供充足的原料基础。
1 材料与方法
1.1 供试菌株柳生金针菇菌株:分离于采自四川省稻城县香格里拉乡亚丁村(地理坐标:100°16′E,28°13′N)的柳生金针菇子实体(编号:T23093)。菌种保藏于食药用菌教育部工程研究中心菌种库。
1.2 培养基(1)平板培养基(PDA综合培养基):马铃薯 200 g,葡萄糖 20 g,KH2PO41.5 g,MgSO40.75 g,VB10.1 g、琼脂 20 g,水 1 L,pH 自然[5]。(2)液体种子培养基:马铃薯200 g,葡萄糖20 g,蛋白胨2 g,酵母浸粉2 g,KH2PO41.5 g,MgSO40.75 g,VB110 mg、水1 L,pH自然[6]。(3)液体培养基:葡萄糖 20 g,蛋白胨 2 g,酵母浸粉 2 g,KH2PO41.5 g,MgSO40.75 g,VB110 mg,水1 L,pH自然[7,8]。
1.3 试验方法
1.3.1 柳生金针菇菌种ITS鉴定 采用CTAB法提取柳生金针菇菌丝rDNA并进行琼脂糖凝胶电泳检测同时对所提取的DNA进行PCR扩增,引物序列为ITS1(5’-TCC GTA GGT GAA CCT GCG G-3’)和ITS4(5’-TCC TCC GCT TAT TGA TAT GC-3’)。PCR采用50 μL扩增体系,反应条件为:94℃预变性10 min;94℃变性 30 s,55℃退火 30 s;72℃延伸2 min,共计30个循环,72℃温浴10 min。
1.3.2 制备母种 将在4℃条件下保存的柳生金针菇菌种取出,放于24℃恒温培养箱中活化一天。然后制备PDA培养基,取一小块活化后的菌种,于无菌条件下接种于该PDA培养基上,后将其放在24℃恒温培养箱中培养5 d,选择菌丝洁白、生长速度快的菌种作为母种。
1.3.3 液体菌种培养 将已活化好的柳生金针菇菌种(0.5 cm大小2块)在无菌条件下接入100 mL液体种子培养基中(250 mL三角瓶),23℃、150 r/min摇床培养5~7 d,制得一级种子液。
1.3.4 液体发酵条件筛选
1.3.4.1 装液量筛选 配置液体发酵培养基,装入250 mL三角瓶,装液量分别为60 mL、90 mL、120 mL、150 mL、180 mL,121℃高压灭菌25 min,灭菌后于无菌室无菌操作台接种10%液体柳生金针菇菌种,23℃、150 r/min恒温摇床震荡培养,设三次重复。一周后测定菌丝体干重,发酵液多糖含量,筛选最适装液量。
1.3.4.2 接种量筛选 接种量分别为5%、10%、15%、20%和25%。培养方法等同1.3.4.1,筛选最适接种量。
1.3.4.3 最适温度筛选 培养温度分别设置为17℃、20℃、23℃、26℃和29℃。培养方法等同1.3.4.1,筛选最适温度。
1.3.4.4 摇床转速筛选 摇床转速分别设置为100 r/min、120 r/min、140 r/min、160 r/min和180 r/min,培养方法等同1.3.4.1,筛选最适转速。
1.3.5 发酵培养条件优化 选择装液量、接种量、最适温度、摇床转速4个因素,进行正交试验,每个因素三个水平,测定菌丝体干重及发酵液多糖产量,优化发酵培养条件。正交试验设计L9(34)见表1。
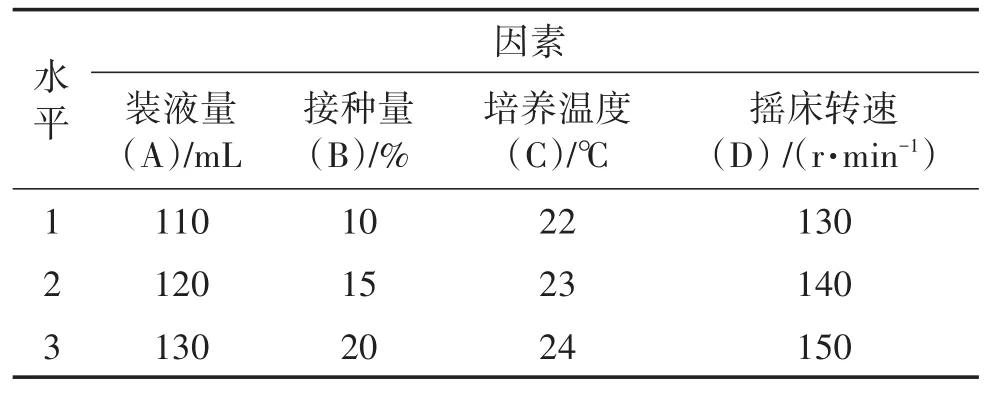
表1 正交试验因素及水平
1.3.6 热水浸提法提取多糖工艺 选取对菌丝体多糖提取有较大影响的3个因素,即浸提时间、液料比和浸提温度,每个因素各取3个水平,设计正交试验[8],以菌丝体多糖提取率为指标,确定菌丝体多糖提取的最佳工艺,试验设计L9(33)见表2。提取工艺:将抽滤得到的菌丝体用蒸馏水洗涤至洗涤液无色,放置45℃烘箱中恒温干燥,准确称取1.0000 g烘干菌丝体,研磨成粉末,按照表1试验设计,提取菌丝体多糖。每组提取3次,合并提取液,旋转蒸发仪浓缩,用4倍体积无水乙醇4℃冰箱沉淀过夜,3500 r/min离心,分离收集沉淀,乙醇液回收再利用,沉淀于-80℃冷冻过夜,真空冷冻干燥机干燥,称重,溶解粗多糖,弃沉淀,再次醇沉过夜,收集沉淀,-80℃预冷过夜,真空冷冻干燥,称重并计算提取率。

表2 热水浸提法L9(33)正交试验因素及水平
提取率(%)=(菌丝体粗多糖总量/菌丝体干重)×100
2 结果与分析
2.1 柳生金针菇序列分析试验以ITS1和ITS4为引物,对柳生金针菇rDNA进行PCR扩增,将测定结果应用BLAST程序与GenBank数据库中的已有序列进行同源相似性比较,结果表明:与KF179735.1的同源相似性达到98%,表明试验所用的柳生金针菇与GenBank数据库中的柳生金针菇为同种。
2.2 液体发酵条件筛选
2.2.1 装液量对柳生金针菇菌丝体干重及发酵液多糖的影响 食用菌在液体发酵过程中需要一定的氧气供应,装液量的多少直接影响培养瓶内氧气含量,其他培养条件一致的情况下,装液量越多,瓶内氧气越少,溶氧量大小直接影响菌丝体生物量及多糖产量。由图1看出在装液量为120 mL/250 mL时柳生金针菇菌丝体干重,多糖含量均达到最大值。因此,确定柳生金针菇液体发酵摇瓶实验装液量为120 mL/250 mL。
2.2.2 不同接种量对柳生金针菇菌丝体干重及发酵液多糖的影响 液体培养过程中,接种量的多少对菌种培养周期的长短、生物量的多少直接影响,接种量过多,发酵液营养不够用,菌丝体有效多糖积累量少;接种量过少,菌丝体生物量少,培养周期长。由图2看出接种量为10%~15%时,柳生金针菇菌丝体干重及发酵液多糖均达到最大值。接种量超过15%,菌丝体生长受到抑制,多糖产量不会增加,污染几率大。
2.2.3 不同培养温度对柳生金针菇菌丝体干重及发酵液多糖的影响 培养温度过高或过低都会导致菌丝体生长缓慢,甚至停止生长,而且温度高易染细菌。由图3看出,柳生金针菇菌丝最适生长温度为23℃。此温度下,菌丝体干重及发酵液多糖含量均达到最大值,分别为0.39 g/100 mL和0.55 g/100 mL。温度为26℃,柳生金针菇菌丝体在培养液中的呼吸作用加快,分解速率大于合成速率,菌丝体处于过度消耗状态。温度达到29℃时,菌丝体生长缓慢,菌丝球表面发黄,色泽暗淡,活力衰退,各种代谢活动不能正常进行。
2.2.4 摇床转速对柳生金针菇菌丝体干重及发酵液多糖的影响 摇床转速影响培养瓶与外界通气量的大小,进而影响发酵液溶氧量的多少;摇床转速不同,菌丝球的大小也不同,进而菌丝体生物量也不同。由图4得出,菌丝体及发酵液多糖都呈现先增加后减少的趋势,当摇床转速为140 r/min时,发酵液多糖及菌丝体生物量达到0.59 g/100 mL和0.37 g/100 mL,为最大值。转速过低,菌丝球相对较大,但生长速度出现先快后慢的趋势;转速过高,菌丝球相对较小,生长速度慢,摇瓶内出现气泡,影响菌丝体换气。
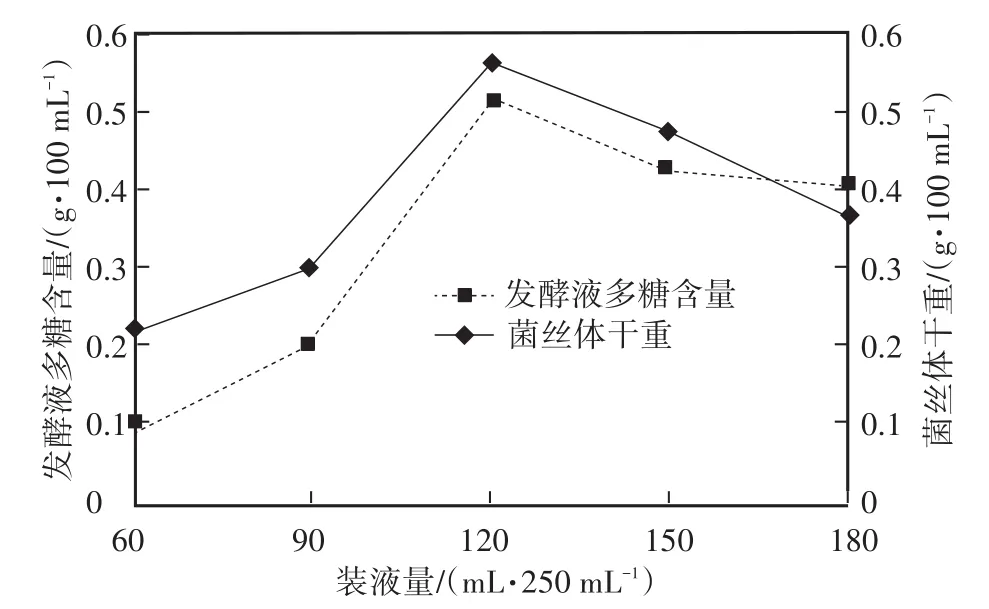
图1 装液量对柳生金针菇菌丝体干重及发酵液多糖的影响
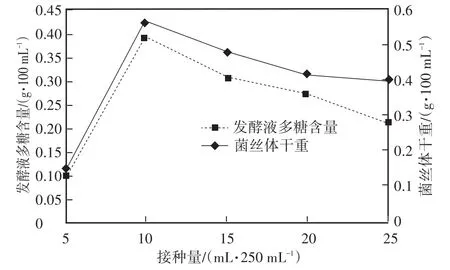
图2 接种量对柳生金针菇菌丝体干重及发酵液多糖的影响

图3 培养温度对柳生金针菇菌丝体干重及发酵液多糖的影响

图4 摇床转速对菌丝体干重及发酵液多糖的影响
2.2.5 正交试验优化发酵培养条件 根据单因素试验结果,选取影响因子合适区间值进行正交试验,正交试验结果分析见表3。由表3可以分析出4个因素对柳生金针菇菌丝体干重的影响程度由大到小为:A(装液量)>B(接种量)>D(摇床转速)>C(培养温度),对柳生金针菇发酵液多糖产量的影响程度由大到小为:B(接种量)>D(摇床转速)>C(培养温度)>A(装液量);由表3可以看出积累菌丝体生物量最多的最优组合为A2B1C2D3,即装液量120 mL,接种量10%,培养温度23℃,150 r/min;获得发酵液多糖产量最多的最优组合为A2B1C2D3,综合菌丝生物量及多糖产量两个指标,最终确定柳生金针菇发酵培养的最佳组合为:A2B1C2D3,此条件下菌丝体干重及发酵液多糖产量均能得最大值。
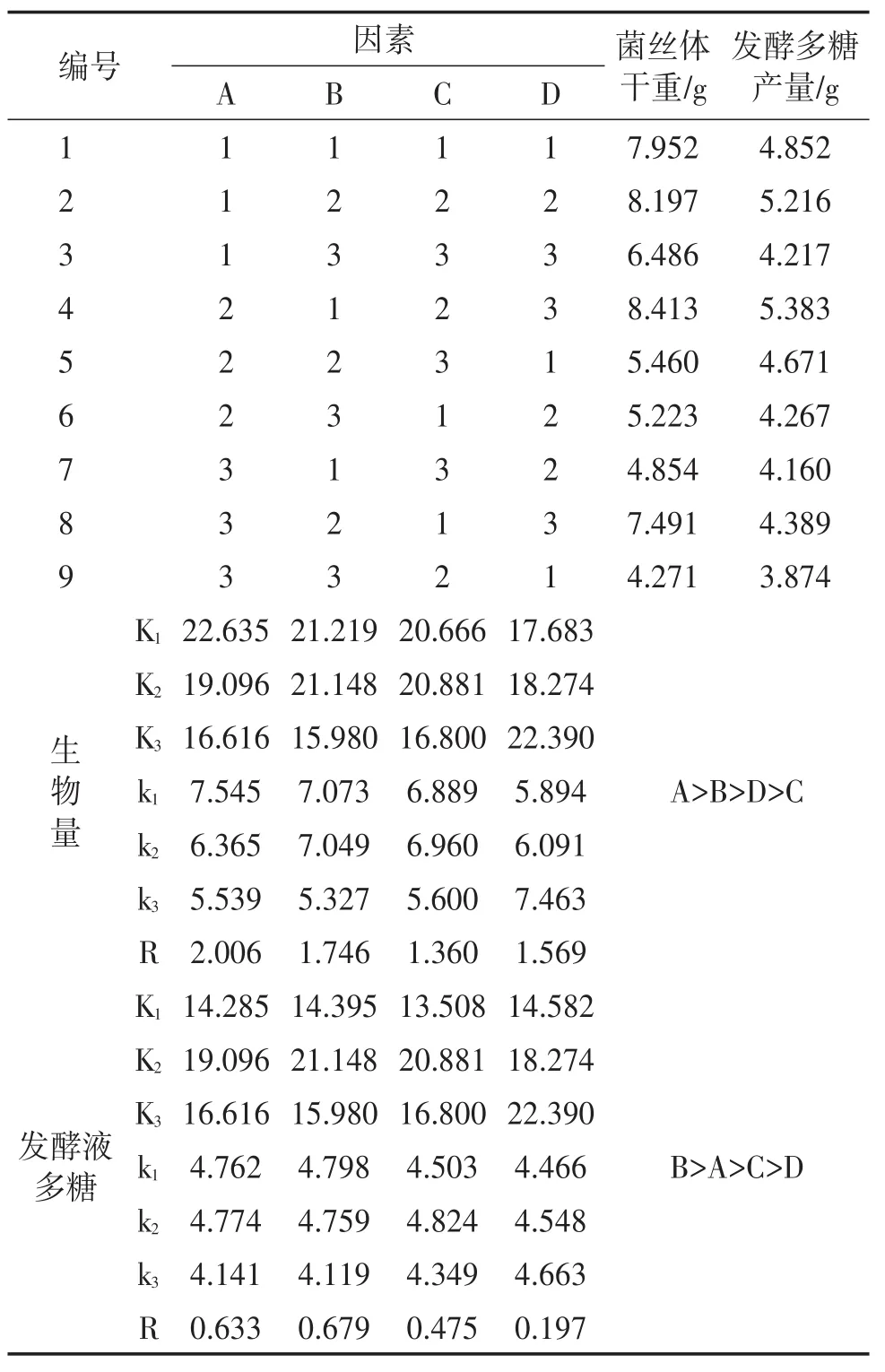
表3 正交试验L9(34)结果极差分析
2.3 热水浸提法最佳工艺确定由表4看出,B(液料比)是影响柳生金针菇菌丝体多糖提取率3个因素中最主要的因素,其他依次为浸提温度(C)和浸提时间(A)。热水浸提的最佳提取工艺为A1B2C2,即浸提时间2 h,液料比50∶1,浸提温度90℃,此条件下多糖的提取率为74.39%。
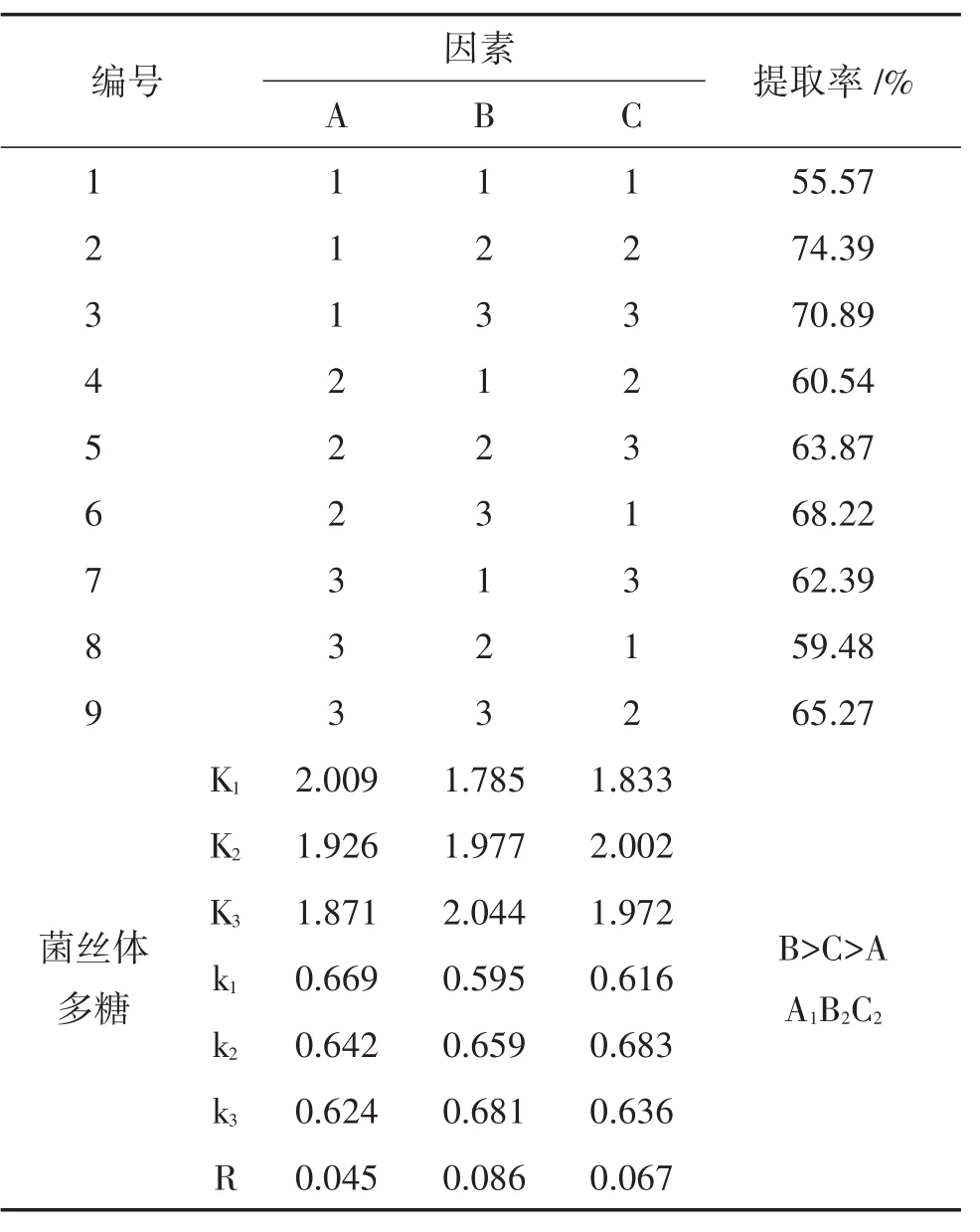
表4 正交试验L9(33)结果极差分析
3 小结与讨论
食用真菌多糖是国际公认的天然免疫增强剂,它可参与细胞识别、抗原呈递、调节机体免疫应答及新陈代谢等,真菌多糖通常与TLRs协同激活机体细胞,经过多条通路启动机体细胞的吞噬活性、ROS的产生及细胞因子的合成释放[10-13]。其中金针菇多糖主要作用于腹腔渗出细胞膜上的TLR4,从而激活P38MAPK信号通路,活化转录因子NF-κβ,后者启动TNF-α基因转录,最终导致TNF-α的合成与分泌增加。金针菇具有增智菇的说法,邹宇晓等得出金针菇多糖可有效改善氢溴酸东莨菪碱诱导的记忆障碍模型小鼠、大鼠的学习记忆能力,并且治疗效果优于脑复兴[14]。金针菇发酵液还具有抗衰老的作用,研究发现金针菇发酵液能够极显著降低脑中MAO-B的活性,对肝MAO-B活性无显著影响,能使肝中LPO含量降低,血中SOD活性增加,皮肤中Hyp(Hydroxyproline)含量上升,表明其具有提高机体内胶原蛋白的作用[15,16]。作为新纪录菌种,朱宴妍等研究发现,柳生金针菇多糖对肝癌H-22细胞有针对性抑制的同时,对机体也具有调高免疫和调解平衡的作用[4]。因此,为进一步探讨柳生金针菇发挥生物活性的作用机制,开发以柳生金针菇多糖为原料的医药产品及功能食品,大量培育柳生金针菇成为了重中之重。
为适应市场发展,获得高产菌株及代谢产物,发酵工程技术应运而生,其培育时间短,产量高,受外界影响少,故能大批量生产其活性成分,有利于菌物医药行业的发展。根据不同菌种适应生长条件不同,应进行培养条件筛选优化,选取最佳提取工艺路线。
试验对柳生金针菇进行液体发酵培养,优化发酵培养条件,筛选最佳多糖提取工艺,为高效、快速开发柳生金针菇相关产品提供理论依据及技术支持。试验筛选出柳生金针菇液体发酵最适培养条件为:装液量120 mL/250 mL,接种量10%,培养温度23℃,摇床转速150 r/min。多糖产量往往受到提取方法及条件不同的影响,目前多糖的提取方法包括热水提法、稀酸稀碱提取法以及微波、酶、膜处理、超声波等辅助提取法。试验采用传统的热水浸提法优化多糖提取工艺,避免了稀碱或稀酸浸提法等对多糖糖苷键的破坏,从而造成多糖的损失,另外,由于柳生金针菇菌丝体及发酵液中均含有较多不溶性多糖,故采取多糖复溶措施,两次醇沉干燥,提高可溶性多糖提取率,为后续药理实验的准确性奠定基础。试验得到的柳生金针菇菌丝体多糖最佳提取工艺为:浸提时间2 h,液料比50∶1,浸提温度90℃,两次醇沉,此条件下多糖提取率为74.39%。

