蒙古沙冬青根系DSE定殖与土壤因子典范对应分析
王少杰,侯力峰,解琳琳,胡从从,贺学礼
(河北大学 生命科学学院,河北 保定 071002)
蒙古沙冬青根系DSE定殖与土壤因子典范对应分析
王少杰,侯力峰,解琳琳,胡从从,贺学礼
(河北大学 生命科学学院,河北 保定 071002)
为进一步明确不同荒漠地区蒙古沙冬青(Ammopiptanthusmongolicus)根系深色有隔内生真菌(DSE)生态分布与土壤环境之间的关系,分别于2015年7月从乌海、磴口、阿拉善左旗、民勤和沙坡头5个样地采集蒙古沙冬青根围0~10、10~20、20~30、30~40和40~50 cm共5个土层土壤样品,运用典范对应分析(CCA)方法系统研究了DSE生态分布及其与土壤因子的相关性.结果表明,蒙古沙冬青根系DSE分布与环境密切相关,其分布在不同样地间差异显著,定殖率表现为阿拉善左旗>乌海>沙坡头>民勤>磴口.5个样地DSE平均定殖率为52.02%,说明蒙古沙冬青与DSE能形成良好根-菌共生关系.不同样地土壤性质差异显著,对DSE分布具有重要影响.主要表现为同一样地不同土层,DSE分布与土壤理化指标均表现出浅土层大于深土层的趋势.CCA结果表明,DSE菌丝、微菌核、定殖率和定殖强度在CCA排序轴上得到较好分化.CCA二维排序图表明,乌海样地影响DSE菌丝定殖的主要土壤因子为酸性磷酸酶(ACP)、碱性磷酸酶(ALP)和速效P;磴口样地主要为碱解N和有机C;阿拉善左旗样地主要为ALP和pH;民勤样地主要为pH、ALP和土壤脲酶(Urease);沙坡头样地主要为ACP、Urease和碱解N.研究表明,不同地区DSE分布受不同土壤因子影响,这可为荒漠地区土壤状况评估以及改善提供依据.
深色有隔内生真菌(DSE);定殖率;土壤因子;典范对应分析
蒙古沙冬青(Ammopiptanthusmongolicus)属第三纪孑遗物种,是国家保护渐危种,主要分布在干旱地区,是西北荒漠独有的旱生常绿豆科阔叶灌木[1].沙冬青的抗逆能力极强,在高盐度、强紫外辐射和极端温度等环境条件下具有较强的适应性[2].马彦军等[3]通过对沙冬青种子萌发期抗逆性研究,证明沙冬青种子在萌发期及幼苗期具有较强的耐旱、耐盐性.Wu等[4]利用Illumina技术和DEGs分析比较了蒙古沙冬青种子在干旱和低温环境下的基因图谱,得到完整的沙冬青耐旱耐寒基因转录图谱,进一步表明沙冬青的耐旱、耐寒性.
深色有隔内生真菌(dark septate endophytes,DSE)泛指一类定居在植物根表皮、皮层和维管组织细胞内或细胞间隙的内生真菌,具有深色有隔菌丝和微菌核等结构[5-6].DSE广泛分布在沿海滩涂、内陆高原山地和热带、温带、冻原及南北极地区[7].据调查,DSE宿主涵盖114科320属600余种植物[5],除菌根植物外,在莎草科、十字花科、藜科等传统非菌根植物根系中也有定殖[7].DSE细胞壁中产生的黑色素能够增强宿主植物在重金属污染区[8]、干旱地区[9]以及低pH土壤[10]等胁迫环境中的抗逆性;分泌的多种胞外水解酶,能够保证其对各种形态营养元素的利用[11].研究发现,蒙古沙冬青根部皮层组织有DSE定殖,并形成菌丝网络、胞间菌丝和微菌核等结构,其定殖率与土壤理化性质具有显著相关性[12].目前,关于蒙古沙冬青DSE空间分布与土壤因子的相关性时有报道[13-14],但尚未对不同地区影响蒙古沙冬青DSE分布的主要土壤因子进行系统研究.
本实验通过对西北不同荒漠样带蒙古沙冬青根围土壤样品采集和分析,基于典范对应分析(CCA)来探讨不同样地蒙古沙冬青DSE定殖规律与土壤因子的交互关联,旨在阐明不同荒漠环境影响DSE定殖和生态分布的主要土壤因子,为充分利用微生物资源和荒漠生态改良提供依据.
1 材料和方法
1.1 样品采集
实验样地为内蒙古乌海、磴口、阿拉善左旗,甘肃民勤和宁夏沙坡头(表1).2015年7月在各样地随机选取4株长势良好的蒙古沙冬青植株,在距植株主干0~30 cm范围内挖土壤剖面,分别在0~10、10~20、20~30、30~40和40~50 cm 5个土层采集土样和根样,编号装入自封袋中,记录采样时间、地点、土壤类型等,带回实验室.自然风干后,过2 mm筛分离根样和土样.土样用于土壤理化性质测定,将根样剪成1 cm长根段,用于DSE形态结构和定殖率观测.

表1 样地概况Tab.1 Sampling sites and overview
1.2 研究方法
根据Phillips和Hayman方法[15]对DSE进行染色,然后按Biermann和Linderman的方法[16]测定DSE定殖率.随机选取30条1 cm长根段用100 g/L KOH处理,酸性品红染色后,脱色液脱色,在光学显微镜下观察DSE定殖结构,并统计DSE定殖率和定殖强度.


根据Li等[12]研究,本实验选取pH、速效P、有机C、碱解N、酸性磷酸酶(ACP)、碱性磷酸酶(ALP)、土壤脲酶(Urease)等土壤因子作为测量指标.其中土壤pH值用电位法测定,用碳酸氢钠-钼锑抗比色法测定,碱解N用碱解扩散法测定,用灼烧质量法测定土壤有机C.ACP和ALP用改进的Tabatabai和Brimner方法[17]测定,活性分别以每g土样培养1 h ACP和ALP转化对硝基苯磷酸二钠(pNPP)的量(μg·g-1)表示; Urease用改进的Hoffmann和Tabatabai 比色法[18]测定,活性以每g土样培养1 h催化尿素分解产生NH3-N的μg表示.
1.3 数据处理
数据经 Excel 整理后,采用 SPSS20 统计软件进行单因子方差( One-Way ANOVA)分析和Pearson 法两两相关分析,用Canoco 4.5软件进行典范性分析(canonical correspondence analysis,CCA)[19].
2 结果与分析
2.1 DSE定殖结构
观察结果表明,DSE能够侵入到蒙古沙冬青根组织,形成菌丝和微菌核结构.菌丝多为深色,具横隔,能侵入到宿主根系表皮和维管组织(图1a-e).菌丝可在皮层细胞间隙延伸并形成菌丝网(图1c),有时可延伸到皮层细胞内形成胞内菌丝(图1d),偶见横隔距离缩短的特化菌丝(图1e).微菌核是由皮层细胞或维管组织(图1f-l)内膨大、加厚、变圆的菌丝堆积而成,根据其形态可分为聚合型和离散型,其中聚合型多为脑状(图1g-h)、哑铃状(图1i);离散型多为带状(图1j)和链状(图1k),有时呈星点状(图1l).
2.2 DSE空间分布
由表2可知,沙冬青根围DSE分布与生态环境密切相关.同一样地,DSE各项指标在不同土层间无显著差异,除乌海外,其他样地菌丝定殖率和微菌核定殖率最大值均在0~20 cm土层.不同样地,乌海和阿拉善左旗菌丝定殖率显著大于其他样地,民勤最低;微菌核定殖率在不同样地差异显著,表现为沙坡头>民勤>乌海>阿拉善左旗>磴口;总定殖率表现为阿拉善左旗>乌海>沙坡头>民勤>磴口;阿拉善左旗、民勤和沙坡头定殖强度显著大于乌海和磴口.
同列数据后不同小写字母表示同一样地不同土层间在P<0.05 水平差异显著,不同大写字母表示不同样地同一土层在P<0.05水平差异显著;同列均值后不同大写字母表示不同样地在P<0.05水平上差异显著.
2.3 土壤因子空间分布
由表3知,土壤pH在不同样地差异显著,沙坡头显著大于其他样地,但同一样地,不同土层间无显著差异.不同样地,民勤ACP和ALP活性最大,磴口最小;各样地0~10 cm土层ACP活性最大;乌海和阿拉善左旗样地0~10 cm土层ALP活性最大,并随土层加深而降低,磴口和民勤样地0~20 cm土层ALP活性显著大于20~50 cm土层,沙坡头样地ALP活性最大值在30~40 cm土层.乌海、磴口和阿拉善左旗样地Urease活性显著大于民勤和沙坡头;乌海和民勤样地Urease活性最大值在0~10 cm土层,并随土层加深而降低;磴口和阿拉善左旗样地Urease活性最大值在30~40 cm土层,沙坡头样地在10~20 cm土层,3样地最小值均在40~50 cm土层.
速效P、有机C和碱解N含量变化与样地和土层深度有密切关系.速效P、有机C和碱解N最大值均在民勤样地.乌海不同土层间速效P无显著差异,其他样地最大值均在0~10 cm土层.乌海、民勤、阿拉善左旗和沙坡头样地有机C最大值均在0~10 cm土层,磴口最大值在20~30 cm土层.乌海、阿拉善左旗和民勤样地0~10 cm土层碱解N显著大于其他土层,并随土层加深而降低,沙坡头最大值在10~20 cm土层,磴口样地土层间碱解N无显著差异.
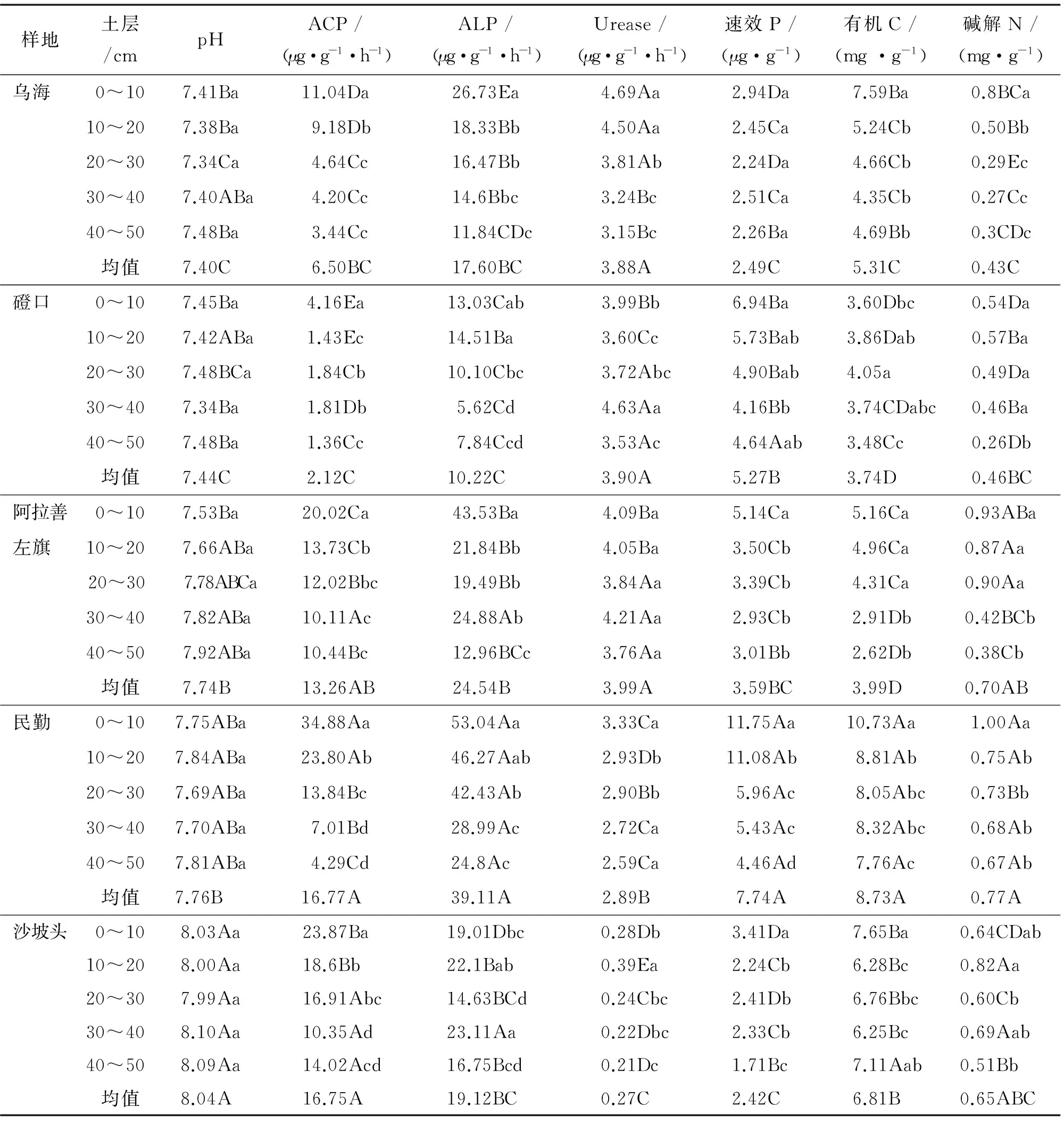
表3 蒙古沙冬青根围土壤因子空间分布Tab.3 Spatial distribution of soil factors in the rhizosphere of Ammopiptanthus mongolicus
同列数据后不同小写字母表示同一样地不同土层间在P<0.05 水平差异显著,不同大写字母表示不同样地同一土层在P<0.05水平差异显著;同列均值后不同大写字母表示不同样地在P<0.05水平上差异显著.
2.4 DSE不同定殖指标的相关性
由表4可知,DSE菌丝定殖率与微菌核定殖率呈负相关,与总定殖率呈极显著正相关;DSE微菌核定殖率与定殖强度呈极显著正相关;总定殖率与定殖强度显著正相关.
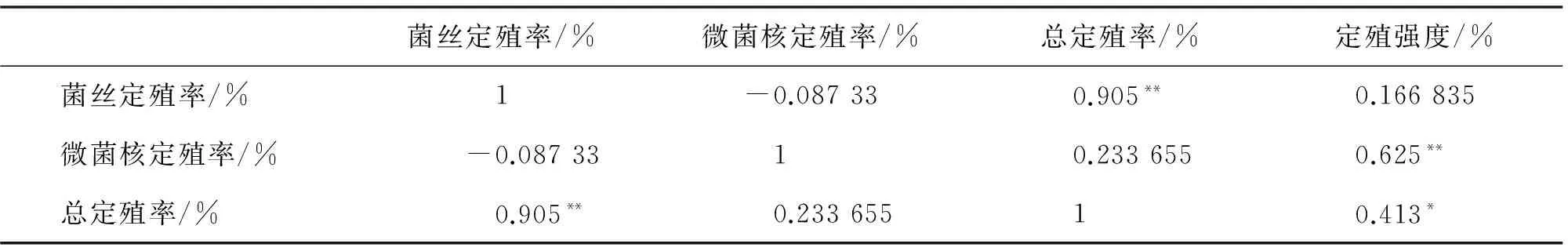
表4 DSE不同定殖指标的相关性分析Tab.4 Correlation analysis of different colonization indexes of DSE
* 表示两者之间在P<0.05 水平(双侧)上显著相关;**表示两者之间在P<0.01水平上极显著相关.
2.5 DSE分布与土壤因子的CCA
由表5可知,CCA 排序中前2个轴累积解释了物种-环境关系的90%以上,说明CCA前两轴已能较好地反映DSE分布与土壤因子的关系.图2为各样地DSE分布与土壤因子的CCA排序图,通过排序图可直观看出不同土壤因子(箭头表示)之间以及DSE分布(三角符号表示)与土壤因子之间的关系[20].
由表5可知,乌海样地土壤因子与第1排序轴相关性最高的是pH,其次是ACP、ALP和有机C;磴口样地最高为速效P,其次为有机C、ACP和ALP;阿拉善左旗样地最高为pH,其次为Urease和ALP;民勤样地最高为pH,其次是碱解N、ALP和Urease;沙坡头样地最高为速效P,其次是ACP、Urease和碱解N.乌海样地土壤因子与第2排序轴相关性最高的土壤因子为ACP,其次是速效P、ACP、Urease和碱解N;磴口样地最高为pH,其次为Urease和碱解N;阿拉善左旗样地最高为ACP,其次为pH;民勤样地最高为碱解N,其次是ALP、Urease和有机C;沙坡头样地最高为pH,其次是Urease、碱解N和速效P.

表5 土壤因子与CCA排序轴的相关关系及排序概要Tab.5 Correlation coefficients between soil factors and CCA ordination axes and and summary
AX1为第1排序轴,AX2为第2排序轴.
CCA排序图中,研究对象(三角符号)与箭头越接近,表明受到土壤因子的影响越大,两者的相关性越高[20].由图2可知,乌海DSE菌丝定殖率与总定殖率与ACP、ALP和速效P呈正相关,微菌核定殖率主要受pH的影响.磴口DSE菌丝定殖率与碱解N和有机C具有正相关,微菌核受ACP、ALP和速效P影响.阿拉善左旗DSE菌丝定殖率与ALP和pH的相关性较大,微菌核主要受Urease和有机C影响.民勤菌丝主要受pH、ALP和Urease的影响,微菌核与碱解N具有相关性.沙坡头菌丝定殖率主要受Urease、碱解N和ACP影响,微菌核主要受速效P、ALP和有机C影响.
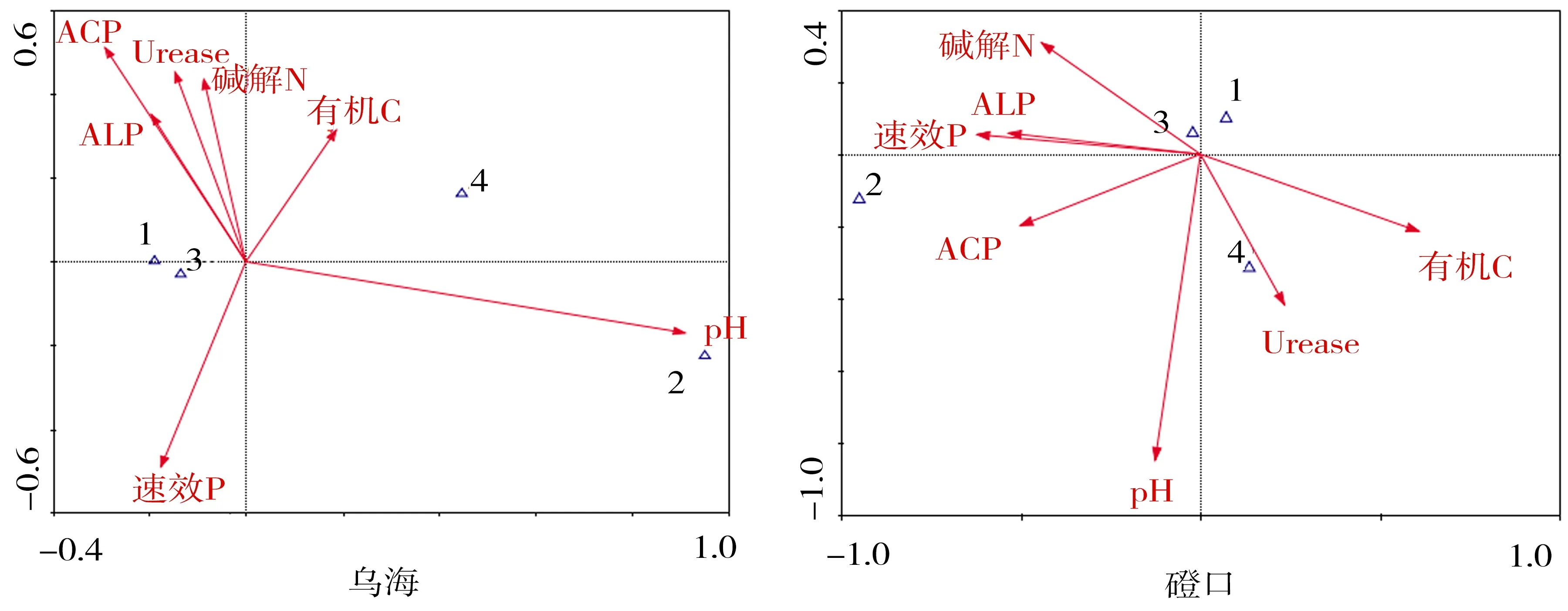

1.菌丝定殖率;2.微菌核定殖率;3.总定殖率;4.定殖强度.图2 各样地DSE定殖与土壤因子的CCA排序Fig.2 CCA ordination biplot between DSE and soil factors in all samples
3 讨论
实验结果表明,5个样地总定殖率为43.33%~58.22%,平均总定殖率为52.02%,这与前人研究结果一致[21].说明DSE是蒙古沙冬青根部重要组成.从实验结果来看,荒漠区植物根系DSE定殖强度(31.29%)和重金属矿区植物根系(32.8%)基本一致,但荒漠区植物根系DSE微菌核具有多种形态,且定殖率(10.62%)明显高于重金属矿区(2.4%)[22].说明DSE在不同生态系统均有广泛分布,相对于重金属矿区,荒漠环境更利于微菌核分布.
本研究中,DSE菌丝定殖率与微菌核定殖率表现出明显的空间异质性,且菌丝定殖率与微菌核定殖率呈负相关关系.菌丝是DSE与植物进行营养物质交换的通道[23], DSE黏质菌丝可帮助宿主植物在干旱环境中维持水分和营养的运输[24].微菌核是DSE菌丝膨大加厚堆积而成,有时与菌丝相连[8],可作为DSE的繁殖结构[14],因此菌丝和微菌核可能存在一种相互转化关系.当宿主植物与DSE互动联系降低时,为应对不利环境,菌丝转变成微菌核,此外微菌核内还含有多种酶,能够帮助荒漠植物分解土壤中的营养物质[21];反之微菌核则重新萌发出菌丝.
研究表明,土壤理化性质对植被分布、微生物群落的组成和功能具有重要影响[25-26],其中土壤有机C是土壤碳库的重要组成,对土壤特性、根系深度和有效水分保持能力等土壤学特性具有重要影响,其含量的高低可直接影响土壤肥力[27].贺学礼等[28]研究表明,土壤有机C、碱解N和ALP对土壤细菌、真菌和放线菌数量具有显著影响.实验结果表明磴口有机C含量显著低于其他样地,土壤肥力相应偏低,植物不能为DSE生长提供足够的养分,直接影响DSE菌丝和微菌核分布.沙坡头和民勤样地微菌核定殖率和磷酸酶活性均显著大于其他样地,土壤磷酸酶主要来自土壤微生物和植物根系分泌,能够分解土壤有机磷[29],增加土壤P含量.DSE微菌核与其他土壤微生物能够协同作用,可通过分泌多种酶来改善植物根部微环境,增加土壤养分,促进植物营养吸收.此外,沙坡头和民勤样地有机C和碱解N含量也很丰富,植物可直接从土壤中吸收养分,DSE菌丝对宿主植物的促生作用降低,DSE菌丝分布减少.阿拉善左旗样地菌丝定殖率高,可增加根系营养和水分吸收面积,促进植物生长,反过来植物又为DSE生长提供养分,因此,DSE菌-根共生结构可能是旱生植物应对干旱环境的有效对策之一.
本实验中,除了乌海样地,其他样地DSE菌丝定殖率和微菌核定殖率最大值都出现在0~20 cm土层,并随土层加深而有减少趋势.土壤酶活性和有机C、速效P和碱解N等土壤因子也表现出浅土层大于深土层的趋势.这可能因为土壤表层落叶和腐殖质积累较多,土壤通气状况好,微生物种类丰富,有利于DSE生长.Stone等[30]研究表明随着土壤深度增加,土壤理化性质和土壤酶活性也随之发生变化.Eilers等[31]指出随着土壤深度增加,碳氮含量以及土壤微生物量和相对丰度也随之降低.CCA结果表明,DSE定殖率与土壤因子呈正相关,这一对应关系也说明DSE的生长与土壤养分密切相关.在一定养分范围内,随着土壤养分的增加,可供蒙古沙冬青吸收的养分也随之增加,为DSE菌丝萌发和生长提供养料,从而提高蒙古沙东青DSE定殖率.
CCA能够直接反映环境因子对排序结果的影响[32],相对于常规统计学方法而言,其所包含的信息量更大,结果更加直观[20].近年来,CCA排序法已广泛应用于物种分布与环境因子关系的研究[33],在土壤-环境领域和土壤性质与环境因子间定量关系方面也取得了重要进展[34].本实验CCA排序图结果表明,5个样地影响DSE分布的主要土壤因子各不相同.研究表明,土壤生物碳储量[35]和侵蚀程度[36]对土壤理化性质和微生物分布具有重要影响.本实验5个样地位于西北不同荒漠地带,其气候特征、地质状况以及土壤侵蚀情况(表1)、主要植物种群分布均具有较大差异[13,37],使得不同样地影响DSE分布的主要土壤因子存在差异.Li[12]、孙茜[13]和张淑容[14]等人通过主成分分析法已经证实西北荒漠区蒙古沙冬青DSE生态分布与碱解N、土壤酶和球囊霉素等土壤因子具有显著相关性,与本实验结果相比具有一定差异.这可能因为前者是对西北整个荒漠地区DSE生态分布与土壤因子的相关性进行分析,而忽略了不同样地之间的差异.因此,本实验在前人研究的基础上,利用典范对应分析法对每个地区DSE分布与土壤因子的相关性进行分析,并筛选出每个样地影响DSE分布的主要土壤因子,用于评估5个样地土壤营养状况,并为土壤肥力改善提供支持.
综上,植物共生真菌、宿主植物和环境因子是一个相互联系、相互制约的动态平衡体系.通过检测荒漠地区植被DSE定殖情况及其与土壤因子之间的关系,可评估荒漠土壤环境状况,进一步认识荒漠地区DSE 的生态作用和意义,为荒漠土壤环境改善和充分利用土壤真菌资源,促进荒漠环境植被恢复提供理论基础.
[1] 尹林克,潘伯荣,赵振东,等.沙冬青属植物引种试验研究[J].干旱区研究,1988(4): 36-43.DOI:10.13866/j.azr.1988.04.007.
[2] 王烨,尹林克.两种沙冬青耐盐性测定[J].干旱区研究,1991,8(2): 20-22.DOI:10.13866/j.azr.1991.02.005.
[3] 马彦军,段慧荣,曹致中,等.沙冬青种子萌发期抗逆性研究[J].中国沙漠,2011,31(4): 963-967.
MA Y J,DUAN H R,CAO Z Z,et al.Stress resistance ofAmmopiptanthusmongolicusseeds during germination period[J].Journal of Desert Research,2011,31(4): 963-967.
[4] WU Y,WEI W,PANG X,et al.Comparative transcriptome profiling of a desert evergreen shrub,Ammopiptanthusmongolicus,in response to drought and cold stresses[J].BMC Genomics,2014,15(1): 671.DOI:10.1186/1471-2164-15-671.
[5] JUMPPONEN A,TRAPPE J M.Dark septate endophytes: a review of facultative biotrophic root-colonizing fungi[J].New Phytologist,1998,140(2): 295-310.DOI:10.1046/j.1469-8137.1998.00265.x.
[6] BARROW J,AALTONEN R.Evaluation of the internal colonization ofAtriplexcanescens(Pursh)Nutt.roots by dark septate fungi and the influence of host physiological activity[J].Mycorrhiza,2001,11(4):199-205.DOI 10.1007/s005720100111
[7] 刘茂军,张兴涛,赵之伟.深色有隔内生真菌(DSE)研究进展[J].菌物学报,2009,28(6): 888-894.DOI:10.13346/j.mycosystema.2009.06.009.
LIU M J,ZHANG X T,ZHAO Z W.Advances in the research of dark septate endophytes[J].Mycosystema,2009,28(6): 888-894.DOI:10.13346/j.mycosystema.2009.06.009.
[8] ZHAO D,LI T,SHEN M,et al.Diverse strategies conferring extreme cadmium (Cd)tolerance in the dark septate endophyte (DSE),Exophialapisciphila: evidence from RNA-seq data[J].Microbiol Res,2015,170: 27-35.DOI:10.1016/j.micres.2014.09.005.
[9] KNAPP D G,PINTYE A,KOVáCS G M.The dark side is not fastidious-dark septate endophytic fungi of native and invasive plants of semiarid sandy areas[J].PLoS ONE,2012,7(2): e32570.DOI:10.1371/journal.pone.0032570.
[10] POSTMA J W M,OLSSON P A,FALKENGREN-GRERUP U.Root colonisation by arbuscular mycorrhizal,fine endophytic and dark septate fungi across a pH gradient in acid beech forests[J].Soil Biology and Biochemistry,2007,39(2): 400-408.DOI:10.1016/j.soilbio.2006.08.007.
[11] MANDYAM K,JUMPPONEN A.Seeking the elusive function of the root-colonising dark septate endophytic fungi[J].Studies in Mycology,2005,53: 173-189.DOI:10.3114/sim.53.1.173.
[12] LI B,HE X,HE C,et al.Spatial dynamics of dark septate endophytes and soil factors in the rhizosphere ofAmmopiptanthusmongolicusin Inner Mongolia,China[J].Symbiosis,2015,65(2): 75-84.DOI:10.1007/s13199-015-0322-6.
[13] 张淑容,贺学礼,徐浩博,等.蒙古沙冬青根围 AM 和 DSE 真菌与土壤因子的相关性研究[J].西北植物学报,2013,33(9): 1891-1897.
ZHANG S R,HE X L,XU H B,et al.Correlation study of AM and DSE fungi and soil factors in the rhizosphere ofAmmopiptanthusmongolicus[J].Acta Botanica Boreali-Occidentalia Sinica,2013,33(9): 1891-1897.
[14] 孙茜,贺超,贺学礼,等.沙冬青与伴生植物深色有隔内生真菌定殖规律及其与土壤因子的相关性[J].植物生态学报,2015,39(9): 878-889.DOI:10.17521/cjpe.2015.0084.
SUN Q,HE C,HE X L,et al.Colonization of dark septate endophytes in roots ofAmmopiptanthusmongolicusand its associated plants as influenced by soil properties[J].Chinese Journal of Plant Ecology,2015,39(9): 878-889.DOI:10.17521/cjpe.2015.0084.
[15] PHILLIPS J M,HAYMAN D S.Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J].Transactions of the British Mycological Society,1970,55(1): 158-118.DOI:10.1016/s0007-1536(70)80110-3.
[16] BIERMANN B,LINDERMAN R G.Quantifying vesicular-arbuscular mycorrhizae: a proposed method towards standardization[J].New Phytologist,1981,87(1): 63-67.DOI:10.1111/j.1469-8137.1981.tb0190.x.
[17] 宋勇春,李晓林,冯固.菌根真菌磷酸酶活性对红三叶草生境中土壤有机磷亏缺的影响[J].生态学报,2001,21(7): 1130-1135.DOI:10.3321/j.issn:1000-0933.2001.07.014.
SONG Y C,LI X L,FENG G.Effect of phosphatase activity on soil organic phosphorus loss in the environment of clover growth[J].Acta Ecologica Sinica,2001,21(7):1130-1135.DOI:10.332/j.issn:1000-0933.2001.07.014.
[18] 周礼恺.土壤酶学[M].北京:科学出版社,1987.
[19] 魏玉莲,姬兰柱,王淼,等.长白山北坡静水水体中水甲虫分布与环境关系的典范对应分析[J].应用生态学报,2002,13(1): 91-94.DOI :10.13287/j .1001 -9332.2002.0020.
WEI Y L,JI L Z,WANG M,et al.CCA of water beetles' distribution and environmental factors in lentic samples of North Changbai Mountain.[J].Chinese Journal of Applied Ecology,2002,13(1): 91-94.DOI :10.13287/j .1001 -9332.2002.0020.
[20] 杨思存,逄焕成,王成宝,等.基于典范对应分析的甘肃引黄灌区土壤盐渍化特征研究[J].中国农业科学,2014,47(1): 100-110.DOI:10.3864/j.issn.0578-1752.2014.01.011.
YANG S C,PANG H C,WANG C B,et al.Characterization of soil salinization based on canonical correspondence analysis method in Gansu Yellow River Irrigation District of Northwest China[J].Scientia Agricultura Sinica,2014,47(1): 100-110.DOI:10.3864/j.issn.0578-1752.2014.01.011.
[21] 姜桥,贺学礼,陈伟燕,等.新疆沙冬青 AM 和 DSE 真菌的空间分布[J].生态学报,2014,34(11): 2929-2937.DOI: 10.5846 / stxb201305121025.
JIANG Q,HE X L,CHEN W Y,et al.Spatial distribution of AM and DSE fungi in the rhizosphere ofAmmopiptanthusnanus[J].Acta Ecologica Sinica,2014,34(11): 2929-2937.DOI: 10.5846 / stxb201305121025.
[22] XU R,LI T,CUI H,et al.Diversity and characterization of Cd-tolerant dark septate endophytes (DSEs)associated with the roots of Nepal alder (Alnusnepalensis)in a metal mine tailing of southwest China[J].Applied Soil Ecology,2015,93: 11-18.DOI:10.1016/j.apsoil.2015.03.013.
[23] PETERSON R L,WAGG C,PAUTLER M.Associations between microfungal endophytes and roots: do structural features indicate function[J].Botany,2008,86(5): 445-456.DOI:10.1139/b08-016.
[24] BARROW J R.Atypical morphology of dark septate fungal root endophytes ofBoutelouain arid southwestern USA rangelands[J].Mycorrhiza,2003,13(5): 239-247.DOI:10.1007/s00572-003-0222-0.
[25] 陈少锋,韩新辉,冯永忠,等.陕北黄土丘陵区土壤碳氮库对人工植被恢复的响应[J].河北大学学报(自然科学版),2014,34(05):508-515.DOI:10.3969/j.issn.1000-1565.2014.05.012.
CHEN S F,HAN X H,FENG Y Z,et al.Response of soil organic carbon and total nitrogen pool to different types of artificial vegetations in the gully region of Loess Plateau[J].Journal of Hebei University(Natural Science Edition),2014,34(05):508-515.DOI:10.3969/j.issn.1000-1565.2014.05.012.
[26] 尚占环,丁玲玲,龙瑞军,等.江河源区退化高寒草地土壤微生物与地上植被及土壤环境的关系[J].草业学报,2007,16(1): 34-40.DOI:10.3321/j.issn:1004-5759.2007.01.006.
SHANG Z H,DING L L,LONG R J,et al.Relationship between soil microorganisms,above-ground vegetation,and soil environment of degraded alpine meadows in the headwater areas of the yangtze and yellow rivers,qinghai-tibetan plateau[J].Acta Prataculturae Sinica,2007,16(1): 34-40.DOI:10.3321/j.issn:1004-5759.2007.01.006.
[27] 徐薇薇,乔木.干旱区土壤有机碳含量与土壤理化性质相关分析[J].中国沙漠,2014,34(6): 1558-1561.DOI:10.7522/j.issn.1000-694X.2013.00311.
XU W W,QIAO M.Soil carbon contents in relation to soil physicochemical properties in arid regions of china[J].Journal of Desert Research,2014,34(6): 1558-1561.DOI:10.7522/j.issn.1000-694X.2013.00311.
[28] 贺学礼,李宝库,陈严严,等.蒙古沙冬青根围土壤微生物分布及与土壤因子相关性研究[J].干旱区资源与环境,2016,30(4): 51-55.DOI:10.13448/j.cnki.jalre.2016.112.
HE X L,LI B K,CHEN Y Y,et al.Correlations between soil microbial distribution and soil factors in the rhizosphere ofAmmopiptanthusmongolicus[J].Journal of Arid Land Resources and Environment,2016,30(4): 51-55.DOI:10.13448/j.cnki.jalre.2016.112.
[29] 张爱民,李乃康,赵钢勇,等.土壤中解磷、解钾微生物研究进展[J].河北大学学报(自然科学版),2015,35(4):442-448.DOI:10.3969/j.issn.1000-1565.2015.04.019.
ZHANG A M,LI N K,ZHAO G Y,et al.Research progress on the phosphate-solubilizing and potassium-solubilizing microorganisms[J].Journal of Hebei University(Natural Science Edition),2015,35(4):442-448.DOI:10.3969/j.issn.1000-1565.2015.04.019.
[30] STONE M M,DEFOREST J L,PLANTE A F.Changes in extracellular enzyme activity and microbial community structure with soil depth at the Luquillo Critical Zone Observatory[J].Soil Biology and Biochemistry,2014,75: 237-247.DOI:10.1016/j.soilbio.2014.04.017.
[31] EILERS K G,DEBENPORT S,ANDERSON S,et al.Digging deeper to find unique microbial communities: The strong effect of depth on the structure of bacterial and archaeal communities in soil[J].Soil Biology and Biochemistry,2012,50: 58-65.DOI:10.1016/j.soilbio.2012.03.011.
[32] LEP J,MILAUER P.Multivariate analysis of ecological data using CANOCO[M].Cambridge: Cambridge University Press,2003.
[33] BROWN N D,CURTIS T,ADAMS E C.Effects of clear-felling versus gradual removal of conifer trees on the survival of understorey plants during the restoration of ancient woodlands[J].Forest Ecology and Management,2015,348: 15-22.DOI:10.1016/j.foreco.2015.03.030.
[34] JIN Z,LI Z,LI Q,et al.Canonical correspondence analysis of soil heavy metal pollution,microflora and enzyme activities in the Pb-Zn mine tailing dam collapse area of Sidi village,SW China[J].Environmental Earth Sciences,2014,73(1): 267-274.DOI:10.1007/s12665-014-3421-4.
[35] HERATH H M S K,CAMPS-ARBESTAIN M,HEDLEY M.Effect of biochar on soil physical properties in two contrasting soils: an alfisol and an andisol[J].Geoderma,2013,209: 188-197.DOI:10.1016/j.geoderma.2013.06.016.
[36] 胡婵娟,刘国华,郭雷,等.土壤侵蚀对土壤理化性质及土壤微生物的影响[J].干旱区研究,2014,31(4): 702-708.DOI:10.13866/j.azr.2014.04.17.
HU C J,LIU G H,GUO L,et al.Effects of soil erosion on soil physicochemical properties and soil microorganisms[J].Arid Zone Research,2014,31(4): 702-708.DOI:10.13866/j.azr.2014.04.17.
[37] 郭清华,胡从从,贺学礼,等.蒙古沙冬青伴生植物AM真菌的空间分布[J].生态学报,2016,36(18):5809-5819.DOI: 10.5846 /stxb201503300609.
GUO Q H,HU C C,HE X L,et al.Exploration of the spatial distribution of AM fungi in the rhizospheres ofAmmopiptanthusmongolicus-associated plants[J].Acta Ecologica Sinica,2016,36(18): 5809-5819.DOI: 10.5846 /stxb201503300609.
(责任编辑:赵藏赏)
CCAanalysisofcolonizationofDSEintherhizosphereofAmmopiptanthusmongolicusinrelationtosoilfactors
WANGShaojie,HOULifeng,XIELinlin,HUCongcong,HEXueli
(College of Life Sciences,Hebei University,Baoding 071002,China)
Ammopiptanthusmongolicusis the only evergreen broadleaf shrub grown in the northwest China that has the characteristics of cold and drought resistance,salt resistance and wind resistance.It plays an important role in windbreak and soil and water conservation.To elucidate the spatial distribution of dark septate endophytes (DSE)and the relationship of DSE with soil factors associated with the desert plantA.mongolicusbased on canonical correspondence analysis (CCA),the author sampled from five different sites in northwest China in July 2015,which are Wuhai,Dengkou,Alxa,Minqin and Shapotou,respectively.Root samples were collected from four robustA.mongolicus,and soil samples were taken from the rhizosphere ofA.mongolicusin five sites and divided into five depth intervals,0-10 cm,10-20 cm,20-30 cm,30-40 cm and 40-50 cm,respectively.The results showed that the roots ofA.mongolicuscould be infected highly by DSE and formed a typical type of septate hyphae and microsclerotia.The distribution of DSE was significantly affected by ecological conditions.There were significant differences in distribution of DSE among the five sites.The colonization rates of DSE among the five sites exhibited a pattern as Alxa>Wuhai>Shapotou>Minqin>Dengkou.The average colonization rate of five sites was 52.02%,which showed thatA.mongolicusand DSE could form a symbiotic relationship.There were also significant differences in soil factors among different sites.In the same site,DSE distribution and soil indicators had the maximum values in the profile of a surface layer and showed the trend of decreasing with the depth of the profile.The results of CCA showed that DSE hyphae,microsclerotia,colonization rate and colonization intensity in the axis of CCA got better differentiation.The species-environment biplots were drawn based on the result of CCA.The relationships between the colonization of DSE and the seven soil factors were clearly revealed on these biplots.Accoding to the biplots,the main soil factors of five sites were different.The acid phosphatase (ACP),alkaline phosphatase (ALP)and available phosphate were found to be main soil factors affecting the hypha colonization of DSE in Wuhai.The main soil factors of Dengkou were available nitrogen and organic carbon.The hypha colonization of DSE in Alxa were mainly affected by ALP and pH.The main soil factors affecting the hypha colonization of DSE were pH,ALP and Urease,in Minqin.And the main soil factors affecting the hypha colonization of DSE in Shapotou were ACP,Urease and available nitrogen.The research results showed that the distribution of DSE in different regions was affected by different soil factors,which could provide the basis for the evaluation and improvement of soil conditions in the desert area.
dark septate endophytes (DSE);colonization rate;soil factors;canonical correspondence analysis
Q939.96
A
1000-1565(2017)05-0497-11
10.3969/j.issn.1000-1565.2017.05.009
2016-11-20
国家自然科学基金资助项目(31170488)
王少杰(1988—),男,河南漯河人,河北大学硕士研究生,主要从事菌根生物学研究.E-mail: wsj663@163.com
贺学礼(1963—),男,陕西蒲城人,河北大学教授,博士生导师,主要从事菌根生物学与生态学研究.E-mail: xuelh1256@aliyun.com
——致坚守奋斗的你

