新生儿色素失禁症的脑部MRI表现
马秋红 MA Qiuhong
何四平 HE Siping
金 科 JIN Ke
向永华 XIANG Yonghua
李晓明 LI Xiaoming
新生儿色素失禁症的脑部MRI表现
马秋红 MA Qiuhong
何四平 HE Siping
金 科 JIN Ke
向永华 XIANG Yonghua
李晓明 LI Xiaoming
作者单位
湖南省儿童医院放射科 湖南长沙410007
目的 探讨新生儿色素失禁症的脑部MRI表现,提高对本病的认识和诊断水平。资料与方法 回顾性分析2009年1月-2016年12月湖南省儿童医院收治,并经临床、病理及基因证实的13例新生儿色素失禁症的MRI特征,包括T1WI、T2WI常规序列及扩散加权成像(DWI)、磁敏感加权成像序列。结果 13例患儿中,5例脑部MRI表现异常。常规序列中,双侧额叶、右侧顶枕叶皮层少许短T1信号3例,右侧基底节出血1例,双侧基底节少许稍短T1长T2信号1例,蛛网膜下腔出血、双侧脑室扩张各1例。DWI出现高信号病灶4例,其中3例异常信号呈广泛性分布,受累部位主要包括双侧大脑半球各叶深部及皮层下白质、双侧基底节、丘脑、内囊、胼胝体、脑干、小脑。DWI较常规序列可更早、更敏感地显示病变范围。结论 新生儿色素失禁症脑部病变发病率高,当出现神经系统症状时应尽早行MRI检查。本病DWI具有一定的特征性,有助于病变的早期发现及临床预后评估。
色素沉着异常;中枢神经系统;磁共振成像;婴儿,新生
新生儿色素失禁症(incontinentia pigmenti,IP)又称Bloch-Sulzberger综合征,是一种累及多系统,以皮肤损害为主,同时可伴中枢神经系统、眼、骨骼、牙齿等外胚层组织异常的较罕见的X染色体连锁显性遗传疾病。因男性患儿常死于宫内,故IP发病集中为女性患儿[1-2]。皮肤病变常作为IP的首发症状;神经系统病变是IP患者最严重的病变,其发病率为10%~30%[3-4]。本病临床症状缺乏特异性,故早期难以被发现。目前有关IP脑部病变的MRI表现报道极少[5]。本研究以13例新生儿IP为研究对象,探讨新生儿IP的脑部MRI表现,为早期诊断及临床预后评估提供依据。
1 资料与方法
1.1 研究对象 回顾性分析2009年1月-2016年12月湖南省儿童医院诊治的13例具有临床皮损特征,并经皮肤组织病理活检证实的新生儿IP,年龄1~28 d,平均(8.92±6.21)d;男1例,女12例;足月12例,早产1例;均为顺产。1例母亲患鱼鳞病,1例外婆患癫痫和IP,1例孕32周时双侧脑室扩张,其余无家族遗传病史。9例于出生1周内出现典型的皮损,4例皮肤病变不典型。9例神经系统最初主要表现为惊厥、拒奶。临床表现有惊厥、肌张力异常、癫痫发作、拒奶、嗜睡及呼吸暂停等症状;同时除外出生有宫内窘迫、窒息缺氧及产伤史;排除电解质紊乱、脑脊液生化异常、低血糖、宫内感染、败血症等其他疾病所致脑损伤。
1.2 仪器与方法 患儿入院后3 d内或病情稳定后行MRI检查。检查前鼻饲5%水合氯醛0.3 ml/kg镇静。采用Siemens Skyra 3.0T MR仪,使用20通道头颈部联合线圈。扫描参数:T1WI:TR 800 ms,TE 15 ms;T2WI:TR 2200 ms,TE 108 ms;扩散加权成像(DWI):TR 5000 ms,TE 60 ms,b值分别为 0和 800 s/mm2,扫描矩阵256×256,视野218 mm×218 mm,层厚4 mm,间距0.8 mm;磁敏感加权成像(SWI):TR 27 ms,TE 20 ms,视野180 mm×180 mm,层厚1.5 mm。13例行T1WI、T2WI常规序列,8例行DWI序列,2例行SWI序列,1例行增强扫描,4例复查。
1.3 图像分析 由2名放射科主任医师采用双盲法观察、分析和记录各种MRI征象,结果不一致时协商并达成一致意见。
2 结果
13例IP患儿中,5例脑部MRI表现异常。常规序列中,双侧额叶、右侧顶枕叶皮层少许短T1 信号3 例,右侧基底节出血1 例,双侧基底节少许稍短T1 长T2信号1 例,蛛网膜下腔出血、双侧脑室扩张各1 例。DWI 出现高信号病灶4 例,其中3 例异常信号呈广泛性分布,受累部位主要包括双侧大脑半球各叶深部及皮层下白质、双侧基底节、丘脑、内囊、胼胝体、脑干、小脑。见图1~5。
3 讨论

图1 女,28 d,IP。常规序列T1WI显示双侧额叶、右侧顶枕叶白质及皮层下稍短T1信号(A);DWI显示双侧大脑半球各叶深部及皮层下白质、双侧基底节、丘脑、内囊、胼胝体广泛性高信号影,部分高信号呈对称性分布,DWI显示病变范围较常规序列更敏感、更广泛(B、C);SWI显示双侧额顶叶深部及皮层下白质点条状低信号影,提示微出血灶或扩张血管(D)
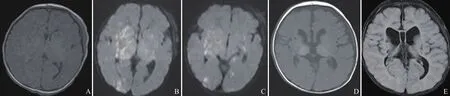
图2 女,4 d,IP。常规序列T1WI显示双侧额叶、右侧顶枕叶及双侧基底节区少许稍短T1信号,边界欠清(A);DWI显示双侧大脑半球各叶深部及皮层下白质、双侧基底节、丘脑、内囊及脑干广泛性、对称性点状、斑片状高信号影,异常信号影范围较前显示更广泛(B、C);4个月后复查示双侧基底节、丘脑病灶软化,双侧侧脑室扩张、变形,T1WI上双侧内囊肢高信号不明显,提示髓鞘化延迟(D、E)
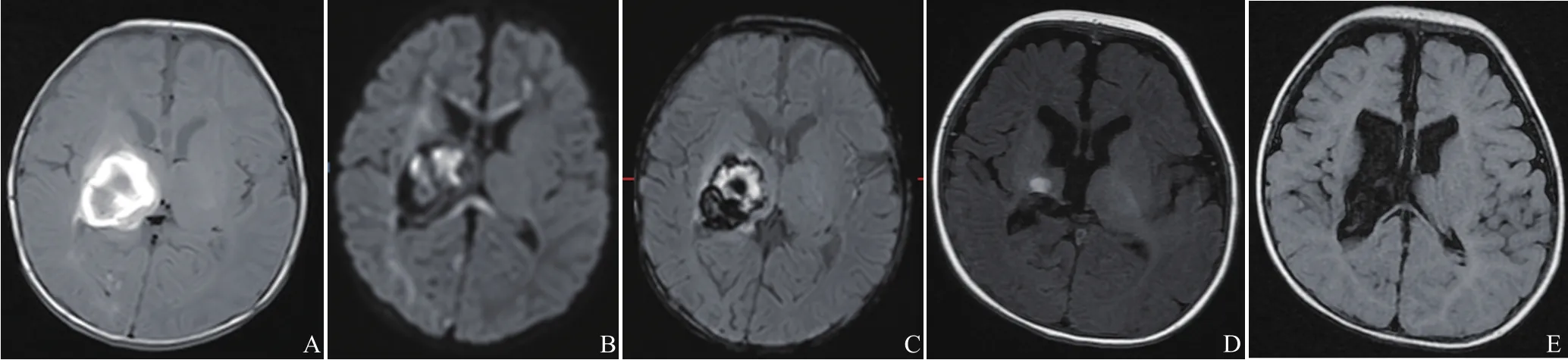
图3 男,16 d,IP。常规序列T1WI示右侧基底节、丘脑区团片状混杂信号,周边见环状短T1信号,提示出血灶,双侧额叶及右侧顶枕叶可见少许条片状稍短T1信号,边缘稍模糊(A);DWI显示右侧基底节、丘脑区混杂信号,双侧额顶枕叶深部及皮层下白质、胼胝体广泛性高信号,病变范围较常规序列显示更广泛(B);SWI示右侧基底节、丘脑区混杂信号,周边见环状低信号影,提示出血灶(C);3个月后复查示右侧基底节、丘脑区团片状异常信号范围较前减小,部分病灶软化,双侧侧脑室扩张、变形,T1WI上双侧内囊肢高信号不明显,提示髓鞘化延迟(D、E)
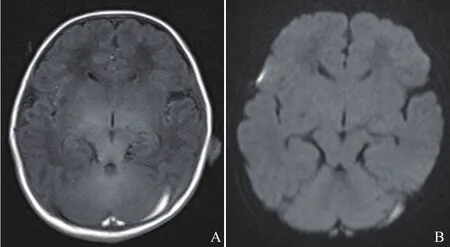
图4 女,5 d,IP。常规序列T1WI示颅后窝及左侧小脑半球表面可见条片状短T1信号(A);DWI显示部分病灶呈稍高信号影,提示蛛网膜下腔出血(B)
3.1 病因与临床特点 新生儿IP是由位于染色体Xq28上的IKBKG基因突变所致。IKBKG基因4~10外显子缺失是最常见的突变,其控制IP的发生[6-7]。IKBKG基因产物激活核转录因子NF-κB,调节大多数细胞基因的表达;在脑部表达最高,主要存在于神经元、星形胶质细胞、神经胶质细胞和少突胶质细胞中。但新生儿IP脑部病变机制不清,推测可能与皮肤病变机制相同,与发育、炎症、血管有关[7-9]。当血管壁细胞IKBKG突变诱导细胞凋亡导致血管受损,包括中、小血管病变引起缺血、出血,从而导致缺血性和出血性脑梗死[10]。本研究患儿脑部受累38.5%(5/13),略高于Minić等[3]的报道。新生儿IP皮肤病变具有特征性,即不同时期沿Blaschko线出现红斑水疱、疣状增生、色素沉着,症状此起彼伏[11]。因此,对有神经系统症状的新生儿IP,应尽早行MRI检查以确诊并干预。
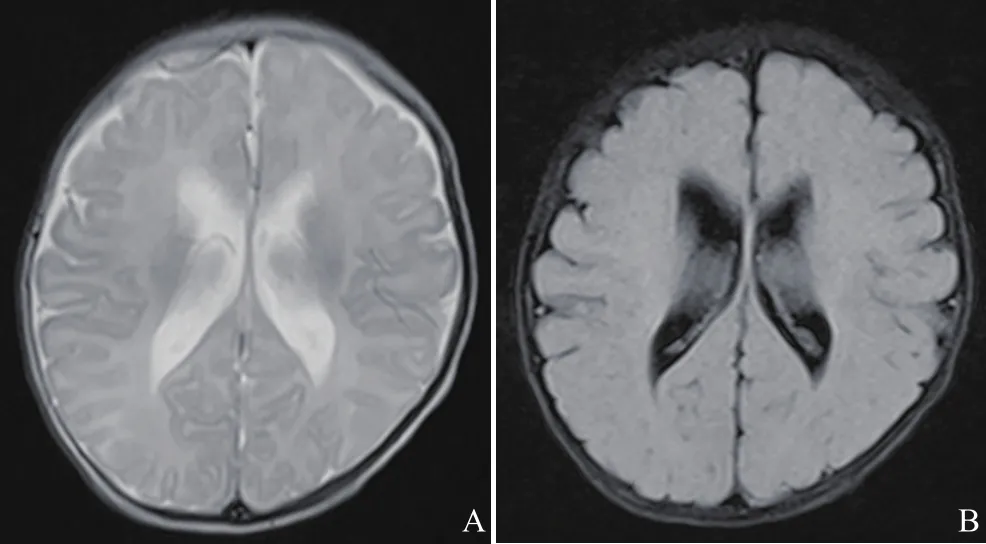
图5 女,17 d,IP。常规序列T2WI(A)及FLAIR(B)示双侧侧脑室扩张,脑内未见明显异常信号影
3.2 新生儿IP脑部的相对早期MRI表现 本研究显示,新生儿IP脑部以双侧大脑半球各叶深部及皮层下白质受累最常见,5例异常患儿中3例深部及皮层下白质受累;此外,胼胝体、基底节、丘脑、内囊、脑干、小脑亦可受累,与国外有关新生儿IP脑部MRI表现的报道[5]一致。有研究认为脑部病变的主要原因在于IKBKG突变基因表达在脑病血管壁上,可诱导细胞凋亡、血管壁损伤,导致局部脑血管闭锁、缺血、出血改变;其次是炎症反应,脑部血管充血继发于出血性炎症反应、出血性坏死继发于缺血性改变[9-10]。本研究中4例DWI信号异常,较常规序列可更早及更准确地显示脑损伤的类型及部位。DWI上信号具有一定特征性,呈弥漫性、广泛分布的点状、斑片状高信号,提示不同部位血管病变导致缺血性改变,从而引起细胞毒性水肿。本研究2例SWI显示脑部多发的低信号,提示出血灶,且低信号范围位于DWI高信号内,即急性缺血的病变内存在出血灶,说明出血病变可能继发于炎症和缺血性改变,故DWI联合SWI序列更有利于发现病变[12];这与Maingay-De Groof等[10]研究相符。有研究报道缺血性脑损伤后,激活NF-κB促进胶质细胞中缺血性神经元变性,对神经元具有保护作用,使神经元的存活增加[13]。此外,Tak等[14]研究发现IP患者可能由于胎儿时期脑发育过程中大脑的异常灌注或氧化、血管损伤或闭塞导致缺血和广泛性萎缩,脑结构发育异常,从而出现一系列脑部病变,MRI表现为脑白质病变、脑萎缩、脑穿通畸形、缺血性病变、出血性坏死、脑积水、基底节及脑干损伤,胼胝体发育不良或多小脑回畸形。本研究中1例胎儿时期发现双侧脑室扩张,3个月时复查双侧侧脑室仍扩张,与文献报道[2]一致。本研究中1例增强扫描示双侧顶叶侧支小血管形成,反映小血管病变,与文献报道的磁共振血管造影异常[15]基本相符。
3.3 短期随访MRI表现 本研究中4例患儿在3~4个月随访时发现有不同程度的后遗改变,3例首次MRI异常者表现双侧基底节、丘脑软化各2例,双侧脑室扩张2例,髓鞘化延迟2例。Hennel等[9]认为IP脑部病变不随时间改变而出现新发病灶[9]。然而,本研究1例患儿首次MRI正常,因发育迟缓3个月时复查MRI,表现为双侧脑室扩张,髓鞘化延迟,提示首次MRI正常的IP患儿后期也可能受累。IP患儿后期出现任何神经系统症状应及时复查MRI并早期干预,该结论与Pizzamiglio等[16]的结论一致。
3.4 鉴别诊断 影像学表现方面,新生儿IP易与新生儿缺氧缺血性脑病、颅内感染、低血糖等相混淆,但其发病机制不同。新生儿缺氧缺血性脑病存在窒息缺氧史,先发生缺氧导致脑组织血流灌注量减低,能量供应下降,进而导致不同部位脑损伤。新生儿低血糖脑损伤存在血糖降低,累及部位最常见于顶枕叶后部,DWI亦呈高信号影。颅内感染的临床表现、血生化及脑脊液异常,有助于鉴别诊断。
总之,当新生儿IP出现神经系统症状时应尽早行MRI检查,其DWI具有一定的特征性。DWI检查有助于病变的早期发现及临床预后评估。首次MRI正常的IP患儿如后期有任何神经系统症状应及时复查MRI及早期干预。本研究为回顾性分析,且纳入与随访病例数较少、随访时间较短,故需扩大样本量进一步研究,以提高对新生儿IP的脑部MRI表现的认识,协助临床诊治及预后评估。
[1] Shankar YU, Fatima N, Kumar MA, et al. Bloch sulzberger syndrome (incontinentia pigmenti): a rare case report with dental defects. J Indian Soc Pedod Prev Dent, 2015, 33(1): 74-77.
[2] Meuwissen ME, Mancini GM. Neurological findings in incontinentia pigmenti; a review. Eur J Med Genet, 2012,55(5): 323-331.
[3] Minić S, Trpinac D, Obradović M. Incontinentia pigmenti diagnostic criteria update. Clin Genet, 2014, 85(6): 536-542.
[4] Minić S, Trpinac D, Obradović M. Systematic review of central nervous system anomalies in incontinentia pigmenti. Orphanet J Rare Dis, 2013, 8(1): 25.
[5] Soltirovska Salamon A, Lichtenbelt K, Cowan FM, et al.Clinical presentation and spectrum of neuroimaging findings in newborn infants with incontinentia pigmenti. Dev Med Child Neurol, 2016, 58(10): 1076-1084.
[6] Hadj-Rabia S, Froidevaux D, Bodak N, et al. Clinical study of 40 cases of incontinentia pigmenti. Arch Dermatol, 2003,139(9): 1163-1170.
[7] Emre S, Firat Y, Güngör S, et al. Incontinentia pigmenti: a case report and literature review. Turk J Pediatr, 2009, 51(2): 190-194.
[8] Lee JH, Im SA, Chun JS. Serial changes in white matter lesions in a neonate with incontinentia pigmenti. Childs Nerv Syst,2008, 24(4): 525-528.
[9] Hennel SJ, Ekert PG, Volpe JJ, et al. Insights into the pathogenesis of cerebral lesions in incontinentia pigmenti.Pediatr Neurol, 2003, 29(2): 148-150.
[10] Maingay-De Groof F, Lequin MH, Roofthooft DW, et al.Extensive cerebral infarction in the newborn due to incontinentia pigmenti. Eur J Paediatr Neurol, 2008, 12(4): 284-289.
[11] Venugopalan P, Pang K. Incontinentia pigmenti: presenting with neonatal seizures and diffuse MRI brain changes. Clin Dysmorphol, 2012, 21(4): 231-233.
[12] Wolf DS, Golden WC, Hoover-Fong J, et al. High-dose glucocorticoid therapy in the management of seizures in neonatal incontinentia pigmenti: a case report. J Child Neurol, 2015, 30(1):100-106.
[13] Pascual-Castroviejo I, Pascual-Pascual SI, Velázquez-Fragua R,et al. Incontinentia pigmenti: clinical and neuroimaging findings in a series of 12 patients. Neurologia, 2006, 21(5):239-248.
[14] Tak PP, Firestein GS. NF-kappaB: a key role in inflammatory diseases. J Clin Invest, 2001, 107(1): 7-11.
[15] Mattson MP, Camandola S. NF-kappaB in neuronal plasticity and neurodegenerative disorders. J Clin Invest, 2001, 107(3):247-254.
[16] Pizzamiglio MR, Piccardi L, Bianchini F, et al. Incontinentia pigmenti: learning disabilities are a fundamental hallmark of the disease. PLoS One, 2014, 9(1): e87771.
(本文编辑 闻 浩)
Brain MRI Features in Newborn Infants with Incontinentia Pigmenti
Purpose To explore brain MRI features in newborn infants with incontinentia pigmenti, and to enhance the understanding and diagnosis level of this disease. Materials and Methods A retrospective analysis on MRI data of 13 neonates with incontinentia pigmenti admitted to Hunan Children's Hospital from January 2009 to December 2016 and further confirmed by clinical, pathology and gene diagnosis were conducted. Such conventional MRI sequences as T1WI and T2WI as well as DWI and SWI sequences were incorporated. Results Five out of 13 newborn infants with incontinentia pigmenti were abnormal in the MRI features. In the conventional sequence, slightly short T1 signals in bilateral frontal lobe and right parietal occipital cortex were identified in 3 cases, right basal ganglia hemorrhage in 1 case. Slightly short T1 and long T2 signals in bilateral basal ganglia were observed in 1 case; 1 case of subarachnoid hemorrhage and 1 case of bilateral lateral ventriculomegaly were noticed as well. The lesion sites of 4 cases were observed high density signal in DWI findings, three of which were widely distributed in abnormal signals. Lobes deep in bilateral cerebral hemispheres and subcortical white matter, bilateral basal ganglia, thalamus, internal capsule, corpus callosum, brain stem and cerebellum were the most affected areas. DWI could detect lesion area earlier and more accurate than conventional sequences. Conclusion Incontinentia pigmenti among newborn infants demonstrates a high incidence. MRI examination should be adopted the moment neurological symptoms occur. Incontinentia pigmenti is relatively distinct in DWI findings, and hence is helpful for early detection of lesions and evaluation of clinical prognosis.
Pigmentation disorders; Central nervous system; Magnetic resonance imaging; Infant, newborn
10.3969/j.issn.1005-5185.2017.09.003
金 科
Department of Radiology, Hunan Children's Hospital, Changsha 410007, China
Address Correspondence to: JIN Ke E-mail: jinke001@sina.com
R445.2;R758
2017-06-05
修回日期: 2017-07-05
中国医学影像学杂志
2017年 第25卷 第9期:651-654
Chinese Journal of Medical Imaging 2017 Volume 25 (9): 651-654

