响应面法优化酶促水解蓝圆鲹蛋白制备抗凝血肽的研究*
周浩纯 顾晗可 单丹婷 宋璐瑶 俞舜杰 黄光荣*
(中国计量大学生命科学学院,浙江杭州 310018)
·基础研究·
响应面法优化酶促水解蓝圆鲹蛋白制备抗凝血肽的研究*
周浩纯**顾晗可 单丹婷 宋璐瑶 俞舜杰 黄光荣***
(中国计量大学生命科学学院,浙江杭州 310018)
以蓝圆鲹加工副产物为原料,探究酶促水解制备抗凝血肽的工艺条件。研究结果表明,碱性蛋白酶对蓝圆鲹蛋白质的水解效果最好,经单因素试验和响应面试验优化后得到碱性蛋白酶酶促水解的最佳条件为:水解pH 7.5,水解温度44℃,碱性蛋白酶添加量9 500 U/g,水解时间4.2 h,响应面模型预测水解液的相对抗凝血活性值为100 AT-U/mL,3次验证试验表明,实际相对抗凝血活性为101 AT-U/mL,水解度为19.55%,与预测值接近。
蓝圆鲹;抗凝血肽;酶促水解;加工副产物;响应面法
蓝圆鲹(Decapterus maruadsi)属于大宗低值鱼,主要分布在我国南海,数量较多,是典型的海洋经济鱼类之一。蓝圆鲹除鲜食外,主要用于加工制作鱼罐头、鱼糜等产品,加工后的副产物富含蛋白质,不易贮藏与运输,通常用作制备饲料,经济价值较低。由于蓝圆鲹加工副产物富含蛋白质,是制备各种生物活性肽的优良原料,如制备抗氧化肽、降血压肽、矿物元素结合肽。目前,利用蓝圆鲹加工副产物制备抗凝血肽的研究尚未见报道。凝血是机体重要的生理防御过程,但在病理条件下可诱发血栓,继而导致如肺梗塞、脑血栓、视网膜动静脉阻塞、心肌梗塞和四肢及周围血管栓塞等疾病,严重危害人类生命健康。目前市面上常见的抗血栓药主要是化学合成西药,也有酶制剂,如瑞替普酶等。近年来的研究表明,一些蛋白质水解得到的生物活性肽也具有抗凝血作用,来源包括黄鳍金枪鱼蛋白、蛋清粉、蝎子蛋白、虾虎鱼蛋白、紫贻贝蛋白、菲牛蛭蛋白。经研究发现,蓝圆鲹加工副产物的酶促水解液具有抗凝血作用,本文主要利用响应面法优化酶促水解蓝圆鲹加工副产物制备抗凝血肽的工艺条件。
1 材料与方法
1.1 试验材料
蓝圆鲹加工副产物,浙江省温州洞头区水产品市场。
1.2 试验方法
1.2.1 原料预处理
蓝圆鲹加工副产物→烘干→去头→粉碎过筛→异丙醇脱脂2~3次→挥发有机试剂→烘干→粉碎过筛→低温密封保存
1.2.2 酶促水解
称取脱脂后的鱼粉于锥形瓶中,加入一定pH的磷酸缓冲液200 mL(胃蛋白酶用KCl缓冲液),摇匀后加入一定量的蛋白酶,在恒温水浴摇床(150 r/min)中水解一定时间后沸水浴灭酶10 min,待冷却后离心(10 000 r/min,4℃,10 min),取上清液,保存备用。
1.2.3 蛋白酶的筛选
选用复合蛋白酶(温度50℃、pH7.5)、碱性蛋白酶(温度50℃、pH8.5)、风味蛋白酶(温度50℃、pH7.0)、胰蛋白酶(温度37℃、pH8.0) 分别对脱脂后的鱼粉进行酶促水解,以抗凝血活性、水解度作为指标,筛选出最适的蛋白酶。
1.2.4 酶促水解条件优化
单因素试验:分别以水解温度(25℃~65℃)、pH值(7.0~9.5)、蛋白酶添加量(8 000 U/g~13 000 U/g,以每g蛋白质所需要的酶添加单位表示)、水解时间(1 h~5 h) 和鱼粉添加量(2 g/L~150 g/L) 为单因素进行水解,测定水解液的水解度和相对抗凝血活性。
响应面优化:根据单因素试验结果,选择pH、水解温度、酶添加量、水解时间4个因素进一步优化,以单因素试验中的较佳水平为中心点,运用CCD(Central Composite Design) 进行响应面试验设计,测定各试验组的水解液相对抗凝血活性,四因素三水平响应面试验设计的因素水平编码值如表1所示。
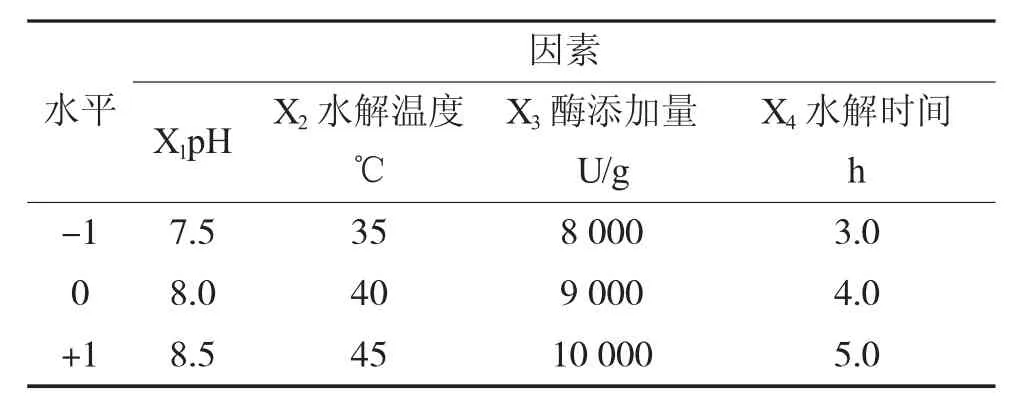
表1 响应面试验因素水平编码表
1.3 测定方法
1.3.1 蛋白质含量的测定
蓝圆鲹鱼粉样品经2.0 mol/L NaOH在80℃条件下回流水解4 h后,以6.0 mol/L HCl调节pH至中性,以福林酚法测定总蛋白质含量。
1.3.2 水解度的测定
根据参考文献[19]中方法测定可溶性肽含量。水解度(DH)用公式计算:水解度=(可溶性肽的含量/总蛋白的含量)×100%。
1.3.4 相对抗凝血活性的测定
根据参考文献[17]中方法测定抗凝血活性,以相对值表示。
1.4 数据分析
重复3次试验,最终结果显示为平均值±标准差,统计图在Origin 8.5软件下完成。响应面分析在Design Expert 8.0软件下完成。
2 结果与分析
2.1 蛋白酶的筛选
以常见的4种商业化蛋白酶对脱脂后的蓝圆鲹加工副产物进行酶促水解,测定其水解度和抗凝血活性,结果如下页图1所示。从图1可以看出,碱性蛋白酶具有更高水解效率,其水解度最高,其次是复合蛋白酶;碱性蛋白酶和胰蛋白酶水解液具有同等的抗凝血活性,结合水解度,最后选择碱性蛋白酶为水解酶,研究其最佳水解条件。
2.2 单因素试验
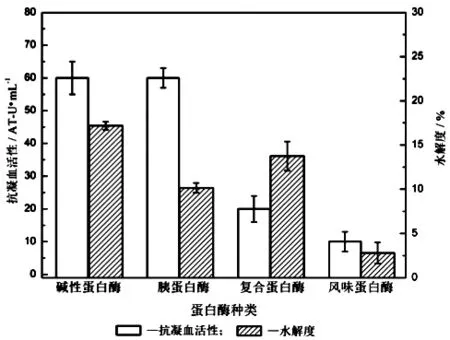
图1 不同蛋白酶水解液的水解度和抗凝血活性的影响
试验研究了鱼粉添加量、碱性蛋白酶添加量、水解温度、pH和水解时间对蓝圆鲹蛋白质酶促水解过程的影响,测定水解液的抗凝血活性和水解度,结果如图2~6所示。由图2可知,鱼粉添加量与水解液抗凝血活性没有明显规律,当鱼粉添加量在5 g/L和20 g/L时抗凝血活性明显高于其他水平,而水解度随着鱼粉的增加而降低。由图3可知,水解度随碱性蛋白酶添加酶量先增加,然后趋于平衡,而抗凝血活性则在酶添加量为9 000 U/g时最高。由图4可知,水解度在水解时间为40℃时最高,但水解液的抗凝血活性在40℃和50℃时均表现出相对较强。由图5可知,水解度在pH8.5及以后表现出较高值,这是碱性蛋白酶的特点,但水解液的抗凝血活性却并未出现有规律的变化,在pH7.0和pH8.0时表现出较大相对抗凝血活性。从图6可知,水解时间越长,抗凝血活性越高,但在4 h后有明显下降,水解度也随着水解时间增加而增加,但在3 h后逐渐减小。因此,通过单因素试验确定下一步响应面优化水解条件的因素为碱性蛋白酶添加量、水解温度、水解时间和pH,其中心点分别为9 000 U/g、40℃、4 h、和8.0。
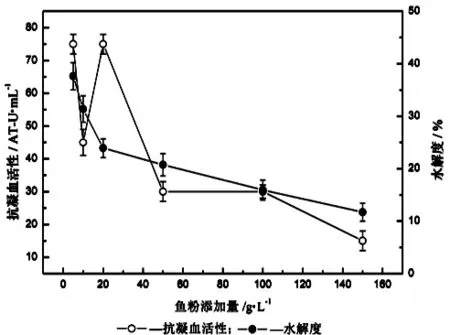
图2 鱼粉添加量对蓝圆鲹蛋白质水解的影响

图3 酶添加量对蓝圆鲹蛋白质水解的影响
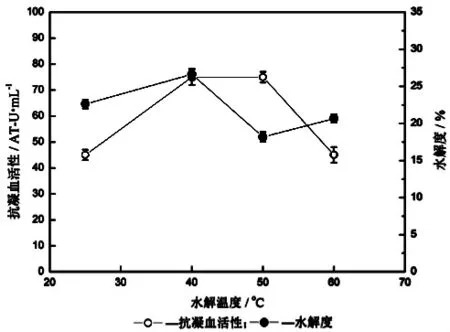
图4 水解温度对蓝圆鲹蛋白质水解的影响
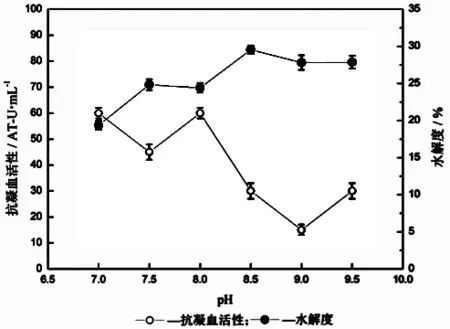
图5 pH对蓝圆鲹蛋白质水解的影响
2.3 响应面优化碱性蛋白酶水解条件

图6 水解时间对蓝圆鲹蛋白质水解的影响
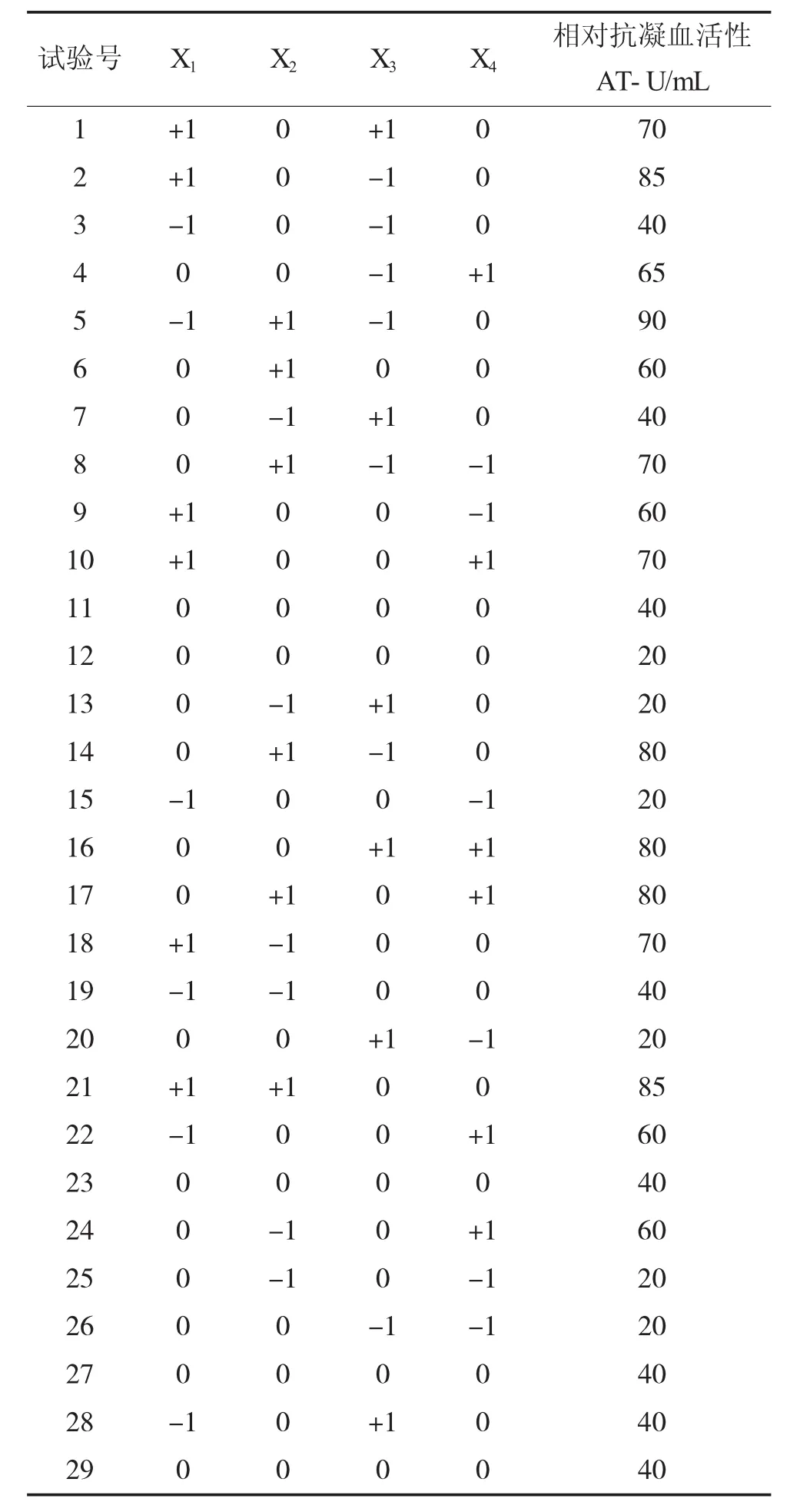
表2 响应面试验结果
以响应面CCD设计,试验了碱性蛋白酶添加量、水解温度、水解时间和pH对水解液抗凝血活性的影响,共29个试验,其中中心点5个,按表2顺序进行试验,测定水解液的抗凝血活性,结果如表2所示。利用Design Expert 8.0软件,以抗凝血活性为响应值,酶添加量、水解温度、水解时间和pH为变量,进行二次回归模型分析,得到预测模型公式为:
抗凝血活性=+563.365 23-128.808 89X1+2.321 81X2-0.024 253X3+12.166 67X4-0.355 56X1X2-3.780 09E-017X1X3-2.000 00X1X4+1.15266E-018X2X3-0.333 33X2X4+1.000 00E-003X3X4+9.813 33X12+0.030 288X22+8.533 33E-007X32+2.583 33X42,其中X1为pH,X2为水解温度(℃),X3为酶添加量(U/g),X4为水解时间 (h)。
对影响水解过程的4个因素进行方差分析,结果如表3所示。

表3 响应面试验结果的方差分析
由表3可知,4个因素的显著性影响大小依次为:水解温度>pH>水解时间>酶添加量。其中水解温度这一因素表现为极显著,因此可看出温度对于水解液抗凝血活性的影响非常大;该模型中只有酶添加量这一个因素为不显著,分析原因可能是所加的酶量均达到或接近饱和。用Design Expert8.0软件预测得到的最优水解条件为:碱性蛋白酶添加量9 500 U/g,水解温度44℃,水解时间4.2 h和水解pH7.5,在此条件下进行验证试验,测得该条件下蓝圆鲹水解液的相对抗凝血活性达100 AT-U/mL,与预测值101 AT-U/mL非常接近。此时,水解液的水解度为19.55%。
3 结论
蓝圆鲹是我国南海经济鱼类之一,加工后的副产物含有大量的蛋白质,是一种较好的蛋白质资源。本文以蓝圆鲹加工后的副产物为原料,脱脂后经过酶促水解,制备成具有抗凝血作用的水解液。结果表明,碱性蛋白酶对蓝圆鲹蛋白质的水解效果最好,经单因素和响应面试验优化的水解条件为:水解pH 7.5,水解温度44℃,碱性蛋白酶添加量9 500 U/g,水解时间4.2 h,在此条件下进行水解,相对抗凝血活性可达到100 AT-U/mL,水解度可达19.55%。
[1]蒋日进,徐汉祥,金海卫,等.东海蓝圆鲹的摄食习性[J].水产学报,2012,36(2):216-227.
[2]刘光明,李晓燕,胡家伟,等.一种蓝圆鲹罐头的加工方法:中国,CN201510223447.X[P].2015-08-26.
[3]张浩.蓝圆鲹冷冻鱼糜加工关键工艺研究[D].福州:福建农林大学,2014.
[4]蒋海萍.蓝圆鲹蛋白制备抗氧化肽的研究[D].南宁:广西大学,2014.
[5]何婷.蓝圆鲹蛋白控制酶解及酶解物抗氧化特性研究[D].广州:华南理工大学,2008.
[6]杨燊,郝更新,陈申如,等.蓝圆鲹酶解条件的响应面法优化及其产物抗氧化活性的研究[J].中国食品学报,2012,12(8):32-40.
[7]JIANG H P,TONG T Z,SUN J H,et al.Purification and characterization of antioxidative peptides from round scad(Decapterus maruadsi) muscle protein hydrolysate [J].Food Chemistry,2014,154(2):158-163.
[8]舒冰.酶解蓝圆鲹蛋白制备降血压肽的研究[D].南宁:广西大学,2012.
[9] ZHANG W T,LI Y N,ZHANG J,et al.Optimization of Hydrolysis Conditions for the Production of Iron-Binding Peptides from Scad (Decapterus maruadsi) Processing Byproducts [J].American Journal of Biochemistry and Biotechnology,2016,12(4):220-229.
[10]SCHWIENHORST A.Direct thrombin inhibitors:a survey of recent developments [J].Cellular and Molecular Life Sciences,2006,9(63):150-160.
[11]AGHAABDOLLAHIAN S,RABBANI M,GHAEDI K,et al.Molecular cloning of Reteplase and its expression in E.coliusing tacpromoter [J].Advanced Biomedical Research,2014,3:190-190.
[12]NIRANJAN R,JUNG W K,ERESHA M,et al.A Novel AnticoagulantPurified from Fish Protein Hydrolysate Inhibits Factor Ⅶ and Platelet Aggregation [J].Life Science,2005,76(22):2 607-2 619.
[13]刘静波,王菲,王翠娜,等.Alcalase酶解蛋清粉制备抗凝血肽的工艺优化[J].吉林大学学报(工学版),2012,42(1):250-255.
[14]REN Y,WU H,LAI F R,et al.Isolation and identification of a novel anticoagulant peptide from enzymatic hydrolysates of scorpion (Buthus martensii Karsch)protein [J].Food Research International,2014,64:931-938.
[15]NASRI R,AMOR I B,BOUGATEF A,et al.Anticoagulant activities of goby muscle protein hydrolysates [J].Food Chemistry,2012,133(3):835-841.
[16]JUNG W K,KIM S K.Isolation and characterization of an anticoagulant oligopeptide from blue mussel,Mytilus edulis[J].Food Chemistry,2009,117(4):687-692.
[17]钟超.菲牛蛭抗凝血肽的酶法制备及其活性研究[D].广州:华南理工大学,2012.
[18]PARK K A,CHOI Y M,KANG S,et al.Effects of Proteins on the Reactivity of Various Phenolic Compounds with the Folin-Ciocalt Reagent[J].Korean Journal of Food Science&Technology,2015,47(3):299-305.
[19]ADLER-NISSEN J.Determination of the degree of hydrolysis of food protein hydrolysates by trinitrobenzenesulfonic acid [J].Journal of Agricultural and Food Chemistry,1979,27(6):1 256-1 262.
Optimization ofenzymatic hydrolysis of Decapterus maruadsi protein for anticoagulant peptides production by response surface methodology*
ZHOUHaochun**GUHankeSHANDantingSONGLuyaoYUShunjieHUANGGuangrong***
(College oflife sciences,China jilianguniversity,ZhejiangHangzhou 310018,China)
The anticoagulant peptides fromblue scad(Decapterus maruadsi)processingby-products byenzymatic hydrolysis were investigated in this paper.The results showed that alcalase was the best choice for producinganticoagulant peptides fromblue scad processingby-products.The best hydrolysis conditions were optimized bysingle-factor-experiment and response surface methodology(RSM)as following:hydrolysis pH 7.5,hydrolysis temperature of44℃,alcalase addition of 9 500 U/g and hydrolysis time of 4.2 h.The relative anticoagulant activity by the RSMprediction model was 100 AT-U/mL,which was veryclose tothat ofthree verification experiments,101 AT-U/mL,and the degree ofhydrolysis was 19.55%at the best hydrolysis conditions.
Decapterus maruadsi;anticoagulant peptides;enzymatic hydrolysis;processing by-products;response surface methodology
TS254.4
A
1673-6044(2017)03-0052-05
10.3969/j.issn.1673-6044.2017.03.016
国家大学生创新创业训练计划项目(201610356004)
**周浩纯,女,1996年出生,中国计量大学食品质量与安全专业在读本科。
*** 黄光荣,通讯作者,E-mail:grhuang@126.com.
2017-04-18

