乙酸铵离心交换法和乙酸钙离心交换法测定土壤阳离子交换量
拉毛吉 王玉功 张 榕
(国土资源部兰州矿产资源监督检测中心,兰州 730050)
乙酸铵离心交换法和乙酸钙离心交换法测定土壤阳离子交换量
拉毛吉 王玉功 张 榕
(国土资源部兰州矿产资源监督检测中心,兰州 730050)
土壤阳离子交换量(CEC)的测定在农业中有重要的意义,对农业行业标准NY/T295—1995和NY/T1121.5—2006中的离心交换法测定土壤中CEC值的方法进行了优化,讨论了不同pH值的土壤样品对两种方法的选择依据,分析了CEC值测定重现性较差的原因。结果表明,pH值的范围是方法选择的重要依据,pH<7.0的样品适合用乙酸铵离心交换法,pH≥7.0的样品则适用乙酸钙离心交换法。优化后方法的准确度和精密度有了较大的改善,实验中对各步骤的优化缩短了约40%的操作时间,减少工作量,适合于批量样品的准确测定。
土壤阳离子交换量;乙酸铵离心交换法;乙酸钙离心交换法;pH值
前言
土壤阳离子交换量(Cation Exchange Capacity,即CEC)作为土壤保肥能力、改良土壤和合理施肥的评价指标,其测定结果在农业生产上有重要的参考价值[1]。因此对某一地区的土壤进行广泛的样品采集和CEC的准确测定,从而可以掌握这一地区的土壤特性,对农业生产有重要的指导意义[2]。由于不同地域其土壤组成和酸碱度也大不相同,而这些都是影响CEC准确测定的重要因素,因此选择合适的CEC测定方法非常关键。
一般来说,对于大批量的土壤样品,酸性和中性土壤常采用经典的乙酸铵离心交换法[3],此方法优点是铵在土壤中含量少,且易除去,在清洗时土壤不易分散,测定结果重现性高。石灰性土壤则选取乙酸钙离心交换法[4],此方法不用蒸馏,操作简单,较文献[5-6]中提到的方法更便于操作。本文选取上述两种方法进行CEC的测定,而土壤的pH值则成为对这两种方法选择的重要依据。本文通过大量的实验数据建立了pH值的范围与CEC的相关性,确定了不同酸碱性的土壤CEC测定方法的选择,并优化了两种测定方法,减少了工作时间,提高了方法重现性,对实验室测定土壤阳离子交换量具有重要参考价值。
1 实验部分
1.1主要仪器及试剂
凯特TD5B型离心机(转速3 000 ~4 000 r/min,盐城市凯特实验仪器有限公司);杰瑞尔HY-6双层振荡器(振荡频率220 r/min ±20 r/min,金坛市杰瑞尔电气有限公司)。
所用的氢氧化钠标准溶液和盐酸标准溶液均由本检测中心标准室提供;所有试剂均为分析纯。分析用水为二次去离子水。
1.2实验方法
乙酸铵离心交换法和乙酸钙离心交换法分别见文献[3-4]。
2 结果与讨论
2.1乙酸铵离心交换法方法优化
按实验方法,随机选取252份样品洗涤后对残留离子进行检测,检测结果见表1。由表1可以看出,用乙酸铵洗涤3次后溶液未检出钙离子,即土壤阳离子已被铵离子完全交换,形成铵离子饱和土壤。用乙醇洗涤3次后溶液中铵离子的未检出率83.3%,由于乙醇对土壤有分散作用,若延长振荡时间不易离心澄清,因此可选择增加洗涤次数,洗涤4次后铵离子未检出率为99.6%,表明用乙酸铵洗涤时残留的过量铵离子已洗去。这样对批量样品进行CEC值测定时,可直接用乙酸铵洗涤3次,乙醇洗涤4次,不必再做残存离子检测。
在使用离心机离心时,为节省时间,可先对离心杯进行称重编号,将重量相当的离心杯对角放置于离心机内。由于实验操作中两次洗涤(乙酸铵洗涤、乙醇洗涤)均为加入60 mL溶液,实验室中可自制体积为60~70 mL的塑料勺,每次定量加入,缩短操作时间。
2.2乙酸钙离心交换法方法优化
按实验方法,随机选取256份样品洗涤后对残留离子进行检测,检测结果见表1。标准方法[4]中对样品用盐酸(0.25 mol/L)进行浸泡放置过夜,以分解土壤中的碳酸盐和石膏,再用盐酸(0.05 mol/L)洗涤3次振荡5 min后溶液中钙离子的未检出率78.5%。但若对样品用盐酸(0.25 mol/L)进行浸泡后振荡15 min左右并放置过夜,用盐酸(0.05 mol/L)洗涤3次时每次振荡时间延长至10 min后钙离子的未检出率则提高为99.2%,说明土壤阳离子已被氢离子完全交换,形成氢离子饱和土壤。乙醇(40%)洗涤时3次即未检测出氯离子,表明残留过量盐酸已被洗去。通过上述结果,对批量样品进行CEC值测定时,可对样品用盐酸(0.25 mol/L)浸泡后振荡15 min放置过夜,盐酸(0.05 mol/L)洗涤3次,延长每次振荡时间至10 min,乙醇(40%)洗涤3次,不必再做残存离子检测。
此方法三次洗涤(盐酸洗涤、乙醇洗涤、乙酸钙洗涤)过程中也是定量加入60 mL溶液,因此也可使用自制60~70 mL的塑料勺加入洗涤溶液,缩短操作时间。
2.3方法的重现性比较
按照实验优化后的方法,选取国家标准物质GBW07412a(pH=6.80±0.6)、GBW07413a(ASA-2a) (pH=8.15±0.08),让两组分析人员分别对样品用优化前和优化后的方法各进行平行5次CEC值测定,测定值见表2。如表2所示,乙酸氨法优化前后的变异系数为0.14%、0.13%,乙酸钙法优化前后的变异系数为2.08%、0.93%,可见优化后两种方法的重现性有了较大的改善。这是由于优化后时间大大缩短,可在较短时间内一次将所有流程操作完毕,完成对结果的测定,减少了操作流程过长而引起的其它不确定因素。

表1 振荡时间和洗涤次数的确定Table 1 Oscillation time and the washing frequency
表2 方法重现性对比Table 2 Comparison of methods reproducibility(n=5)
2.4方法的选择与pH值的关系
一般土壤分为五级,即强酸性(pH<5.0)、酸性(pH5.0~6.5)、中性(pH6.5~7.5)、碱性(pH7.5~8.5)、强碱性(pH>8.5)。在对西藏某一地区的CEC值进行测定时,根据部分测定的pH值结果(图1),发现这一地区的土壤样品pH值集中在7.0~8.5(75.4%),少量样品的pH值在5.0~7.0(10.5%),8.5~9.5(14.1%)。为了能选取更适合在实验室中实际操作的方法,针对随机选取的部分样品,我们对两种方法测得的结果进行了对比。

图1 pH值结果散点图Figure 1 Scatter plot of pH results.
随机选取了pH从5.0到9.0均匀分布的60份西藏土壤样品,对同一样品用两种方法分别测得其CEC值,对结果进行平行对比(图2),可以看出同一样品两种方法测得的CEC值都很接近,两种方法所得的结果大部分结果相对误差在6.5%之内。但能明显看到pH<6.98的样品乙酸铵法做得的结果会偏高于乙酸钙法,而pH≥6.98的样品则刚好相反。这是由于在酸性土壤中,土壤阳离子组成以H+、Al3+较多,乙酸钙法是以HCl溶液洗涤样品,以H+置换土壤阳离子,这必然使得测定结果偏低。土壤在pH>7.0时,土壤中阳离子组成则Ca2+、Mg2+的含量会增加,而乙酸铵法会造成土壤中的石灰质(CaCO3、MgCO3)溶解于交换剂中,阻碍交换性Ca、Mg被交换完全,致使结果偏低。因此,在对大批量样品进行CEC值测定时,可以对pH<7.0的样品采用乙酸铵法测定,pH≥7.0的样品则采用乙酸钙法。
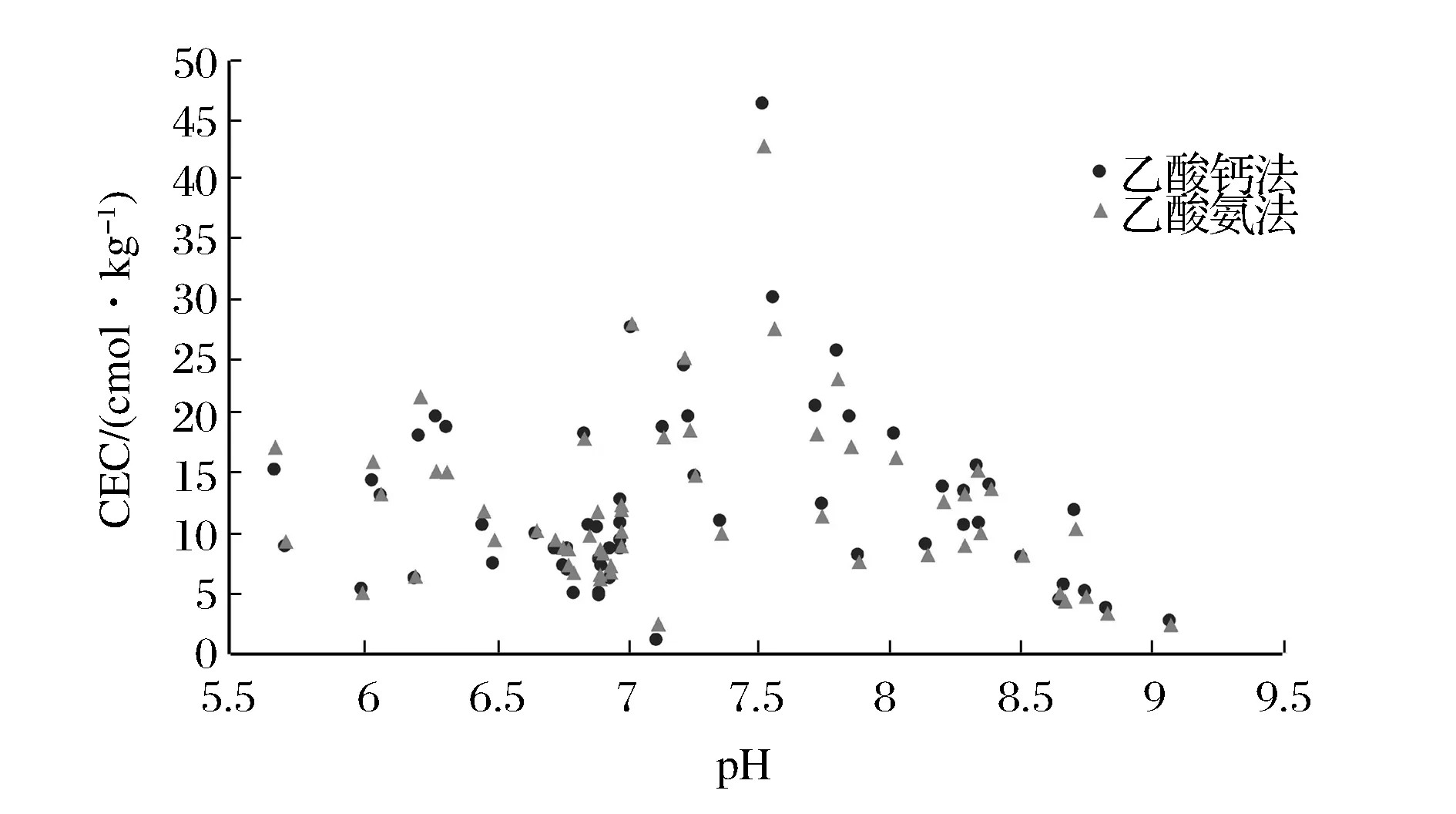
图2 两种方法CEC值结果对比图Figure 2 Comparison of CEC values for the two methods.
2.5CEC值与pH值之间的关系
随机选取样品248份(pH<7.0)用乙酸铵法测定CEC值,对结果绘制散点图(图3),可以看到CEC值大部分(73.79%)在10~25 cmol/kg,而pH<6.0的样品,其CEC值明显较低。
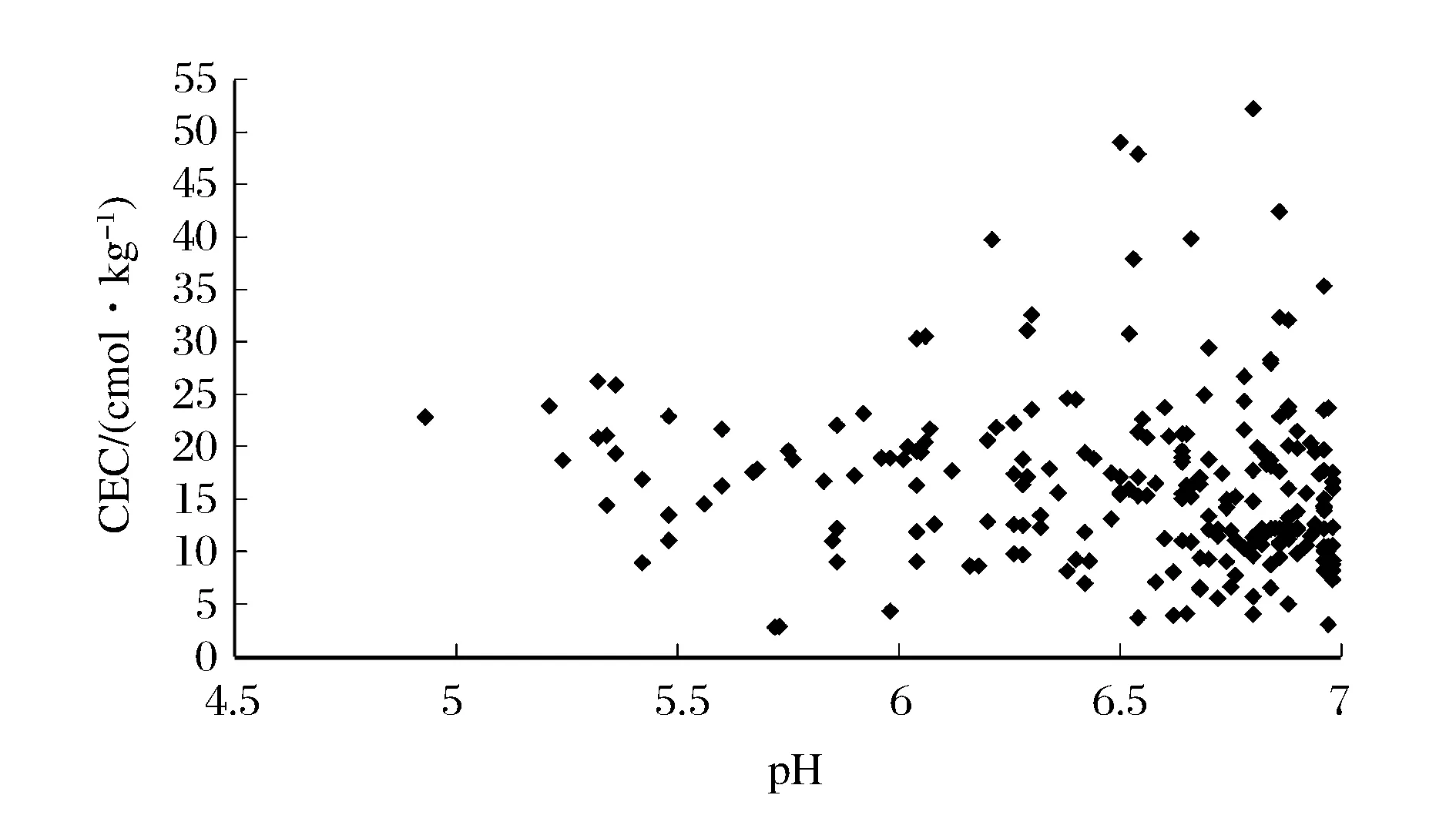
图3 乙酸铵法测定CEC结果散点图Figure 3 Scatter plot of CEC results by ammonium acetate method.
随机选取样品250份(pH≥7.0)用乙酸钙法测定CEC值,对结果绘制散点图(图4),可以看到CEC值大部分(67.60%)在10~35 cmol/kg,而pH>8.55的样品,其CEC值明也显较低。
一般认为CEC值大于20 cmol/kg保肥能力强,CEC值在10~20 cmol/kg保肥能力中等,CEC值小于10 cmol/kg保肥能力较弱。从这随机抽取的448份样品的CEC值大概可以看出,这一地区总体的土壤保肥性能和缓冲能力一般,处于中等水平,pH值在6.0~8.55的保肥能力最好,而pH<6.0和pH>8.55的土壤保肥性能和缓冲能力减弱。
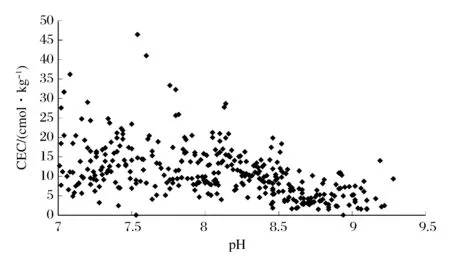
图4 乙酸钙法测定CEC结果散点图Figure 4 Scatter plot of CEC results by calcium acetate method.
3 结论
土壤阳离子交换量(CEC)是土壤胶体所能吸附各种阳离子的总量。本文对乙酸铵离心交换法和乙酸钙离心交换法进行了优化,对优化前后的方法进行了对比,发现两种方法的重现性在优化后都得到了提高,操作时间也大大缩短。而在实验室中对大批量土壤样品进行CEC值测定时,pH<7.0的样品适用乙酸铵离心交换法,pH≥7.0的样品则适用乙酸钙离心交换法。对近450份样品进行CEC值的测定后也可看到土壤pH值与CEC值有很大的关系,是影响土壤保肥能力的重要因素。
[1] 朱祖祥.土壤学 [M]. 第一版.北京:农业出版社,1983.
[2] 谈近强,刘洪宜,卢瑛,等.中山市不同土地利用方式下土壤肥力特性的剖面分布特征[J].广东农业科学(GuangdongAgriculturalSciences),2015,42(6):45-50.
[3] 全国农业分析标准化技术委员会.NY/T295—1995 中性土壤阳离子交换量和交换性盐基的测定[S].北京:中国标准出版社,1996.
[4] 全国农业分析标准化技术委员会.NY/T1121.5—2006 石灰性土壤阳离子交换量的测定[S].北京:中国标准出版社,2006.
[5] 谭美娟,汪晨霞,卫晋波.乙酸铵交换法测定酸性土壤阳离子交换量的方法改良探讨[J].化工管理(ChemicalEnterpriseManagement),2016(20) :148-150.
[6] 王黎明.土壤中阳离子交换量的快速测定——蒸馏法[J].宁夏农林科技(NingxiaJournalofAgricultureandForestryScienceandTechnology),2012,53(9):156-156.
DeterminationofCationExchangeCapacityofSoilbyCentrifugalExchangeofAmmoniumandCalciumAcetates
LA Maoji, WANG Yugong, ZHANG Rong
(LanzhouTestingandQualitySupervisionCenterforGeologicalandMineralProducts,TheMinistryofLandandResources,Lanzhou,Gansu730050,China)
The results of Cation Exchange Capacity (CEC) for soil has important significance in agriculture. In this paper, the centrifugal exchange methods used in the agricultural industry standards of NY/T295—1995 and NY/T1121.5—2006 for CEC determination are optimized. The selection of two methods on the basis of soil samples with different pH is discussed. The reason behind the poor reproducibility of CEC determination is also analyzed. The results show that the pH range could be used as an important basis for the methods selection. The samples with pH<7.0 were suitable for centrifugal exchange of ammonium acetate and those with pH≥7.0 for centrifugal exchange of calcium acetate. Accuracy and precision of the optimized method have been greatly improved and the experimental time is reduced about 40% by optimizing the operating steps. After the final optimization, the reduced workload is suitable for the accurate determination of a large number of samples.
Cation Exchange Capacity (CEC); centrifugal exchange of ammonium acetate; centrifugal exchange of calcium acetate; pH
10.3969/j.issn.2095-1035.2017.03.010
O657.7+5;TH833
A
2095-1035(2017)03-0038-04
2016-10-24
2016-11-21
拉毛吉,女,工程师,主要从事土壤化学分析、水质分析研究。E-mail: 109618967@qq.com
本文引用格式:拉毛吉,王玉功,张榕. 乙酸铵离心交换法和乙酸钙离心交换法测定土壤阳离子交换量[J].中国无机分析化学,2017,7(3):38-41. LA Maoji, WANG Yugong, ZHANG Rong. Determination of Cation Exchange Capacity of Soil by Centrifugal Exchange of Ammonium and Calcium Acetates[J].Chinese Journal of Inorganic Analytical Chemistry, 2017,7(3):38-41.

