一株产耐热甘露聚糖酶细菌的筛选及其酶学性质初探
王瑞君,成莉凤,冯湘沅,段盛文,郑科,刘志远,曾洁,刘正初1,*
(1.湖南农业大学植物保护学院,长沙410128;2.中国农业科学院麻类研究所,长沙410205;3.宜春学院化学与生物工程学院,江西宜春336000)
一株产耐热甘露聚糖酶细菌的筛选及其酶学性质初探
王瑞君1,2,3,成莉凤2,冯湘沅2,段盛文2,郑科2,刘志远2,曾洁2,刘正初1,2*
(1.湖南农业大学植物保护学院,长沙410128;2.中国农业科学院麻类研究所,长沙410205;3.宜春学院化学与生物工程学院,江西宜春336000)
为获得耐热甘露聚糖酶,从天然高温泉水中筛选出了一株产甘露聚糖酶的细菌。结合形态学、生理生化和分子生物学等手段,确定所筛选的菌株为地衣芽孢杆菌(Bacillus licheniformis)。并研究了温度、pH值和金属离子等因素对甘露聚糖酶活力的影响。结果显示,该酶的最适反应温度和pH分别为60℃和5.0。Co2+和Al3+对该酶的活力有抑制作用,Mn2+、K+和Ca2+对该酶活力有一定的促进作用,其它离子对酶活力没有显著影响。该菌株生产的甘露聚糖酶具有耐热偏酸性的特点。该研究为甘露聚糖酶制剂产业提供了可靠的菌种资源,可用于纺织、食品、饲料等方面,并为将来进一步研究其用途奠定了基础。
耐热甘露聚糖酶;地衣芽孢杆菌;筛选;酶学性质
甘露聚糖属于半纤维素,根据侧链的不同主要有甘露聚糖、半乳甘露聚糖、葡甘露聚糖、半乳葡甘露聚糖等几种[1],存在于植物细胞壁中。水解甘露聚糖的关键酶是β-甘露聚糖酶,其主要水解以β-1,4-D-吡喃甘露糖苷键为主链的甘露聚糖[2]。
甘露聚糖酶可应用于纺织[3]、造纸[4]、饲料[5]、食品[6]、医药以及石油[7]等领域。其可由动物、植物、微生物等生物分泌产生,但主要来源于细菌、真菌等微生物。微生物具有生境多样、种类多样的特点,从而使其产生的甘露聚糖酶也具有多样性,此外,微生物还具有生长周期短、产物易提纯等优点,使微生物来源的甘露聚糖酶具有广泛的应用范围。
现在已商业化的甘露聚糖酶主要来源于曲霉、木霉等少数几种真菌类微生物,其它来源的微生物类甘露聚糖酶由于酶活力低、生产成本高而应用不广,并且多数甘露聚糖酶存在耐热性不高的缺点,导致其在生产、运输中生物活性不稳定。因此,筛选耐热性强、酶活高的甘露聚糖酶是甘露聚糖酶研究的一个重要方向[8]。最近已发现一些嗜热或耐热细菌产生的酶具有良好耐热性,具备一些中温微生物产生的酶所不具备的优点,耐热酶的最适作用温度在60℃以上,降低了杂菌的污染,减少了杂菌代谢产物的干扰;较高的反应温度,可提高酶的催化能力和催化效率。已有研究者开始从嗜热环境中筛选产甘露聚糖酶的细菌[9]。本文拟从江西宜春温泉中分离一株产甘露聚糖酶的细菌,并研究其酶学性质,旨在为甘露聚糖酶在高温环境下的储存和应用提供依据。
1 材料与方法
1.1 材料
1.1.1 样品
江西省宜春市温汤镇温泉水。
1.1.2 培养基
富集培养基:酵母膏0.5 g,胰蛋白胨 1 g,NaCl 1 g,魔芋粉 0.5 g,水 100 mL。选择培养基[10]:在富集培养基的基础上添加0.02%曲利苯蓝和2%的琼脂粉。
1.1.3 主要试剂
细菌基因组提取试剂盒购于OMEGA(美国)公司;细菌通用引物27F:5’-AGTTTGATCCTGGCTCAG-3’和1492R:5’-GGTTACCTTGTTACGACTT-3’由上海生工生物工程技术服务有限公司合成;魔芋胶购于成都路特实业有限公司(葡甘聚糖纯度>95%)。
1.2 方法
1.2.1 分离产甘露聚糖酶的嗜热菌株
用无菌容器采集温泉水,量取温泉水10 mL,加入40 mL的富集培养基中,共3个样品。分别置于50、55、60℃条件下培养6 h。发酵液10倍梯度稀释后选择合适的稀释度涂布于选择培养基上。分别置于50、55、60℃条件下培养16~24 h,挑取水解圈与菌落直径之比(D/d)较大的菌落接种于选择培养基中划线纯化,纯化后的菌株接种于富集培养基中,150 r/min过夜培养后,检测酶活力,酶活力较大者为候选菌株。
1.2.2 菌种鉴定
挑取酶活力最大者在LB琼脂平板上培养,观察菌落形态并挑取单菌落进行芽孢染色和革兰氏染色。进行有关的生化试验,方法参照《常见细菌系统鉴定手册》[11]。
挑取单菌落接种于LB液体培养基,55℃过夜培养。用细菌基因组提取试剂盒(OMEGA)提取细菌基因组。以提取的基因组DNA为模板,以细菌通用引物27F和1492R为上下游引物,进行16SrDNA的PCR扩增。扩增产物送上海生工生物工程技术服务有限公司测序。将测得的序列提交到NCBI网站,使用BLAST搜索相似序列,找到同源性较高(>98%)的序列,利用MEGA5.1构建系统发育树。
1.2.3 甘露聚糖酶酶活的测定
以2%接种量接入富集培养基中,55℃、150 r/min过夜培养。菌液5000 r/min,4℃离心10 min,收集上清液即为粗酶液。
在柠檬酸-NaH2PO4缓冲液中配制5 g/L的魔芋胶溶液,粗酶液1 mL加入到1 mL的魔芋胶底物中,60℃水浴反应5 min,采用DNS法测定所释放的还原糖[12]。酶活力单位定义为每分钟水解魔芋胶产生1μmol还原糖所需要的酶量为一个酶活单位。
1.2.4 酶学性质的研究
(1)不同pH值对酶活力的影响:采用不同pH(3.8~7.0)柠檬酸-磷酸氢二钠缓冲液溶解魔芋胶底物,在60℃下,按照1.2.3的方法测定酶活,以最大值为100%,分别计算各pH下的相对酶活。
(2)金属离子对酶活力的影响:将粗酶液和金属离子的母液混匀,使酶液中金属离子的终浓度为1 mmol/L或0.5 mmol/L,测定酶活,甘露聚糖酶粗酶液中加入相同体积不含金属离子的超纯水作为空白对照。金属离子包括 Na+、Ca2+、Mn2+、Mg2+、Zn2+、Fe2+、Co2+、Cu2+、K+、Al3+,以其氯化物形式检测金属离子对酶活的影响。
2 结果
2.1 菌株筛选
在选择培养基上培养后,挑取了D/d≥2的菌株,从50、55℃培养的选择培养基上筛选到10株产甘露聚糖酶的细菌,如图1所示。表1结果显示,挑取水解圈较大的菌落纯化后,测得Mas1菌株酶活力最大,故选择其作为试验菌株。

图1 10株产甘露聚糖酶菌株的水解圈Fig.1 The hydrolysis halos of ten strains producingmannanases

表1 10株菌的D/d及酶活力Tab.1 The ratio of D/d and enzyme activity of ten strains
2.2 菌株的鉴定
菌株在LB琼脂培养基上生长,菌落中间干燥,边缘湿润不整齐(图2)。革兰氏染色结果表明,嗜热菌株为革兰氏阳性杆菌。用孔雀绿进行芽孢染色的结果见图3,图中可见绿色的芽孢和红色的菌体,图3表明,菌体内部有膨大的芽孢。菌株Mas1生化鉴定结果见表2。鉴定结果与《常见细菌系统鉴定手册》[11]所描述的地衣芽孢杆菌(Bacillus licheniformis)的生化特征相似。

图2 菌落形态Fig.2 Colonymorphology

图3 菌株Mas1的芽孢染色Fig.3 Endospore stain of strain Mas1

表2 Mas1菌株生化鉴定结果Tab.2 Biochemical properties of isolated strain Mas1
利用NCBIGenBank中的Blast程序进行序列同源性比对,结果表明,菌株Mas1的16SrDNA序列与地衣芽孢杆菌(Bacillus licheniformis)同源性达99%。来自菌株Mas1的16SrDNA序列与相似性较高的序列构建系统发育树(见图4)。由系统发育树状图可知,Mas1与菌株Bacillus licheniformis D50在同一个进化分支上,表明两者有最近的亲缘关系。结合生化试验结果,鉴定该菌为地衣芽孢杆菌(Bacillus licheniformis)。

图4 Neighbor-joining法构建的Mas1系统发育树Fig.4 A neighbor-joining phylogenetic tree of the strain Mas1
2.3 酶学性质
2.3.1 pH对甘露聚糖酶活力的影响
为确定pH对甘露聚糖酶活力的影响,在60℃条件下测定了不同pH值下该酶的活力。由图5可知,该酶的最适pH值为5.0。在pH 4.6~5.8的范围内,该酶的相对酶活力保持在70%以上,这一结果表明该甘露聚糖酶为偏酸性酶。

图5 不同pH值对甘露聚糖酶活力的影响Fig.5 Effect of pH onmannanase activity
2.3.2 温度对酶活力的影响
在pH 5.0条件下,测定了不同温度对酶活力的影响,结果见图6。由图6可知,在温度低于60℃时,随着温度的升高相对酶活力升高。高于60℃后,酶活力快速下降,在75℃时的相对酶活力只有24.5%,在40~70℃范围内相对酶活力可保持近60%以上。在60℃时,酶活力达到最高,60℃为该酶反应的最适温度。已有研究[13]认为耐热酶的最适温度范围为60~80℃,超嗜热酶最适反应温度大于80℃,根据这一标准,Mas1产生的甘露聚糖酶为耐热酶。

图6 甘露聚糖酶的最适反应温度Fig.6 Effect of temperature on mannanase activity
2.3.3 金属离子对酶活力的影响
金属离子对甘露聚糖酶的影响见表3。数据表明,在1、0.5 mmol/L的浓度下,Ca2+和Mn2+对酶活力有促进作用。在1 mmol/L浓度下,Mg2+、K+、Cu2+等离子对酶活力有一定的促进作用。在两种浓度下,Al3+与Co2+对酶活力有抑制作用,其它离子对酶活力没有明显的抑制作用。
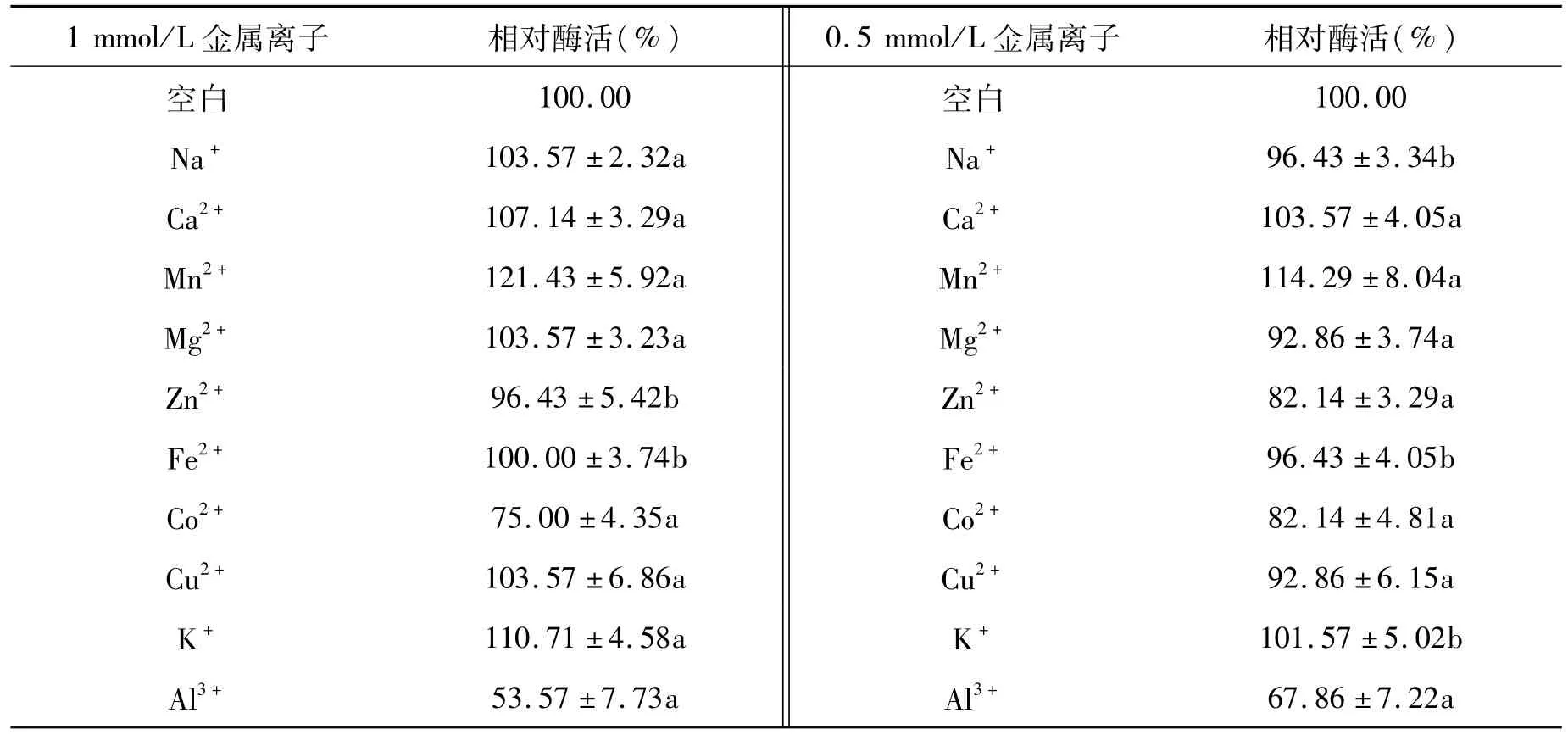
表3 金属离子对甘露聚糖酶的影响Tab.3 Effect ofmetal ions on activity ofmannanase
3 讨论
常见的产甘露聚糖酶的细菌包括革兰氏阳性的芽孢杆菌[14,15],革兰氏阴性的产酸克雷伯菌(Klebsiella oxytoca)[16]、路德维希肠杆菌(Enterobacter ludwigii)[17]等。已有的研究数据表明[18,19],筛选的产甘露聚糖酶的芽孢类菌株中,枯草芽孢杆菌较多,地衣芽孢杆菌较少。本研究从江西温泉中筛选到一株产甘露聚糖酶的细菌,经形态学、生理生化鉴定和分子鉴定,确定为地衣芽孢杆菌,丰富了产甘露聚糖酶菌种的多样性。
甘露聚糖酶的性质因来源不同而不同。图5、6显示,从温泉中分离的菌株Mas1分泌的甘露聚糖酶最适pH值为5.0,在酸性范围保持较高的酶活力;该酶的最适温度为60℃,在40~70℃范围保持近60%以上的酶活力。唐嘉婕等[20]从臭豆腐卤液中筛选到的短小芽孢杆菌所分泌的甘露聚糖酶最适pH和反应温度为分别为6.0和40℃。吴华伟[21]从土壤中筛选的菌株产甘露聚糖酶的最适pH和反应温度分别为6.5和50℃。Mas1最适反应温度为60℃,
甘露聚糖酶在发酵生产或使用中常遇到钠、钾、钙、镁、铜、锌、铁、锰、铝或钴等金属离子,这些金属离子可能对甘露聚糖酶有抑制或激活作用。为了更好地了解这些金属离子对酶的影响,本文研究了这些金属离子对甘露聚糖酶的影响。由结果可知,Ca2+和Mn2+对酶活力有激活作用,Al3+与Co2+对酶活力有抑制作用,其它离子对酶活力没有明显的抑制作用。金属离子对甘露聚糖酶的影响较为复杂,表现在不同来源的甘露聚糖酶对金属离子的要求不同:Ca2+、K+、Zn2+、Na+、Mg2+等离子对来源于海洋微生物的甘露聚糖酶活力有抑制作用[22]。本研究中的甘露聚糖酶对常见的金属离子具有较好的耐受性,可以有较广的应用范围。
不同性质的甘露聚糖酶可以满足不同的需求。本文筛选到了一株产耐热偏酸性甘露聚糖酶的菌株,有关其产生的甘露聚糖酶的应用需作进一步研究。
4 结论
本文从江西温泉中筛选到产甘露聚糖酶的菌株,鉴定结果表明,所筛选的菌株为地衣芽孢杆菌。该菌株产生的甘露聚糖酶在60℃偏酸性条件下具有较高的酶活力,该酶对发酵过程或使用中遇到的常见金属离子具有较好耐受性。
[1]Chauhan PS,PuriN,Sharma P,etal.Mannanases:microbial sources,production,properties and potentialbiotechnologicalapplications[J].Applied Microbiology&Biotechnology,2012,93(5):1817-1830.
[2]Moreira L R S,Filho E X F.An overview ofmannan structure andmannan-degrading enzyme systems[J].Applied Microbiology&Biotechnology,2008,79(2):165-178.
[3]郭营,丁若壵,郁崇文.亚麻原麻及其粗纱生物酶处理工艺条件的优化[J].纺织学报,2016,37(4):70-74.
[4]Dhawan S,Kaur J.Microbial Mannanases:An Overview of Production and Applications[J].Critical Reviews in Biotechnology,2007,27(4):197-216.
[5]Tewoldebrhan TA,Appuhamy JA,Lee JJ,etal.Exogenousβ-mannanase improves feed conversion efficiency and reduces somatic cell count in dairy cattle[J].Journal of Dairy Science,2017.
[6]Sachslehner A,Foidl G,Foidl N,et al.Hydrolysis of Isolated Coffee Mannan and Coffee Extract by Mannanases of Sclerotium rolfsii[J].Journal of Biotechnology,2000(80):127-134.
[7]Comfort D A,Chhabra SR,Conners S B,et al.Strategic biocatalysis with hyperthermophilic enzymes[J].Green Chemistry,2004,6(9):459-465.
[8]Maijala P,Kango N,Szijarto N,et al.Characterization of hemicellulases from thermophilic fungi[J].Antonie Van Leeuwenhoek,2012,101(4):905-917.
[9]Summpunn P,Chaijan S,Isarangkul D,etal.Characterization,gene cloning,and heterologous expression ofβ-mannanase from a thermophilic Bacillus subtilis[J].Journal of Microbiology,2011,49(1):86.
[10]马向东,柯涛,熊兰,等.一种鉴定多糖水解酶类及其产生菌的新方法[J].微生物学报,2007,47(6):1102-1104.
[11]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:353-391.
[12]Akino T,Nakamura N,Horikoshi K.Production ofβ-mannosidase andβ-mannanase by an alkalophilic Bacillussp[J].Applied Microbiology and Biotechnology,1987,26(4):323-327.
[13]Van Den Burg.Extremophiles as a source for novel enzymes[J].Current opinion in microbiology,2003,6(3):213-218.
[14]MEM Mabrouk,AMD El Ahwany.Production of 946-mannanase by Bacillus amylolequifaciens10A1 cultured on potato peels[J].African Journal of Biotechnology,2008,7(8),1123-1128.
[15]Meenakshi,Singh G,Bhalla A,et al.Solid state fermentation and characterization of partially purified thermostablemannanase from Bacillus sp.MG-33.[J].Bioresources,2010,5(3):1689-1701.
[16]Titapoka S,Keawsompong S,Haltrich D,etal.Selection and characterization ofmannanase-producing bacteria useful for the formation of prebioticmanno-oligosaccharides from coprameal[J].World JournalMicrobiology Biotechnology,2008(24):1425-1433.
[17]杨苗,卢晓华,王常高,等.产β-甘露聚糖酶菌株的筛选鉴定及产酶条件的优化[J].工业微生物,2015,45(4):51-57.
[18]李文玉,董志扬,崔福绵.枯草芽孢杆菌中性内切β-甘露聚糖酶的纯化及性质[J].微生物学报,2000,40(4):420-424.
[19]龚劲松,李恒,刘恒霞,等.碳氮源对枯草芽孢杆菌发酵产甘露聚糖酶的影响[J].食品与发酵工业,2015,41(10):34-399.
[20]唐嘉婕,郭苏,王伟,等.短小芽孢杆菌耐碱性β-甘露聚糖酶基因的异源表达及其酶学特性[J].微生物学报,2015,55(11):1445-1457.
[21]吴华伟,蔚鑫鑫,陈雪秋.产甘露聚糖酶细菌的分离鉴定、酶的部分纯化及酶学性质研究[J].湖北农业科学,2014,53(15):3601-3605.
[22]李云程,林娟,梁燕辉,等.产甘露聚糖酶海洋微生物的筛选及酶学性质研究[J].中国食品学报,2015,15(12):66-73.
Screening of a Thermophilic Mannanase Producing Bacterium and Studies on the Enzymatic Properties of Mannanase
WANG Ruijun1,2,3,CHENG Lifeng2,FENG Xiangyuan2,DUAN Shengwen2,ZHENG Ke2,LIU Zhiyuan2,ZENG Jie2,LIU Zhengchu1,2*
(1.College of Plant Protection,Hunan Agricultural University,Changsha 410128,China;2.Institute of Bast Fiber Crops,Chinese Academy of Agricultural Sciences,Changsha 410205,China;3.College of Chemistry and Bioengineering,Yichun University,Yichun,Jiangxi336000,China)
A mannanase producing bacterial strain named Mas1 was newly isolated from a hot spring in Jiangxi Province.Mas1 was identified as B.licheniformis by 16SrRNA gene sequence analysis,morphological detection,physiological and biochemical identification.The effectof temperature,pH andmetal ions on the activity and stability of crudemannanases from B.licheniformis Mas1 was studied.The results showed that the optimal temperature and pH for themannanase activity was 60℃and 5.0 respectively;Co2+and Al3+were themosteffective inhibitor of the enzyme activity,while Mn2+,K+and Ca2+could promote the activity of the enzyme,and other ions had no significant effect on the enzyme activity.This strain could be used for the production ofmannan-degrading enzymes,and has great potential for applications in textile,food,feed and other fields.
thermophilic mannanase;Bacillus licheniformis;screening;enzymatic properties
Q556
A
1671-3532(2017)05-0234-07
2017-07-20
中国农业科学院创新工程(ASTIP-IBFC08);湖南省自然科学基金(2016 jj3126);国家现代农业产业技术体系建设专项项目(CARS-19-E24)
王瑞君(1970-),女,副教授,主要从事农产品加工微生物研究。E-mail:wruijun@163.com
*通讯作者:刘正初(1956-),男,研究员,主要从事农产品加工微生物研究。E-mail:ibfclzc@189.cn

