破壁方式对蜂花粉抑制α-葡萄糖苷酶活性的影响
刘文静 张志旭 秦 丹
(1. 湖南农业大学食品科技学院,湖南 长沙 410128;2. 国家中医药管理局亚健康干预技术实验室,湖南 长沙 410128;3. 湖南农业大学食品科技学院,湖南 长沙 410128)
破壁方式对蜂花粉抑制α-葡萄糖苷酶活性的影响
刘文静1张志旭2秦 丹3
(1. 湖南农业大学食品科技学院,湖南 长沙 410128;2. 国家中医药管理局亚健康干预技术实验室,湖南 长沙 410128;3. 湖南农业大学食品科技学院,湖南 长沙 410128)
以不同破壁方式处理过的油菜蜂花粉为研究对象,提取水溶活性成分,以4-硝基苯-α-D-吡喃葡萄糖苷(PNPG)作为底物,对蜂花粉作为天然α-葡萄糖苷酶活性抑制剂的功效进行了评价。结果表明:破壁方式对蜂花粉功能活性成分以及功效评价结果影响显著,温差破壁、超临界二氧化碳破壁、超声辅助酶解破壁及对照组对α-葡萄糖苷酶的抑制率分别为(13.73±1.15)%,(-8.07±0.93)%,(16.70±0.87)%,(9.68±0.89)%;油菜蜂花粉多糖对α-葡萄糖苷酶的抑制率在(3.46±0.31)%~(-0.78±0.03)%,无明显线性关系;破壁后的样品多糖含量显著增加,但油菜蜂花粉多糖对α-葡萄糖苷酶活性无作用,可能与黄酮等其它成分相关。
蜂花粉;α-葡萄糖苷酶;破壁方式;降血糖;多糖
Abstract: The wall of rape bee pollens were broken by using different methods, and them the water-soluble ingredients were extracted. Therefore, the 4-Nitrophenylα-D-glucopyranoside (PNPG) was as substrate to evaluate the efficiency of bee pollen as a natural alpha glucosidase inhibitor. The results showed that the wall-breaking manners had significant effect on the active ingredient. The inhibition rate of thealphaglucosidase was found ordered as following, temperature difference (13.73±1.15)%, supercritical CO2(-8.07±0.93)%, ultrasonic assisted enzymatic (16.70±0.87)%,and untreated (9.68±0.89)%. Moreover, the inhibition rate of rape pollen polysaccharide on alpha glucosidase activity was fluctuated at (2.46±0.31)%~(-0.78±0.03)%, and there was no obvious linear relationship. Finally, after the walls were broken, the content of polysaccharides increased significantly, but rape pollen polysaccharide had no effect on alpha glucosidase activity. This might be related to flavonoids or other components.
Keywords: rapebee pollen; alpha glucosidase; wall-breaking manner; decrease blood glucose; polysaccharide
糖尿病是一种常见的内分泌系统疾病,现已在世界范围内严重威胁到人们的生命健康[1]。空腹血糖或餐后血糖维持在较高的水平是糖尿病前期的主要症状,也是导致糖尿病并发症的重要因素。目前主要使用α-葡萄糖苷酶抑制剂类药物作为降低餐后血糖、治疗糖尿病的一线药物[2-4],主要包括:拜糖平(阿卡波糖)和米格列醇等。但这些药物具有一定的副作用,会造成肠道系统紊乱等免疫疾病[5]。α-葡萄糖苷酶是一类能够催化水解α-葡萄糖基的酶的总称,分布广泛,在人体内可将饮食中的碳水化合物水解为单糖供人体吸收,是引起餐后血糖增加的重要酶类。因此,随着糖尿病患者和潜在患者在全球范围内急剧增加,直接从日常饮食中寻找天然高效的α-葡萄糖苷酶抑制剂成为研究热点。
蜂花粉是一种兼具食用与药用价值的食品,富含营养物质同时又有多种生理活性功能如增强免疫力、抗氧化、抗辐射、降血脂等[6-7]。近年来也有研究[8-9]报道了蜂花粉提取物具有降血糖的功效。蜂花粉细胞壁坚硬,壁上存在萌发孔,可与外界联通,但通常为闭锁状态,使得花粉细胞内溶物难以溶出[10]。因此体外对蜂花粉进行功效评价,必须进行破壁处理,以释放花粉的活性成分。破壁前后花粉品质以及功能活性物质会有所改变,这与破壁的方式存在很大的关联性[11]。使用不同破壁方式处理的蜂花粉进行α-葡萄糖苷酶活性抑制试验,据此可以推测产生抑制作用的主要成分。目前关于破壁方式影响蜂花粉降血糖功效方面的研究还未见报道。对于蜂花粉功能活性的研究当前以醇提物为主,对水溶活性成分的报道比较少见。油菜蜂花粉在中国产量大,资源丰富,本试验拟以不同破壁方式处理的油菜蜂花粉水溶活性成分为研究对象进行抑制α-葡萄糖苷酶的试验,以期对花粉中抑制α-葡萄糖苷酶的主要成分进行筛选和评价,为开发出新的蜂花粉产品提供理论依据。
1 材料与方法
1.1 材料与试剂
蜂花粉:油菜蜂花粉,市售;
芦丁标准品:≥98%,国药化学试剂有限公司;
α-葡萄糖苷酶(α-glucosidase):≥10 U/mg,美国Sigma公司;
4-硝基苯-α-D-喃葡萄糖苷(PNPG):≥99%,美国Sigma公司;
葡萄糖标准品、磷酸二氢钠、磷酸氧二钠、三氯乙酸、无水乙醇、3,5-二硝基水杨酸、无水碳酸钠等:分析纯,国药化学试剂有限公司;
纤维素酶:≥1 500 U/g,国药化学试剂有限公司;
果胶酶:≥50 U/g,国药化学试剂有限公司;
阿卡波糖:上海源叶生物技术有限公司。
1.2 仪器与设备
紫外可见光分光光度计:UV-1800型,日本岛津公司;
高速离心机:2-16R型,湖南恒诺仪器设备有限公司;
冷冻干燥机:Lab-1B-50E型,北京博医康实验仪器有限公司;
超声清洗仪:KQ-5200B型,昆山美美超声仪器有限公司;
酶标仪:Multiskan FC型,美国Thermo Fisher公司;
扫描电镜:JSM-6380LV型,日本JEOL公司。
1.3 方法
1.3.1 花粉破壁方式
(1) 温差破壁:参照文献[12]。
(2) 超临界二氧化碳破壁:参照文献[13]。
(3) 超声辅助酶解破壁:参照文献[14~15]略做改进,取去杂研磨均匀的花粉10 g加入纤维素酶0.2 g,果胶酶0.8 g,40 ℃震荡酶解3 h,超声3 h。
(4) 未破壁花粉:研磨均匀后溶于水。
各破壁方法保证花粉的料液比为1∶8 (g/mL),抽滤,离心(7 000 r/min,10 min)取上清液备用,残渣冷冻干燥后镜检。
1.3.2 花粉黄酮、多糖、还原糖含量的测定 以葡萄糖为标样,用3,5-二硝基水杨酸法测定总糖和还原糖的含量两者之差即为多糖含量[16];以芦丁为标样,采用亚硝酸钠-硝酸铝比色法测定总黄酮含量[17]。
1.3.3 粗多糖的提取 参照文献[18~19]的方法略做改进。将破壁花粉以1∶8 (g/mL)的比例溶于热水,95 ℃蒸馏水回流提取1 h,提取过程中加入3%的三氯乙酸去蛋白,提取液减压浓缩至原体积的1/2,加3倍体积无水乙醇沉淀12 h;取沉淀用蒸馏水溶解,离心(7 000 r/min,10 min)取上清液,再次加入3倍体积无水乙醇沉淀12 h,收集沉淀,冷冻干燥即得粗多糖。
1.3.4 蜂花粉水提物对底物(PNPG)的作用 分别在96孔板中加入不同破壁方式处理的花粉水提物10 μL按照1.3.5(1) 的方式测定吸光值。试验组:用缓冲溶液代替α-葡萄糖苷酶溶液;对照组:用缓冲溶液代替α-葡萄糖苷酶溶液和PNPG溶液。
1.3.5 酶反应条件的筛选
(1) 酶反应浓度的筛选:于96孔板中加入不同质量浓度的α-葡萄糖苷酶溶液(0.000,0.893,1.786,3.571,5.357,7.143,8.929 μg/mL)140 μL,37 ℃孵育10 min,加入2.5 mmol/L 的PNPG 30 μL反应一定时间,加入0.2 mol/L Na2CO380 μL终止反应,于405 nm处测吸光值[5]。
(2) 酶反应时间的筛选:取一定质量浓度的α-葡萄糖苷酶溶液,37 ℃孵育10 min,加入2.5 mmol/L的PNPG 30 μL 反应不同时间(0,10,15,20,25,30 min)后,加入0.2 mol/L Na2CO380 μL终止反应,于405 nm处测吸光值。
(3) 最优条件下试验样品对酶的抑制作用:分别在96孔板中加入10 μL不同质量浓度的葡萄糖溶液(0,10,20,30,40,50,60 mg/mL)、不同破壁方式处理的花粉水提物10 μL、不同质量浓度的花粉多糖溶液(0.0,0.5,1.0,1.5,2.0,2.5,3.0 mg/mL)按照1.3.5(1)的方式测定吸光值,对照组加10 μL缓冲溶液代替抑制剂,以3 mg/mL的阿卡波糖为阳性对照,试验温度37 ℃。每组平行试验3次。按式(1)计算抑制率[5]。

(1)
式中:
c——抑制率,%;
A1、A2——分别为对照样的试验组与空白组的吸光值;
A3、A4——分别为样品的试验组与空白组。
2 结果与分析
2.1 蜂花粉破壁率及主要抑酶成分含量变化
黄酮类化合物与多糖类物质是蜂花粉水溶性物质中的主要功能成分,并且结构相对稳定,近年来成为天然产物中的研究热点。大量研究[20-23]表明,天然产物中的黄酮类和多糖类物质具有降血糖的作用。本试验以总黄酮和多糖的溶出率为指标结合破壁率,评价不同的花粉破壁方式,结果见表1。
由表1可知,各种破壁方式处理过的油菜蜂花粉破壁率及萌发孔打开率均明显提高,证明破壁有效,破壁后的样品多糖含量显著增加,但总黄酮含量有增有减。相比于较温和的温差与超声辅助酶法破壁方式,超临界二氧化碳处理的花粉破壁率最高,但其总黄酮含量反而比未破壁的样品低,说明在超临界二氧化碳激烈的破壁的过程中造成了某些成分的损失或改变,孙丽萍等[13]的研究也有相似的结论。
2.2 蜂花粉水提物对底物(PNPG)的作用
蜂花粉中本身含有多种酶类物质,如α-淀粉酶等[24],可能会对试验结果产生影响。图1显示各处理方式得到的样品试验组和对照组之间无显著性差异,说明花粉水提物本身并不会对底物产生影响进而影响到试验结果。
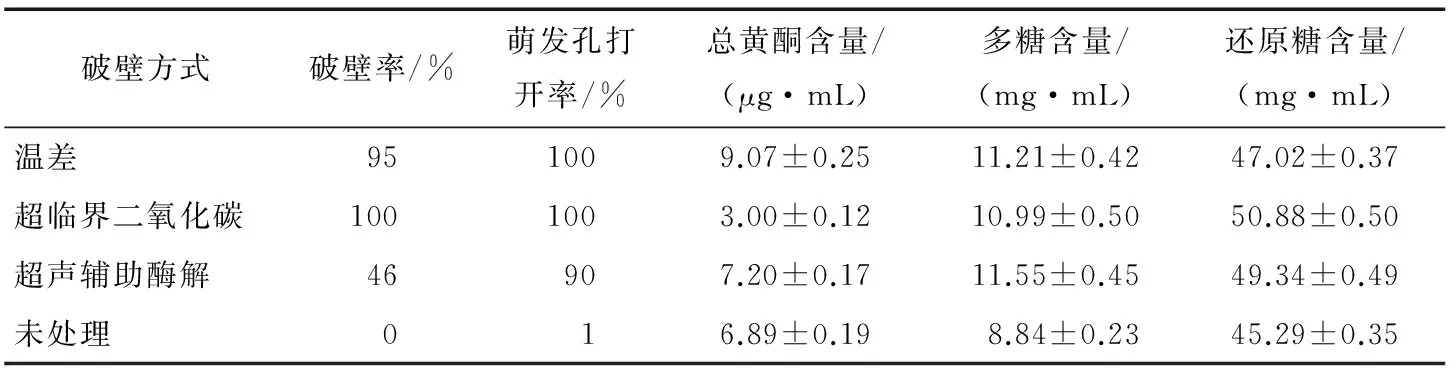
表1 样品破壁率、黄酮、多糖以及还原糖含量

图1 样品对底物的作用
2.3 酶反应条件的筛选
通过对酶浓度和时间的筛选,确定最佳反应条件为:酶质量浓度1.786 μg/mL,反应时间15 min。
2.4 蜂花粉水提物对a-葡萄糖苷酶的抑制作用
图2的结果显示不同破壁方式处理样品对α-葡萄糖苷酶的抑制率之间存在显著性差异。超临界二氧化碳流体处理的样品减去还原糖后的抑制率出现负值(-8.07±0.93)%,另外3种样品都为正值。温差(13.73±1.15)%和超声辅助酶法(16.70±0.87)%处理的样品抑制率高于未处理样品(9.68±0.89)%,说明花粉破壁后有助于抑酶因子的溶出。4种样品的总抑制率均低于阳性对照的。这主要是因为蜂花粉水溶液中含有较多葡萄糖,对葡萄糖苷酶有抑制作用(图3)而使结果出现假阳性,因此采用较低的试验浓度消除葡萄糖的影响,阿卡波糖选择3 mg/mL的浓度是为了与后面的多糖试验浓度一致。蜂花粉成分复杂,富含多种生物活性物质[25],试验结果表明其中含有天然α-葡萄糖苷酶抑制成分,对比表1与图2可知,样品对α-葡萄糖苷酶的抑制效果与其中总黄酮含量呈正相关关系,可以推测蜂花粉中黄酮类化合物为α-葡萄糖苷酶抑制剂。

图2 不同破壁方式处理的样品的抑制率
超临界二氧化碳流体处理的样品对α-葡萄糖苷酶活性表现出促进作用,可能是处理过程中瞬间释放高压使原本溶于二氧化碳流体中的功能活性成分随之释放到大气中[26],导致抑酶因子的损失或失活,使得总体上出现负值。基于目前油菜蜂花粉主要是作为一种食物,因此无论是在研究还是加工食用过程中都应尽量使用相对温和的破壁方式。
α-葡萄糖苷酶作用于α-1,4糖苷键,水解多糖为单糖,蜂花粉水提物中含有大量的单糖类物质会对该酶起到负反馈抑制,出现假阳性的结果。由图3可知,葡萄糖浓度与抑制率近似呈直线关系,由此可推算不同浓度的还原糖对α-葡萄糖苷酶的抑制作用已排除干扰。

图3 葡萄糖抑制率
2.5 粗多糖对α-葡萄糖苷酶的抑制作用
蜂花粉破壁后多糖含量显著增加,可能是使其对α-葡萄糖苷酶抑制率上升的原因。花粉中黄酮类化合物已有前人作了系统的研究,但多糖类对α-葡萄糖苷酶活性作用的研究却罕有报道[8]。蜂花粉多糖功能多样且安全,备受人们喜爱并成为研究热点,现已被应用于医药、保健、化妆品等行业[27]。有研究[28]表明蜂花粉多糖类可以降低糖尿病小鼠的血糖值。因此,本试验提取水溶性粗多糖进行α-葡萄糖苷酶抑制试验,由图4可知,油菜蜂花粉多糖对α-葡萄糖苷酶活性的抑制率极低,在(3.46±0.31)%~(-0.78±0.03)%间波动,且随着多糖质量浓度的增加,并没有出现明显的规律,说明油菜蜂花粉粗多糖对α-葡萄糖苷酶活性没有显著影响。

图4 多糖对α-葡萄糖苷酶的抑制作用
3 结论
本试验以油菜蜂花粉为研究对象,探索了蜂花粉水溶性成分对α-葡萄糖苷酶的作用,以及不同破壁方式对该作用的影响。试验证明:经过分离提取的蜂花粉水溶性多糖对α-葡萄糖苷酶活性无影响,该结果对蜂花粉降糖机理进行了理论补充,为后来的研究者提供了借鉴;蜂花粉水提物对α-葡萄糖苷酶活性的抑制率与黄酮含量呈正相关关系,破壁方式对其有显著性影响;该结果证实了孙岩等[8-9]的结论,提示在生产和应用过程中应选择合适的破壁方式处理蜂花粉。需要指出的是在相同抑制率的情况下,本试验中实际加入的总黄酮含量远低于孙岩等[8]的加入量,提示蜂花粉中可能还含有别的对α-葡萄糖苷酶有抑制作用的物质有待研究与开发。
[1] 刘杨, 刘仲华. 苦菜降血糖作用及机理研究进展[J]. 食品研究与开发, 2014, 35(22): 132-134.
[2] MORITOH Y, TAKEUCHI K, HAZAMA M. Voglibose, an alpha-glucosidase inhibitor, to increase active glucagon-like peptide-1 levels[J]. Molecular & Cellular Pharmacology, 2009, 1(4): 188-192.
[3] PATEL S S. Cerebrovascular complications of diabetes: Alpha glucosidase inhibitor as potential therapy[J]. Hormone & Metabolic Research, 2016, 48(2): 83-91.
[4] ZHAO Jian-qiang, WANG Yan-ming, YANG Yan-long, et al. Antioxidants andα-glucosidase inhibitors from “Liucha” (young leaves and shoots of Sibiraealaevigata )[J]. Food Chemistry, 2017, 230: 117-124.
[5] 费群勤, 秦一禾, 杨孟伽, 等. 乌龙茶粗多酚、EGCG和EGCE3”Me体外抑制α-葡萄糖苷酶活性[J]. 食品科学, 2014, 35(21): 10-15.
[6] SUN Li-ping, GUO Yan, ZHUANG Yan-xin, et al.Antioxidant and anti-tyrosinase activities of phenolic extracts from rape bee pollen and inhibitory melanogenesis by cAMP/MITF/TYR pathway in B16 mouse melanoma cells[J].Frontiers in Pharma-cology, 2017, 8(104): 1-9.
[7] ZHANG Ya-wei, YANG Feng-tian, JAMALI M A, et al. Antioxidant enzyme activities and lipid oxidation in rape (Brassica campestris L) bee pollen added to salami during processing[J]. Molecules, 2016, 21(11): 1 439-1 447.
[8] 孙岩, 郭庆兴, 童群义. 油菜蜂花粉黄酮体外降糖活性研究[J]. 食品工业科技, 2015, 36(12): 122-126.
[9] 赖小燕, 姜泽东, 倪辉, 等. 茶花粉黄酮对α-葡萄糖苷酶抑制作用的研究[J]. 食品工业科技, 2016, 37(5): 353-357.
[10] 王凯, 任向楠, 董捷, 等. 多指标评价果胶酶对油菜蜂花粉的破壁作用[J]. 食品与机械, 2015, 31(6): 164-168.
[11] 连文绮, 薛霖莉, 郑晓楠. 油菜蜂花粉破壁前后的品质分析[J]. 山西农业科学, 2016, 44(10): 1 464-1 466.
[12] 胡筱波, 徐明刚, 吴谋成, 等. 温差破壁法对油菜蜂花粉中主要营养素含量的影响[J]. 食品科学, 2005, 26(10): 120-124.
[13] 孙丽萍, 徐响. 超临界二氧化碳处理对油菜蜂花粉破壁的影响[J]. 食品科学, 2008, 29(6): 56-58.
[14] 任向楠. 超声波辅助酶法破壁油菜花粉的研究[D]. 北京: 中国农业科学院, 2010: 11-18.
[15] 董亚婷, 杨远帆, 倪辉, 等. 茶花粉酶法破壁工艺提高提取物抗氧化活性及多酚含量[J]. 农业工程学报, 2013, 29(21): 288-294.
[16] 杨博文, 王晓晓, 李曦, 等. 5种当归类药材多糖量的比较[J]. 中草药, 2016, 47(21): 3 896-3 900.
[17] 喻玲玲, 杨静毅, 吴梅, 等. 银合欢种皮总黄酮含量测定及抗氧化活性研究[J]. 食品科学, 2015, 36(8): 187-190.
[18] 魏淑飞. 云南产油菜蜂花粉多糖的分离提取及其生物活性的研究[D]. 大理: 大理学院, 2015: 14-21.
[19] 董吉林, 申瑞玲. 油菜蜂花粉多糖和黄酮的提取研究[J]. 现代食品科技, 2008, 24(10): 1 022-1 025.
[20] SUGAYA K, IGARASHI M, KOJIMA Y, et al. Evaluation of the effect of flavangenol on serum lipid peroxide levels and development of atherosclerosis in spontaneously hyperlipidemia B6KOR-Apoeshl mice[J]. International Journal of Molecular Medicine, 2011, 27(1): 33-38 .
[21] MULVIHILL E E, HUFF M W. Antiatherogenic properties of flavonoids: implications for cardiovascular health[J]. Canadian Journal of Cardiology, 2010, 26(Suppl. A): 17A-21A.
[22] 尹红力, 赵鑫, 佟丽丽, 等. 黑木耳多糖体外和体内降血糖功能[J]. 食品科学, 2015, 36(21): 221-226.
[23] WANG Yun-ting, LIN Ding-bo, LI Guang-huai, et al. The impact of a novel peach gum-derived polysaccharide on postprandial blood glucose control in streptozotocin-induced diabetic mice[J]. International Journal of Biological Macromolecules, 2017(98): 379-386.
[24] 张红城, 程蒙, 董捷, 等. 六种蜂花粉中酶活性的研究[J]. 食品科学, 2009, 30(21): 229-233.
[25] LEE I K, HWANG B S, KIM D W, et al. Characterization of neuraminidase inhibitors in koreanpapaverrhoeas bee pollen contributing to anti-influenza activities in vitro[J]. Planta Medica, 2016, 82(6): 524-529.
[26] 薛艳华, 史权, 庞海河,等. 灵芝孢子几种破壁方法比较分析[J]. 植物研究, 2005, 25(2): 216-218.
[27] 李敏. 油菜花粉多糖的分离、纯化、结构鉴定及抗氧化活性的研究[D]. 南昌: 南昌大学, 2007: 1-2.
[28] 林春榕, 张翠香, 左绍远. 荞麦蜂花粉多糖对糖尿病大鼠血糖、血脂的影响[J]. 亚太传统医药, 2013, 9(3): 7-9.
Effects of wall breaking manners on the inhibition of alpha glucosidase activity in bee pollen
LIU Wen-jing1ZHANGZhi-xu2QINDan3
(1.CollegeofFoodScienceandTechnology,HunanAgriculturalUniversity,Changsha,Hunan410128,China;2.StateKeyLaboratoryofSubhealthInterventionTechnology,Changsha,Hunan410128,China; 3.CollegeofFoodScienceandTechnology,HunanAgriculturalUniversity,Changsha,Hunan410128,China)
10.13652/j.issn.1003-5788.2017.08.035
科技部国际科技合作专项(编号:2013DFA31790)
刘文静,女,湖南农业大学在读硕士研究生。
张志旭(1972—),男,湖南农业大学讲师,博士。 E-mail: 532000632@qq.com
2017—05—19

