阿魏酸与咖啡酸对丙烯酰胺形成及消减的影响
吴豪杰 于 淼 黄才欢 欧仕益
(暨南大学食品科学与工程系,广东 广州 510632)
阿魏酸与咖啡酸对丙烯酰胺形成及消减的影响
吴豪杰 于 淼 黄才欢 欧仕益
(暨南大学食品科学与工程系,广东 广州 510632)
探讨阿魏酸与咖啡酸在美拉德模拟体系中对丙烯酰胺形成和消减的影响。结果表明:在天冬酰胺/葡萄糖模拟反应体系中,阿魏酸与咖啡酸的添加量为250 mmol/L和25 mmol/L时可抑制丙烯酰胺的形成,而二者浓度低于2.5 mmol/L时则促进丙烯酰胺的形成。将阿魏酸与咖啡酸分别与丙烯酰胺单独高温处理,发现2种酚酸对丙烯酰胺都具有消减效果,但效果不明显,因此判定阿魏酸与咖啡酸对美拉德模拟体系中丙烯酰胺含量的影响主要作用于丙烯酰胺的形成阶段。另外,酸性条件下,醌型酚酸比酚型酚酸对丙烯酰胺的消减作用更大,而在中性条件下,酚型酚酸的消减作用更强。
丙烯酰胺;阿魏酸;咖啡酸;消减;形成
Abstract: In this study, caffeic and ferulic acids were used to test the effect on acrylamide formation and elimination in model reaction systems. In asparagine/glucose reaction system, addition of caffeic and ferulic acid at the concentration of 25 mmol/L and 250 mmol/L inhibited acrylamide formation. However, they increased acrylamide formation below 2.5 mmol/L. It was found that both of phenolic acids increased acrylamide elimination when ferulic acid or caffeic acid were heated with acrylamide, but the effect is not obvious, so effect of caffeic acid and ferulic acid influenced on acrylamide content in Maillard reaction system mainly influence on acrylamide formation stage. Otherwise, The acrylamide elimination of quinone type of phenolic acid is higher than phenol type in the acidic condition while phenol type is higher in neutrallty condition.
Keywords: acrylamide; ferulic acid; caffeic acid; elimination; formation
丙烯酰胺是一种具有致癌性与潜在生殖毒性的神经毒素[1-3],国际癌症机构把它列为“人类可能致癌物”[4]。热加工食品中的丙烯酰胺主要由天冬酰胺和羰基类化合物通过美拉德反应产生,也可通过丙烯醛途径产生,即丙烯醛被氧化为丙烯酸后,再与氨反应生成丙烯酰胺[5-6],在咖啡制品、谷物制品、高温土豆制品中含量较高。
食物中含有丰富的咖啡酸与阿魏酸,它们作为天然多酚,具有抗病毒、抗菌、抗氧化、抗肿瘤、抗血小板凝集、抑制突变、缩短出血和血凝时间等多种重要的生理功能[7-10],对人类健康有一定的保健功能[11-13]。
天然抗氧化剂如酚酸类物质对丙烯酰胺的形成表现出促进和抑制的双重作用。张英等[14]研究表明:竹叶提取物(主要是竹叶黄酮)和绿茶提取物(EGT)在天冬酰胺/葡萄糖模拟反应体系中可使丙烯酰胺的生成量分别降低了74.4%和74.3%;欧仕益等[15]向模拟体系中添加天然抗氧化剂提取物(主要是苹果、蓝莓、火龙果等)时,发现火龙果提取物不仅没有抑制丙烯酰胺形成,反而起促进作用。目前关于咖啡酸与阿魏酸在高温下对丙烯酰胺形成与消减作用的报道不多。本研究将阿魏酸与咖啡酸分别加入到天冬酰胺/葡萄糖体系中加热,探讨2种酚酸对丙烯酰胺形成与消减的影响,旨在为富含酚酸类的食品调控丙烯酰胺的含量提供新的思路。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
丙烯酰胺:99%,天津市化学试剂研究所;
咖啡酸:99%,百灵威科技有限公司;
阿魏酸:99%,广州齐云生物技术有限公司;
过氧化钙:分析纯,阿拉丁试剂公司;
磷酸氢二钠、磷酸二氢钠:分析纯,天津市化学试剂厂;
二甲基硅油:H201-500型,国药集团化学试剂有限公司;
甲醇:色谱纯,美国J.T Baker公司;
冰醋酸、乙腈:色谱纯,天津科密欧化学试剂有限公司。
1.1.2 仪器与设备
电子分析天平:HR-200型,日本A&D公司;
集热式磁力加热搅拌器:DF-II型,江苏省金坛市神科仪器厂;
HPLC分析系统:SHIMADZMLC-20AT型,日本岛津仪器公司;
质谱联用仪:SHIMADZU LCMS-8045型,日本岛津仪器公司。
1.2 试验方法
1.2.1 丙烯酰胺在美拉德模拟体系中的形成与消减 按表1将各反应物添加到不锈钢试管中,研究各体系中丙烯酰胺的形成与消减情况,其中丙烯酰胺溶液浓度为200 μg/mL。将不锈钢试管放入160 ℃二甲基硅油中加热30 min后,冰水浴中快速冷却至室温。生成物转移到100 mL容量瓶,蒸馏水定容后,用高效液相色谱测定丙烯酰胺的含量。
1.2.2 美拉德反应体系中2种酚酸对丙烯酰胺形成与消减的影响
(1) 酚酸的添加量对丙烯酰胺形成的影响:在Asn/Glc模拟体系中,将132.1 mg天冬酰胺和1 mL 葡萄糖溶液(浓度为1 mol/L)添加到不锈钢试管中,然后将1 mL 不同浓度的2种酚酸(浓度为0.1,1,10,100,1 000 mmol/L)分别添加到模拟体系中混合,用蒸馏水定容至4 mL;以不添加酚酸的样品作为对照。反应30 min后,测各样品中丙烯酰胺的含量。反应条件同1.2.1。
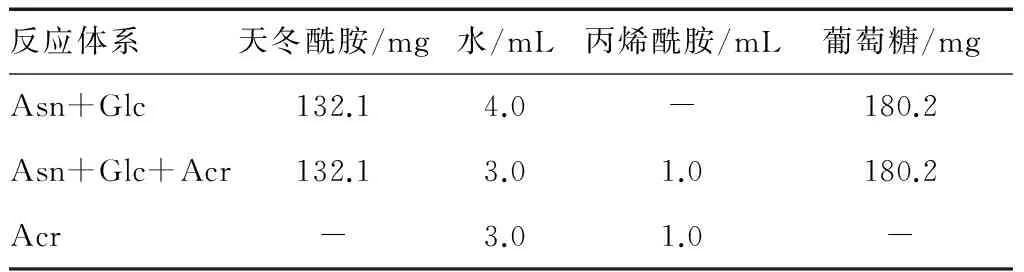
表1 丙烯酰胺形成与消减反应体系†
† Glc、Asn、Acr分别代表葡萄糖、天冬酰胺、丙烯酰胺。
(2) 模拟体系中2种酚酸对丙烯酰胺形成与消减的影响:根据1.2.2(1)中的结果选用2个适宜的酚酸(阿魏酸与咖啡酸)添加量,按表2构建不同的反应体系,研究了阿魏酸、咖啡酸在美拉德反应中对丙烯酰胺形成与消减的影响。其中丙烯酰胺标准溶液为200 μg/mL。反应条件同1.2.1。

表2 酚酸对丙烯酰胺形成与消减反应体系†
† Glc、Asn、PA、Acr分别代表葡萄糖、天冬酰胺、两种酚酸(包括咖啡酸与阿魏酸)及丙烯酰胺。
(3) 不同浓度的2种酚酸对丙烯酰胺消减的影响:设置10 mmol/L的丙烯酰胺水溶液体系,分别添加适量的阿魏酸或咖啡酸,使酚酸的最终浓度分别为1,5,10,25,100,250 mmol/L,以不添加酚酸的样品作为对照。反应条件同1.2.1。
1.2.3 不同形态的2种酚酸对丙烯酰胺的消减作用
(1) 酚型阿魏酸和咖啡酸对丙烯酰胺的消减作用:分别将1 mL的阿魏酸和咖啡酸(浓度均为200 mmol/L)与0.5 mL 丙烯酰胺溶液(浓度为40 mmol/L)添加到不锈钢试管中,用蒸馏水定容至2 mL。以10 mmol/L丙烯酰胺溶液为空白样品,反应条件同1.2.1。
(2) 醌型阿魏酸和咖啡酸对丙烯酰胺的消减作用:分别将1 mL的阿魏酸和咖啡酸(浓度均为200 mmol/L)与0.5 mL 丙烯酰胺溶液(浓度为40 mmol/L)添加到不锈钢试管中,用蒸馏水定容至2 mL。在玻璃小管中放置0.56 g 过氧化钙,管口用少量的脱脂棉轻轻塞住,把玻璃小管放置于不锈钢试管中,将管盖旋紧。向不锈钢试管中加入同样放置0.56 g过氧化钙的玻璃小管作为空白样品,其中空白样品为0.5 mL丙烯酰胺溶液(浓度为40 mmol/L)和1.5 mL蒸馏水混合液。反应条件同1.2.1。
1.2.4 pH对反应体系中丙烯酰胺消减的影响 用磷酸缓冲溶液(浓度为0.2 mol/L)配置丙烯酰胺溶液(浓度为8.00 mg/L)与2种酚酸溶液(咖啡酸溶液浓度为3.05 g/L,阿魏酸溶液浓度为3.29 g/L)。
分别将1 mL的阿魏酸和咖啡酸与1 mL的丙烯酰胺溶液添加到不锈钢试管中,然后加入2 mL的磷酸缓冲溶液。空白样品为1 mL丙烯酰胺溶液和3 mL磷酸缓冲溶液的混合液。反应条件同1.2.1。
1.3 丙烯酰胺的检测
色谱柱:Ultimate AQ-C18,4.6 mm×250 mm,5 μm;流动相:A为甲醇,B为0.1%冰醋酸水溶液,洗脱条件为:0~10 min,5% A;10.01~15.00 min,5%~80% A;15.1~17.0 min,80%~5% A;17.1~25.0 min,5% A,流速0.6 mL/min;进样量5 μL;柱温40 ℃;检测波长为205 nm。
1.4 数据处理
对每种处理进行3次平行试验,用SPSS 17.0对试验结果进行数据处理。
2 结果与分析
2.1 丙烯酰胺在模拟体系中的形成与消减
由图1可知, 美拉德体系中,葡萄糖和天冬酰胺在反应后生成的丙烯酰胺为141.52 μg,分析这是丙烯酰胺自身生成与降解的综合结果[16-17]。 添加200 μg丙烯酰胺的标准品后,最终丙烯酰胺的量为301.23 μg,比未添加样品只增加了160 μg。 由此可见,生成后的丙烯酰胺可大量降解,且降解率可达20%。这可能是体系中同时生成的类黑素与丙烯酰胺反应所致[18]。此外,类黑素还可作用于丙烯酰胺的前体物质,从而抑制体系中丙烯酰胺的生成。试验所测得的丙烯酰胺含量是其在体系中生成与消减的综合结果,体系中的其它物质可与生成的丙烯酰胺相互作用,从而使丙烯酰胺的含量大大减少[19-20]。
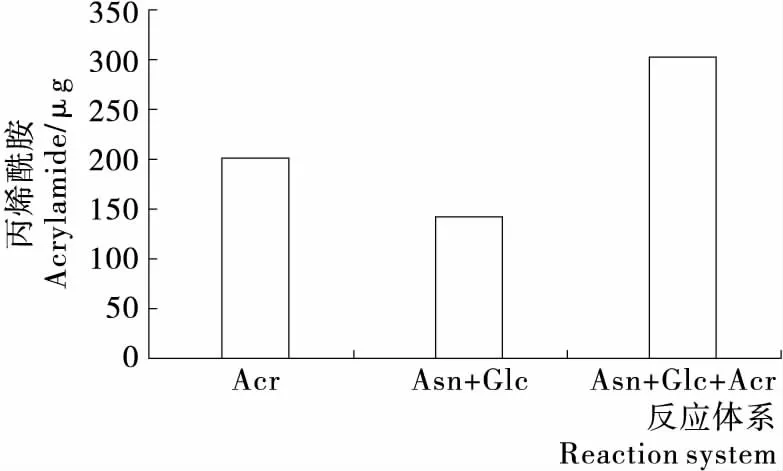
图1 美拉德体系中丙烯酰胺的生成与消减
2.2 美拉德反应体系中2种酚酸对丙烯酰胺形成与消减的影响
2.2.1 酚酸添加量对丙烯酰胺的作用 由图2可知,在模拟体系中,不同添加量的阿魏酸和咖啡酸对丙烯酰胺的作用效果截然相反。在较高的添加量(0.1,1 mmol)下,酚酸对丙烯酰胺的形成表现为抑制作用,当添加量为1 mmol时,其抑制率分别为58.14%(咖啡酸)和59.64%(阿魏酸);而添加量≥0.01 mmol 时,2种酚酸对丙烯酰胺的形成均表现为促进作用;当酚酸添加量为0.001 mmol 时所生成的丙烯酰胺量最大,分别为194.12 μg(咖啡酸)和 199.41 μg(阿魏酸),其促进率分别为15.79% (咖啡酸)和18.94%(阿魏酸)。同时,样品的颜色变化也随添加量的改变而出现明显差异,在较高浓度下,样品颜色随着添加量的增高而变浅;在而低添加量下样品颜色变化不大。
2.2.2 美拉德反应体系中2种酚酸对丙烯酰胺形成与消减的影响 根据1.2.2(1)中的结果,分别选取0.01 mmol和0.1 mmol的2个酚酸添加量,进一步考察咖啡酸与阿魏酸对丙烯酰胺形成与消减的影响。由表3可知:酚酸添加量为0.1 mmol时,咖啡酸和阿魏酸对丙烯酰胺的消减率分别为42.58%和36.14%;而当酚酸添加量为0.01 mmol时,体系中丙烯酰胺的量均有所增加,表现为促进丙烯酰胺的形成。另外,加入丙烯酰胺标准品后对丙烯酰胺的形成与消减影响不大。

图2 咖啡酸与阿魏酸添加量对美拉德模拟体系中丙烯酰胺的消减影响
Figure 2 Addition amounts of caffeic acid and ferulic acid on the effect of acrylamide in Maillard model reaction system
2.2.3 不同浓度的2种酚酸单一添加时对丙烯酰胺消减的影响 在丙烯酰胺水溶液体系中,设置了5个浓度的酚酸,分别添加于样液中,探讨不同浓度下2种酚酸各自对丙烯酰消减的影响。由图3可知:随着2种酚酸浓度的增加,体系中丙烯酰胺含量有所减少,但变化均不明显,只有阿魏酸在高浓度下(250 mmol/L)对丙烯酰胺有明显的消减作用,且消减率为15.50%。结合2.2.1及2.2.2的结果,可以推测酚酸影响体系中丙烯酰胺的含量主要发生在丙烯酰胺的形成阶段。
2.3 酚型和醌型的咖啡酸与阿魏酸对丙烯酰胺的消减作用
酚酸在有氧的环境下可被氧化为醌型[21-22]。加热时水蒸气与玻璃小管中的过氧化钙反应后会产生氧气[23-24]。在不锈钢试管内加入含过氧化钙的玻璃试管后,体系中的氧气可由原来的8 mg增加到120 mg(不锈钢管深为128.8 mm,内径为8.0 mm,按空气中氧气比例为21%算),可将体系中酚酸氧化为醌型。由图4可知,加入过氧化钙后的体系与未加入相比,对丙烯酰胺消减的能力更强,但咖啡酸与阿魏酸的消减效果差别不大;而未加入过氧化钙的体系中阿魏酸对丙烯酰胺的消减效果要比咖啡酸好。
由此推测2种酚酸对丙烯酰胺产生消减作用的机制可能为:① 丙烯酰胺与酚酸或酚酸的降解产物发生反应形成新的物质,从而降低了体系中丙烯酰胺的含量,且醌型酚酸更容易与丙烯酰胺发生反应;② 酚酸在加热的条件下不稳定,可释放出自由基,进而促进了丙烯酰胺的聚合反应;③ 在酸性条件下丙烯酰胺容易形成丙烯酸[25-26],从而降低了体系中丙烯酰胺的含量。
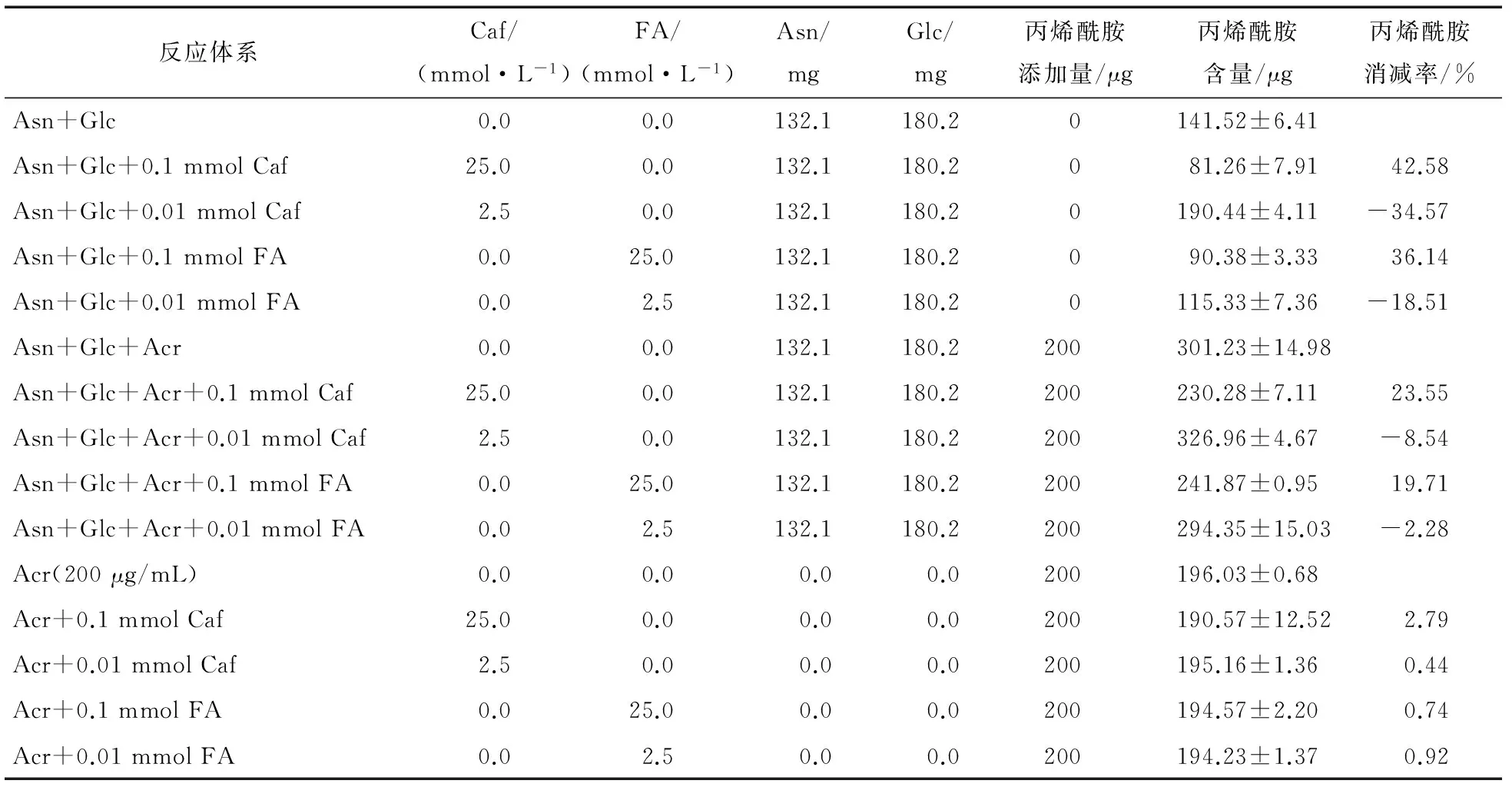
表3 不同添加量的两种酚酸对美拉德模拟体系中丙烯酰胺消减的影响†
† Glc、Asn、Caf、FA、Acr分别代表葡萄糖、天冬酰胺、咖啡酸、阿魏酸及丙烯酰胺。
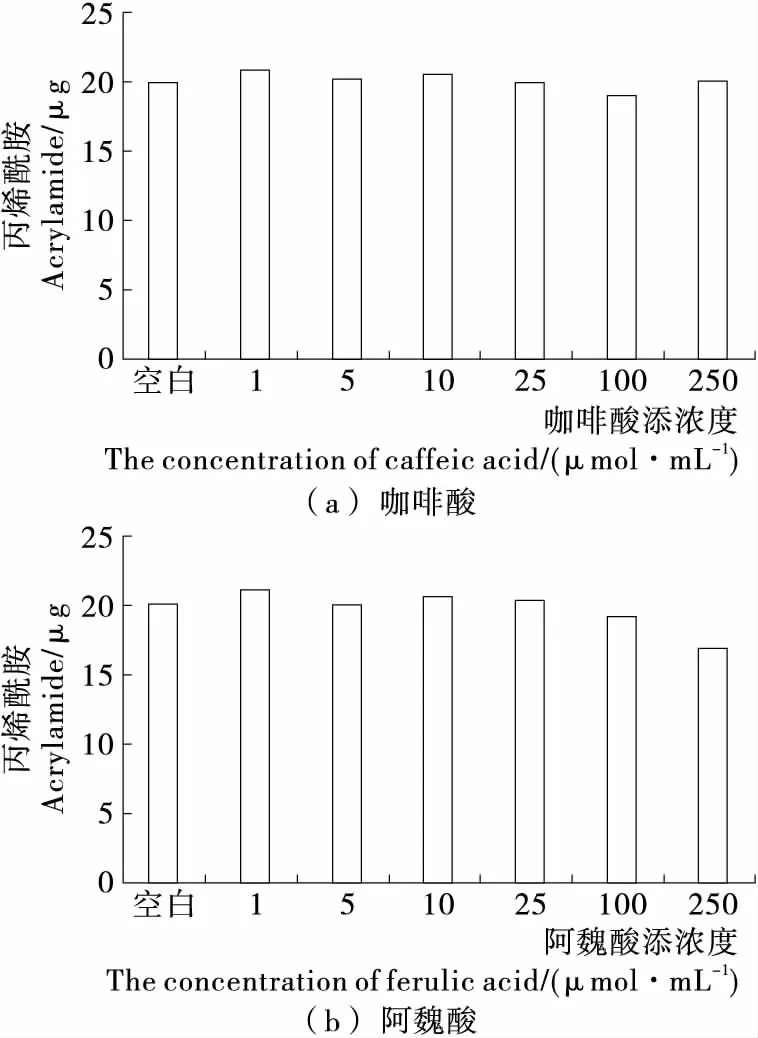
图3 咖啡酸与阿魏酸浓度对丙烯酰胺消减的影响
2.4 pH对模拟体系中丙烯酰胺消减的影响
由图5可知,当 pH调到7.0后,不加入酚酸的体系中,其丙烯酰胺的消减率为14%;而加入酚酸后,体系中丙烯酰胺的消减率都明显降低,均小于5%。
丙烯酰胺单独加热时,在较短时间内十分稳定[27],此处空白样品中丙烯酰胺的消减率高达14%,说明磷酸盐可促进丙烯酰胺的消减,可能与磷酸盐对丙烯酰胺的作用有关。Rizzi[28]认为缓冲溶液可以促进某些反应的进行,如美拉德反应过程中葡萄糖的降解。酚酸的加入削弱了磷酸盐对丙烯酰胺的消减作用。

图4 不同形态的酚酸对丙烯酰胺消减的影响

图5 pH 7.0条件下酚酸对模拟体系中丙烯酰胺消减的影响
3 结论
本研究采用天冬酰胺/葡萄糖模拟体系,探究阿魏酸与咖啡酸对丙烯酰胺的形成与消减的影响。结果表明:
(1) 在美拉德模拟体系中咖啡酸与阿魏酸均对丙烯酰胺的形成表现出抑制和促进的双重作用,在高浓度下(250 mmol/L和25 mmol/L)对丙烯酰胺的形成起抑制作用,而二者浓度低于2.5 mmol/L时则表现为促进作用。然而,在丙烯酰胺体系中分别添加阿魏酸与咖啡酸,丙烯酰胺的含量虽有减少,但不明显,由此可见,在美拉德体系中2种酚酸的作用主要发生在丙烯酰胺的形成阶段,进而影响丙烯酰胺的含量。
(2) 在酸性条件下,醌型酚酸比酚型酚酸对丙烯酰胺的消减作用更大,而在中性条件下,酚型酚酸的消减作用更强。可见,在食品加工中可通过调控酚酸类物质的量,既可达到控制丙烯酰胺含量的目的,也可发挥酚酸的保健功能。本研究不仅丰富了抗氧化剂影响丙烯酰胺形成的理论,也为富含酚酸类食品调控丙烯酰胺的含量提供了新的思路。
[1] WANG Shu-jun, YU Jing-lin, XIN Quan-wei, et al. Effects of starch damage and yeast fermentation on acrylamide formation in bread[J]. Food Control, 2017, 73(Part_B): 230-236.
[2] 张娟, 杨媛媛, 王文娟, 等. 丙烯酰胺对雄性小鼠生殖毒性的研究[J]. 毒理学杂志, 2011, 25(2): 90-92.
[3] KATEN A L, STANGER S J, ANDERSON A L, et al. Chronic acrylamide exposure in male mice induces DNA damage to spermatozoa; Potential for amelioration by resveratro[J]. Reproductive Toxicology, 2016, 63: 1-12.
[4] MARONPOT R R, THOOLEN R J M M, HANSEN B. Two-year carcinogenicity study of acrylamide in Wistar Han rats with in utero exposure[J]. Experimental and Toxicology Pathology, 2015, 67(2): 189-195.
[5] 刘洁, 袁媛, 赵广华, 等. 食品中丙烯酰胺形成途径的研究进展[J]. 中国粮油学报, 2009, 24(2): 160-163.
[6] PEDRESCHI F, MARIOTTI M S, GRANBY K. Current issues in dietary acrylamide: formation, mitigation and risk assessment[J]. Journal of the Science of Food and Agriculture, 2014, 94(1): 9-20.
[7] TANG Wei, XING Zhu-qing, LI Chao, et al. Molecular mechanisms and in vitro antioxidant effects of Lactobacillus plantarum MA2[J]. Food Chemistry, 2017, 221: 1 642-1 649.
[8] 金寒冰, 方丽, 赖蓓蕾, 等. 苦苣多酚超声辅助提取及抗氧化研究[J]. 食品与机械, 2014, 30(5): 211-215.
[9] 周佳, 阮征, 江波, 等. 蔬菜抗氧化能力及与酚酸和总黄酮相关性研究[J]. 食品与机械, 2012, 28(3): 139-143.
[10] CHAND K, RAJESHWARI, HIREMATHAD A, et al. A review on antioxidant potential of bioactive heterocycle benzofuran: Natural and synthetic derivatives[J]. Pharmacological Reports, 2017, 69(2): 281-295.
[11] MARTIN M A, RAMOS S. Health beneficial effects of cocoa phenolic compounds: a mini-review[J]. Current Opinion in Food Science, 2017, 14: 20-25.
[12] HELENO S A, MARTIN A, QUEIROZ M J R P, et al. Bioactivity of phenolic acids: Metabolites versus parent compounds: A review[J]. Food Chemistry, 2015, 173: 501-513.
[13] ALU’DATT M H, RABABAH T, ALHAMAD M N, et al. A review of phenolic compounds in oil-bearing plants: Distribution, identification and occurrence of phenolic compounds[J]. Food Chemistry, 2017, 218: 99-106.
[14] 张英, 龚金炎, 李栋, 等. 竹叶黄酮最新研究进展之二: 竹叶酚性化学素抑制食品中丙烯酰胺形成及化解人体丙毒危害的作用和机制研究[J]. 中国食品添加剂, 2009(5): 56-62, 145.
[15] CHENG Ka-wing, SHI Jian-jun, OU Shi-yi, et al. Effects of fruit extracts on the formation of acrylamide in model reactions and fried potato crisps[J]. Journal of Agricultural and Food Chemistry, 2010, 58(1): 309-312.
[16] 林流丹, 黄才欢, 欧仕益. 食品中丙烯酰胺形成机理的研究进展[J]. 现代食品科技, 2006(1): 168-171.
[17] MICHALAK J, GUJSKA E, NOWAK F, et al. Effect of different home-cooking methods on acrylamide formation in pre-prepared croquettes[J]. Journal of Food Composition and Analysis, 2017, 56: 134-139.
[18] PASTORIZA S, RUFIAN-HENARES J A, MORALES F J, et al. Reactivity of acrylamide with coffee melanoidins in model systems[J]. Food Science and Technology, 2012, 45(2): 198-203.
[19] DIAS F F G, JUNIOR S B, HANTAO L W, et al. Acrylamide mitigation in French fries using native l-asparaginase from Aspergillus oryzae CCT 3940[J]. LWT-Food Science and Technology, 2017, 76(Part_B): 222-229.
[20] DANIALI G, JINAP S, HAJEB P, et al. Acrylamide formation in vegetable oils and animal fats during heat treatment[J]. Food Chemistry, 2016, 212: 244-249.
[21] ROHN S, PETZKE K J, RAWEL H M, et al. Reactions of chlorogenic acid and quercetin with a soy protein isolate -influence on the in vivo food protein quality in rats[J]. Molecular Nutrition and Food Research, 2006, 50(8): 696-704.
[22] 于淼, 江姗姗, 欧仕益. 绿原酸影响氨基酸消减丙烯酰胺的研究[J]. 中国粮油学报, 2012, 27(11): 80-83.
[23] 李明, 李玉芳. 过氧化钙的制备及其应用研究进展[J]. 乙醛醋酸化工, 2016(12): 19-22.
[24] 王春德, 齐翠红, 李朝霞. 过氧化钙的净水增氧效果评估[J]. 生命科学研究, 2012, 16(4): 345-349.
[25] 孟青青, 杨建国, 王凤寰. 生物法合成丙烯酸的研究进展[J]. 中国生物工程杂志, 2012, 32(10): 119-127.
[26] COLBY J, SNELL D, BLACK G W. Immobilization of Rhodococcus AJ270 and use of entrapped biocatalyst for the production of acrylic acid[J]. Monatshefte fuer Chemie, 2000, 131(6): 655-666.
[27] ADAMS A, HAMDANI S, VAN LANCKER F, et al. Stability of acrylamide in model systems and its reactivity with selected nucleophiles[J]. Food Research International, 2010, 43(5): 1 517-1 522.
[28] RIZZI G P. Role of phosphate and carboxylate ions in Maillard browning[J]. Journal of Agricultural and Food Chemistry, 2004, 52(4): 953-957.
Effect of ferulic acid and caffeic acid on acrylamide formation and elimination
WU Hao-jieYUMiaoHUANGCai-huanOUShi-yi
(DepartmentofFoodScienceandEngineering,JinanUniversity,Guangzhou,Guangdong510632,China)
10.13652/j.issn.1003-5788.2017.08.001
国家自然科学基金(编号:31071596);广东省自然科学基金(编号:32215105)
吴豪杰,男,暨南大学在读硕士研究生。
欧仕益(1963—),男,暨南大学教授,博士。 E-mail: tosy@jnu.edu.cn
2017—06—12

