响应面优化复合酶法提取干巴菌多糖工艺
张岚,和劲松,王雪峰,廖国周,普岳红,葛长荣,范江平,谷大海
(云南农业大学食品科学技术学院,云南昆明650201)
响应面优化复合酶法提取干巴菌多糖工艺
张岚,和劲松,王雪峰,廖国周,普岳红,葛长荣,范江平*,谷大海*
(云南农业大学食品科学技术学院,云南昆明650201)
探讨应用复合酶法提取干巴菌多糖的最佳工艺条件。以多糖提取率为考察指标,在单因素优化的基础上,应用Box-Behnken试验设计优化得出影响因素的最佳参数水平,进而获得最佳工艺条件。结果表明:复合酶法提取干巴菌多糖的最佳工艺条件为酶解时间64 min,料液比1∶40(mg/L),复合酶浓度0.47%,在此条件下干巴菌多糖提取率为17.87%,提取效果最优。
干巴菌;多糖;复合酶法;响应面分析法;工艺优化
Abstract:The paper was aimed to study the optimal conditions for compound enzyme extraction of polysaccharides of Thelephora ganbajun Zang.The extraction rate of polysaccharides was main value index,based on single factor tests,the optimal parameters of influence factors were optimized by Box-Behnken design,and then the optimal conditions were obtained.The results showed that the optimal extraction conditions were hydrolysis time 64 min,material-liquid ratio 1∶40(mg/L),compound enzyme 0.47%.Under these conditions,the extraction rate of polysaccharides could be up to 17.87%,as well as show the optimal extraction results.
Key words:Thelephora ganbajun Zang;polysaccharide;compound enzymes methods;response surface analysis;processing optimization
多糖作为自然界中含量最多的天然聚合物之一,是生命物质中重要的组成成分,由于其丰富的生物活性以及独特的生理功能,多糖类化合物在医药、石化工业、环保工业以及食品工业中有广泛的应用,成为当今国内外的研究热点。食用菌多糖因其具有纯天然、无毒害、活性高等特点,拥有巨大的应用价值和较为广阔的市场前景[1-2]。
干巴菌又名绣球菌,也叫对花菌、马牙菌等,属于真菌门、层菌纲、褶菌目、革菌科,主产于云南,是一种珍稀名贵的食药两用真菌[3-4]。干巴菌主要分布在云南省昆明、呈贡、安宁、楚雄、保山等地,集中在海拔1 000 m~2 200 m的松林中,是野生食用菌中的上品。已有实验证明,干巴菌的活性成分中,多糖含量较高,具有抗氧化、增强免疫力等功效[5]。由于干巴菌季节性很强,为云南特有地方性食用菌,仅在云南省尤其是昆明以及其临近地区有食用习惯[6],因此,国内外对干巴菌的研究极少,可能与原料的产地与产量较少有关。目前针对菌类多糖提取工艺的研究多采用传统热水法,多糖难以释放出来,导致多糖得率较低[7]。而复合酶法可以最大限度的将植物组织分解,提高多糖得率;同时减少多糖结构及生物活性的破坏,已逐渐成为植物活性成分提取工艺的研究热点[8]。响应面分析法是利用合理的试验设计方案,通过对回归方程的分析,优化工艺参数的统计方法[9]。该方法设计合理,结果准确,被越来越多的应用于工艺优化中。因此,本研究采用响应面优化复合酶法提取干巴菌多糖工艺,考察各工艺参数对多糖得率的影响,旨在为干巴菌多糖活性的深入研究及其开发和利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
新鲜干巴菌:云南易门康源菌业有限公司,干巴菌经低温干燥后,粉碎,备用。
纤维素酶、木瓜蛋白酶:Sangon Biotech公司;无水乙醇、葡萄糖、苯酚、浓硫酸:天津市致远化学试剂有限公司;所用试剂均为分析纯。
1.2 仪器与设备
紫外分光光度计:上海翱艺仪器有限公司;AR224CN电子天平:常州奥豪斯仪器有限公司;DKZ-1电热恒温水浴锅:上海精密实验设备有限公司;EU-K1-20TQ超纯水器:南京欧铠环境科技有限公司;TGC20M离心机:湖南湘立科学仪器有限公司;FW135型粉碎机:天津泰斯特仪器有限公司。
1.3 方法
1.3.1 复合酶法提取干巴菌多糖工艺
干巴菌原料进行干燥粉碎,精确称取过80目筛的干巴菌粉5 g,按照试验设计,加入一定料液比及复合酶量,于设定温度的水浴锅中,不停搅拌,酶解反应至设定时间,反应结束后,置于沸水浴中灭酶10 min,离心待用。采用苯酚硫酸法[10]测定多糖含量,计算提取率。
1.3.2 标准曲线的绘制[11]
称取葡萄糖标准品200 mg,向其中加入蒸馏水使其溶解,定容至 100 mL。分别吸取标液 2、4、6、8、10 mL,分别定容至100 mL。再吸取2 mL溶液,然后加入5%苯酚溶液1 mL,迅速加入5 mL浓硫酸,振摇5 min,置沸水浴上加热15 min,然后置冷水浴中冷却30 min,以蒸馏水为空白作对照,在490 nm处用分光光度计测量吸光度,以葡萄糖浓度为横坐标,吸光值为纵坐标,绘制标准曲线,得回归方程:y=11.656x+0.025 8,R2=0.998 5。
1.3.3 干巴菌多糖提取率测定
精确吸取2 mL粗多糖溶液,然后加入5%苯酚溶液1 mL,迅速加入5 mL浓硫酸,振摇5 min,置沸水浴上加热15 min,然后置冷水浴中冷却30 min,以蒸馏水为空白作对照,在490 nm处用分光光度计测量吸光度。根据葡萄糖含量的标准曲线,由样品溶液的吸光度计算粗多糖提取率。多糖提取率计算式如下:
多糖提取率/%=[(C×V×d)/m]×100
式中:C为测得的样品溶液的葡萄糖质量浓度,mg/mL;V为样品液体积,mL;d为稀释倍数;m为样品质量,mg。
1.3.4 单因素试验设计
在复合酶法提取干巴菌多糖过程中,影响多糖提取率最重要的因素为酶解时间、料液比、复合酶浓度。为研究以上因素对多糖提取率的影响规律,试验对反应条件进行了设置。单因素试验中,考察酶解时间(40、50、60、70、80 min)、料液比[1∶10、1∶20、1∶30、1∶40、1∶50(mg/L)]复合酶选用(木瓜蛋白酶∶纤维素酶=2∶1)混合酶,考察酶加量(0.2%、0.3%、0.4%、0.5%、0.6%)对干巴菌多糖提取效果的影响。每组试验重复3次,结果取平均值。
1.3.5 响应面优化最佳提取工艺
在单因素优化的基础上,应用Box-Behnken试验设计原理,选取复合酶酶解时间(A)、料液比(B)、复合酶浓度(C)3个对多糖提取率影响较显著因素,采用三因素三水平的响应面分析法优化干巴菌多糖提取工艺。试验因素与水平设计见表1。

表1 Box-Behnken试验设计因素与水平Table 1 Design factors and levels of Box-Behnken experiment
1.4 数据处理
本试验设计采用Design-Expert8.0统计分析软件,图形制作采用Excel数据处理软件。
2 结果与分析
2.1 单因素试验结果
2.1.1 酶解时间对干巴菌多糖提取率的影响
固定料液比1∶40(mg/L)、复合酶浓度0.5%、酶解温度55℃,考察酶解时间对干巴菌多糖提取率的影响,结果见图1。
由图1可知,酶解时间在40 min~60 min范围内,干巴菌多糖的提取率随时间的延长而增加,在60 min时,多糖提取率达到最大,说明酶解时间在60 min时,酶与底物充分反应。因此,考虑到实际生产问题,选取60 min为最佳酶解时间。
2.1.2 料液比对干巴菌多糖提取率的影响
固定复合酶浓度0.5%、酶解温度55℃,酶解时间60 min,考察料液比对干巴菌多糖提取率的影响,结果见图2。

图1 酶解时间对干巴菌多糖提取率的影响Fig.1 Effect of hydrolysis time on the yield of polysaccharides
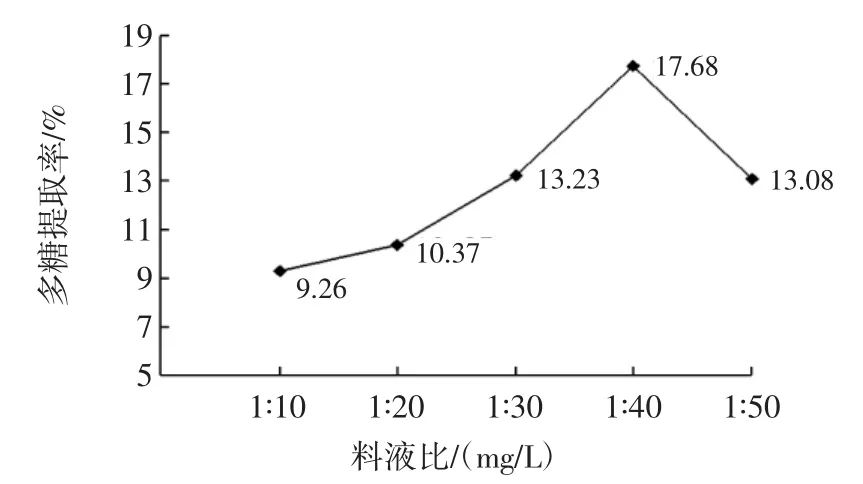
图2 料液比对干巴菌多糖提取率的影响Fig.2 Effect of marerial-liquid ratio on the yield of polysaccharides
由图2可知,干巴菌多糖提取率在料液比为1∶10(mg/L)~1∶40(mg/L)时,提取率明显增长,随着液体量的增大,多糖提取率呈下降趋势,说明在料液比为1∶40(mg/L)时,多糖已经充分溶解到溶液中,继续增大料液比可能会导致溶剂量过大而使有效成分流失。因此,选定料液比为1∶40(mg/L)为最佳料液比。
2.1.3 复合酶浓度对干巴菌多糖提取率的影响
固定料液比 1∶40(mg/L)、酶解温度 55℃、酶解时间60 min,考察复合酶浓度对干巴菌多糖提取率的影响,结果见图3。

图3 复合酶浓度对干巴菌多糖提取率的影响Fig.3 Effect of compound enzyme concentration on the yield of polysaccharides
在复合酶浓度为0.2%~0.5%的时候,多糖提取率随酶浓度的增加而增长,在复合酶浓度达到0.5%以后,多糖提取率趋于平缓,这是由于,在一定酶解条件下,酶浓度不足时,酶浓度越大裂解细胞壁的效率越高,当酶浓度到饱和后,再增加酶浓度对结果的影响就变弱了[12],因此,选取复合酶浓度为0.5%为最佳复合酶浓度。
2.2 响应面优化干巴菌多糖提取工艺
2.2.1 响应面分析方案及结果
在单因素试验的基础上,选取酶解时间(A)、料液比(B)、复合酶浓度(C)作为试验设计的3个自变量,通过响应面试验设计建立干巴菌多糖提取率与自变量直接的函数关系,进而寻求复合酶法提取干巴菌多糖的最佳提取工艺。用Design-Expert8.0统计分析软件对数据进行处理。试验方案及结果见表2。
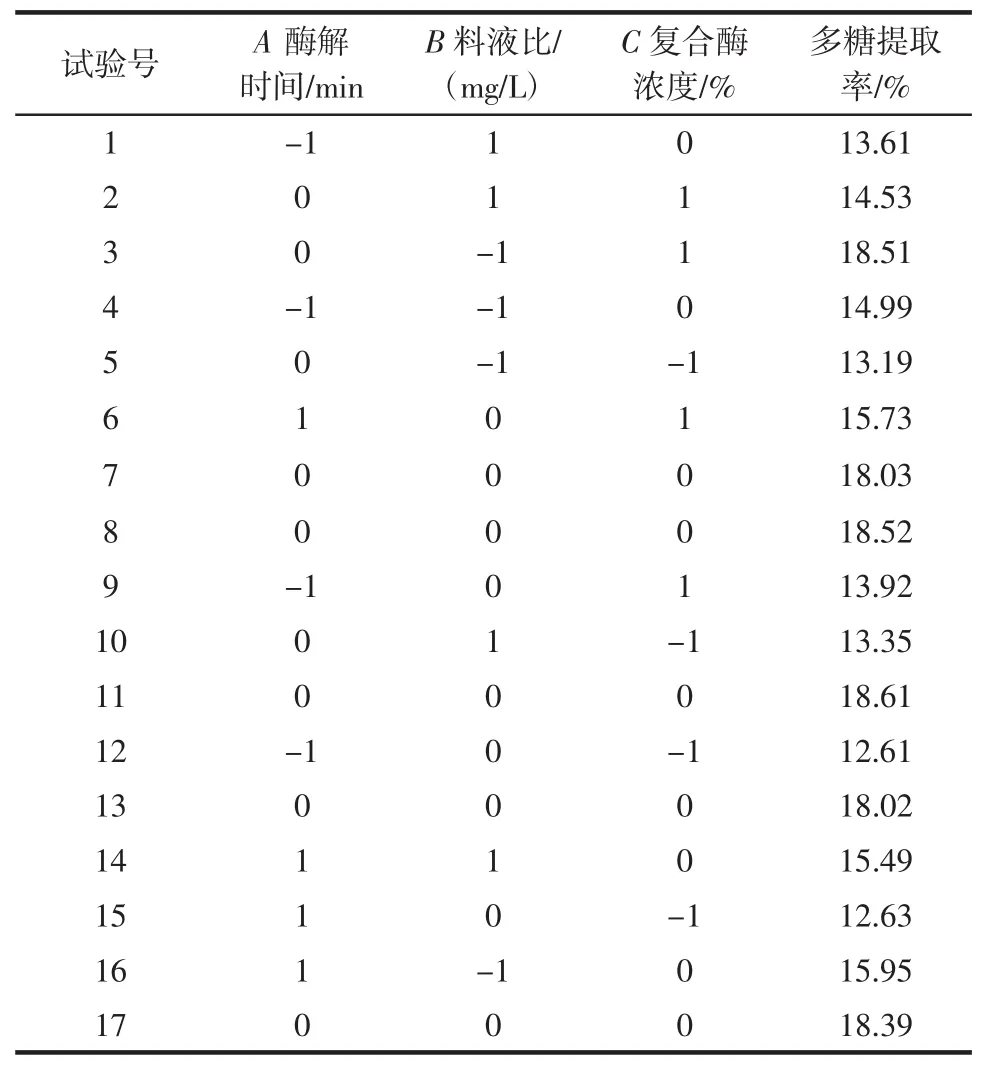
表2 设计方案与试验结果Table 2 Experimental design and yield
2.2.2 回归模型的方差分析
回归模型的方差分析[13]见表3。

表3 模型的方差分析结果Table 3 Analysis results of analysis of variance of model

续表3 模型的方差分析结果Continue table 3 Analysis results of analysis of variance of model
由表3可知,模型对试验拟合良好,模型的P值<0.000 1,表明该试验模型极显著。失拟项P=0.074 3>0.05,说明失拟项检验不显著,该回归模型的总决定系数R2=0.979 7,调整决定系数R2Adj=0.959 4,说明方程对试验的拟合度较好,能够较真实地反应试验结果,可用此模型来分析和预测复合酶提取法提取干巴菌多糖的结果。对表3中数据进行回归拟合,得到自变量与干巴菌多糖得率(Y)的二次多项回归方程为:

2.2.3 响应面分析
响应面分析[13]见图4。
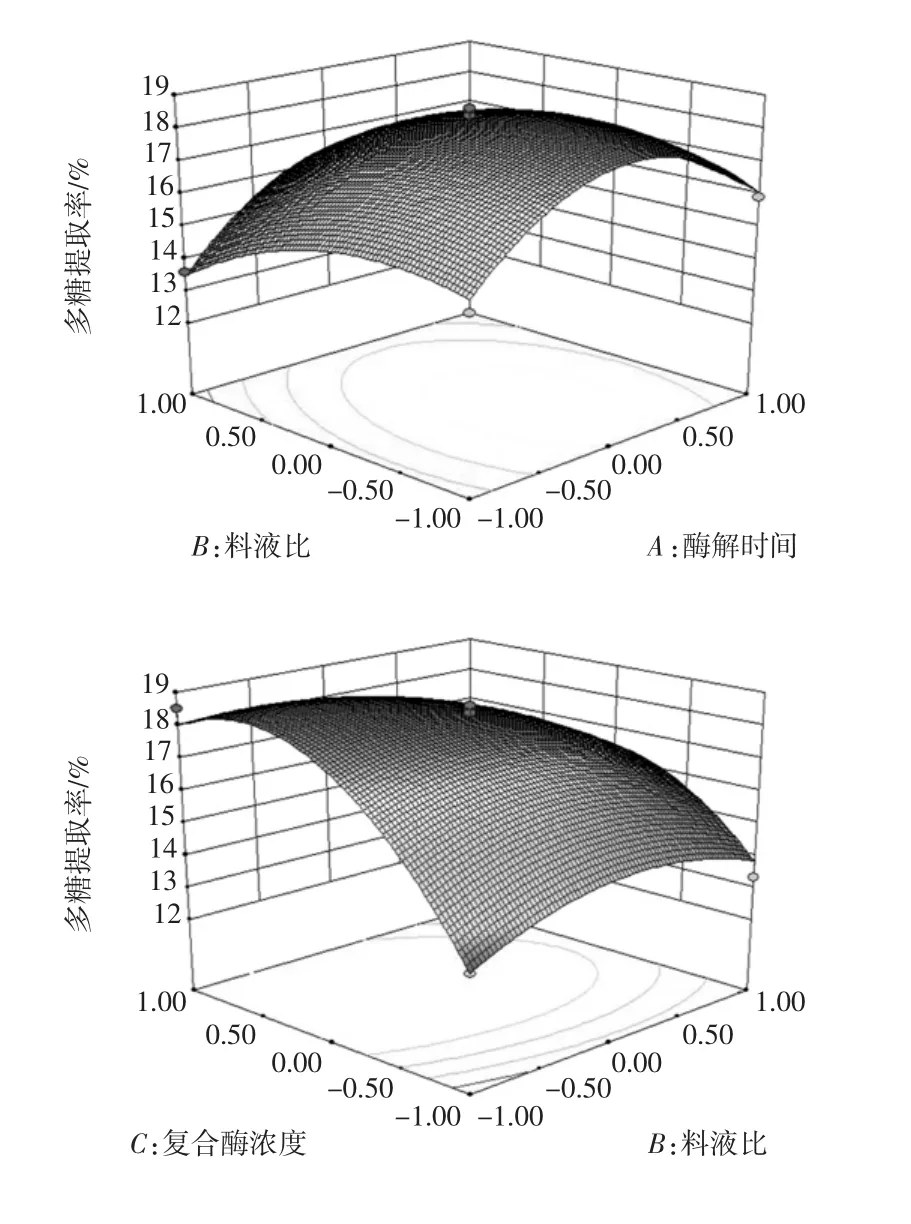
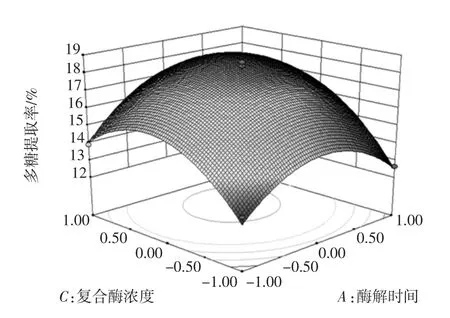
图4 两两因素交互作用对多糖提取率影响的响应面图Fig.4 Response surface for the effects of processing parameters on the extraction rate of polysaccharides
对模型的方差分析表明,响应曲面越陡说明各因素之间两两交互作用越显著,由图4可以看出,C(复合酶浓度)与B(料液比)交互作用最为显著;B(料液比)与A(酶解时间);A(酶解时间)与C(复合酶浓度)次之,此结果与回归分析结果吻合。可知,复合酶浓度对干巴菌多糖提取率的影响最为显著。
由图4可知,复合酶浓度与料液比对干巴菌多糖的影响均成抛物线形,即随着复合酶浓度与料液比同时增加,多糖提取率呈现先增大后降低趋势,所以,应用到提取工艺中,可适当增加复合酶浓度与料液比,可以提高干巴菌多糖提取率。而料液比对多糖的提取率的影响大于酶解时间,因为当提取率达到平衡之前,原料与介质之间的浓度差影响表观速率常数,料液比数值越大,更有利于表观速率常数维持在较大水平[14],提高干巴菌多糖提取率。而适当延长酶解时间可以提高干巴菌多糖提取率,但是酶解时间过长,会造成提取物自身的水解,或者造成大量目标产物被吸附,从而导致干巴菌提取率下降。因此,在实际生产中,应控制酶解时间在最佳范围内。
为检验响应面优化复合酶法提取干巴菌多糖工艺的可靠性,采用优化后的复合酶法提取工艺条件进行验证试验,采用优化后的工艺参数,即酶解时间64 min,料液比 1∶40(mg/L),复合酶浓度 0.47%,在此条件下,干巴菌多糖提取率为17.55%,而模型预测值为17.87%。二者接近,表明运用响应面法优化得到的模型参数准确可靠[15]。
3 结论
本研究采用复合酶法提取干巴菌多糖,该工艺通过酶能使细胞壁破碎的作用,使细胞内的多糖物质可以充分溶出,从而显著提高了干巴菌多糖的提取工艺。
为进一步优化复合酶法提取干巴菌多糖工艺条件,本试验考察了酶解时间、料液比、复合酶浓度3个因素对干巴菌多糖提取率的影响。在单因素试验基础上,采用响应面优化复合酶法提取干巴菌多糖,得到多项式回归方程,直观体现了各试验因素与试验结果的相关性,影响干巴菌多糖提取率的工艺因素中,复合酶浓度对干巴菌多糖提取率的影响最为显著。最终确定复合酶法提取干巴菌多糖的最佳工艺为酶解时间 64 min,料液比 1∶40(mg/L),复合酶浓度 0.47%,在此条件下干巴菌多糖得率为17.87%。而实测值为17.55%,试验结果为干巴菌多糖的提取以及多糖性质的研究提供了一定的试验基础,并能对工业化生产起到指导作用。
[1]Bertozzi CR,Kiessling LL.Chemical glycobiology[J].Science,2001,291(5512):2357-2364
[2]Whitmancm J,Bond Mr,Kohler JJ.Chemical glycobiology[J].Comprehensive Natural ProductsⅡ,2010,6(4):175-224
[3]黄年来.中国大型真菌原色图鉴[M].北京:中国农业出版社,1998:216-217
[4]傅四清,魏蓉城.干巴菌研究进展[J].林业科技通讯,1997(8):21-23
[5]陆文娟,喻晨.响应面优化提取干巴菌多糖的工艺研究[J].南京师范大学学报,2015,15(3):84-92
[6]桂明英,刘蓓,朱萍,等.干巴菌生态学初步研究[J].西南农业学报[J].西南农业学报,2005,18(3):325-327
[7]YANG Bao,ZHAO Mouming,JOHN S,et al.Effect of ultrasonic treatment on the recovery and DPPH radical scavenging activity of polysaccharides from longan fruit percarp[J].Food Chemistry,2008,106(2):685-690
[8]李小平,陈锦平.油枣多糖的酶法提取及其对多糖分子量分布的影响[J].食品科学,2007,28(8):191-194
[9]ZHONG K,WANG Q.Optimization of ultrasonic extraction of polysaccharides from dried longan pulp using response surface methodology[J].Carbohydrate Polymers,2010,80(1):19-25
[10]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1999:455-456
[11]王心诗,邰丽梅,吴素蕊.响应面法优化水提野生铜色牛肝菌多糖工艺[J].中国食用菌,2015,34(1):60-64
[12]董丽辉,范三微,凌庆枝.酶法提取亮菌多糖的研究[J].中国酿造,2012,31(4):51-54
[13]费荣昌.试验设计与数据处理(第四版)[M].无锡:江南大学出版社,2001:59-63
[14]王占一,张立华.复合酶法提取石榴籽多糖的工艺优化[J].食品科学,2016,37(18):19-25
[15]王根女,苏平,黄恺婷,等.响应面法优化微波提取紫苏叶多酚物质[J].中国食品学报,2009,9(5):87-92
Optimization of Compound Enzyme Extraction Technology of Polysaccharide of Thelephora ganbajun Zang via Response Surface Methodology
ZHANG Lan,HE Jin-song,WANG Xue-feng,LIAO Guo-zhou,PU Yue-hong,GE Chang-rong,FAN Jiang-ping*,GU Da-hai*
(College of Food Science and Technology,Yunnan Agricultural University,Kunming 650201,Yunnan,China)
2017-03-30
10.3969/j.issn.1005-6521.2017.20.010
云南省省院省校科技合作专项(2013IB010)
张岚(1988—),女(汉),硕士,研究方向:食品工程。
*通信作者:范江平(1972—),男(汉),教授,博士,研究方向:食品科学;谷大海(1980—),男(汉),讲师,硕士,研究方向:食品科学与工程。

