一株产几丁质脱乙酰酶海洋细菌的筛选、鉴定及发酵优化
, ,,,,,,,*
(1.淮海工学院海洋生命与水产学院,江苏连云港 222005;2.江苏省海洋资源开发研究院,江苏连云港 222005)
一株产几丁质脱乙酰酶海洋细菌的筛选、鉴定及发酵优化
顾张慧1,刘姝2,胡晟源1,来蒋丽1,王淑军2,焦豫良1,房耀维1,2,*
(1.淮海工学院海洋生命与水产学院,江苏连云港222005;2.江苏省海洋资源开发研究院,江苏连云港222005)
目的:从海洋样品中筛选产几丁质脱乙酰酶细菌,对菌株进行鉴定和发酵条件优化。方法:利用显色平板从黄海海州湾燕尾港海域的海泥中筛选几丁质脱乙酰酶产生细菌。利用形态学、生理生化特性以及16S rDNA序列分析对菌株进行鉴定。利用单因素实验和正交实验优化菌株发酵条件。结果:筛选获得几丁质脱乙酰酶产生菌MCDA01,经形态学特征、生理生化特性以及16S rDNA序列分析将菌株鉴定为天目不动杆菌(Acinetobacterschindleri)。菌株最佳生长条件为30 ℃,pH8.0,NaCl 4%。最佳产酶发酵条件为:发酵时间60 h,发酵温度20 ℃,培养基起始pH7,装液量20%,诱导剂几丁质浓度1%。在此条件下,产酶量达到201.37 U/mL,比优化前提高了4.14倍。结论:几丁质脱乙酰酶产生菌MCDA01产酶量达到201.37 U/mL,有工业应用潜力。
几丁质脱乙酰酶,菌株筛选,鉴定,发酵优化
Abstract:Objective:Screen chitin-deacetylase-producing strains from marine samples,identify the strain and optimize its fermentation conditions. Methods:Chitin-deacetylase-producing strains were screened by color culture medium from the marine mud of Yanwei Harbor. The strains were identified by morphological,physiological and biochemical characteristics and 16S rDNA sequence analysis. The single factor and orthogonal experimental design were used to optimize the fermentation conditions. Results:Strain MCDA01 producing chitin deacetylase was screened,and it was identified asAcinetobacterschindlerithrough morphological,biochemical characteristics,and 16S rDNA sequence analysis. The optimal culture conditions of strain MCDA01 was obtained as follows:30 ℃,pH8.0,and NaCl 4%. The optimal fermentation conditions was obtained as follows:the fermentation time was 60 h,the fermentation temperature was 20 ℃,the culture medium starts pH was 7,the liquid loading amount was 20%,and the inducer chitin concentration was 1%. Under this condition,production of enzyme was up to 201.37 U/mL,which was increased by 4.14 times. Conclusion:The maximum of enzyme production were optimized to 201.37 U/mL,and have industrial application potential.
Keywords:chitin deacetylase;strain screening;identifiction;fermentation optimization
几丁质又叫甲壳素、甲壳质,是仅次于纤维素居世界第二的天然有机化合物,大多存在于无脊椎动物的外骨骼和表皮以及真菌、藻类的细胞壁中[1-3]。甲壳素是由N-乙酰葡萄糖胺(GlcNAc)通过β-1,4糖苷键连接而成的直链大分子物质,不溶于水、稀酸、稀碱、浓碱及一般有机溶剂,商业价值不大。但其脱去乙酰基团后的产物壳聚糖(脱乙酰度超过55%的几丁质)可以溶于稀盐酸、硝酸等无机酸和大多数有机酸,并具有抑菌[4]、抗癌、降低胆固醇、降血压等生物活性[5],被现代科学称为继糖、蛋白质、脂肪、维生素、矿物质等五大生命要素之后的第六大生命要素,广泛应用于医药、食品、化工、化妆品等行业,有很高的应用价值和开发前景[6]。
目前,将几丁质转化为壳聚糖主要有化学热碱法和生物酶法[7-9]。化学法需要使用大量浓碱处理,具有反应时间长,生产成本高、脱乙酰度不易被控制以及排放物会对环境造成严重污染等缺点。而酶法制备壳聚糖有条件温和、绿色环保、得到的产品品质高、制备周期短等优点,越来越引起人们的关注。几丁质脱乙酰酶(Chitin deacetylase,CDA,E.C. 3.5.1.41)是催化甲壳素脱乙酰基生成壳聚糖的酶。利用该酶催化制备的壳聚糖具有脱乙酰程度一致、脱乙酰度高等优点,更为关键的是生物酶法绿色环保,实现了壳聚糖的绿色生产。CDA的研究和规模化制备是生物法制备壳聚糖的前提条件。目前已有很多人致力于微生物产几丁质脱乙酰酶的研究。1974年,Mucor rouxii CDA被日本研究者首次报道[10]。随后,研究者已经从真菌、细菌和昆虫分离获得了CDA[11-14],其中大多数产CDA的菌株为真菌[15-16]。目前已报道的微生物CDA的最适温度为50~60 ℃[17]。
本研究从海洋样品中筛选产几丁质脱乙酰酶的海洋细菌菌株,通过形态学、生理生化特性以及16S rDNA序列分析对菌株进行鉴定,并优化了其最适生长条件和最适产酶条件。
1 材料与方法
1.1 材料与仪器
海泥样品 采集于中国黄海海州湾燕尾港海域,样品采集后置于冰盒,并尽快带回实验室进行实验;几丁质 江苏澳新生物工程有限公司;蛋白胨、酵母粉、对硝基-N-乙酰苯胺、K2HPO4、KH2PO4、NaCl、(NH4)2SO4等实验试剂 均为分析纯,上海博微生物科技有限公司;引物 由南京思普金生物公司合成。
himac.CR22G高速冷冻离心机 日本HITACHI公司;T6新世纪分光光度计 北京普析通用仪器有限责任公司;SPX-250B-2生化培养箱 上海博迅实业有限公司;DK-8D 电热恒温水槽 上海一恒科技有限公司;Nikon 90i全电动显微镜 上海普赫光电科技有限公司。
1.2 主要培养基
1.2.1 筛选培养基 胶体几丁质0.2%,K2HPO40.07%,KH2PO40.03%,MgSO40.05%,对硝基-N-乙酰苯胺 0.02%,陈海水配制,pH7.0。
1.2.2 种子培养基 酵母粉0.1%,蛋白胨0.5%,NaCl 1%,陈海水配制,pH7.0。
1.2.3 2216E培养基 蛋白胨0.5%,酵母粉 0.1%,FePO40.01%,琼脂2%,陈海水配制,pH7.0。
1.2.4 发酵培养基 蛋白胨0.5%,葡萄糖0.2%,(NH4)2SO40.3%,KH2PO40.15%,MgSO40.05%,粉末几丁质2%,陈海水配制,pH7.0。
1.3 实验方法
1.3.1 产几丁质脱乙酰酶菌株的筛选 从黄海海州湾燕尾港海域取海泥样品,用蒸馏水对样品进行梯度稀释。分别吸取10-4、10-5、10-6梯度的稀释液50 μL涂布三个平板。将涂布完的平板置于25 ℃环境下培养5~7 d后观察菌落生长和透明圈情况。挑取生长状况良好且具有透明圈的菌落分别在2216E培养基上进行划线纯化培养。纯化后的菌株转接入种子培养液中培养,再以1%的接种量接种至发酵培养基,25 ℃、180 r/min的条件下培养72 h后,将发酵液10000 r/min离心10 min,上清液作为粗酶液,测定几丁质脱乙酰酶活性。
1.3.2 几丁质脱乙酰酶酶活性的测定 试管中加入30 ℃预保温的0.05 mol/L pH7.0的磷酸缓冲液3 mL,200 mg/L的对硝基乙酰苯胺水溶液1 mL,酶液1 mL,于30 ℃水浴反应15 min,沸水浴终止酶促反应,3000 r/min离心10 min,测定上清液的吸光度(A400)。以添加1 mL同样浓度沸水浴灭活15 min的酶液为对照。酶活单位(U)定义:在上述反应条件下每小时产生1 μg对硝基苯胺所需要的酶量为一个酶活力单位。
1.3.3 菌株的鉴定 对纯化培养的菌株进行形态学的观察并参考伯杰氏细菌手册对菌株MCDA01进行生理生化鉴定[18]。
1.3.4 菌株的16S rDNA序列分析 提取菌株的基因组DNA作为PCR扩增的模板[19],用于PCR反应的通用引物为:27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′,所述反应体系为:PCR mix(21 μL),上下游引物(各1 μL),DNA模板(2 μL)。反应程序:94 ℃变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸90 s,32个循环;72 ℃终延伸10 min。将PCR产物送至南京思普金公司测序。测定序列后,将测定的序列提交至GenBank数据库进行相似性比较,并用MEGA 7软件进行同源性分析。
1.3.5 菌株生长条件的研究
1.3.5.1 生长温度 将菌接种于pH7.0的2216E培养基中,分别置于5、15、25、30、35 ℃下,180 r/min培养。每隔6 h测定其OD600值。
1.3.5.2 生长pH 将菌分别接种于pH为2.0~11.0的2216E培养基中,25 ℃、180 r/min培养24 h后,测定其OD600值。
1.3.5.3 NaCl浓度 将菌接种于NaCl浓度分别为0~10%、pH7.0的2216E培养基中,25 ℃、180 r/min培养24 h后,测定其OD600值。
1.3.6 菌株产酶条件的确定
1.3.6.1 菌株MCDA01的发酵 将菌株MCDA01接种于种子培养基中,在25 ℃过夜培养得种子液。再将种子液接种于发酵培养基中,初始发酵条件为:发酵温度25 ℃,发酵时间72 h,初始pH为7.0,摇床转速180 r/min,接种量1%(v/v),装液量20%。发酵后按1.3.2方法测定酶活,并以最高酶活力作为100%,计算不同发酵条件下几丁质脱乙酰酶的相对酶活力,以每次测定的变量为横坐标,相对酶活力为纵坐标,确定最佳发酵条件。
1.3.6.2 发酵温度对菌株MCDA01产酶的影响 在初始发酵条件下,采用不同的培养温度5、10、15、20、25、30 ℃,培养后测定酶活,确定其最佳的产酶温度。
1.3.6.3 发酵时间对菌株MCDA01产酶的影响 在初始发酵条件下,对菌株进行培养,每隔12 h取一次样,测定其酶活,确定最佳产酶时间。
1.3.6.4 pH对菌株MCDA01发酵产酶的影响 在初始发酵条件下,采用不同的初始pH2、3、4、5、6、7、8、9、10、11,培养后测定酶活,确定最佳的初始pH。
1.3.6.5 装液量对菌株MCDA01发酵产酶的影响 在初始发酵条件下,采用不同的装液量10%、20%、30%、40%、50%,培养后测定酶活,确定最佳装液量。
1.3.6.6 诱导剂几丁质浓度对菌株MCDA01发酵产酶的影响 在初始发酵条件下,采用不同的诱导剂浓度1%、2%、3%、4%、5%、6%、7%,培养后测定酶活,确定最佳的诱导剂浓度。
1.3.7 正交法发酵产酶条件优化 在单因素实验基础上,对发酵时间、温度、培养基起始pH、装液量、诱导剂浓度进行L16(45)的正交实验(如表1),以确定最终的最佳发酵条件。
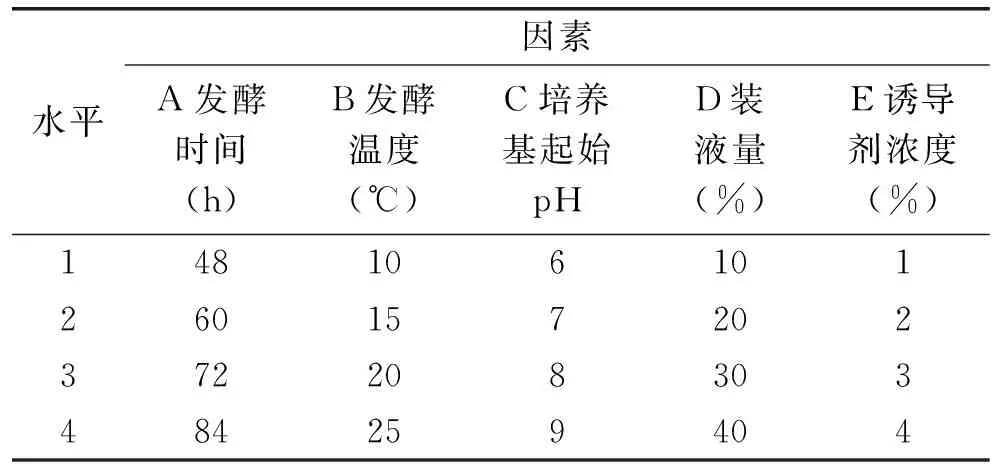
表1 正交实验因素水平Table 1 The factor and level of orthogonal experiment
1.4 数据处理与分析
每组实验设三组平行,实验结果用平均值±标准方差(n=3)表示,采用SPSS Statistics19.0对实验结果进行统计分析。
2 结果与分析
2.1 产几丁质脱乙酰酶菌株MCDA01的分离
通过含有对硝基-N-乙酰苯胺和粉末几丁质的筛选平板筛选得到5株可以在筛选平板上形成变色圈的菌株。将5株菌发酵后得粗酶液,酶活测定结果见表2。其中MCDA01的变色圈最大、活性最强,所以选取MCDA01为后续实验的菌株。
2.2 菌株的鉴定
2.2.1 菌株MCDA01的形态学特征 该菌株为革兰氏阴性短杆菌(图1a),无芽孢。在LB固体培养上培养48 h后:菌落白色、不透明、表面光滑湿润、稍有突起,菌落边缘呈小锯齿状、不易挑取。在含有几丁质和对硝基-N-乙酰苯胺的筛选培养基上能够产生黄色变色圈(图1b)。

表2 产几丁质脱乙酰酶菌株的酶活Table 2 Enzyme activity of the chitin deacetylase-producing strains

图1 菌株MCDA01的形态学特征Fig.1 Morphological features of strain MCDA01
2.2.2 菌株MCDA01的生理生化特征 该菌株不发酵葡萄糖产气,吲哚实验、VP实验、甲基红实验、明胶液化、淀粉水解、硝酸盐还原、氧化酶性、尿素酶、精氨酸脱羧酶、赖氨酸脱羧酶、鸟氨酸脱羧酶实验呈阴性,不产生硫化氢,不利用蔗糖、乳糖、鼠李糖、甘露醇、肌醇、山梨醇,能利用柠檬酸盐,接触酶阳性。部分生理生化结果见表3。通过形态学特征和生理生化实验结果将菌株MCDA01初步鉴定为天目不动杆菌(Acinetobacterschindleri)。
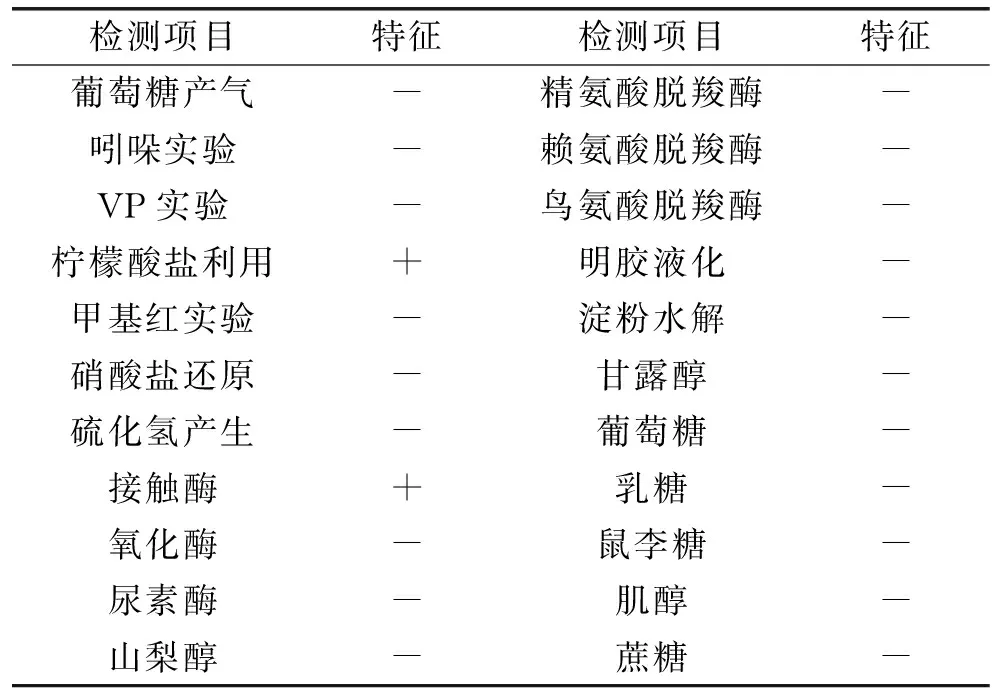
表3 菌株MCDA01部分生理生化实验结果Table 3 Some physiological and biochemical test results of strain MCDA01
注:+:阳性;-:阴性。
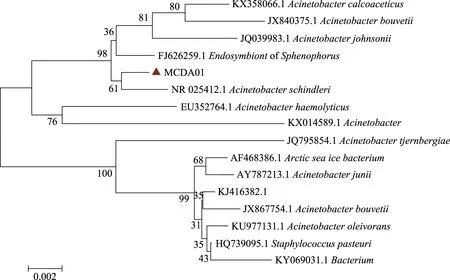
图3 基于菌株MCDA01 16S rDNA序列构建的系统发育树Fig.3 Phylogenetic tree of the strain MCDA01 based on 16S rDNA sequences
2.2.3 菌株MCDA01的16S rDNA序列分析 以MCDA01菌株的DNA为模板扩增菌株MCDA01 16S rDNA,得到1500 pb左右PCR产物(图2)。将PCR产物纯化测序后,将所得1412 bp序列提交至GenBank(登录号:KY385627)做Blast比对后,发现菌株MCDA01与Acinetobacterschindleri(登录号:CP018152.1)的同源性最高,相似度达100%。利用MEGA7.0软件通过邻接法并构建系统发育树(图3),菌株MCDA01与Acinetobacterschindleri在同一分支,进一步表明二者亲缘关系最近。进一步证明菌株MCDA01为天目不动杆菌。目前,尚无天目不动杆菌分泌几丁质脱乙酰酶的报道。
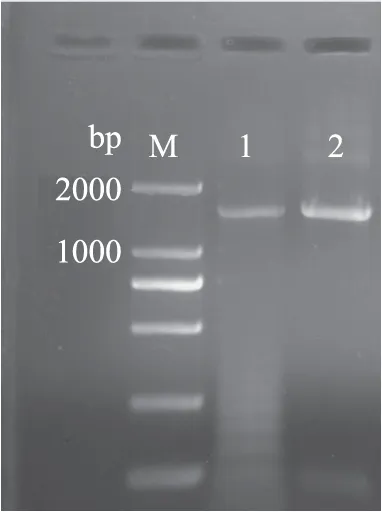
图2 PCR扩增产物的琼脂糖凝胶电泳Fig.2 Agarose-gel electrophoresis of PCR-amplified 16S rDNA gene fragments 注:1、2:菌株MCDA01 16S rDNA扩增产物;M:DL 2000 DNA Marker。
2.2.4 菌株MCDA01生长条件的研究
2.2.4.1 温度对菌株MCDA01生长的影响 培养温度对菌株MCDA01生长的影响如图4,菌株MCDA01可以生长的温度范围为5~35 ℃,在温度为15~30 ℃时菌株生长较快,30 ℃为菌株MCDA01生长的最适温度。一旦培养温度超过30 ℃,菌株生长的速度会下降。

图4 温度对菌株MCDA01生长的影响Fig.4 Effect of temperature on the growth of strain MCDA01
2.2.4.2 pH对菌株MCDA01生长的影响 培养基初始pH对菌株MCDA01生长的影响如图5,菌株MCDA01在pH为2.0时几乎不生长;随着pH的增大,菌株在pH6.0~9.0范围内生长良好,其最适生长pH为8.0,而在pH<6.0或pH>9.0时,菌株的生长速率会显著下降。

图5 pH对菌株MCDA01生长的影响Fig.5 Effect of pH on the growth of strain MCDA01
2.2.4.3 NaCl浓度对菌株MCDA01生长的影响 NaCl浓度对菌株生长的影响如图6,菌株MCDA01在0~10%的NaCl浓度范围内可以生长。当NaCl浓度达到4%时,菌株MCDA01的生长状况最佳;NaCl浓度超过6%时,菌株的生长速率显著下降;NaCl浓度超过10%时,菌株几乎不生长。菌株MCDA01最适生长的NaCl浓度为4.0%,无NaCl时有一定的生长,属于耐盐海洋微生物。
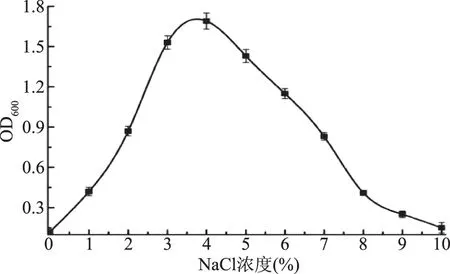
图6 NaCl浓度对菌株生长的影响Fig.6 Effect of the concentration of NaCl on the growth of strain MCDA01
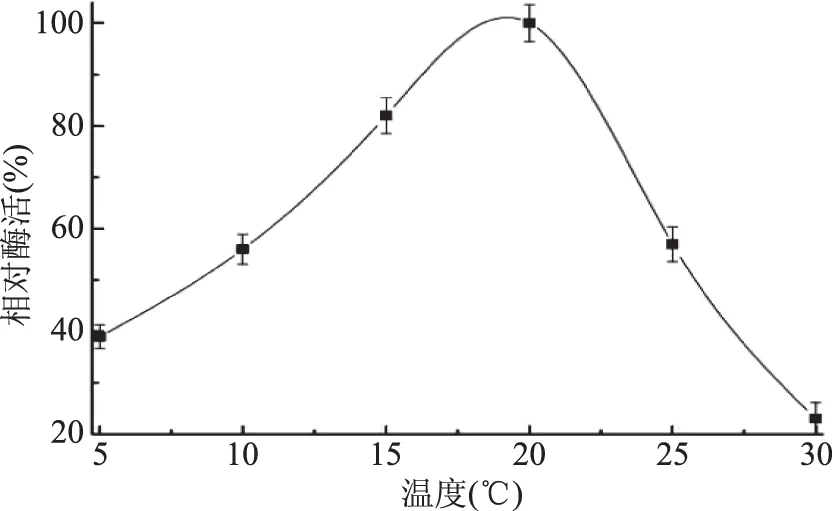
图7 温度对菌株MCDA01产酶的影响Fig.7 Effect of the temperature on enzyme production of the strain MCDA01
2.3 菌株MCDA01发酵产酶条件的确定
2.3.1 发酵温度对菌株MCDA01产酶的影响 如图7所示,在20 ℃时菌株MCDA01产几丁质脱乙酰酶的量最高,而15 ℃仅为最高产酶量的80%。温度超过20 ℃时,菌株的产酶量迅速下降。到30 ℃时,菌株的产酶量降到最高产酶量的20%左右。
2.3.2 发酵时间对菌株MCDA01产酶的影响 如图8所示,发酵时间大于24 h后随着发酵时间的增加,菌株MCDA01的产酶量显著增加,当发酵时间为72 h时菌株MCDA01的产酶量最高。当发酵时间超过72 h时,菌株MCDA01的相对酶活下降。

图8 发酵时间对菌株MCDA01产酶的影响Fig.8 Effect of the time on enzyme production of strain MCDA01
2.3.3 pH对菌株MCDA01发酵产酶的影响 如图9所示,随着初始pH的升高,菌株MCDA01的产酶量逐渐增加,当pH达到8.0时的产酶量达到最大,pH<5.0或>10.0时的酶产量会降低。菌株MCDA01发酵产酶的最适pH为8.0。
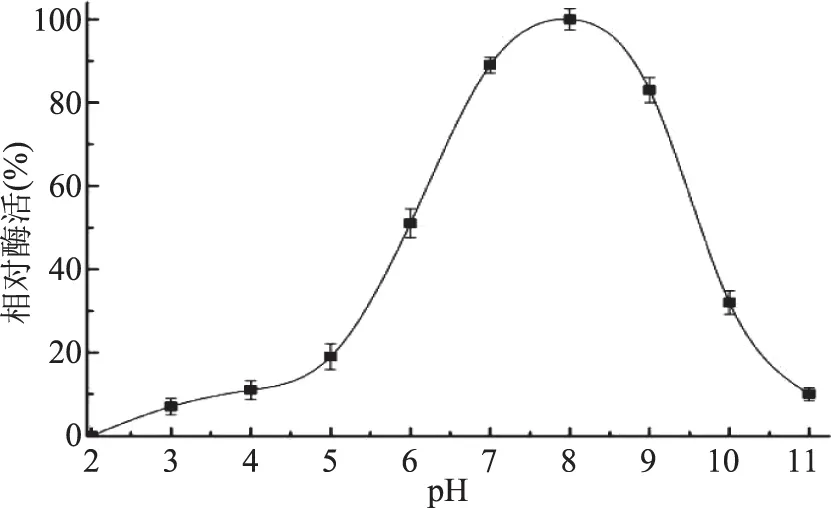
图9 pH对菌株MCDA01产酶的影响Fig.9 Effect of initial pH on enzyme production of strain MCDA01
2.3.4 装液量对菌株MCDA01发酵产酶的影响 如图10所示,当装液量不足20%时,酶产量逐渐增加;当装液量为20%时,菌株MCDA01的产酶量达到最大值;当装液量超过20%时,菌株的产酶量下降。
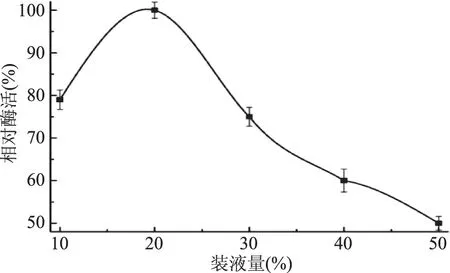
图10 装液量对菌株MCDA01产酶的影响Fig.10 Effect of liquid volume on enzyme production of strain MCDA01
2.3.5 诱导剂几丁质浓度对菌株MCDA01发酵产酶的影响 如图11所示,当不添加诱导剂几丁质时,菌株MCDA01的相对酶活为0,而诱导剂几丁质的添加量为1%~5%时产酶量达到最大值,低于1%或高于5%时,产酶量降低。综合考虑成本和产酶量,选择1%的几丁质添加量。

图11 几丁质浓度对MCDA01产酶的影响Fig.11 Effect of the concentration of chitin on enzyme production of strain MCDA01
2.4 菌株MCDA01发酵产酶条件正交优化实验
由R值可知,各个因素对酶活力影响大小顺序依次为:培养基起始pH>装液量>发酵时间>发酵温度>诱导剂几丁质浓度。由表4可知,16组实验中的最优组合为A3B2C2D4E1,由K值可知,最优组合为A2B3C2D2E1。验证实验表明,A2B3C2D2E1的酶活达到201.37 U/mL,因此确定A2B3C2D2E1为发酵产酶的最优组合,即发酵时间60 h,发酵温度20 ℃,培养基起始pH7,装液量20%,诱导剂浓度1%。
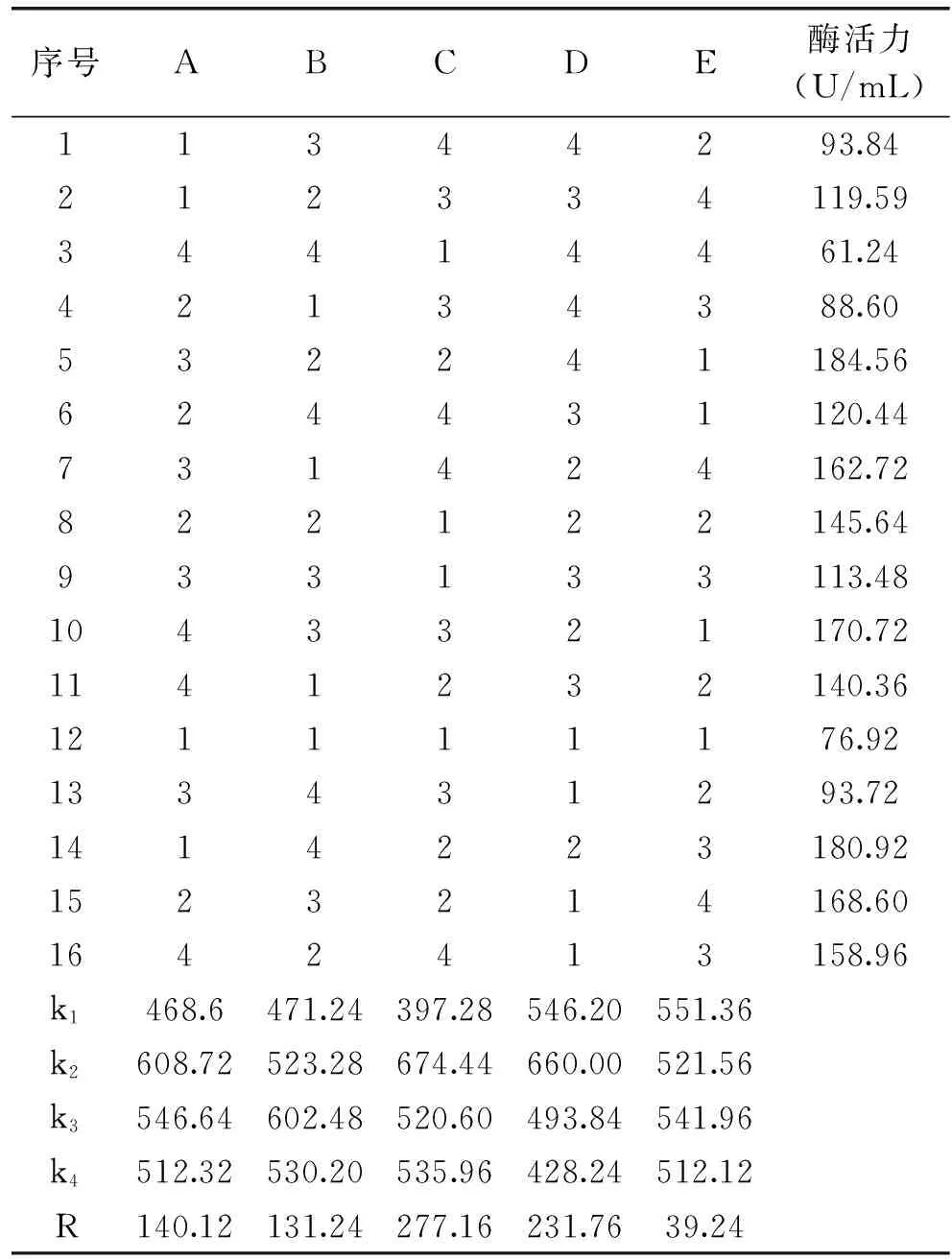
表4 L16(45)正交实验结果分析Table 4 Design and analysis of L16(45)orthogonal test
3 结论
从黄海海州湾燕尾港海域的海泥中筛选得到5株产几丁质脱乙酰酶的菌株,从中选定一株酶活最高的菌株MCDA01,通过形态学特征、生理生化特性以及16S rDNA序列分析将菌株MCDA01鉴定为天目不动杆菌(Acinetobacterschindleri)。目前,尚无天目不动杆菌分泌几丁质脱乙酰酶的报道。发酵条件优化后,菌株MCDA01产酶水平达到201.37 U/mL,与初始酶活相比提高了4.14倍。本实验丰富了产几丁质脱乙酰酶菌株的品种资源,并且为菌株MCDA01的进一步研究和开发利用奠定基础。
[1]Rudrapatnam N T,Farooqahmed S K. Chitin-The Undisputed Biomolecule of Great Potential[J]. Critical Reviews in Food Science and Nutrition,2003,43(1):61-87.
[2]王小红,马建标. 甲壳素,壳聚糖及其衍生物的应用[J]. 功能高分子学报,1999(2):197-202.
[3]严俊. 甲壳素的化学和应用[J]. 化学通报,1984(11):28-33.
[4]屠洁,刘冠卉,程曦. 壳聚糖的抑菌效果研究及其与苯甲酸钠的比较[J]. 食品工业科技,2008(5):83-85.
[5]Amorim R V,Melo E S,Carneirodacunha M G,et al. Chitosan fromSyncephalastrumracemosumused as a film support for lipase immobilization[J]. Bioresource Technology,2003,89(1):35-39.
[6]Araki Y,Ito E. A Pathway of Chitosan Formation in Mucor rouxii[J]. Biochemical & Biophysical Research Communications,2008,55(1):71-78.
[8]陈东辉,陈亮,胡家震. 壳聚糖制备方法的比较研究[J]. 化学研究与应用,2002,14(1):56-58.
[9]张立彦,曾庆孝. 酶法在低聚壳聚糖制备上的研究现状及展望[J]. 广东海洋大学学报,2000,20(4):72-78.
[10]Araki Y,Ito E. A pathway of chitosan formation in Mucor rouxii Enzymatic deacetylation of chitin[J]. European Journal of Biochemistry,1975,55(1):71-78.
[11]张菁菁,董文宾,缑敬轩. 几丁质脱乙酰酶菌株的筛选鉴定及酶学性质[J]. 食品工业科技,2012,33(6):244-246.
[12]Cai J,Yang J,Du Y,et al. Purification and characterization of chitin deacetylase fromScopulariopsisbrevicaulis[J]. Carbohydrate Polymers,2006,65(2):211-217.
[13]Sun Y,Zhang J,Wu S,et al. Statistical optimization for production of chitin deacetylase fromRhodococcuserythropolisHG05[J]. Automobile Technology,2014,102(1):649-652.
[14]Yong Z,Ro-Dong P,Muzzarelli R A A. Chitin Deacetylases:Properties and Applications[J]. Marine Drugs,2010,8(1):24-46.
[15]Srinivasan V R. Biotransformation of chitin to chitosan:U S,Patent 5739015[P]. 1998-4-14.
[16]Chatterjee S,Chatterjee S,Chatterjee B P,et al. Enhancement of growth and chitosan production by Rhizomes oryzae in whey medium by plant growth hormones[J]. International Journal of Biological Macromolecules,2008,42(2):120-126.
[17]王皓,吴丽,朱小花,等.甲壳素脱乙酰酶的研究概况及展望[J]. 中国生物工程杂志,2015,35(1):96-103.
[18]布坎南R E,吉本斯 N E. 伯杰氏细菌鉴定手册[D]. 第8版. 北京:科学出版社,1984:474-482.
[19]Kuwahara T,Norimatsu L,Nakayama H,et al. Genetic variation in 16S-23S rDNA internal transcribed spacer regions and the possible use of this genetic variation for molecular diagnosis of bacteroides species[J]. Microbiology & Immunology,2001,45(3):191.
Screeningandidentificationofamarinebacteriaproducingchitindeacetylaseandoptimizationofitsfermentationconditions
GUZhang-hui1,LIUShu2,HUSheng-yuan1,LAIJiang-li1,WANGShu-jun2,JIAOYu-liang1,FANGYao-wei1,2,*
(1.College of Marine Science and Technology,Huaihai Institute of Technology,Lianyungang 222005,China;2.Jiangsu Marine Resources Development Research Institute,Lianyungang 222005,China)
TS201.3
A
1002-0306(2017)18-0129-06
2017-03-20
顾张慧(1994-),女,硕士研究生,研究方向:海洋微生物生物技术,E-mail:18262792387@163.com。
*通讯作者:房耀维(1978-),男,博士,副教授,研究方向:海洋微生物生物技术,E-mail:foroei@163.com。
国家自然科学基金(31201687);中国博士后科学基金资助项目(2016M592245);教育部留学回国人员科研启动基金;江苏省自然科学基金面上项目(BK20151282);江苏省六大人才高峰项目(SWYY-195);江苏省高校“青蓝工程”;山东省博士后创新项目;淮海工学院科研创新基金(Z2014016);中国博士后科学基金(160034);青岛博士后基金。
10.13386/j.issn1002-0306.2017.18.025

