近红外成像用于双向电泳前的蛋白质快速定量
刘 云, 曹 嵩, 李 科, 李三华, 宋长伟, 覃 成, 朱欣婷*,4
(1.遵义医学院贵州省普通高等学校特色药物肿瘤防治重点实验室,贵州遵义 563000 2.贵州省麻醉与器官保护基础研究重点实验室,贵州遵义 563000 3.遵义医学院附属口腔医院,贵州遵义 563000 4.遵义医学院基础医学院,贵州遵义 563000)
双向电泳技术(2D)是蛋白组学研究过程中的常用技术,而蛋白质样品的准确定量是做好双向电泳的前提条件。常用的蛋白质定量方法有Bradford法和二辛可宁酸(BCA)法,两者都是通过测定样品吸光度值进行蛋白质的定量。但是由于双向电泳蛋白质样品在制备过程中会不可避免的引入硫脲、尿素、SDS、NP-40、Triton X-100等试剂,这些试剂易与Bradford法中的考马斯亮蓝(CBB)和BCA法中的二辛可宁酸反应显色而影响蛋白质定量的准确性。因此,上述两种常用的蛋白质定量方法不宜应用于2D实验。鉴于此,GE和Bio-Rad公司各自研发出专属于2D的蛋白质定量试剂盒。但是此类试剂盒价格昂贵,其售价为常规蛋白质定量试剂盒的10倍以上,且操作步骤繁琐、耗时耗力。因此,建立一种快速、准确、成本低廉的双向电泳蛋白质定量方法亟待研究人员的关注。
CBB属于三苯甲烷类染料。Bradford于1976年发现CBB-G250(以下简称G250)与蛋白质结合后,其最大吸收波长会从465 nm转移至595 nm[1],由此建立了Bradford蛋白质定量法,并被广泛应用于蛋白质定量实验。CBB常用于聚丙烯酰胺凝胶染色[2 - 4],也是Blue Native Page(BN-PAGE)电泳技术中不可或缺的染色剂[5]。Luo等[6]发现SDS-PAGE电泳中的蛋白条带经CBB染色后可在近红外线下发出荧光。本课题组前期也报道了一种CBB凝胶染色联合近红外成像用于双向电泳前的蛋白质定量的方法[4]。该方法的优点是试剂兼容性好、定量准确,缺点是在定量过程中需要先进行凝胶电泳,再染色扫描定量,操作步骤略显复杂。
在后续的研究工作中,本课题组发现牛血清白蛋白(BSA)溶液与G250混合后,在近红外荧光成像系统680 nm波长下可以被激发出荧光(发射波长720 nm),其荧光强度与蛋白质浓度之间具有良好的线性关系。进一步研究发现,在上述蛋白质溶液中加入硫脲、尿素等2D样品制备试剂后,并未影响到这种线性关系。基于上述发现,本课题组建立了一种基于近红外成像法以96孔板为载体的蛋白质定量方法。该方法具有操作简单、快速、重复性好,且成本低廉等优点,既能用于普通蛋白质定量实验,又适用于双向电泳前蛋白质样品的定量。
1 实验部分
1.1 仪器、试剂与材料
Li-Cor Odyssey红外荧光成像系统(美国,Gene公司)。
BSA、硫脲、尿素(美国,Sigma公司); G250、CHAPS(美国,Amresco公司);DTT、溴酚蓝(美国,Bio-Rad公司)。实验用水为超纯水。
人胃腺癌SGC-7901细胞株,购自中国科学院典型培养物保藏委员会细胞库。
1.2 制备待测蛋白质样品
以本实验中双向电泳蛋白质样品的制备过程为例:取含人胃腺癌SGC-7901细胞培养瓶,PBS冲洗3次后胰酶消化,用含10%胎牛血清的培养液终止消化。充分吹打后离心(800 r·min-1),弃上清液。加入3 mL双向电泳细胞裂解液(2 mol·L-1硫脲、7 mol·L-1尿素、65 mmol·L-1DTT、4% CHAPS、0.001%溴酚蓝),重悬后冰上超声破碎,每次超声运行10 s,暂停10 s,计5个循环。14 000 r·min-1,4 ℃,离心30 min。将上清液分装后于-80 ℃保存,待测。
1.3 制备蛋白质-G250混合溶液
1.3.1制备模拟2D实验的2D-BSA-G250溶液用上述双向电泳细胞裂解液配制2 mg·mL-1的BSA溶液(2D -BSA溶液),分别取0、5、15、25、35、50、75、100 μL加入到8支离心管,用超纯水补足到1 mL(蛋白终浓度分别为 0、0.01、0.03、0.05、0.07、0.1、0.15、0.2 mg·mL-1)。各管中再加入0.01% G250染液(即0.01% (m/V)G -250、4.5%(m/V)乙醇、8.5%(m/V)磷酸,下同) 5 mL,最终总体积为6 mL,充分混匀为双向电泳BSA-G250混合溶液(2D -BSA-G250)。
1.3.2制备普通BSA-G250溶液用超纯水配制2 mg·mL-1的BSA溶液,分别取0、5、15、25、35、50、75、100 μL加入到8支离心管,用超纯水补足到1 mL(蛋白终浓度分别为 0、0.01、0.03、0.05、0.07、0.1、0.15、0.2 mg·mL-1)。各管中再加入0.01%G250染液5 mL,最终总体积为6 mL,充分混匀为BSA-G250混合溶液(BSA-G250)。
1.3.3制备待测蛋白质-G250混合溶液按1.2取未知浓度的待测SGC-7901蛋白质样品50 μL,用超纯水补足1 mL,再加入0.01%G250染液5 mL,充分混匀为双向电泳SGC-7901蛋白质-G250溶液(2D -SGC-7901-G250)。
1.4 上样
取96孔板,每孔上样300 μL蛋白质-G250混合溶液(上样前充分混匀),具体上样情况见2.1。
1.5 扫描并框选荧光值
上样完成后需马上检测。将96孔板置于LI-COR Odyssey近红外荧光成像系统进行扫描。扫描物品选择microplate 2;focus offset选择3.5 mm;曝光强度设为5.0;成像质量选择medium;选择700 channel(即680 nm波长通道);选择成像区域后运行扫描程序并框选荧光区域。
1.6 绘制标准曲线
统计各孔荧光强度,以BSA浓度为X轴,吸光度值为Y轴,将荧光强度和各孔BSA蛋白浓度做相关分析,拟合标准曲线的回归方程。
1.7 计算未知样品蛋白量
将待测蛋白样品孔的荧光值代入回归方程,即可计算出待测蛋白质的终浓度。待测样品蛋白质的浓度(mg·mL-1)=蛋白质的终浓度×稀释倍数。
2 结果与讨论
2.1 扫描图像
图1所示为蛋白质-G250染液在680 nm波长下的扫描图像。每个圆圈代表96孔板的一个孔。大矩形框为标曲样品区:上排为2D -BSA-G250,下排为BSA-G250;两排样品从左到右浓度均分别为0、0.01、0.03、0.05、0.07、0.1、0.15、0.2 mg·mL-1;小矩形框中的两个孔为测试区:左孔为0.05 mg·mL-1的2D -BSA-G250;右孔为0.15 mg·mL-1的BSA-G250。箭头所指孔为待测的2D -SGC-7901-G250。由图1可见染液在近红外下可被激发出荧光信号,其主要原因是CBB在600~800 nm的近红外荧光波长下吸收光谱变化不大且信号相对较弱,但当其与蛋白质结合后,在680 nm左右时其荧光信号就会迅速增大[6]。需要注意的是混合后长时间放置会有聚集现象,因此最好在加样5 min之内就扫描检测,以减少误差。
2.2 荧光值的线性分析
在图1的基础上框选荧光值得图2。图2中白色圆圈框出的区域即各孔蛋白质-G250混合溶液荧光所在区域;ID为样品编号;数字代表每个样品的荧光值。

图1 蛋白质-G250溶液近红外荧光成像图(680 nm 通道)Fig.1 Near-infrared fluorescence imaging of protein-G250 solutions
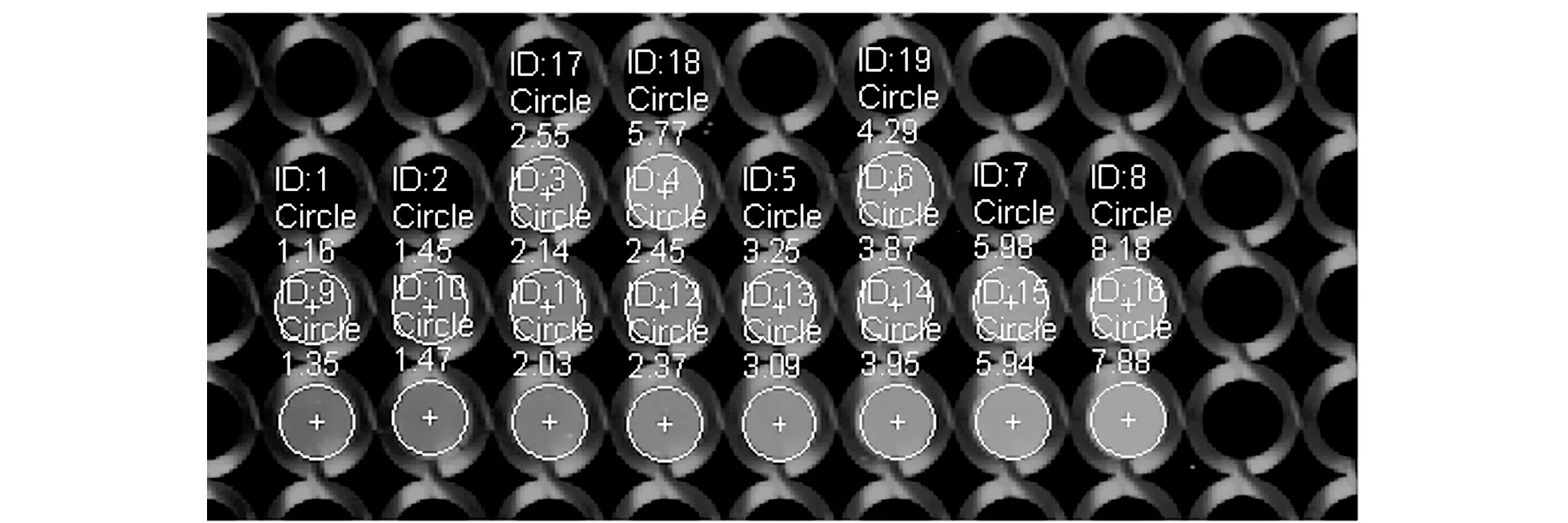
图2 蛋白质-G250溶液的近红外荧光成像图对应的荧光值Fig.2 Near-infrared fluorescence imaging and corresponding fluorescent intensity of protein-G250 solutions
将8个2D -BSA-G250样品(大方框,上排)荧光值和对应的BSA蛋白浓度做相关分析,得标准曲线(图3A),其回归方程为:Y=34.23X+0.949,R2=0.986(方程1)。将8个BSA-G250样品(大方框,下排)荧光值和对应的BSA蛋白浓度做相关分析,得到标准曲线(图3B),其回归方程为:Y=32.89X+1.001,R2=0.987(方程2)。从标准曲线可知,2D -BSA-G250和BSA-G250样品的荧光值和蛋白质浓度之间均具有良好的线性关系,因此可以用于双向电泳蛋白和普通蛋白的定量。
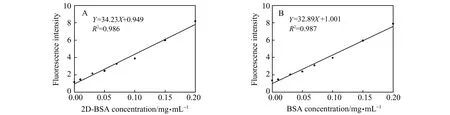
图3 2D -BSA-G250(A)和BSA-G250(B)的校准曲线 Fig.3 Calibration curves showing the fluorescent intensity with the increasing concentration of 2D -BSA-G250(A) and BSA-G250(B)
2.3 相对误差分析
将17号蛋白样品孔(2D -BSA-G250)荧光值2.55代入方程1计算得蛋白质浓度为0.047 mg·mL-1,相对误差为6%。将18号蛋白样品孔(BSA-G250)的荧光值5.77代入方程2计算得到蛋白质浓度为0.141 mg·mL-1,相对误差为6%。定量结果显示, 2D -BSA-G250和BSA-G250 两种样品制备的标准曲线均具有良好的线性关系,且测定浓度值与实际浓度值偏差较小。因此,该方法可以用于包括2D实验在内的蛋白质定量。
2.4 SGC-7901总蛋白质定量
将19号蛋白样品孔(2D -SGC-7901-G250)的荧光值4.29代入方程1,计算得细胞总蛋白质浓度为0.098 mg·mL-1,则原液蛋白质浓度为0.098×20(稀释倍数)=1.96 mg·mL-1。
3 结论
本研究建立了一种基于近红外成像法以96孔板为载体的蛋白质定量方法,与常规蛋白质定量方法比较,该方法具有独特的优势:(1)与BCA法相比,不需37 ℃孵育30 min,蛋白质-G250混合溶液制备完成后即可上机扫描,实验步骤简化,操作方便。(2)与凝胶染色法相比,省去了SDS-PAGE这一步骤,因此能大幅减少每次定量实验所需的时间;此外,以孔板(如96孔板)为载体,一次可检测几十个样品,检测通量是凝胶染色法的数倍。(3)与Bradford法相比,可适用于双向电泳蛋白质样品及某些试剂兼容性较差的蛋白质样品浓度的测定,建立的方法使用范围广,实用性强。以上所述显示,本文所建立方法省时易操作,样本检测通量大,且能排除干扰物影响,可用于双向电泳在内的蛋白质样品的快速定量。

