中华蜜蜂化学感受蛋白CSP1的功能模式分析及亚细胞定位
谭静,宋欣密,傅晓斌,唐明珠,吴帆,华启云,李红亮
中华蜜蜂化学感受蛋白CSP1的功能模式分析及亚细胞定位
谭静1,宋欣密1,傅晓斌1,唐明珠1,吴帆1,华启云2,李红亮1
(1中国计量大学生命科学学院/生物计量及检验检疫技术浙江省重点实验室,杭州 310018;2金华市农业科学院,浙江金华 321000)
【目的】研究中华蜜蜂(,简称中蜂)重组化学感受蛋白CSP1与不同化学信息素的结合功能、模式及其亚细胞定位,明确触角特异表达的CSP1蛋白功能。【方法】将克隆的中蜂构建至pET-32a(+)载体并转入BL21(DE3)感受态细菌中,挑取单克隆菌落接种于LB培养基,培养过夜后按1%(V/V)进行转接,继续培养至OD600≈0.4左右时,加入IPTG至终浓度为1 mmol·L-1后继续诱导5 h。将诱导好的CSP1大肠杆菌菌液离心弃上清,再加入细菌裂解液超声破碎,离心后上清用镍柱对CSP1重组蛋白进行亲和层析纯化,再经PBS透析液透析后,最终获得可溶的具有生物活性的CSP1重组蛋白。设定荧光分光光度计的激发波长为281 nm,测定竞争性荧光探针1-NPN与CSP1的相互作用,用Scatchard方程计算其解离常数,再计算获得CSP1与各种候选化学信息素的亲和力。以CSPMbraA6晶体结构(PDB代码:1n8v)为模板,通过同源建模和分子对接解析CSP1蛋白与化学信息素的结合模式,根据MolDock Score选出最佳对接模型进行作用机理分析,获得结合时配基周围的CSP1残基分布以及氢键产生情况,以此获得信息素与CSP1的结合模式。最后将CSP1免疫注射兔子获得多克隆抗体,并对中蜂工蜂触角进行低温固定、脱水和包埋后进行超薄切片,然后对样品切片进行免疫胶体金电镜定位,以解析CSP1在触角感器中的亚细胞分布。【结果】成功诱导获得可溶性的重组中蜂CSP1蛋白,利用荧光光谱分析1-NPN与CSP1的解离常数1-NPN为2.1 μmol·L-1,结合位点数为0.99,表明结合时基本以1﹕1结合,线性相关系数为0.9933。在9种化学信息物质中,CSP1与两种蜜蜂蜂王信息素成分对羟基苯甲酸甲酯(HOB)和9-羰基-2癸烯酸(9-ODA),和植物挥发物成分3-蒈烯均具有较强的结合能力,其中与CSP1亲和力最强的对羟基苯甲酸甲酯的[50]和解离常数D分别达到10.1和7.68 μmol·L-1。分子对接显示不同配基与CSP1的结合分别是通过与CSP1疏水腔中特定氨基酸残基(或借助于氢键)作用结合。典型的如CSP1与HOB相互作用过程中,预测主要由8个氨基酸残基贡献能量,包括4个疏水性残基(Phe30、Phe44、Leu70和Phe85),3个极性中性残基(Tyr26、Tyr27和Ser41)以及1个酸性残基(Asp40),其中Asp40中两个羧基上的氧原子分别与HOB苯环中羟基上的氧原子分别产生一个氢键。免疫电镜定位结果显示CSP1主要表达于板形感器周围附属支持细胞中,少量表达于感器内部,这与气味结合蛋白的定位存在明显区别。【结论】中蜂CSP1与两种蜂王信息素成分和某些植物花香成分具有较强的结合能力,集合了信息素结合蛋白和普通气味结合蛋白的功能和相似的作用模式,但其亚细胞定位与气味结合蛋白存在明显区别,显示化学感受类蛋白生理特征的多样性。
中华蜜蜂;化学感受蛋白;配基结合功能;分子对接;免疫细胞化学定位
0 引言
【研究意义】在复杂的自然环境中,昆虫通过其敏锐的化学通讯系统来识别所处环境中的各种化学信息物质,并做出反应[1]。昆虫对性信息素以及植物挥发物的信息识别主要通过嗅觉系统,但是某些昆虫触角化学感受蛋白也被证实能够感受性信息素及植物挥发物成分[2-3]。而在昆虫化学感受系统中,往往存在着两类酸性、低分子量的蛋白,即气味结合蛋白(odorant- binding proteins,OBPs)和化学感受蛋白(chemosensory proteins, CSPs),其中根据功能的差异,OBPs又被分为普通气味结合蛋白(general odorant-binding proteins,GOBPs)和信息素结合蛋白(pheromone- binding proteins,PBPs)[4],CSPs由于最早发现于昆虫化学感受器官,因此被认为与感受化学信息有关,故被称为化学感受蛋白[5-6]。作为中国的本土蜜蜂,中华蜜蜂(,简称中蜂)善于采集零星蜜源,具有灵敏发达的嗅觉和化学感受系统[7]。触角是蜜蜂重要的嗅觉器官,除了高丰度地表达OBPs外,笔者团队前期发现了一个高丰度表达于工蜂触角的化学感受蛋白CSP1[8],鉴定其是否参与对性信息素及植物挥发物的化学感受识别功能,将对于明确触角独特CSPs蛋白功能,以及丰富中蜂甚至昆虫对化学信息素的化学感受机制,都具有重要的理论意义。【前人研究进展】OBPs和CSPs广泛存在于昆虫的化学通讯系统中,二者分别含有6个和4个保守的半胱氨酸,分别形成3对和2对二硫键。典型的OBPs一般特异表达于触角等嗅觉器官,与嗅觉功能相关;而作为昆虫化学通讯系统的重要组成部分,CSPs除具有化学感受功能外,还具有复杂的生理功能,如肢体再生[9]、胚胎发育[10],甚至型变中的行为调控[11]等。然而愈来愈多报道证明许多CSPs也体现了与OBPs类似的嗅觉功能和特征,如在苜蓿盲蝽()[12-13]、西花蓟马()[14]和烟粉虱()[15]中,CSPs参与包括驱避性气味在内的不同寄生植物挥发物的识别;在沙漠蝗()[16]、竹节虫()[17]和日本弓背蚁()[18]中,CSPs也能与昆虫信息挥发物高亲和力结合。由于CSP1高丰度地表达于工蜂触角,因此CSP1有可能与中蜂的化学感受和嗅觉生理功能有着密切的联系。蜜蜂的化学感受蛋白家族主要包括6个CSPs,且这些CSPs的表达部位与表达时期各不相同,而功能方面则包含了从胚胎发育、化学感受信号传导到角质层的合成等[8,19]不同的作用功能。如意大利蜜蜂(,简称意蜂)中CSP5主要参与了胚胎表皮生成[10],CSP3主要与幼虫信息素中的脂肪酸成分结合[20]。而中蜂的CSP3则发现表达于工蜂触角B型毛形感器[21],也可与某些植物挥发物结合,因此可能作为中蜂化学感受系统的一部分,在其搜寻蜜源时作为气味分子运载体发挥一定的作用[3]。【本研究切入点】在前期研究中,鉴定了中蜂的一个化学感受蛋白CSP1[22],并发现其高丰度地表达于工蜂触角[8],暗示CSP1很可能与中蜂的嗅觉和化学感受功能密切相关。本研究从CSP1的体外功能、作用模式以及亚细胞定位等3方面对中蜂CSP1基因功能进行深入解析。【拟解决的关键问题】对中蜂的一个触角高丰度表达的化学感受蛋白CSP1进行结合功能和模式分析及亚细胞定位。包括获得重组的中蜂CSP1蛋白;利用荧光竞争试验解析CSP1与各种化学信息素的结合功能;通过分子对接解析CSP1与各种化学信息分子的作用模式及可能起主要作用的氨基酸关键位点;利用免疫电镜技术获得CSP1在工蜂触角上的亚细胞定位情况。
1 材料与方法
试验于2016 年在中国计量大学生命科学学院/生物计量及检验检疫技术浙江省重点实验室完成。
1.1 试剂与仪器
中蜂CSP1重组蛋白质粒pET-32a(+)/CSP1由笔者实验室保存于大肠杆菌DH5中;凝胶回收和质粒提取试剂盒、pMD18-T载体以及实验所需内切酶均购于TaKaRa公司;镍柱ProteinIsoTMNi2+-NTA Resin购于北京全式金生物技术有限公司;Ampicillin、甲醇和各种磷酸盐等化学试剂均购自上海生工生物工程股份有限公司;9-ODA(纯度>95 %)为中国科学院西双版纳植物园文平博士馈赠,其他所有化学信息素和气味信息(纯度>97%及以上)均购自上海百灵威化学技术有限公司,其他试剂均为国产分析纯试剂。
1.2 方法
1.2.1 中蜂CSP1重组蛋白的诱导 将克隆的中蜂[22]构建至pET-32a (+)载体中,获得的pET-32a (+)/CSP1质粒转入BL21()感受态菌中,平板涂布后,挑取单克隆菌落接种于5 mL LB培养基(含氨苄青霉素60 μg·mL-1)中,37℃ 220 r/min 振荡培养过夜,次日按1%(V/V)接种量转接 200 mL LB培养基(含氨苄青霉素60 μg·mL-1),继续培养至 OD600≈ 0.4左右时,向原菌液加入 IPTG 至终浓度为 1 mmol·L-1,30℃ 200 r/min诱导5 h。
1.2.2 中蜂CSP1重组蛋白的纯化 将200 mL诱导好的CSP1大肠杆菌菌液,离心弃上清,加入5 mL的细菌裂解液放置30 min后,超声破碎15 min,离心后取上清,利用镍柱对表达于细胞裂解上清液内的CSP1重组蛋白进行亲和层析纯化,最后经过PBS透析液(pH 7.4)透析72 h后,经SDS-PAGE鉴定后,最终获得可溶的具有生物活性的CSP1重组蛋白,利用Bradford法对CSP1重组蛋白浓度进行测定和定量,并置于-20℃保存备用。
1.2.3 中蜂CSP1蛋白与1-NPN荧光探针的相互作用 利用RF-5301PC型荧光分光光度计(日本岛津公司)研究CSP1与1-NPN的相互作用,测试1-NPN 是否可作为荧光报告子[23]。设定荧光分光光度计的激发波长为281 nm,荧光发射与激发狭缝宽度为5 nm,扫描范围为290—500 nm。用PBS缓冲液将CSP1重组蛋白稀释至1 µmol·L-1,取3 mL于石英比色皿中,并以100 µmol·L-1的 1-NPN 溶液进行滴定,每次混匀静止3 min,记录蛋白最大荧光发射波长处的荧光强度。根据下列Scatchard方程[24]对光谱数据线性化:
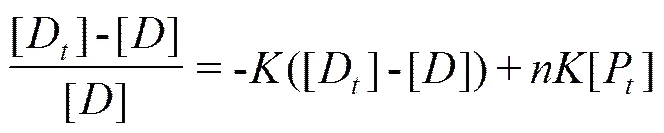
式中,[D]为总1-NPN浓度,[]为体系中游离1-NPN浓度,为重组蛋白与荧光报告子的结合常数,[P]为试验中CSP1的浓度,为二者结合位点数。
1.2.4 中蜂CSP1蛋白的荧光竞争试验 1-NPN 作为荧光报告子,利用竞争结合试验[3]来研究候选配基与中蜂CSP1重组蛋白的解离常数。测试时将9种不同配基用甲醇配制成浓度为1 mmol·L-1,并分别逐次地加入到CSP1与1-NPN的混合液中,记录体系最大荧光发射光谱。根据以下公式[25]计算各个配基的解离常数D:
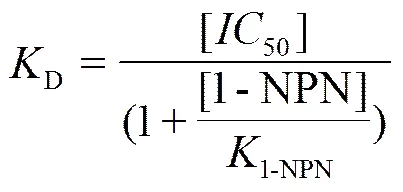
式中,[50]为50%的荧光报告子被替换时候选配基的浓度,[1-NPN]是混合液中游离的1-NPN浓度,1-NPN为CSP1与1-NPN的解离常数。
1.2.5 中蜂CSP1蛋白与气味信息的分子对接 CSP1的预测三维晶体结构是由SWISS-MODEL工作区[26]基于甘蓝夜蛾()的CSPMbraA6晶体结构(PDB entry code,1n8v)[27]中预测获得。所有信息气味物质的3D结构均是从NCBI的PubChem中下载获得。利用Molegro Virtual Docker(MVD)4.2软件将气味物质的3D结构与CSP1蛋白预测晶体结构进行对接,其中根据MolDock Optimizer和MolDock Score两项指标作为搜索标准和评分依据[28]。根据MolDock Score选出最佳对接模型进行作用机理分析,获得结合时配基周围的CSP1残基分布以及氢键产生情况,以此获得各种气味信息与CSP1的结合模式。
1.2.6 中蜂CSP1蛋白的胶体金免疫定位 将纯化后的中蜂CSP1重组蛋白按文献[29]多抗制备方法免疫注射新西兰大白兔,免疫获得多克隆抗体。先对中蜂触角进行低温固定、脱水、渗透、包埋、聚合后进行超薄切片,然后对样品切片进行免疫胶体金标记:将附有切片的载网置于ddH2O,润湿5 min;0.01 mol·L-1PBS(含有1% BSA、0.05% TritonX-100、0.05% Tween20 pH 7.4)常温封闭5 min;CSP1兔抗用0.01 mol·L-1PBS(含有1% BSA、0.05% Tween20 pH 7.4)稀释50倍,将载网置于稀释好的抗体上孵育过夜(同时做空白对照);洗涤之后用稀释100倍的结合有金颗粒的二抗标记1 h;洗涤后用3%的醋酸双氧铀染色5 min,再用柠檬酸铅染色3 min,最后用滤纸吸干,将载网装载入日立H-7650型透射电子显微镜中观察拍照。
2 结果
2.1 重组CSP1蛋白的诱导及纯化
将pET-32a (+)/CSP1质粒转入BL21(DE3)感受态菌中,用IPTG诱导CSP1重组表达,并用镍柱进行纯化、经PBS透析后最终获得中蜂CSP1重组蛋白。蛋白诱导和纯化后的SDS-PAGE电泳结果(考染结果)如图1所示,泳道1为IPTG诱导前的对照,泳道2为IPTG诱导后结果,泳道3为纯化后的CSP1重组蛋白。由图1可明显看出经IPTG诱导的CSP1重组蛋白产生表达以及纯化情况。

M:蛋白分子量标准protein molecular weight marker;1、2:分别显示未经和经过1 mmol·L-1 IPTG诱导的含有pET32-CSP1质粒的细菌裂解产物the whole of bacterial lysis proteins including pET32-CSP1 plasmid without and with induction of 1 mmol·L-1 IPTG, respectively;3:纯化后的重组CSP1蛋白(图右侧箭头所指)The purified recombinant CSP1 protein, which is labelled by an arrow on the right of the figure
2.2 中蜂CSP1与1-NPN报告子的荧光光谱分析
发射光谱扫描确定CSP1的激发波长在281 nm,用100 μmol·L-1的1-NPN溶液滴定1 μmol·L-1重组CSP1蛋白溶液,并进行荧光扫描,如图2所示,荧光光谱的多项式拟合以及Scatchard方程线性化拟合的相关系数分别达到0.9993和0.9933,显示拟合较好。根据公式(1),1-NPN与CSP1的解离常数1-NPN为2.10 μmol·L-1,结合位点数为0.99,表明CSP1与1-NPN结合时基本上为1﹕1结合,因此1-NPN能够用于CSP1与候选化学信息素功能研究时的竞争性荧光报告子。
2.3 中蜂CSP1与不同化学信息配基的竞争性荧光结合分析
共选择了9种化学信息配基进行配基竞争性荧光结合试验,如图3所示,9种配基均能将1-NPN从CSP1的相对荧光值竞争至50%以下,所有配基的解离常数如表1所示,亲和力最强的是两种蜂王信息素成分对羟基苯甲酸甲酯(HOB)和9-ODA以及植物挥发物成分3-蒈烯,三者的解离常数D均<10 μmol·L-1,其他6种配基与CSP1的解离常数均>10 μmol·L-1。

A:不同浓度 1-NPN荧光配基在1 μmol·L-1的重组CSP1 蛋白中的荧光强度Fluorescence intensity of 1 μmol·L-1 recombinant CSP1 protein when different concentrations of 1-NPN added;B:1-NPN与CSP1结合的Scatchard 方程 Scatchard plot of 1-NPN with CSP1

表1 候选化学信息素与重组CSP1蛋白的结合试验和分子对接
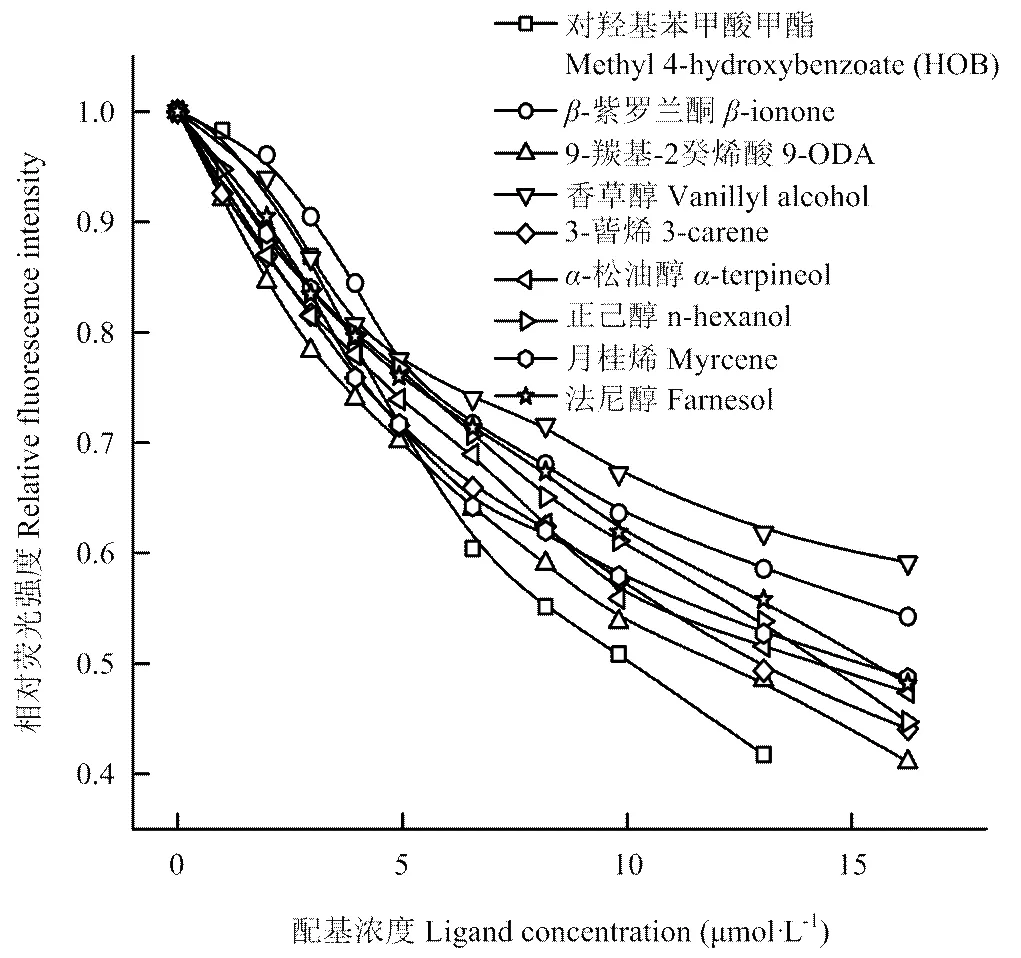
图3 候选配基与荧光配基1-NPN于重组CSP1蛋白的竞争结合
2.4 以对羟基苯甲酸甲酯为代表的蛋白与配基作用模式分析
根据斜纹夜蛾的CSPMbraA6晶体结构(PDB entry code,1n8v),利用SWISS-MODEL预测获得CSP1的三维晶体结构。HOB的3D结构在NCBI(注册码:7456)中下载获得。根据MVD中的MolDock能量得分情况,推测CSP1与HOB的最佳结合模式。基于该模型找到CSP1与HOB相互作用过程中能量贡献主要的8个氨基酸残基,包括4个疏水性残基(Phe30、Phe44、Leu70和Phe85),3个极性中性残基(Tyr26、Tyr27和Ser41)和1个酸性残基(Asp40)。其中主要有两个-螺旋结构:含Tyr26、Tyr27和Phe30,以及Asp40、Ser41和Phe44,与其他的两个氨基酸残基,共同组成了一个HOB的结合腔(图4-A)。且预测HOB苯环中羟基上的氧原子分别与CSP1肽链中Asp40两个羧基上的氧原子各产生一个氢键(图4-B蓝色虚线)。
2.5 中蜂CSP1蛋白的胶体金免疫定位
利用胶体金标记免疫电镜定位技术对中蜂化学感受蛋白CSP1进行了触角定位,结果如图5所示,可以看出大量的金颗粒被标记在嗅觉感器的板形感器周围的附属组织中(图5-B、5-C),而对于蜜蜂的主要嗅觉感受器——板形感器内部(图5-D),虽然也有金颗粒的标记,但在数量上明显低于板形感器周围的附属细胞组织,这也与中蜂的普通气味结合蛋白ASP2主要表达于嗅觉功能的板形感器[30]存在显著差异,所以笔者认为CSP1尽管能与信息素等气味信息物质结合,但与气味结合蛋白的生物特征存在明显区别。
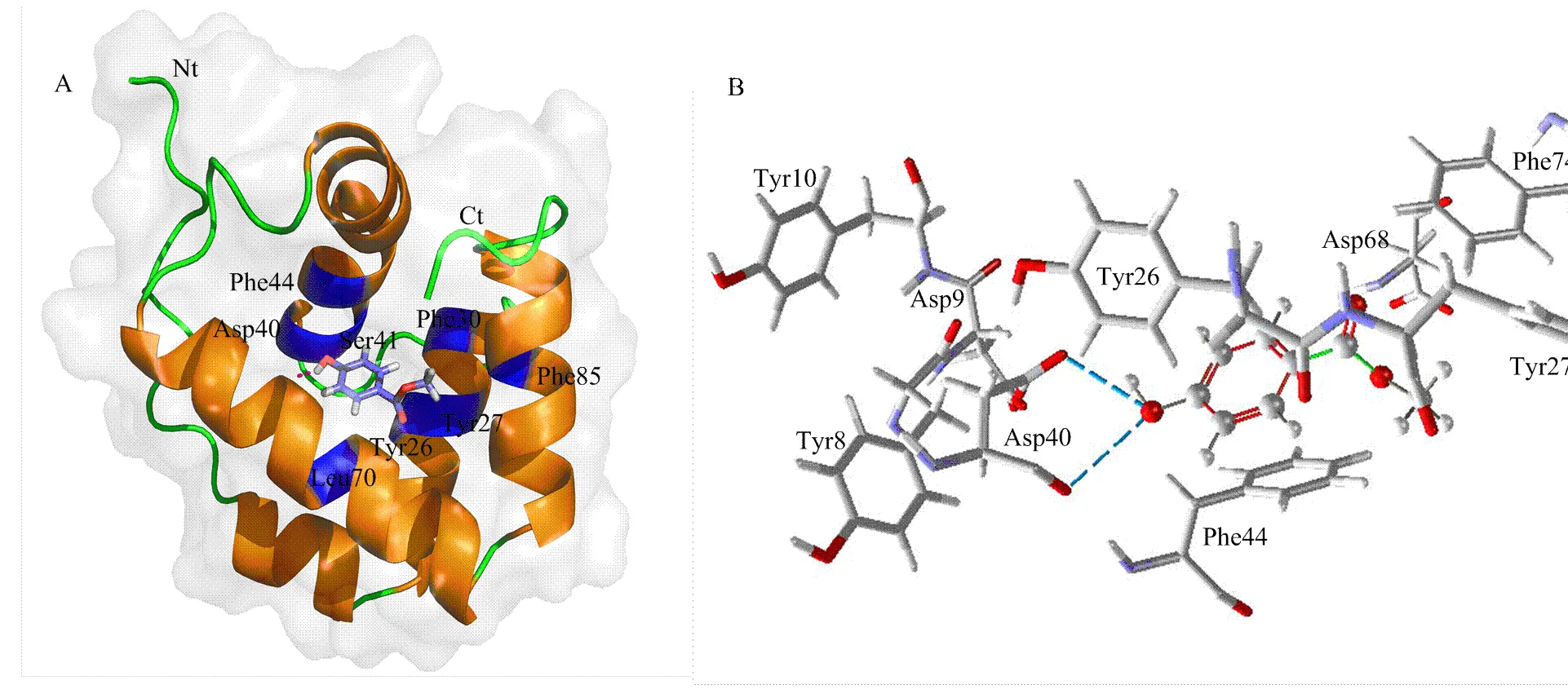
A:对羟基苯甲酸甲酯与N端柔性区域的α螺旋作用。蓝色代表提供疏水相互作用的残基 HOB interacts with residues located on α-helices as well as N-terminal flexible region. Blue represented the residues that provide hydrophobic interactions;B:CSP1与对羟基苯甲酸甲酯作用过程中的氢键The hydrogen bonds of CSP1 interacting with HOB
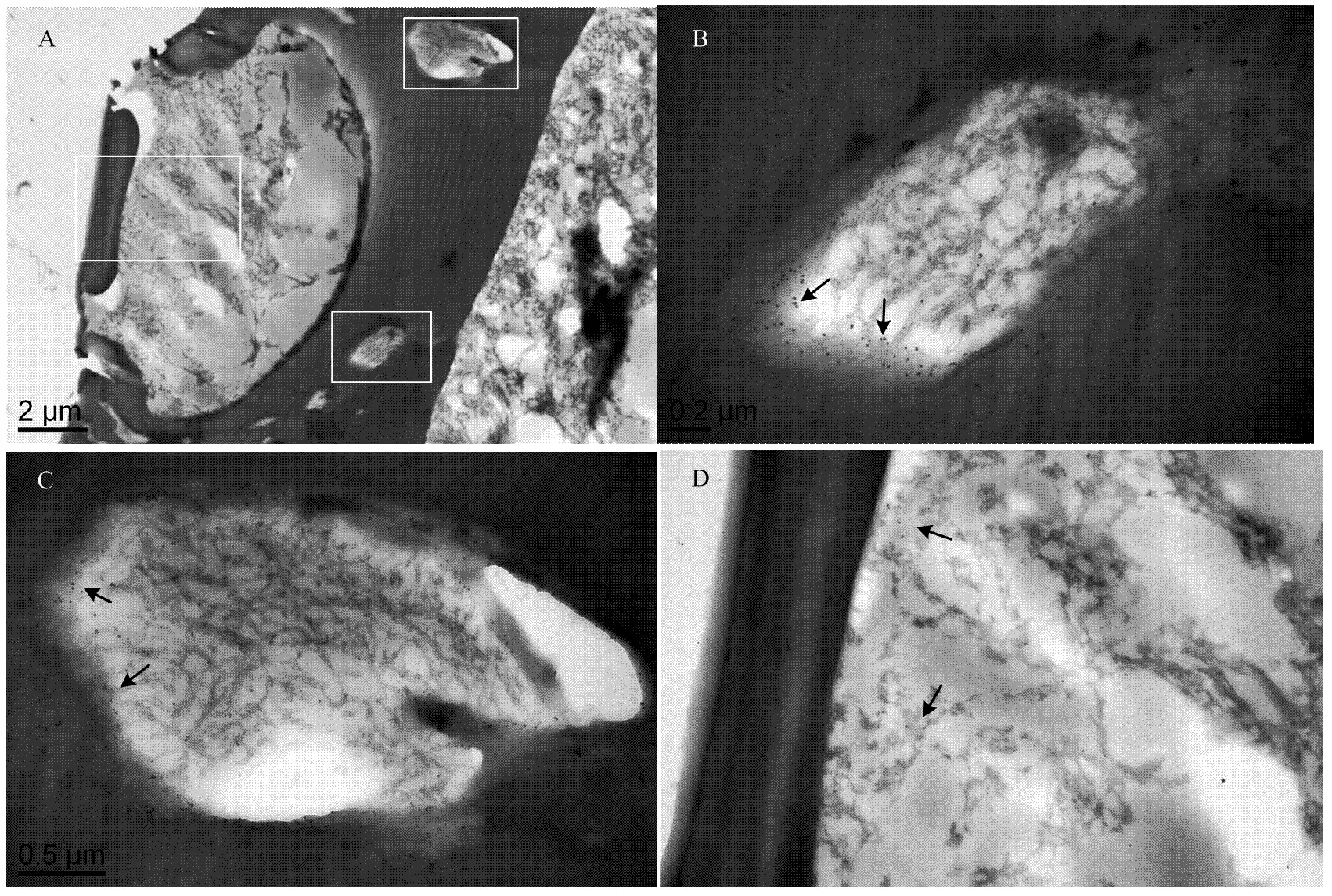
图5 基于免疫电镜的中蜂CSP1触角板形感器中的的亚细胞定位
3 讨论
在前期研究中,CSP1基因被证实高丰度地表达于中蜂的工蜂触角,表明其可能与中蜂的嗅觉功能有关[8,22]。为进一步深入研究CSP1的结合功能和模式,本研究首先获得了CSP1的重组蛋白,再利用竞争荧光法研究了基于1-NPN荧光配基的CSP1与9种候选化学信息素配基的结合作用。1-NPN是一种常用于研究昆虫蛋白功能的荧光报告子,已经应用于多种CSPs的功能研究中[3,15,31],本试验中1-NPN与CSP1的D值为2.10 μmol·L-1,与其他昆虫CSPs相比,如1-NPN与造纸胡蜂()的CSP以及家蚕()中CSP4的D值为分别为2.2和4.8 μmol·L-1[32-33],均高于中蜂CSP1与1-NPN的D,表明CSP1与1-NPN的结合较强,1-NPN能够用于CSP1与候选化学信息素功能研究时的竞争性荧光报告子。
在所有测试的化学信息素中,CSP1与两种蜂王信息素成分——对羟基苯甲酸甲酯(HOB)和9-ODA结合力最强,HOB与9-ODA属于蜂王上颚腺信息素成分之一[34],其作用为抑制工蜂卵巢发育[35],抑制工蜂培育新蜂王[36],吸引工蜂聚集到蜂王周围[37]。这与先前报道的另外两个中蜂信息素结合蛋白ASP1[38]和OBP10[39]功能相似,而且CSP1与HOB的亲和力要较二者更强,表明CSP1可能在工蜂感受蜂王上颚腺信息素的生殖调控和社会行为方面甚至较PBPs发挥着更重要的作用。
此外,本研究选用的5种植物挥发物成分包括2种烯烃、2种醇类和1种酮类,都是常见的花香味植物性挥发物[40-43],均与CSP1具有较强的亲和力,说明作为中蜂化学感受系统中的信息转运蛋白,CSP1可能在中蜂访花和寻找蜜源植物时作为气味分子转运载体而发挥一定的作用。在5种植物挥发物中CSP1与3-蒈烯亲和力最强,由于3-蒈烯不但存在于很多植物花香成分中,还存在于对某些昆虫如烟粉虱产生驱避作用的寄主植物中[44],而烟粉虱CSP1也被证实与3-蒈烯有较强的亲和力[15],不过3-蒈烯是否能对中蜂产生驱避作用还需要进一步研究。此外,-紫罗兰酮是一种非常易于与各种昆虫嗅觉相关蛋白结合的花香类物质[13,45-47],本研究中CSP1与其也有较强的亲和力,解离常数D为14.84 μmol·L-1,亲和力要强于中蜂另外一个化学感受蛋白CSP3(D为23.07 μmol·L-1[23]),与两个中蜂信息素结合蛋白ASP1(D为14.69 μmol·L-1[38])和OBP10(D为10.20 μmol·L-1[39])较为接近,而明显弱于中蜂气味结合蛋白ASP2(与-紫罗兰酮的D为5.14 μmol·L-1[3]),表明CSP1在-紫罗兰酮这种蜜蜂偏好性气味的识别和结合能力强于化学感受蛋白CSP3,接近信息素结合蛋白ASP1和OBP10,但不及普通气味结合蛋白ASP2。
利用分子对接对CSP1与荧光竞争测试配基进行能量预测(表1),作为蛋白与小分子结合时的自由能表征值,MolDock得分与荧光结合结果基本相符。另外发现在9种测试化学信息物质中,有5种能与CSP1蛋白间产生氢键,且其中4种都与Asp40作用产生氢键,暗示Asp40在CSP1与化学信息素的结合过程中发挥着重要作用。在气味结合蛋白AcerASP2与配基的结合过程中,其疏水结合腔中的Lys74和Lys51残基也容易与配基产生氢键[23]。表明嗅觉相关蛋白与气味信息物质的结合很有可能是与信息分子和蛋白结合腔内的某些特定氨基酸残基间产生氢键密切相关。然而另一方面,3-蒈烯、-松油醇、月桂烯和-紫罗兰酮等4种物质均未与CSP1产生氢键,表明氢键的作用也是局限性的,还会受到气味分子整体结构与CSP1疏水内腔微结构的其他相互作用的综合因素影响和限制。
通过免疫胶体金电镜定位,CSP1主要被标记在板形感器的周围附属组织;在板形感器内部也有少量标记。这与中蜂普通气味结合蛋白ASP2主要表达于嗅觉功能的板形感器[30]存在差异显著。此外,在中蜂化学感受蛋白CSP3的免疫定位中,几乎所有的板形感器即嗅觉感器几乎没有任何标记,但是发现板形感器周边的裂缝内的浅沟却被明显标记[21]。因此,CSP1尽管能与蜂王信息素和某些化学信息物质具有较强结合能力,但与普通气味结合蛋白的组织定位存在明显区别,与气味结合蛋白的作用方式也大相径庭。
4 结论
中蜂CSP1与两种蜜蜂蜂王信息素成分对羟基苯甲酸甲酯(HOB)和9-ODA以及植物挥发物成分3-蒈烯具有较强的结合能力,且与对羟基苯甲酸甲酯亲和力最强。而CSP1的胶体金免疫电镜定位试验发现板形感器的内部以及周围附属组织中均有金颗粒的标记,但周围附属组织中的金颗粒多于感器内部,这与普通气味结合蛋白ASP2主要表达于嗅觉功能的板形感器存在差异,所以笔者认为CSP1是一种能与信息素等物质识别,但与其他嗅觉基因定位生理特征存在明显区别的化学感受蛋白。
References
[1] PELOSI P, ZHOU J J, BAN L P, Calvello M. Soluble proteins in insect chemical communication., 2006, 63(14): 1658-1676.
[2] 刘金香, 钟国华, 谢建军, 官珊, 胡美英. 昆虫化学感受蛋白研究进展. 昆虫学报, 2005, 48(3): 418-426.
LIU J X, ZHONG G H, XIE J J, GUAN S, HU M Y. Recent advances in chemosensory proteins of insects., 2005, 48(3): 418-426. (in Chinese)
[3] 李红亮, 张林雅, 倪翠侠, 商晗武. 中华蜜蜂化学感受蛋白AcerCSP3的配基结合功能分析. 昆虫学报, 2011, 54(3): 259-264.
LI H L, ZHANG L Y, NI C X, SHANG H W. Molecular binding characterization with chemical ligands of a chemosensory protein AcerCSP3 in the Chinese honeybee,(Hymenoptera: Apidae)., 2011, 54(3): 259-264. (in Chinese)
[4] VOGT R G, PRESTWICH G D, LERNER M R. Odorant- binding-protein subfamilies associate with distinct classes of olfactory receptor neurons in insects.,1991, 22(1): 74-84.
[5] PELOSI P, IOVINELLA I, FELICIOLI A, DANI F R. Soluble proteins of chemical communication: an overview across arthropods.,2014, 5: 320.
[6] 徐浩智, 游银伟, 张龙. 昆虫化学感受蛋白及其功能研究进展. 农业生物技术学报, 2015, 23(1): 118-125.
XU Z H, YOU Y W, ZHANG L. A review on chemosensory protein and its functions in insects., 2015, 23(1): 118-125. (in Chinese)
[7] 杨冠煌. 中华蜜蜂. 北京: 中国农业科技出版社, 2001.
Yang G H.. Beijing: China Agricultural Science and Technology Press, 2001. (in Chinese)
[8] 倪翠侠, 张林雅, 李红亮, 商晗武. 中华蜜蜂化学感受蛋白基因家族克隆及表达特征分析. 中国农业科学,2013, 46(8): 1706-1715.
NI C X, ZHANG L Y, LI H L, SHANG H W. Molecular cloning and expression profiles analysis of chemosensory protein genes family in the Chinese honeybee ()., 2013, 46(8): 1706-1715. (in Chinese)
[9] NOMURA A, KAWASAKI K, KUBO T, NATORI S. Purification and localization of p10, a novel protein that increases in nymphal regenerating legs of(American cockroach).,1992, 36(3): 391-398.
[10] MALESZKA J, FORET S, SAINT R, MALESZKA R. RNAi-induced phenotypes suggest a novel role for a chemosensory protein CSP5 in the development of embryonic integument in the honeybee ().,2007, 217(3): 189-196.
[11] GUO W, WANG X, MA Z, XUE L, HAN J, YU D, KANG L. CSP and takeout genes modulate the switch between attraction and repulsion during behavioral phase change in the migratory locust.,2011, 7(2): e1001291.
[12] GU S H, WANG S Y, ZHANG X Y, JI P, LIU JT, WANG G R, WU K M, GUO Y Y, ZHOU J J, ZHANG Y J. Functional characterizations of chemosensory proteins of the alfalfa plant bugindicate their involvement in host recognition.,2012, 7(8): e42871.
[13] SUN L, ZHOU J J, GU S H, XIAO H J, GUO Y Y, LIU Z W, ZHANG Y J. Chemosensillum immunolocalization and ligand specificity of chemosensory proteins in the alfalfa plant bug(Goeze).,2015, 5: 8073.
[14] ZHANG Z K, LEI Z R. Identification, expression profiling and fluorescence-based binding assays of a chemosensory protein gene from the Western flower thrips,.,2015, 10(1): e0117726.
[15] 吴帆, 张晓曼, 赵磊, 崔旭红, 李红亮, 罗晨. Q型烟粉虱化学感受蛋白CSP1与植物挥发物的结合特征. 中国农业科学,2015, 48(10): 1955-1961.
WU F, ZHANG X M, ZHAO L, CUI X H, LI H L, LUO C. Binding characterization of chemosensory protein CSP1 in theBiotype Q with plant volatiles., 2015, 48(10): 1955-1961. (in Chinese)
[16] ANGELI S, CERON F, SCALONI A, MONTI M, MONTEFORTI G, MINNOCCI A, PETACCHI R, PELOSI P. Purification, structural characterization, cloning and immunocytochemical localization of chemoreception proteins from.,1999, 262(3): 745-754.
[17] MONTEFORTI G, ANGELI S, PETACCHI R, MINNOCCI A. Ultrastructural characterization of antennal sensilla and immunocytochemical localization of a chemosensory protein inBrünner (Phasmida: Phasmatidae).,2002, 30(3): 195-205.
[18] OZAKI M, WADAKATSUMATA A, FUJIKAWA K, IWASAKI M, YOKOHARI F, SATOJI Y, NISIMURA T, YAMAOKA R. Ant nestmate and non-nestmate discrimination by a chemosensory sensillum.,2005, 309(5732): 311-314.
[19] FORET S, WANNER K W, MALESZKA R. Chemosensory proteins in the honey bee: Insights from the annotated genome, comparative analyses and expressional profiling.,2007, 37(1): 19-28.
[20] BRIAND L, SWASDIPAN N, NESPOULOUS C, BEZIRARD V, BLON F, HUET J C, EBERT P, PERNOLLET J C. Characterization of a chemosensory protein (ASP3c) from honeybee (L.) as a brood pheromone carrier., 2002, 269(18): 4586-4596.
[21] LI H L, LOU B G, CHENG J A, GAO Q K. The chemosensory protein of Chinese honeybee,: molecular cloning of cDNA, immunocytochemical localization and expression.,2007, 52(10): 1355-1364.
[22] 李红亮, 倪翠侠, 姚瑞, 高其康, 商晗武. 中华蜜蜂化学感受蛋白基因. 昆虫学报,2010, 53(9): 962-968.
LI H L, NI C X, YAO R, GAO Q K, SHANG H W. Molecular cloning, characterization, and expression pattern of chemosensory protein 1 gene () in the Chinese honeybee,(Hymenoptera: Apidae)., 2010, 53(9): 962-968. (in Chinese)
[23] 李红亮, 张林雅, 庄树林, 倪翠侠, 韩宝瑜, 商晗武. 中华蜜蜂普通气味结合蛋白ASP2的气味结合功能模式分析. 中国农业科学,2013, 46(1): 154-161.
LI H L, ZHANG L Y, ZHUANG S L, NI C X, HAN B Y, SHANG H W. Interpretation of odorant binding function and mode of general odorant binding protein ASP2 in Chinese honeybee ()., 2013, 46(1): 154-161. (in Chinese)
[24] 范成平, 商志才, 郭明, 俞庆森. 荧光法研究加替沙星与牛乳铁蛋白的相互结合作用. 浙江大学学报(理学版), 2005, 32(1): 62-65.
FAN C P, SHANG Z C, GUO M, YU Q S. Study on the interaction between gatifloxacin and bovine lactoferrin by fluorescence spectrophotometry., 2005, 32(1): 62-65. (in Chinese)
[25] BAN L, SCALONI A, D'AMBROSIO C, ZHANG L, YAHN Y, PELOSI P. Biochemical characterization and bacterial expression of an odorant-binding protein from.,2003, 60(2): 390-400.
[26] SCHWEDE T, KOPP J, GUEX N, PEITSCH M C. SWISS-MODEL: an automated protein homology-modeling server.,2003, 31(13): 3381-3385.
[27] CAMPANACCI V, LARTIGUE A, HALLBERG B M, JONES T A, Giudiciorticoni MT, Tegoni M, Cambillau C. Moth chemosensory protein exhibits drastic conformational changes and cooperativity on ligand binding.,2003, 100(9): 5069-5074.
[28] RENE T, CHRISTENSEN M H. MolDock: a new technique for high-accuracy molecular docking.,2006, 49(11): 3315-3321.
[29] 张林雅, 谢冰花, 倪翠侠, 赵磊, 李红亮, 商晗武. 中华蜜蜂 Orco 嗅觉受体基因的克隆、表达及亚细胞定位. 昆虫学报,2012, 55(11): 1246-1254.
ZHANG L Y, XIE B H, NI C X, ZHAO L, LI H L, SHANG H W. Cloning, expression and subcellular localization of the olfactory co-receptor Orco gene in the Chinese honeybee,(Hymentoptera: Apidae)., 2012, 55(11): 1246-1254. (in Chinese)
[30] LI H L, ZHANG Y L, GAO Q K, CHENG J A, LOU B G. Molecular identification of cDNA, immunolocalization, and expression of a putative odorant-binding protein from an Asian honeybee,.,2008, 34(12): 1593-1601.
[31] 郭兴国, 陈莹, 邢秋婷, 邢万静, 阚云超, 乔惠丽. 家蚕化学感受蛋白CSP16的表达及结合特性分析. 昆虫学报,2016, 59(6): 613-621.
GUO X G, CHEN Y, XING Q T, XING W J, KAN Y C, QIAO H L. Expression and binding characterization of chemosensory protein CSP16 in the silkworm,.,2016, 59(6): 613-621. (in Chinese)
[32] CALVELLO M, GUERRA N, BRANDAZZA A, AMBROSIO C D, SCALONI A, DANI F R, TURILLAZZI S, PELOSI P. Soluble proteins of chemical communication in the social wasp., 2003, 60(9): 1933-1943.
[33] 邓培渊, 乔惠丽, 李丹丹, 鲁云风, 李生才, 阚云超. 家蚕化学感受蛋白BmCSP4表达谱及结合特性分析. 昆虫学报, 2011, 54(8): 869-876.
DENG P Y, QIAO H L, LI D D, LU Y F, LI S C, KAN Y C. Expression pattern and binding specificity of chemosensory protein BmCSP4 in the silkworm,.,2011, 54(8): 869-876. (in Chinese)
[34] 胡福良, 玄红专. 蜜蜂蜂王信息素研究进展. 应用昆虫学报,2004, 41(3): 208-211.
HU F L, XUAN H Z. The recent advances in honeybee queen pheromone., 2004, 41(3): 208-211. (in Chinese)
[35] HOOVER S E R, KEELING C I, WINSTON M L, SLESSOR K N. The effect of queen pheromones on worker honey bee ovary development.,2003, 90(10): 477-480.
[36] MELATHOPOULOS A P, WINSTON M L, PETTIS J S, PANKIW T. Effect of queen mandibular pheromone initiation and maintenance of queen cells in the honey bee (L.).,1996, 128(128): 263-272.
[37] KAMINISKI L A, SLESSOR K N, WINSTON M L, HAY N W, BORDEN J H. Honeybee response to queen mandibular pheromone in laboratory bioassays.1990, 16(3): 841-850.
[38] 翁琛, 张林雅, 赵磊, 付余霞, 罗晨, 李红亮. 中华蜜蜂性信息素结合蛋白ASP1的原核表达及配基结合特性分析. 昆虫学报,2013, 56(10): 1110-1116.
WENG C, ZHANG L Y, ZHAO L, FU Y X, LUO C, LI H L. Prokaryotic expression and ligand binding characteristics of pheromone binding protein ASP1 in the Chinese honeybee ()., 2013, 56(10): 1110-1116. (in Chinese)
[39] 吴帆, 黄君君, 谭静, 唐明珠, 李红亮. 中华蜜蜂信息素结合蛋白OBP10的基因克隆、原核表达和配基结合特性分析. 昆虫学报,2016, 59(1): 25-32.
WU F, HUANG J J, TAN J, TANG M Z, LI H L. Molecular cloning, prokaryotic expression and ligand-binding characterization of a novel pheromone binding protein OBP10 in(Hymenoptera: Apidae)., 2016, 59(1): 25-32. (in Chinese)
[40] KNUDSEN J T, TOLLSTEN L, BERGSTROM L G. Floral scents—a checklist of volatile compounds isolated by head-space techniques.,1993, 33(2): 253-280.
[41] 吴丹, 罗世琼, 杨占南, 马敬, 余正文. 桂花不同组织器官挥发物质特征. 西南农业学报,2014, 27(3): 1243-1247.
WU D, LUO S Q, YANG Z N, MA J, YU Z W. Characteristics of volatile phytochemical components of different organs ofvar.., 2014, 27(3): 1243-1247. (in Chinese)
[42] FARREARMENGOL G, FILELLA I, LLUSIA J, PENUELAS J. Pollination mode determines floral scent.2015, 61: 44-53.
[43] 王伟, 戴华国, 陈发棣, 郭维明. 菊花花部特征及花冠精油组分与访花昆虫的相关性. 植物生态学报,2008, 32(4): 776-785.
WAND W, DAI H G, CHEN F D, GUO W M. Correlation between floral traits of chrysanthemum () and insect visitors., 2008, 32(4): 776-785. (in Chinese)
[44] 赵艳群, 赵金瑞, 毛黎娟, 施祖华. 不同番茄品种挥发物对B型烟粉虱寄主选择行为的影响. 应用生态学报,2012, 23(9): 2509-2514.
ZHAO Y Q, ZHAO J R, MAO L J, SHI Z H. Effects of the volatiles from different tomato varieties on host selection behavior of B-biotype., 2012, 23(9): 2509-2514. (in Chinese)
[45] 张帅, 张永军, 苏宏华, 高希武, 郭予元. 中红侧沟茧蜂化学感受蛋白MmedCSP1的结合特征. 昆虫学报,2009, 52(8): 838-844.
ZHANG S, ZHANG Y J, SU H H, GAO X W, GUO Y Y. Binding characterization of chemosensory protein MmedCSP1 in(Hymenoptera: Braconidae)., 2009, 52(8): 838-844. (in Chinese)
[46] SUN H Y, GUAN L, FENG H L, YIN J, CAO Y Z, XI J H, LI K B. Functional characterization of chemosensory proteins in the scarab beetle,Faldermann (Coleoptera: Scarabaeida).,2014, 9(9): e107059.
[47] DENG S S, YIN J, ZHONG T, CAO Y Z, LI K B. Function and immunocytochemical localization of two novel odorant-binding proteins in olfactory sensilla of the scarab beetleFaldermann (Coleoptera: scarabaeidae).,2012, 37(2): 141-150.
(责任编辑 岳梅)
Functional mode and immunocytochemical localization of Chemosensory protein 1 (CSP1) in
TAN Jing1, SONG XinMi1, Fu XiaoBin1, TANG MingZhu1, Wu Fan1, HUA QiYun2, LI HongLiang1
(1College of Life Sciences, China Jiliang University/Zhejiang Provincial Key Laboratory of Biometrology and Inspection & Quarantine, Hangzhou 310018;2)
【Objective】The objective of this study is to research the functional mode with candidate semiochemicals and immunocytochemical localization of the recombinant chemosensory protein1 (CSP1) in Chinese honey bee,. It has an important theoretical significance for clarifying the function of CSP1, which is specifically expressed in antennae, and enriching the chemosensory mechanism of Chinese honey bee to semiochemicals. 【Method】was constructed into the pET-32a (+) vector and transferred into BL21 (DE3) competent. The single positive clone was inoculated on LB medium and cultured overnight (followed by 1% (v/v) transfer to the OD600≈0.4), then added the IPTG with a final concentration of 1 mmol·L-1and continued to be induced for 5 h. The recombinant CSP1 protein existing in the supernatant was purified by Ni2+-NTA affinity chromatography. The soluble recombinant CSP1 protein with biological activity was finally obtained after dialyzed by PBS (pH 7.4). When the excitation wavelength of the fluorescence spectrophotometer was 281 nm, the interaction between the fluorescent probe 1-NPN and CSP1 was determined. The dissociation constant was calculated by Scatchard equation, and the binding affinities of CSP1 with various candidate semiochemicals were also measured. Based on the CSPMbraA6 crystal structure (PDB entry code: 1n8v) as template, the binding model of CSP1 protein and semiochemicals was analyzed by homology modeling and molecular docking. In order to obtain the binding mode of pheromone and CSP1, according to MolDock Score, the best mechanism of the docking model was analyzed, and the hydrogen bonds between the ligand and the CSP1 residues were obtained. Finally, the polyclonal antibody of CSP1 was obtained by immunizing rabbits, and the antennae of worker bee were immobilized at low temperature, dehydrated and embedded. The subcellular distribution of CSP1 on the antennal sections samples were then immunogolded by colloidal gold and finally observed with the electron microscopy. 【Result】 After the soluble recombinant CSP1 protein was successfully induced and purified, the fluorescence quenching assay was used to obtain the dissociation constant1-NPNbetween CSP1 and 1-NPN as 2.1 μmol·L-1. The number of binding siteswas 0.99, indicating the bind ratio of CSP1 and 1-NPN was 1﹕1. In the candidate 9 semiochemicals, CSP1 and two queen pheromone components: p-hydroxybenzoic acid methyl ester (HOB) and (E)-9-Oxodec-2-enoic acid (9-ODA), and plant volatile components, 3-carene had a strong ability to bind, the [50] and dissociation constantDof the most strongly bound HOB was 10.1 and 7.68 μmol·L-1, respectively. The results of molecular docking showed that the binding of various ligands to CSP1 was due to some specific amino acid residues (or by means of the hydrogen bonds) in the hydrophobic cavity of CSP1. Typically, the interaction between CSP1 and HOB is predicted by the contribution of eight amino acid residues, including four hydrophobic residues (Phe30, Phe44, Leu70 and Phe85), three polar neutral residues (Tyr26, Tyr27 and Ser41) and one acidic residue (Asp40). The two hydrogen bonds were produced between the oxygen atoms on the two carboxyl groups in Asp40 and the oxygen atoms on the hydroxyl group in the HOB benzene ring, respectively. The results of immuno-electron microscopy showed that CSP1 was mainly expressed in the ancillary supporting cells around the sensilla placodea, while only slightly expressed in the inner area of sensilla placodea. It was significantly different from the localization of odorant binding proteins.【Conclusion】 CSP1 ofhas a strong ability to bind two queen pheromone components and some plant floral scents, and concentrates the function of pheromone binding protein and general odorant-binding protein. Although their functional modes are similar, there are significant differences in the antennal subcellular localization between CSP1 and odorant-binding proteins, showing the physiological characteristics variation of chemoreceptive proteins.
; chemosensory protein; functional mode; molecular docking; immunocytochemical localization
2017-02-21;接受日期:2017-03-20
国家自然科学基金(31372254)、金华市农业公益项目(2016-4-001)
谭静,E-mail:786867455@qq.com。通信作者李红亮,E-mail:hlli@cjlu.edu.cn

