连翘脂素去甲基衍生物的合成
樊宏宇
(大连富生天然药物开发有限公司, 辽宁 大连 116000)
·研究简报·
连翘脂素去甲基衍生物的合成
樊宏宇
(大连富生天然药物开发有限公司, 辽宁 大连 116000)
以连翘苷为原料,依次经水解反应、氯化铝/吡啶催化的去甲基化反应和差向异构化反应,合成了两个连翘脂素去甲基衍生物(1和2),其结构经1H NMR,13C NMR, 2D NMR(COSY, NOESY, HSQC, HMBC), IR和MS(ESI)确证。经结构解析对比,1和2与连翘苷的大鼠体内次级代谢产物一致。
连翘苷; 去甲基化反应; 差向异构化反应; 合成; 体内代谢产物
Abstract: Starting with phillyrin, two (+)-phillygenin desmethyl derivatives(1and2) were synthesized by hydrolysis reaction, aluminum chloride/pyridine catalyzed demethylation and epimerization, respectively. The structures were confirmed by1H NMR,13C NMR, 2D NMR(COSY, NOESY, HSQC, HMBC), IR and MS(ESI).1and2were consistent with the secondary metabolites in rats.
Keywords: phillyrin; demethylation; epimerization; synthesis; metabolite
连翘为木犀科连翘属植物连翘的干燥果实,主要分布于河南、山西、陕西、山东等地,常用于治疗急性风热感冒、痈肿疮毒、淋巴结结核和尿路感染等[1-3]。连翘的主要药效成分之一为连翘苷,具有抗病毒[4-6]、抗肿瘤[7]、抗菌[8]、保肝[9-11]、抗炎[12]、抗衰老[13]、降血脂[14]和抗氧化[15]等药理作用[4-15]。
去甲基化反应是一类重要的有机反应,在药物合成和天然产物合成、修饰中有广泛应用。1962年,Robert[16]在AlCl3/Pyridine/CH2Cl2体系中,在回流条件下脱除了香草醛的甲基,为酚羟基邻位甲氧基脱除甲基提供了一个新方法。2008年,Eckart等[17]采用该方法,选择性脱除了罗汉松脂酚、牛蒡子苷元和络石甙元酚羟基邻位甲氧基的甲基,并推测该方法也适用于连翘脂素的去甲基化反应。
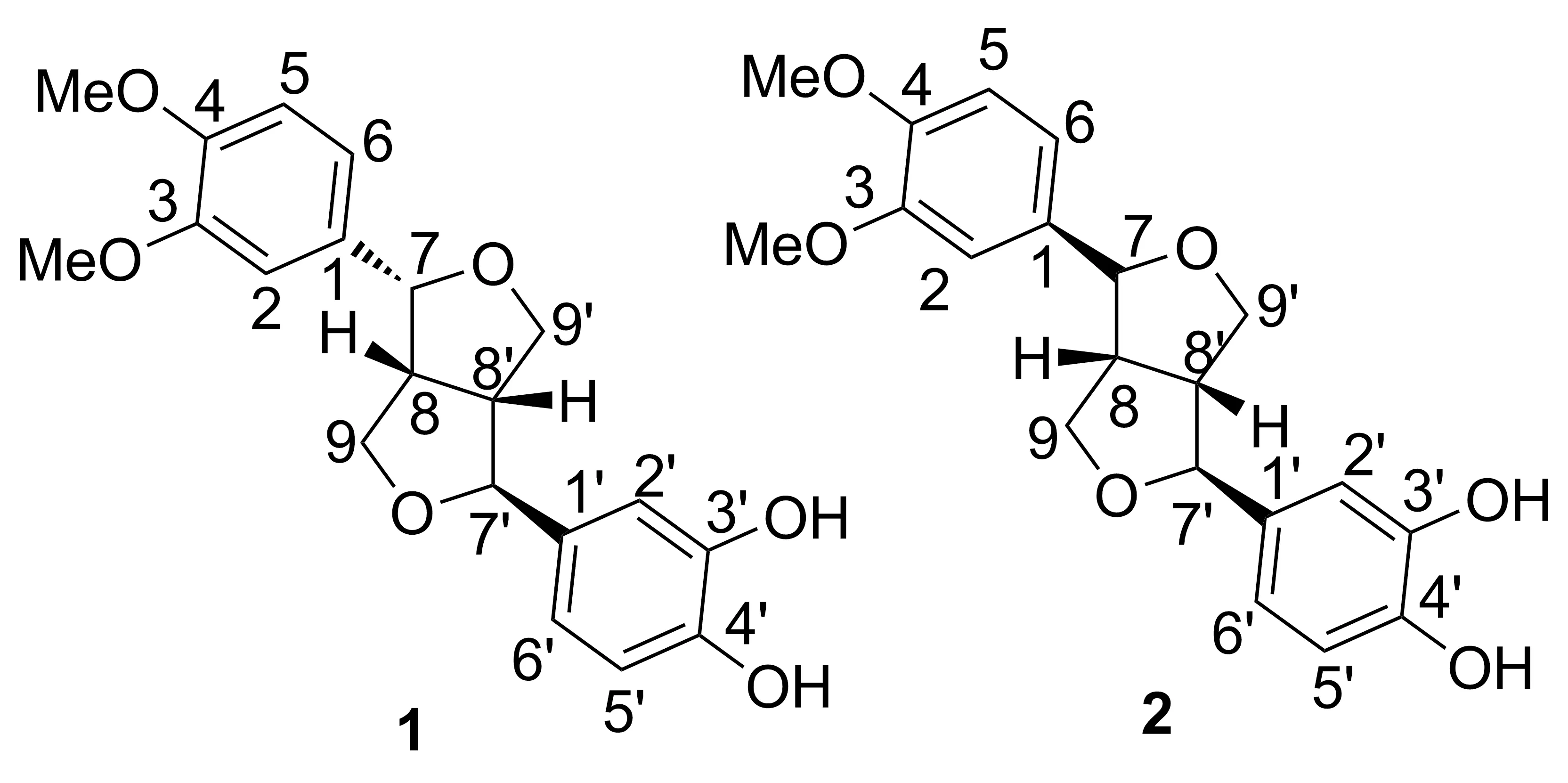
Chart 1
我们在实验中发现,大鼠静脉注射连翘苷后,其尿样经LC-MS检测到两个与时间相关的代谢物(1和2, Chart 1),其特征峰为25.6 min(m/z
Scheme1
381.131)和24.16(m/z381.131)。分析连翘苷的结构特点并参考类似物的代谢方式,我们推测1和2为连翘脂素的O-去甲基化产物,O-去甲基位点为3′-位甲氧基。1和2在药物代谢和毒理研究中具有重要价值,其化学合成方法具有较高应用价值。
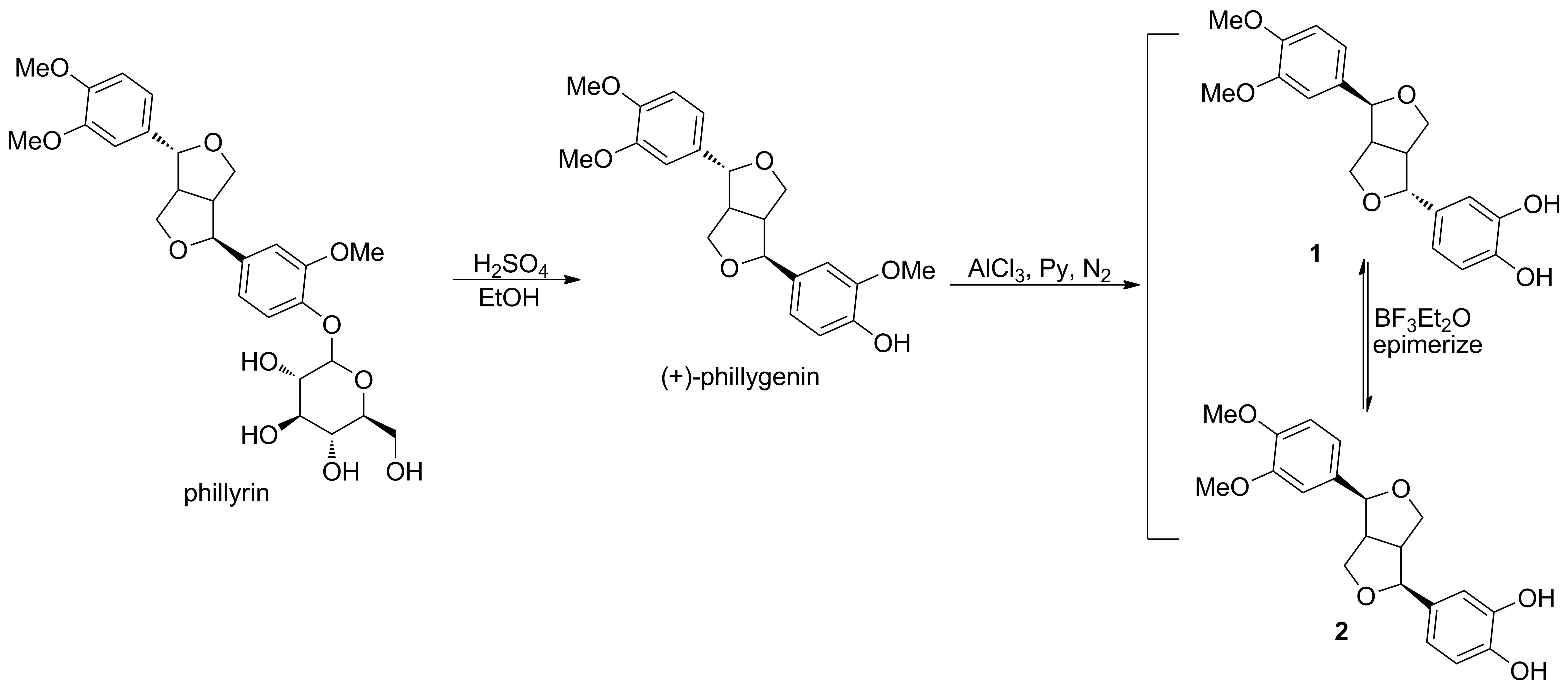
本文以连翘苷为起始原料,以连翘苷为原料,依次经水解反应、氯化铝/吡啶催化的去甲基化反应和差向异构化反应,合成了1和2(Scheme 1),其结构经1H NMR,13C NMR, 2D NMR(COSY, NOESY, HSQC, HMBC), IR和MS(ESI)确证。
1 实验部分
1.1 仪器与试剂
Varian Mercury-400 MHz型核磁共振仪 (DMSO-d6为溶剂,TMS为内标);Thermo Nicolet Nexus 470 FT-IR型傅立叶变换红外光谱仪(KBr压片);Bruker Daltonics APEX III型傅立叶变换离子回旋共振质谱仪;Q-TOF Synapt型四极杆-飞行时间串联质谱仪(ESI源);Waters Acquity UPLC型液相色谱仪。
所用试剂均为分析纯。
1.2 合成
(1) 连翘脂素的合成[18]
在反应瓶中加入连翘苷2.0 g(3.74 mmol)和80%乙醇50 mL,搅拌使其溶解;加入浓硫酸1.5 mL,回流反应3 h。用10%氢氧化钠溶液调至pH 7,蒸除乙醇,残余物经硅胶柱层析[洗脱剂:A=V(氯仿)/V(甲醇)=10/1]纯化得白色晶体1.2 g,收率95%;1H NMRδ: 8.92(s, 1H), 6.93(d,J=8.8 Hz, 3H), 6.89(d,J=8.3 Hz, 1H), 6.77(dt,J=18.3 Hz, 4.8 Hz, 2H), 4.80(d,J=6.0 Hz, 1H), 4.33(d,J=6.9 Hz, 1H), 4.07(d,J=9.2 Hz, 1H), 3.83~3.68(m, 11H), 3.42~3.33(m, 1H), 3.08(t,J=8.7 Hz, 1H), 2.83(dd,J=15.7 Hz, 6.6 Hz, 1H);13C NMRδ: 49.84, 54.41, 55.93, 56.06, 69.33, 70.8, 81.73, 87.49, 109.88, 110.75, 111.99, 115.65, 118.03, 119.12, 131.69, 132.80, 146.47, 148.01, 148.08, 148.94; MS(ESI)m/z: 394.88{[M+Na]+}。
(2)1和2的合成[19-20]
氮气保护下,在干燥的三口瓶中加入连翘脂素940.0 mg(2.52 mmol)和无水吡啶20 mL,搅拌使其溶解;缓慢升温至120 ℃,分3批加入无水三氯化铝740.0 mg(5.54 mmol),反应20 h(TLC跟踪)。旋干溶剂,残余物经硅胶柱层析(洗脱剂:A=20/1)纯化得1和2的混合物M。经制备液相分离得1639 mg,产率70.8%和2127.8 mg,产率14.2%。
在三口瓶中加入1716 mg(2 mmol)和二氯甲烷20 mL,搅拌使其溶解;滴加三氟化硼乙醚络合物2 mL,滴毕,反应4 h。加水淬灭反应,分液,有机相用水洗涤,无水硫酸钠干燥,蒸除溶剂,经制备液相分离得灰白色固体2342 mg,回收灰白色固体1338 mg,转位产率50%(HPLC归一化)。
1:1H NMRδ: 8.87(br, 2H, OH), 6.93~6.58(m, 6H), 4.78~4.77(d,J=6.4 Hz, 1H), 4.25~4.23(d,J=6.8 Hz, 1H), 4.03~4.01(d,J=8.8 Hz, 2H), 3.75(m, 7H), 3.72(t,J=8.4 Hz, 2H), 2.83(t,J=8.6 Hz, 1H), 2.76~2.78(m, 1H);13C NMRδ: 49.7(C-8), 54.2(C-8′), 55.9(OCH3), 69.2(C-9), 70.8(C-9′), 81.6(C-7), 87.3(C-7′), 109.7(C-2), 111.9(C-5), 113.8(C-2′), 115.6(C-5′), 117.5(C-6), 117.9(C-6′), 131.6(C-1), 132.8(C-1′), 145.1(C-4′), 145.5(C-3′), 147.9(C-3), 148.8(C-4); IRν: 3 420(OH), 2 961(CH3), 1 610(C=C), 1 518(C=C) cm-1; MS(ESI)m/z: Calcd for C20H22O6Na+{[M+Na]+}381.131 00, found 381.130 86。
2:1H NMRδ: 8.89(br, 2H, OH), 6.91~6.60(m, 6H), 4.63~4.62(d,J=4.8 Hz, 1H), 4.55~4.54(d,J=4.4 Hz, 1H), 4.12~4.08(m, 2H), 3.74~3.72(m, 8H), 2.98(m, 2H);13C NMRδ: 53.9(C-8), 54.1(C-8′), 55.9(OCH3), 71.1(C-9), 71.4(C-9′), 85.4(C-7), 85.4(C-7′), 110.3(C-2), 111.9(C-5), 114.0(C-2′), 115.7(C-5′), 117.4(C-6), 118.6(C-6′), 132.7(C-1), 134.2(C-1′), 145.0(C-4′), 145.5(C-3′), 148.5(C-3), 149.1(C-4); IRν: 3 442(OH), 2 926(CH3), 1 632(C=C), 1 517(C=C) cm-1; MS(ESI)m/z: Calcd for C20H22O6Na+{[M+Na]+}381.130 91, found 381.130 86。
2 结果与讨论
2.1 合成产物与代谢物的对比
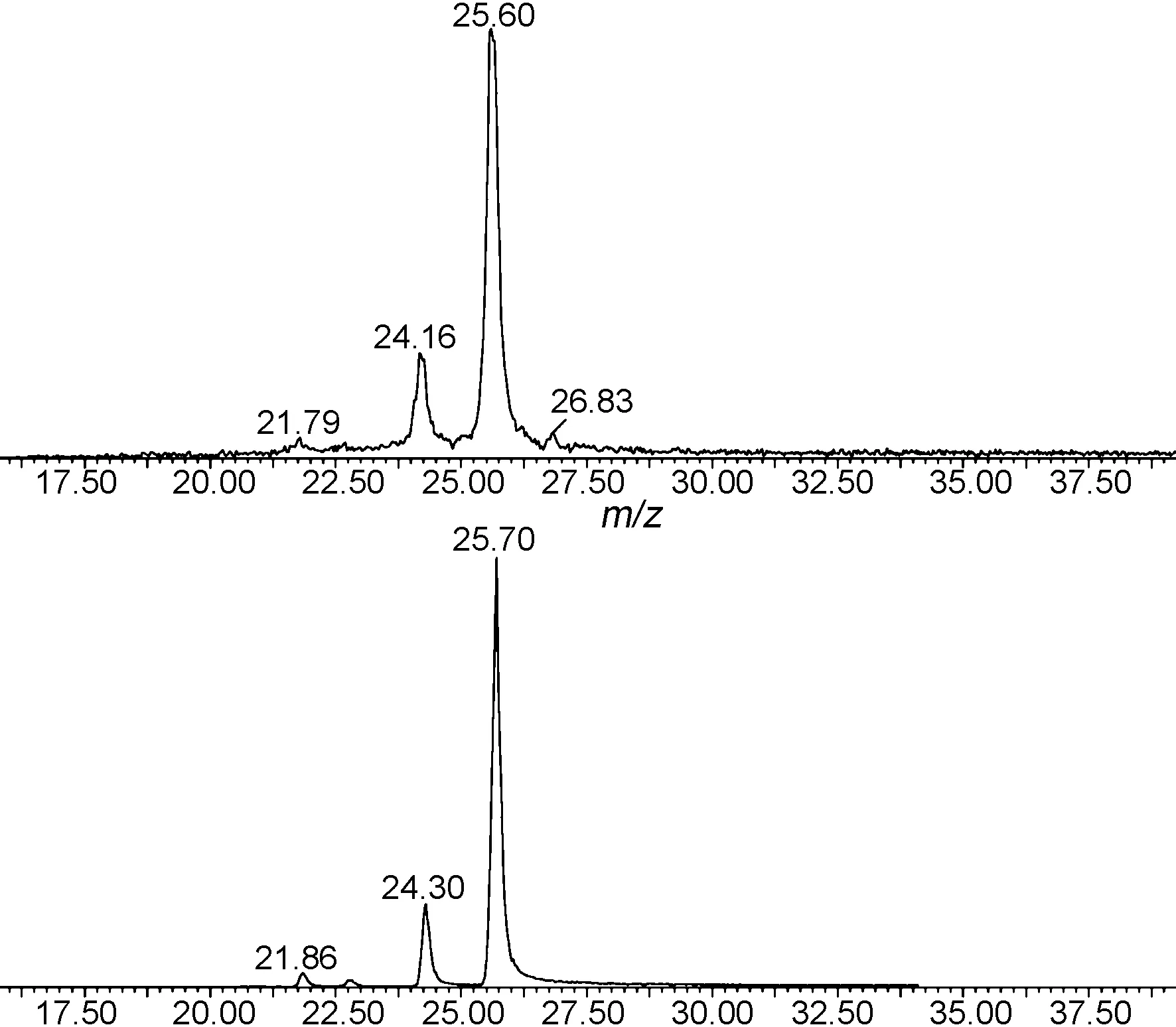
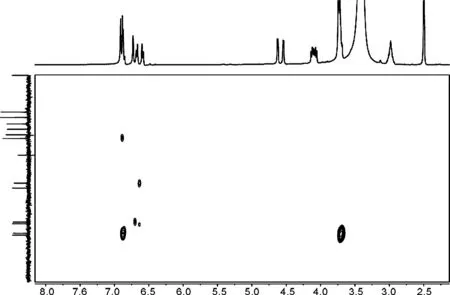
图1为大鼠尿液样品和合成产物的LC-MS谱图。由图1可见,25.60 min和24.15 min分别为1和2的色谱峰,其保留时间,相对分子量与代谢物色谱峰(25.60 min)和(24.16 min)一致。
2.21和2的结构分析
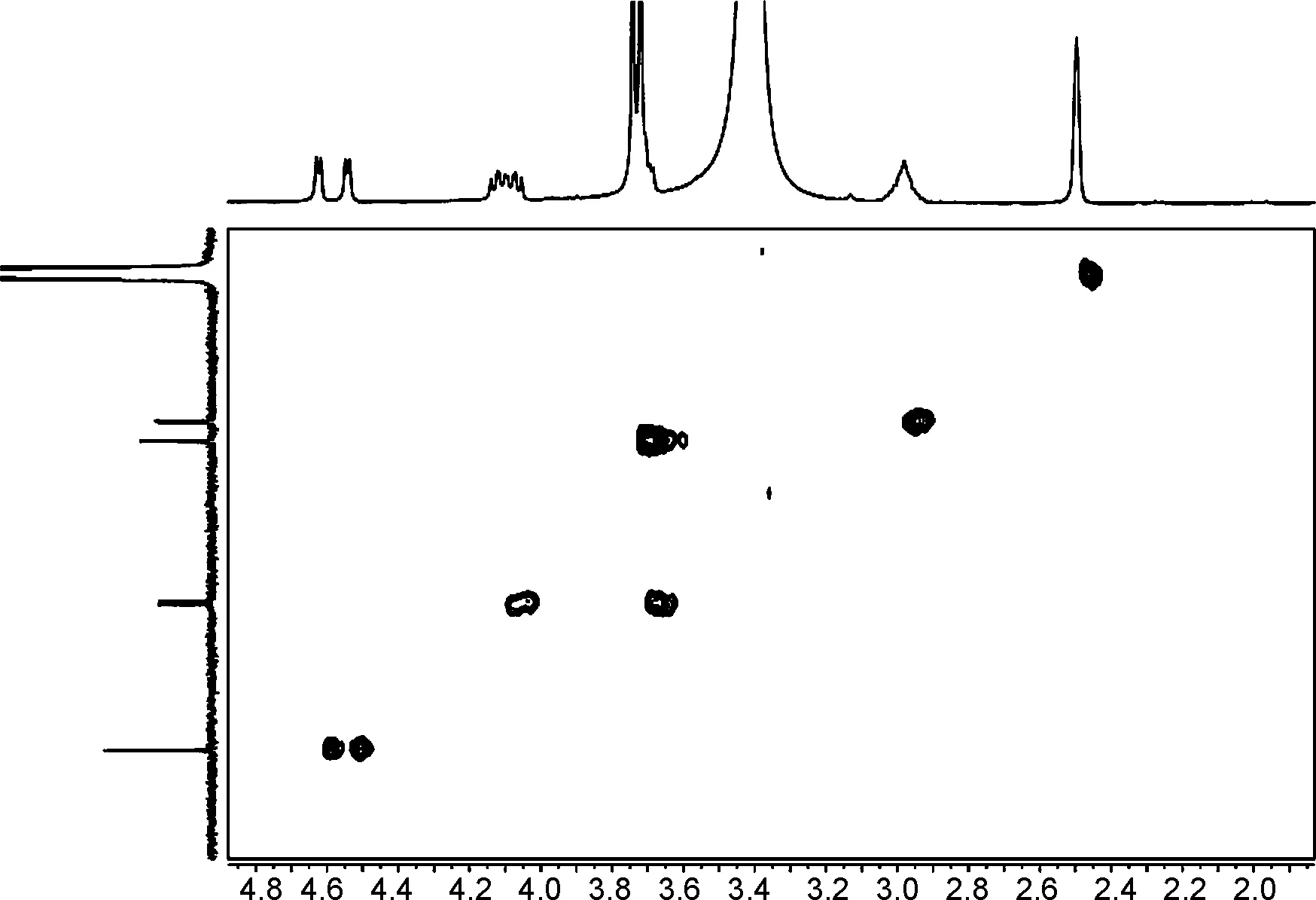
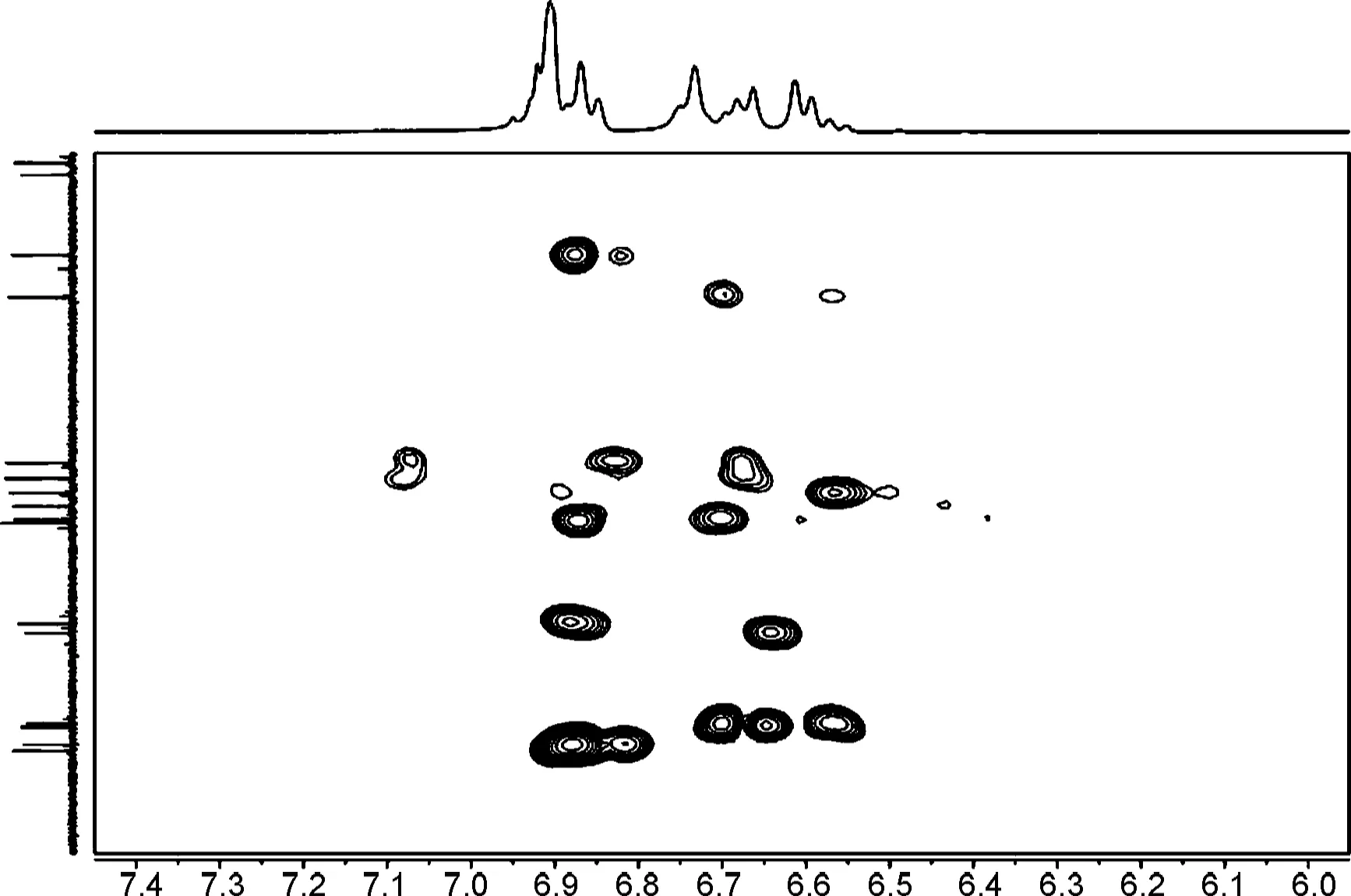
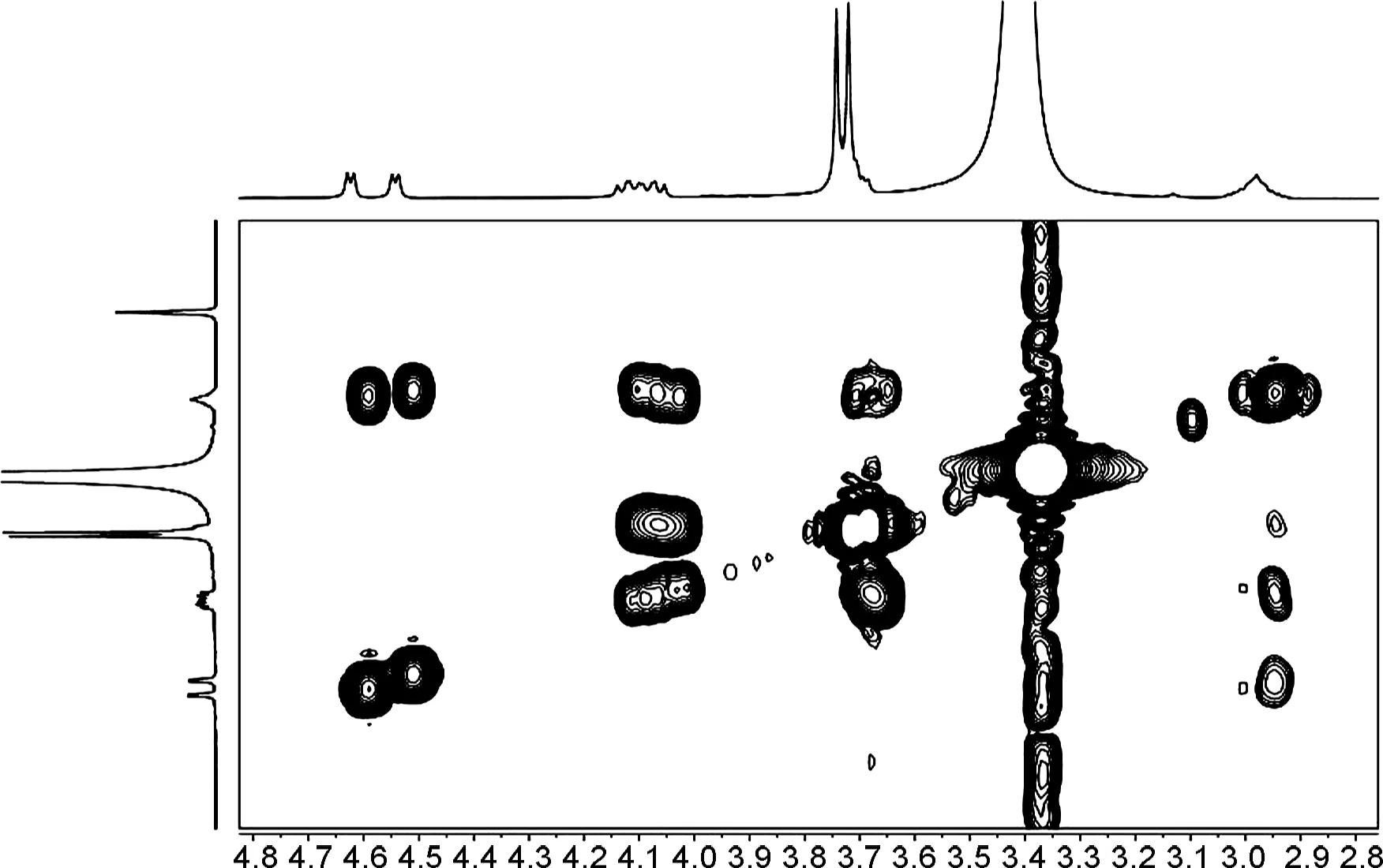
图2和图3为1和2的HSQC和HMBC部分谱图。与连翘脂素的13C NMR谱图[21]对比发现,1和2的13C NMR谱图中的高场均少了一个甲基峰,δC-2′向低场移动,δC-3′向高场移动,说明在C-3′位发生了选择性的O-去甲基化反应。此外,1的δC-7,δC-7′,δC-8,δC-8′,δC-7,7′和δC-8,8′分别为87.3, 81.6, 49.7, 54.2, 5.7和4.5,说明7,7′-位上芳基为反式取向。2的δC-7,δC-7′,δC-8,δC-8′,δC-7,7′和δC-8,8′分别为85.4, 53.9, 54.1, 0和0.2,说明7,7′-位上芳基为顺式取向[22]。
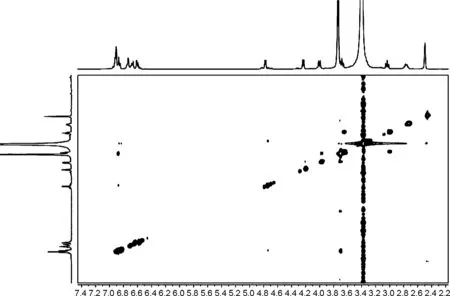
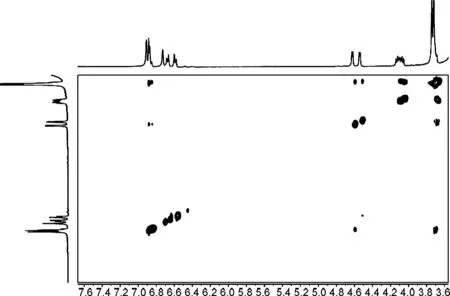
图4和图5为1和2的COSY和2D-NOESY谱图。
m/z

δ
δ
δ
δ

δ
δ
δ
δ
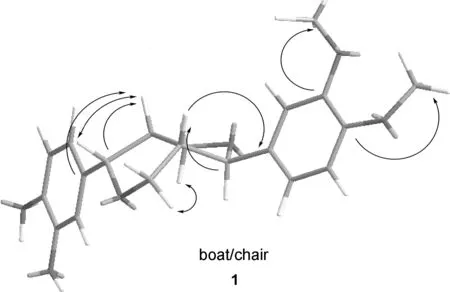

由图可知,化合物1的δH-7,δH-7′和δH-7,H-7′分别为4.25, 4.78和0.53,说明7/7′-位上芳基处于反式取向,而化合物2的δH-7,δH-7′和δH-7,H-7′分别为4.54, 4.63和0.09,说明7/7′-位上芳基处于顺式取向[22];化合物1的 NOE谱图中,δH-7′和δH-8′有相关;δH-7和δH-8无相关,说明双骈四氢呋喃环的相对构型为7′,8′-顺式-7,8-反式-8,8′-顺式(船/椅)。2的NOE谱图中,δH-7′和δH-8′无相关,δH-7和δH-8无相关,说明双骈四氢呋喃环的相对构型为7′,8′-反式-7,8-反式-8,8′-顺式(椅/椅)。
综上,根据1和2的结构,将1命名为(7S,7′R,8S,8′S)-3,4-二甲氧基-3′,4′-二羟基-7,9′ ∶7′,9-双环氧木脂烷,2命名为(7R,7′R,8S,8′S)-3,4-二甲氧基-3′,4′-二羟基-7,9′ ∶7′,9-双环氧木脂烷,两者互为同分异构体(Chart 2)。
3 结论
以连翘苷为原料,依次经水解反应、氯化铝/吡啶催化的去甲基化反应和差向异构化反应,合成了两个连翘脂素去甲基衍生物(1和2)。经结构解析对比,1和2与连翘苷的大鼠体内次级代谢产物一致。
[1] 冯卫生,李珂珂,郑晓珂. 连翘化学成分的研究[J].中国药学杂志,2009,44(7):490-492.
[2] 张海燕. 连翘化学成分及药理活性的研究进展[J].中药材,2000,23(10):657-660.
[3] 樊宏宇,富力. 连翘苷的合成与结构表征[J].辽宁化工,2014,43(3):241-243.
[4] 王业梅,程惠娟. 连翘苷对铜绿假单胞菌粘附功能及生物被膜形成能力的影响[J].中成药,2013,35(4):832-834.
[5] SU W, XU H F , HUANG H. Effects of the extract of forsythia suspensa on influenza a H1N1 infectioninvivo[J].J Med Plants Res,2010,4(14):1455-1458.
[6] SU B N, ZHU Q X, Gao K,etal. Ligand and phenylpropanoid glycosides from lancea tibetica and their antitumor activity[J].Planta Medica,1999,65(6):558-561.
[7] 赵晨阳,邱嵘,郑荣梁. 呋喃骈呋喃木脂素的体外抗肿瘤活性[J].兰州大学学报(自然科学版),2000,36(4):66-68.
[8] 赵咏梅,李发荣,杨建雄,等.连翘降血脂及抗氧化作用研究[J].天然产物研究与开发,2005,17(2):157-159.
[9] 赵咏梅,李发荣,杨建雄,等. 连翘苷对营养性肥胖小鼠减肥作用的影响[J].中药材,2005,28(2):123-124.
[10] 赵咏梅,黄新炜,马蕊,等. 连翘对氧自由基清除作用的研究[J].西安文理学院学报(自然科学版),2008,11(4):14-17.
[11] 刘银华,戚之琳,徐国祥,等. 连翘苷对酒精性肝损伤的保护作用[J].中国临床药理学与治疗学,2016,21(1):6-9.
[12] 王越,赵鸿飞,林创鑫,等. 连翘苷对LPS刺激的BV2小胶质细胞炎性反应的抑制作用[J].中风与神经疾病,2016,33(4):338-341.
[13] 潘晓龙. 连翘苷对LPS诱导炎症反应的影响及分子机制的研究[D].南京:南京师范大学,2014.
[14] 郑末,姜忠敏. 连翘苷对Lewis肺癌VEGF和内皮抑素表达的影响[J].中国病理生理杂志,2016,32(1):167-171.
[15] 颜礼有,刘明娟,闫慧茹,等. 连翘苷抗小鼠衰老作用的研究[J].中国药房,2015,26(1):37-39.
[16] ROBERT G L. Cleavage of alkylo-hydroxyphenyl ethers[J].J Org Chem,1962,27(6):2037-2039.
[17] ECKART E, HEINZ P. (-)-Arctigenin as a lead structure for inhibitors of human immunodeficiency virus type-1 integrase[J].J Med Chem,2008,39(1):86-95.
[18] 西部三省,千葉真理子,久田末雄. 漢薬·レンギョウの成分研究(第1報)市販レンギョウの成分について[J].藥學雜誌,1977,97(10):1134-1137.
[19] LI C Y, CHOW T J, WU T S. The epimerization of sesamin and asarinin[J].J Nat Prod,2005,68(11):1622-1624.
[20] 汪学德,黄雪,刘帅,等. 盐酸-三氯化铁催化芝麻素差向异构化合成细辛素及机理探讨[J].化工学报,2015,66(s2):455-460.
[21] NISHIBE S, TSUKAMOTO H, HISADA S. Effects ofO-methylation andO-glucosylation on carbon-13 nuclear magnetic resonance chemical shifts of matairesinol,(+)-pinoresinol and (+)-epipinoresinol[J].Chem Pharm Bull,1984,32(11):4653-4657.
[22] 石建功. 木脂素化学[M].北京:化学工业出版社,2010.
Synthesisof(+)-PhillygeninDesmethylDerivatives
FAN Hong-yu
(Dalian Fusheng Natural Pharmaceutical Co., Ltd., Dalian 116000, China)
O629.13
A
10.15952/j.cnki.cjsc.1005-1511.2017.10.17072
2017-02-22;
2017-08-12
科技部重大新药创制项目(2012ZX09103201-006)
樊宏宇(1985-),男,汉族,吉林磐石人,硕士研究生,工程师,主要从事天然产物合成的研究。 E-mail: fanhy04@lzu.edu.cn

