花椰菜温敏雄性不育系GS-19花药败育的细胞学及转录组分析
陶兴林,侯栋,朱惠霞,刘明霞,张金文,胡立敏
花椰菜温敏雄性不育系GS-19花药败育的细胞学及转录组分析
陶兴林1,2,侯栋1,朱惠霞1,刘明霞1,张金文2,胡立敏1
(1甘肃省农业科学院蔬菜研究所/农业部园艺作物生物学与种质创制西北地区科学观测实验站,兰州 730070;2甘肃农业大学/甘肃省作物遗传改良与种质创新重点实验室,兰州 730070)
【目的】对花椰菜温敏雄性不育系的花器形态、花药败育时期和败育分子机理进行研究,明确其不育特性发生的细胞学和分子机理,为进一步研究其雄性不育奠定理论基础。【方法】以花椰菜温敏雄性不育系GS-19为试验材料,不同温度(15℃和20℃)处理,采用形态学、细胞学方法及高通量测序技术(Illumina HiSeq 2500),研究其形态特征、花药败育的细胞学及分子机理。【结果】花椰菜温敏雄性不育系GS-19的育性转换受温度控制,高温(20℃)不育,低温(15℃)育性恢复。GS-19不育株与可育株花器差异显著,不育株花器显著小于可育株。花药细胞学观察发现GS-19的花药发育过程有花粉母细胞的分化,形成正常花粉囊,不产生花粉粒或者产生微量的无生活力的花粉粒,花药发育受阻于花粉母细胞到四分体时期,形成了花粉粒外壁发育异常的拟“四分体孢子”,逐渐降解,剩下花粉空壳,属于花粉母细胞败育类型。GS-19不育株和可育株花蕾转录组分析共获得67 930个Unigene,其中Nt数据库比对到相似序列数最多(52 191个),Nr数据库比对到相似序列次之(46 447个),KOG数据库比对相似序列最少(13 198个);GO注释到25 336个Unigene;KOG注释到13 198个Unigene;KEGG注释到14 778个Unigene。基因差异表达分析发现GS-19不育株花蕾和可育株花蕾中有2 170个基因差异表达,1 078个基因上调表达和1 092个基因下调表达。【结论】花椰菜温敏雄性不育系GS-19为高温不育类型,不育株花器显著小于可育株,花丝显著缩短,花药萎缩、干瘪,花药发育受阻于花粉母细胞到四分体时期,属于花粉母细胞败育类型。转录组测序获得了67 930个Unigene,差异表达基因2 170个。
花椰菜;温敏雄性不育系;花药败育;细胞学;转录组分析
0 引言
【研究意义】温敏雄性不育系GS-19作为花椰菜育种中一种新型的雄性不育系,在两系法花椰菜杂交育种中有十分重要的作用。明确花椰菜温敏雄性不育系GS-19育性转换过程中的花器形态特征、花药发育的败育时期、特点和基因表达差异,不仅为阐明该花椰菜温敏雄性不育系的遗传及分子机理奠定基础,而且为花椰菜温敏不育系的利用提供理论依据。【前人研究进展】花椰菜()是一种非常重要的十字花科蔬菜作物,被公认为是最有营养的作物之一,特别是钙、抗氧化剂、维生素A、维生素K、胡萝卜素、核黄素及铁的含量很丰富[1-3],是杂种优势利用潜力很大的一类作物,而雄性不育途径是培育花椰菜新品种的主要途径之一。雄性不育主要特征是雄蕊发育受阻不能产生正常功能的花粉,是杂种优势利用中的重要材料和工具。首个水稻光敏核不育系农垦58S的发现促使两系法杂交水稻育种取得突破性进展[4]。自此以后,小麦[5]、玉米[6]、大豆[7]、水稻[8]、油菜[9]等作物中都发现了光(温)敏雄性不育材料,许多学者对其败育时期和方式进行了研究,发现不同作物或者同一作物不同的雄性不育系之间也有差异。对水稻[10-11]、小麦[12]、油菜[13-15]、玉米[16]、茄子[17]、辣椒[18]、甘蓝[19]等作物的雄性不育系细胞学研究较多,主要有无花粉囊型、花粉母细胞败育型和单核败育型3种。高通量转录组测序技术以其速度快、测序长、通量高、准确率高等优点已被广泛应用于生物学[20]、医学[21]、农学[22-24]等研究领域。在雄性不育相关研究中,高通量测序技术应用主要集中在水稻、小麦、玉米、棉花、菊花等20多个物种中,包括细胞质雄性不育[25-26]、细胞核雄性不育[27-28]、化学诱导雄性不育[29]、光温敏雄性不育[30-31]等多种败育类型,这对于雄性不育败育机理的深入研究具有重要意义,也为相关研究提供了丰富的数据信息。【本研究切入点】2005年,笔者课题组从花椰菜种质资源圃里发现了几株温度敏感的不育株,后经多代自交选育成育性稳定的温敏不育系GS-19[32],属高温不育类型,该雄性不育系已经在生产中进行了应用[33],但导致其花药败育的细胞学和转录组水平上的研究尚未见报道。【拟解决的关键问题】以花椰菜温敏雄性不育系GS-19为试验材料,不同温度(15℃和20℃)处理,采用形态学、细胞学方法及高通量测序技术,研究花椰菜温敏雄性不育系花器形态特征、花药败育的细胞学特点及转录组水平上的基因差异,明确不育系GS-19的花器败育特征、花药败育时期、细胞学特征及差异基因表达特点,为花椰菜温敏雄性不育进一步研究和应用奠定基础。
1 材料与方法
试验于2012—2016年在甘肃省农业科学院蔬菜研究所农业部园艺作物生物学与种质创制西北地区科学观测实验站进行。
1.1 试验材料
试验选取的花椰菜温敏雄性不育系GS-19由甘肃省农业科学院蔬菜研究所选育和提供。育性表现与温度有关,温度高于18℃表现为不育,温度低于16℃时表现为育性完全恢复。
1.2 育性转换观察
2014年3月,在智能玻璃温室中花盆直播不育系GS-19,共播种25盆直径为38 cm的花盆,显球后分别移入20℃(16 h光照/8 h黑暗)和15℃(16 h光照/8 h黑暗)的人工智能气候箱中,开花期观察统计育性情况。
1.3 花器特征观察
在盛花期,采集在不同温度处理下不育系GS-19开花前3—4 d的花蕾和当天完全开放的花各20朵,用游标卡尺测量7个指标,即花蕾长、花蕾宽、花冠开度、花柱长、花药长、花丝长和花药总长各部分大小,进行比较方差分析。
1.4 扫描电镜观察
取不育系GS-19的不育和可育株不同大小花蕾(0.25、0.5、0.75和1.0 cm),用手术刀横切(或剥出花药),确保切面整齐,将导电胶带粘在样品托盘上,再将试验样品切面向上按已标记的顺序粘在胶带上,并用镊子进行固定,粘贴面必须保持平整,确保样品粘贴牢固,直接放入样品台,用HitachiS-3400N型扫描电镜观察并照相。
1.5 透射电镜观察
选取不育系GS-19不育和可育株不同发育时期(孢原细胞、花粉母细胞、单核花粉粒和花粉粒成熟期)的花蕾,快速剥开花蕾,取出花药。采用戊二醛和四氧化锇双重固定法,先用2.5%戊二醛固定6 h,再用1%四氧化锇固定2 h,丙酮进行梯度(70%、80%、90%、100%)脱水,环氧树脂包埋,超薄切片机切成厚度为5 μm的切片,载玻片上粘片,用乙酸双氧铀和柠檬酸铅染色,TEM-1230透射电镜观察并照相。
1.6 转录组分析
RNA提取:在不育系GS-19的盛花期,分别取10株待测不育株和可育株开花前发育成熟的花蕾,采用Trizol法分别提取不育和可育株花蕾总RNA,每个样本取等量混合组成1个RNA池,用带有Oligo(dT)的磁珠富集mRNA,将得到的mRNA逆转录成dsDNA,对其末端修复,加poly(A)并连接测序接头,制备测序文库,PCR富集测序样本。
功能注释:通过Illumina HiSeq 2500 的测序平台,采用PE125的测序方法,构建GS-19不育和可育株花蕾转录组文库后进行测序并获取相关数据。通过Blastx比对工具,将不育系GS-19与蛋白数据库进行比对,根据基因的相似性进行功能注释,得到与给定Unigene具有最高序列相似性的蛋白及功能注释信息。数据库包括Nr(Non-redundant protein database,非冗余蛋白数据库)、Nt(NCBI non-redundant nucleotide database,非冗余核苷酸数据库);SwissProt(SwissProt protein database,蛋白质序列数据库)、COG(Cluster of Orthologous Groups,蛋白质直系同源数据库)、Pfam(Protein families database,蛋白质家族域数据库)、GO(Gene Ontology,基因本体论数据库)、KEGG(Kyoto Encyclopedia of Genes and Genomes,东京基因与基金组百科全书)。
差异基因分析:采用TMM对read count数据进行标准化处理,再用DEG seq进行差异分析,筛选阈值为qvalue<0.005 & |log2FoldChange|>1;对于差异基因,如果基因的log2Foldchange>0,则认为该差异基因是上调;反之,若log2Foldchange<0,认为该差异基因是下调。
1.7 数据处理
试验结果为3次重复的平均值,用Excel 2010进行数据整理、标准偏差计算及图表的绘制,差异显著性用SPSS 18.0 统计软件进行分析。
2 结果
2.1 温敏雄性不育系GS-19的育性转换分析
育性统计结果发现,2个温度处理后的温敏不育系GS-19的育性变化存在显著差异。温敏雄性不育系GS-19在2个温度条件下可育率发生了显著的变化,在15℃条件下,完全可育,可育率为100%,20℃条件下完全不育,可育率为0,说明温敏不育系GS-19育性转换受温度控制,属于高温不育类型。
2.2 雄性不育系GS-19的花器特征分析
花椰菜温敏雄性不育系GS-19的不育株和可育株的花器有显著差异,不育株花器明显小于可育株。方差分析表明(图1),除雄蕊数量没有变化外,不育和可育株的花蕾长、花蕾宽、花冠开度、花丝长、花药总长(花丝+花药)及花柱长都存在显著差异,不育株花明显小于可育株,且雄蕊很短,在开花期看不到雄蕊,雄蕊萎缩在基部,只有柱头明显外露(图2),而且雄蕊也不产生花粉,但可育株的雄蕊基本与雌蕊高度一致,产生大量花粉,能完成正常的授粉。
2.3 雄性不育系GS-19的电镜扫描观察
2.3.1 不育和可育株花药外部形态观察 通过对不育系GS-19不育和可育的花药进行电镜扫描观察,不育和可育株花药外部形态存在显著差异(图3)。花蕾长度为0.25 cm时,不育和可育株花药外部形态无差异,棒状形,光滑饱满;花蕾长度为0.5 cm时,不育和可育株花药变成了锥形,不育株的花药壁出现轻微萎缩现象,表面变得不光滑,可育株花药发育正常,仍然饱满光滑;花蕾长度为0.75 cm时,不育株花药变成干瘪状,明显萎缩,表面变得粗糙不平整,中空明显,表现为完全不育,可育株的花药增大明显,发育正常,饱满光滑;开花期(花蕾长度为1.0 cm)不育株花药发育只剩下开裂的空壳花药壁,无花粉粒,可育株的花药开裂,裂口处能看到大量饱满的花粉粒。
2.3.2 不育和可育株花药横切面观察 通过对不育系GS-19不育和可育株花蕾横切面电镜扫描观察,不育和可育株花蕾发育横切面存在显著差异(图4)。花蕾长度为0.25 cm时,不育和可育株花药横切面差异不明显,都被早期发育的小孢子填充;花蕾长度为0.5 cm时,不育株花药发生了败育,花药横切面有变空现象,能清楚地看到花药壁,但可育株花药内部仍然被小孢子填充,没有出现变空现象;花蕾长度为0.75 cm时,不育株花药横切面中空明显,花药壁变薄,完全不育,而可育株花药横切面变化不明显,明显看到花药里被发育的小孢子填充,没有中空现象;开花期(花蕾长度为1.0 cm左右)不育株花药横切电镜扫描发现花药就剩下薄薄的一层花药壁,没有花粉粒,但可育株的花药被成熟花粉粒填充。
2.3.3 不育和可育株花粉粒的观察 开花期取不育和可育株进行花药扫描电镜观察(图5),发现不育株(20℃)花药干瘪变形,从表面看不到花粉粒,但是剥开花药,发现极少数败育的花粉粒,败育花粉粒为不规则形,凹陷明显。可育株(5℃)花药饱满,明显看到大量的花粉粒,花粉粒呈椭圆形,表面光滑,饱满。
2.4 GS-19的透射电镜观察
通过透射电镜观察,发现不育系GS-19的花药发育受阻于花粉母细胞到四分体时期,属于花粉母细胞败育类型。花药发育早期,不育系GS-19不育和可育株在细胞超微结构上没有差异,花药发育完全正常,分化形成了表皮、药室内壁、中层等结构,绒毡层和造孢细胞之间没有明显的分界线,形成不规则多边形的造孢细胞,能看到细胞核,细胞质浓厚,看不到明显的液泡(图6-A、E)。随着造孢细胞分化,形成了花粉母细胞,此时可育株的花药能明显看到一圈排列整齐的长方形绒毡层,绒毡层细胞核较大,核仁染色深。花粉母细胞被绒毡层包裹,其细胞大,形状不规则,核大且染色较深(图6-B)。不育株花药也能形成绒毡层和花粉母细胞,部分花粉母细胞没有细胞核(图6-F)。小孢子分化形成了被着色深的绒毡层包裹的四分体孢子,可育株的四分体孢子外壁能明显看到深色密点状包裹带,其上出现大量的发状物质。四分体孢子中含有大量的细胞器,细胞内含物逐渐增多至布满整个细胞,染色深且均匀(图6-C)。不育株只能形成拟“四分体孢子”,和可育株一样,外侧同样出现了深色密点状包裹带,包裹带上出现了大量的深色发状物质,但是四分体孢子的细胞器显著减少,内含物降解,出现液泡吞噬现象,导致花药败育(图6-G)。四分体孢子继续发育,可育株能形成成熟花粉粒,花粉粒近圆形,内壁物质显著增厚,形成了萌发孔,内含物丰富且染色深,绒毡层细胞完全降解消失(图6-D)。但是不育株的拟“四分体孢子”不能正常发育,液泡解体,只剩下壁外侧有发状电子致密带,出现没有活力的“空腔”花粉粒现象(图6-H)。
2.5 转录组分析
2.5.1 Unigene 的功能注释相关结果分析 通过BLAST程序,对所组装获得不育系GS-19的Unigene进行7大数据库的比对(表1)。结果表明,功能数据库共注释到67 930个Unigene,7大数据库比对到相似序列数目存在明显差异,比对到的相似序列数从13 198—52 191个,其中Nt数据库比对到相似序列数最多,为52 191个,Nr数据库比对到相似序列次之,为46 447个,KOG数据库比对相似序列最少,为13 198个。Nr功能注释到的匹配物种中,油菜Unigene最多(33 108),然后依次为芜菁(8 841)、拟南芥(643)、芥蓝(634)、山嵛菜(626)等。从匹配物种中发现,不育系GS-19属于十字花科作物,匹配率最高的也是十字花科的油菜和芜菁,从亲缘关系远近也可以证明这一点。
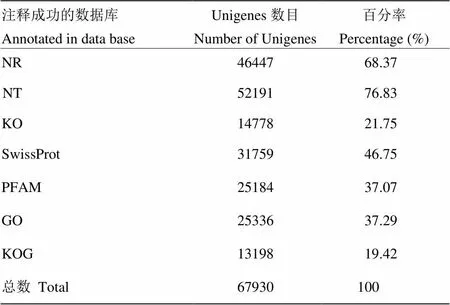
表1 花椰菜温敏雄性不育系GS-19的Unigenes功能注释
GO注释到25 336个Unigene(表2),分为细胞组分、分子功能、生物学过程3个本体共55个功能组;KOG注释到13 198个Unigene(表3),分为26类,注释到最多的是基因功能预测,共2 264个,其次为翻译后修饰,蛋白质折叠,分子伴侣(1 835个),最少的是未知蛋白(1个);KEGG注释到14 778个Unigene(表4),分细胞过程、环境信息处理、遗传信息处理、代谢及有机系统5大类共19个代谢途径,其中涉及较多的有碳水化合物(1 350个),翻译(1 275个),折叠、分类和降解(1 016个)等,较少的为多糖生物合成与代谢(161个),膜输送、膜转运(60个)。
2.5.2 差异表达分析 本试验中发现不育系GS-19不育株的上调表达基因表达水平高于可育株的基因表达水平。如图7所示,在TMS(GS-19不育株花蕾)和TMF(GS-19可育株花蕾)之间发现的67 931 Unigenes中有2 170个基因差异表达,其中1 078个基因上调表达和1 092个基因下调表达。每个比较组合都会得到一个差异基因集,将所有比较组合的差异基因集的并集在每个试验组/样品中的的FPKM(Fragment Per Kilobase of exon model per Million mapped reads)值,就得到了TMS和TMF的聚类分析结果(图8)。

表2 花椰菜温敏雄性不育系GS-19 Unigene的GO分类

表3 花椰菜温敏雄性不育系GS-19 Unigene的KOG系统分类
3 讨论
本研究发现花椰菜温敏雄性不育系GS-19的育性受温度控制,高温(20℃)条件下表现为不育,低温(15℃)条件下完全可育,与前人在甘蓝型油菜温敏核不育系SP2S[14]、TE5A[15]、细胞质雄性不育系392A[13]的育性转换研究结果相同,都表现为高温不育、低温育性恢复。但在油菜温敏雄性不育系Huiyou50S的育性转换研究结果正好与本研究结果相反,表现出低温不育、高温可育的现象[34]。为进一步对温敏雄性不育系GS-19利用,在制种过程中要找到适宜区域,注意监控温度条件,避免影响杂种种子的纯度。
花器形态特征是雄性不育和可育区别的直接表型,大部分研究表明雄性不育的花明显小于可育株的花,不育花器形态有花冠退化型、雄蕊萎缩型、花粉败育型3种[35-36]。本研究发现,高温条件下温敏不育系GS-19的花器显著小于低温下温敏核不育系GS-19,尤其是花的发育后期,不育株花器的雄蕊都萎缩于雌蕊基部,柱头外露,花药干瘪,与前人研究中的雄蕊萎缩型表型一致。童旭宏等[37]观察了陆地棉的G22A、H109A和1793A 3个不育系,均表现花瓣小、花丝短,柱头明显外露,败育彻底,无花粉;张体德等[38]发现芝麻细胞核雄性不育系ms86-1的花器也是不育株小于可育株,这些研究结果都与本研究结果相同。
随着花椰菜雄性不育系的发现,花药发育的细胞学研究也显得非常重要。目前,雄性不育败育研究主要集中在油菜、小麦、水稻等大田作物中,主要有无花粉囊型、花粉母细胞败育型和单核败育型3种,已经研究发现的典型无花囊型油菜不育系有533S[39]、宜3A[40]、212A[41]、Shaan-GMS[42]、9012[43]、BnaC.Tic40[44]、BnMs3[45]等。本研究发现在花蕾发育早期(≤1 mm)时,低温条件下的温敏雄性不育系GS-19处于孢原时期和造孢时期,能分化形成造孢细胞和壁细胞,该时期高温条件下的GS-19的花药发育也正常。随着花蕾的继续发育(>1 mm),高温条件下温敏雄性不育系GS-19不育株的花粉母细胞和可育株一样,也能进行正常减数分裂,但形成的四分体孢子不正常,出现拟四分体孢子现象,细胞器显著减少,内含物降解,出现液泡吞噬现象,导致败育,属于花粉母细胞败育类型,与温敏核不育系小麦BNS[12]和BNS366[46]、甘蓝Ogura CMS[47]的败育类型一致,此外,水稻[45]、小麦[48]、高粱[49]、大豆[50]、红菜薹[51]等作物的雄性不育系也是因为减数分裂过程出现问题,导致花粉母细胞不能形成四分体,也与本试验不育类型一致。但是一些其他的温敏雄性不育水稻、小麦、甘蓝型油菜的花药发育的细胞学观察发现,这些败育类型属于单核败育型[10,34,52]。推断GS-19是一个具有重要利用价值的花椰菜温敏雄性不育系,其不育发生的细胞学研究结果,对于揭示不育发生的细胞学机制和杂交制种具有重要的指导意义。

表4 花椰菜温敏雄性不育系GS-19Unigene的KEGG代谢途径分析
通过基因功能注释,可以明确基因的功能,也可以了解基因的保守结构域,基因自身表达条件和潜在的代谢途径[53]。本研究通过GO数据库,对温敏雄性不育系GS-19 Unigene进行基因生物学特征功能分类,发现37 220个GO条目归属于细胞组分中的20个功能组;29 992个GO条目归属于分子功能中的10个功能组,62 204个GO条目归属于生物学过程中的25个功能组,明显看出GO分析雄性不育相关转录组数据量大,相关差异表达基因集聚在代谢中的多个通路,初步证明花椰菜温敏雄性不育产生机理的复杂性。前人研究发现植物代谢过程中的花粉壁形成、类黄酮合成等过程都与植物雄性不育形成过程中的花粉发育密切相关[54],细胞程序性死亡也与植物雄性不育关系密切[55],这些研究结果与本研究结果相似。相反,大豆的细胞质雄性不育研究中,发现参与胚发育过程的基因数量最多[56];大蒜细胞质雄性不育的花青素代谢相关基因在差异表达基因中数量较多[57],说明败育方式差异会导致雄性不育表现出特有差异基因富集的功能通路。
基因组和转录组数据的缺乏大大限制花椰菜温敏雄性不育系的分子机理方面的相关研究。目前,对温敏雄性不育的转录组分析研究发现,遗传背景、败育时期和方式等多方面因素都会影响基因的表达水平,Mei等[58]在萝卜2个核背景存在差异的同一细胞质雄性不育材料的转录组分析中,发现与其相对应的保持系差异表达基因数分别为3 843和2 041个,这些基因都是与不育特性密切相关的基因;An等[59]发现甘蓝型油菜细胞质雄性不育系Pol不育株中的基因上调表达数目显著高于可育株。本研究发现,在不育株花蕾和可育株花蕾中有2 170个基因差异表达,其中1 078个上调表达和1 092个下调表达,下调表达主要出现在不育材料中,上调表达主要出现在可育材料中,与Qu等[60]在油菜细胞核雄性不育系中的研究结果相一致,可育材料中的差异基因以上调表达为主。但是与Mei等[58]和An等[59]的研究结果有一定差异,可能与基因型有很大的关系,这些研究都说明了基因的表达量及表达的上、下调关系与遗传背景和差异基因的功能密切相关,因此,可以通过对基因表达水平变化的分析,来预测和研究其基因功能的变化。
4 结论
花椰菜温敏雄性不育系GS-19育性转换受温度控制。GS-19不育与可育株花器差异显著,不育株的花器明显小于可育株。超微结构观察发现GS-19不育株的花药发育过程有造胞细胞和花粉母细胞的分化,形成正常花粉囊,不产生花粉粒或者产生微量的无生活力的花粉粒,花药发育受阻于花粉母细胞到四分体时期,形成了花粉粒外壁发育异常的拟“四分体孢子”,随着小孢子发育,拟“四分体孢子”逐渐降解,只剩下花粉空壳,属于花粉母细胞败育类型。转录组分析发现,GS-19共获得了67 930个Unigene,GO注释到25 336个Unigene;KOG注释到13 198个Unigene;KEGG注释到14 778个Unigene。GS-19不育株花蕾和可育株花蕾中有2 170个基因差异表达,1 078个上调表达和1 092个下调表达。
References
[1] VALLEJO F, GARCIA-VIGUERA C, TOMAS-BARBERAN F A. Changes in broccoli () health promoting compounds with inflorescence development., 2003, 51: 3776-3782.
[2] ABDEL-WAHHAB M A, ALY S E. Antioxidants and radical scavenging properties of vegetable extracts in rats fed aflatoxin- contaminated diet., 2003, 51: 2409-2414.
[3] 李杰, 贾豪语, 颉建明, 郁继华, 杨萍. 生物肥部分替代化肥对花椰菜产量、品质、光合特性及肥料利用率的影响. 草业学报, 2015, 24(1): 47-55.
LI J, JIA H Y, XIE J M, YU J H, YANG P. Effects of partial substitution of mineral fertilizer by bio-fertilizer on yield, quality, photosynthesis and fertilizer utilization rate in broccoli., 2015, 24(1): 47-55. (in Chinese)
[4] 石明松. 对光照长度敏感的隐性雄性不育水稻的发现与初步研究.中国农业科学, 1985, 18(2): 44-48.
SHI M S. The discovery and study of the photo-sensitive recessive male-sterile rice., 1985, 18(2): 44-48.(in Chinese)
[5] GUO R X, SUN D F, TAN Z B, RONG D F, LI C D. Two recessive genes controlling thermo-photoperiod-sensitive male sterility in wheat., 2006, 112(7): 1271-1276.
[6] TANG J H, FU Z Y, HU Y M, LI J S, SUN L L, JI H Q. Genetic analyses and mapping of a new thermo-sensitive genic male sterile gene in maize., 2006, 113: 11-15.
[7] FRASCH R M, WEIGAND C, PEREZ P T, PALMER R G, SANDHU D. Molecular mapping of 2 environmentally sensitive male sterile mutants in soybean., 2010, 102: 11-16.
[8] DING J H, LU Q, YANG Y D, MAO H L, ZHANG P B, YAO J L, XU C G, LI X H, XIAO J H, ZHANG Q F. A long noncoding RNA regulates photoperiod-sensitive male sterility, an essential component of hybrid rice., 2012, 109(7): 2654-2659.
[9] ZENG X H, LI W P, WU Y H, LIU F, LUO J L, CAO Y L, ZHU L, LI Y J, LI J, YOU Q B, WU G. Fine mapping of a dominant thermo-sensitive genic male sterility gene (BntsMs) in rapeseed () with AFLP-and-derived PCR markers., 2014, 127: 1733-1740.
[10] SHI Y, ZHAO S, YAO J. Premature tapetum degeneration:a major cause of abortive pollen development in photo-period sensitive genic male sterility in rice., 2009, 51(8): 774-781.
[11] ZHOU H, LIU Q, LI J, JIANG D G, ZHOU L Y, WU P, LU S, ZHU L Y, LIU Z L, CHEN L T, LIU G Y, ZHUANG C X. Photoperiod- and thermo-sensitive genic male sterility in rice are caused by a point mutation in a novel non-coding RNA that produces a small RNA., 2012, 22(4): 649-660.
[12] 李东霄, 邓小莉, 李淦, 徐龙龙, 茹振钢. 温敏核不育小麦可育花药和败育花药发育观察. 中国细胞生物学学报, 2012, 34(9): 880-885.
LI D X, DENG X L, LI G, XU L L, RU Z G. Observation in fertile and sterile anthers of a thermo-sensitive genic male-sterile wheat (L)., 2012, 34(9): 880-885. (in Chinese)
[13] 聂明建, 王国槐, 朱卫平. 甘蓝型油菜 3 种类型雄性不育系花药败育的细胞学研究. 中国农业科学, 2007, 40(7):1543-1549.
NIE M J, WANG G H, ZHU W P. Cytology research on the anther abortion of three male sterility lines in rapeseed (L.)., 2007, 40(7): 1543-1549. (in Chinese)
[14] YU C, GUO Y, GE J, HU Y M, DONG J G, DONG Z S. Characterization of a new temperature-sensitive male sterile line SP2S in rapeseed (L.)., 2015, 206(2): 473-485.
[15] 李可琪, 曾新华, 袁荣, 闫晓红, 吴刚. 甘蓝型油菜温敏细胞核雄性不育系 TE5A花药发育的细胞学研究. 中国农业科学, 2016, 49(12): 2408-2417.
LI K Q, ZENG X H, YUAN R, YAN X H, WU G. Cytological researches on the anther development of a thermo- sensitive genic male sterile line TE5A in., 2016, 49(12): 2408-2417. (in Chinese)
[16] TIMOFEJEVA LS, KIBBS D S, LEE S, GOLUBOVSKAYA L, WANG R, HARPER L, WALBOT V, CANDE W Z. Cytological characterization and allelism testing of anther developmental mutants identified in a screen of maize male sterile lines, 2013, 3(2):231-249.
[17] 陈雪平, 罗双霞, 轩淑欣, 张成合, 申书兴. 茄子雄性不育系花粉败育的细胞学观察. 植物遗传资源学报, 2013, 14(4): 754-758.
CHEN X P, LUO S X, XUAN S X, ZHANG C H, SHEN S X. Cytological observation of pollen abortion in eggplant male-sterile lines., 2013, 14(4): 754-758. (in Chinese)
[18] 何长征, 刘志敏, 熊兴耀, 邹学校, 萧浪涛. 辣椒细胞质雄性不育系9704A花药发育的细胞观察. 园艺学报, 2008, 35(4): 521-528.
HE C Z, LIU Z M, XIONG X Y, ZHOU X X, XIAO L T. Cytologic observations on anther development of 9704A a cytoplasmic male sterile line inL., 2008, 35(4): 521-528. (in Chinese)
[19] 王涛涛, 蔡晓峰, 张俊红, 李汉霞, 叶志彪. 芥菜型油菜雄性不育系与甘蓝远缘杂交胚培养及早代育性鉴定. 园艺学报, 2010, 37(10): 1661-1666.
WANG T T, CAI X F, ZHANG J H, LI H X, YE Z B. The culture and early male sterile identification of distant hybrid embryos derived fromL. and male sterile line in., 2010, 37(10): 1661-1666. (in Chinese)
[20] SULTAN M, SCHULZ M H, RICHARD H, MAGEN A, KLINGENHOFF A, SCHERF M, SEIFERT M, BORODINA T, SOLDATOV A, PARKHOMCHUK D, SCHMIDT D, O'KEEFFE S, HAAS S, VINGRON M, LEHRACH H, YASPO M L. A global view of gene activity and alternative aplicing by deep sequencing of the human transcriptome., 2008, 21: 956-960.
[21] MAHER C A, SINHAL C K, CAO X H, KALYANA-SUNDARAM S, HAN B, JING X J, SAM L, BARRETTE T, PALANISAMY N, CHINNAIYAN A M. Transcriptome sequencing to detect gene fusions in cancer., 2009, 458: 97-101.
[22] FILICHKIN S A, PRIEST H D, SCOTT A, GIVAN S A, SHEN R K, BRYANT D W, FOX S E, WONG W K, MOCKLER T C. Genome-wide mapping of alternative splicing in, 2010, 20: 45-58.
[23] SHI C Y, YANG H, WEI C L, YU O, ZHANG Z Z, JIANG C J, SUN J, LI Y Y, CHEN Q, XIA T, WAN X C. Deep sequencing of the Camellia sinensis transcriptome revealed candidate genes for major metabolic path-ways of tea-specific compounds., 2011, 12: 131.
[24] WEI W L, QI X Q, WANG L H, ZHANG Y X, HUA W, LI D H, LÜ H X, ZHANG X R. Characterization of the sesame (L.) global transcriptome using illumina paired-end sequencing and development of EST-SSR markers., 2011, 12: 451.
[25] AN H, YANG Z H, YI B, WEN J, SHEN J X, TU J X, MA C Z, FU T D. Comparative transcript profiling of the fertile and sterile flower buds ofCMS in., 2014, 15: 258.
[26] LI J J, HAN S H, DING X L, HE T T, DAI J Y, YANG S P, GAI J Y. Comparative transcriptome analysis between the cytoplasmic male sterile line NJCMS1A and its maintainer NJCMS1B in soybean ((L.) Merr.)., 2015, 10(5): e126771.
[27] JEONG H J, KANG J H, ZHAO M A, KWON J K, CHOI H S, BAE J H, LEE H A, JOUNG Y H, CHOI D, KANG B C. Tomato male sterile 1035 is essential for pollen development and meiosis in anthers., 2014, 65(22): 6693-6709.
[28] CHEN C M, CHEN G J, CAO B H, LEI J J. Transcriptional profiling analysis of genic male sterile-fertilereveal candidate genes for pollen development and maturation by RNA-Seq technology., 2015, 122(2): 465-476.
[29] ZHU Q D, SONG Y L, ZHANG G S, JU L, ZHANG J, YU Y A, NIU N, WANG J W, MA S C.assembly and transcriptome analysis of wheat with male sterility induced by the chemical hybridizing agent SQ-1., 2015, 10(4): e0123556.
[30] OMIDVAR V, MOHORIANU I, DALMAY T, FELLNER M. Identification of miRNAs with potential roles in regulation of anther development and male-sterility inmale-sterile tomato mutant., 2015, 16(1): 183.
[31] TANG Z H, ZHANG L P, XU C G, YUAN S H, ZHANG F T, ZHENG Y L, ZHAO C P. Uncovering small RNA-mediated responses to cold stress in a wheat thermo-sensitive genic male-sterile line by deep sequencing., 2012, 159(2): 721-738.
[32] 陶兴林, 胡立敏, 侯栋, 朱惠霞. 花椰菜温敏雄性不育系GS-19的选育. 农业科技通讯, 2010(11): 59-60.
TAO X L, HU L M, HOU D, ZHU H X. Breeding of the cauliflower thermo-sensitive male sterile line GS-19., 2010(11): 59-60. (in Chinese)
[33] 胡立敏, 陶兴林, 朱惠霞, 刘明霞. 花椰菜新品种‘圣雪4号’. 园艺学报, 2015, 42(5): 1007-1008.
HU L M, TAO X L, ZHU H X, LIU M X. A new cauliflower cultivar ‘Shengxue 4’., 2015, 42(5): 1007-1008. (in Chinese)
[34] 葛娟, 郭英芬, 于澄宇, 张国云, 董军刚, 董振生. 甘蓝型油菜光、温敏雄性不育系Huiyou50S花粉败育的细胞学观察. 作物学报, 2012, 38(3): 541-548.
GE J, GUO Y F, YU C Y, ZHANG G Y, DONG J G, DONG Z S. Cytological observation of anther development of photoperiod/thermo sensitive male sterile line Huiyou50S inL., 2012, 38(3): 541-548. (in Chinese)
[35] NIVISON H T, HANSON M R. Identification of a mitochondrial protein associated with cytoplasmic male sterility in petunia, 1989, 1(11): 1121-1130.
[36] 周长久, 张友良.萝卜雄性不育的几种特性研究. 园艺学报, 1994, 21(1): 13-16.
ZHOU C J. ZHANG Y L. Studies on several properties of radish male-sterility.1994, 21(1): 13-16. (in Chinese)
[37] 童旭宏, 秦利, 孔广超, 祝水金. 新型陆地棉细胞质雄性不育系花器形态学和细胞学观察. 棉花学报, 2009, 21(2): 83-88.
TONG X H, QIN L, KONG G C, ZHU S J. Studies on the morphological and anatomic characters of a novel CMS inL.2009, 21(2): 83-88. (in Chinese)
[38] 张体德, 张海洋, 郑永战, 卫双玲, 梅鸿献. 芝麻细胞核雄性不育系ms86-1的花器形态及小孢子发育的细胞学观察. 中国农学通报, 2010, 26(23): 64-68.
ZHANG T D, ZHANG H Y, ZHENG Y Z, WEI S L, MEI H X. The cytological observation on the morphology of the flowers and the microspore development in sesame nuclear male-sterile lines ‘ms86-1’., 2010, 26(23): 64-68. (in Chinese)
[39] 董军刚, 董振生, 刘绚霞, 刘创社, 李红兵. 甘蓝型油菜生态雄性不育系533S花药发育的细胞学研究. 西北农林科技大学学报(自然科学版), 2004, 32(7): 61-66.
DONG J G, DONG Z S, LIU X X, LIU C S, LI H B. Cytological studies on anther development of ecological male sterile line 533S inL., 2004, 32(7): 61-66. (in Chinese)
[40] 杨光圣, 瞿波, 傅廷栋. 三个甘蓝型油菜隐性细胞核雄性不育系小孢子发生的细胞学研究. 华中农业大学学报, 1999, 18(6): 520-523.
Yang G S, QU B. Fu T D. Anatomical studies on the anther’s development of the dominant genic male sterile line YI-3A inL., 1999, 18(5): 405-408. (in Chinese)
[41] 刘燕, 董振生, 张改文, 董军刚, 刘创社, 刘绚霞, 李宏兵. 甘蓝型油菜CMS 212A 花药发育的细胞学研究. 西北农业学报, 2005, 14(1): 33-37.
LIU Y, DONG Z S, ZHANG G W, DONG J G, LIU C S, LIU X X, LI H B. Cytological study on growth of anther of CMS 212A inL., 2005, 14(1): 33-37. (in Chinese)
[42] XIAO Z D, XIN X Y, CHEN H Y, HU S W. Cytological investigation of anther development in DGMS line Shaan-GMS inL., 2013, 49: 16-23.
[43] WAN L L, XIA X Y, HONG D F, LI J, YANG G S. Abnormal vacuolization of the tapetum during the tetrad stage is associated with male sterility in the recessive genic male sterileL. line 9012A., 2010, 53: 121-133.
[44] Dun X L, Zhou Z F, Xia S Q, WEN J, YI B, SHEN J X, MA C Z, TU J X, FU T D. Bna C.Tic40, a plastid inner membrane translocon originating from, is essential for tapetal function and microspore development in.2011, 68: 532-545.
[45] ZHOU Z F, DUN X L, XIA S Q, SHI D Y, QIN M M, YI B, WEN J, SHEN J X, MA C Z, TU J X, FU T D. BnMs3 is required for tapetal differentiation and degradation, microspore separation, and pollen wall biosynthesis in.,2012, 63: 2041-2058.
[46] 贺晓敏, 周美兰, 余传启, 蒋敏敏, 茹振钢. 温敏雄性不育小麦BNS366花粉败育的细胞学观察. 麦类作物学报, 2014, 34(4): 460-466.
HE X M, ZHOU M L, YU C Q, JIANG M M, RU Z G. Cytological observation on pollen male fertility abortion of thermo-sensitive male sterile wheat line BNS366.,2014, 34(4): 460-466. (in Chinese)
[47] MA Y, KANG J G, WU J, ZHU Y G, WANG X W. Identification of tapetum-specific genes by comparing global gene expression of four different male sterile lines in.,2015, 87(6): 541-554.
[48] 樊建青, 张立平, 赵昌平, 许晨光, 王灵云, 苑少华. 光温敏核雄性不育小麦 BS366 花粉母细胞减数分裂的细胞学研究. 中国细胞生物学学报, 2011, 33(6): 622-628.
FAN J Q, ZHANG L P, ZHAO C P, XU C G, WANG L Y, YUAN S H. Studies on mieosis pollen mother cells in photoperiod-temperature sensitive genic male sterile wheat line BS366.,2011, 33(6): 622-628. (in Chinese)
[49] 梁小红, 仪治本, 赵威军, 段运平, 崔贵梅, 孙毅. 高粱A2型细胞质雄性不育系小孢子发生的细胞学观察和减数分裂染色体行为分析. 作物学报, 2006, 32(8): 1107-1110.
LIANG X H, YI Z B, ZHAO W J, DUAN Y P, CUI G M, SUN Y. Cytological observation of microsporogenesis and its chromosomal behavior in meiosis of A2 cytoplasmic-male sterile line in sorghum., 2006, 32(8): 1107-1110.(in Chinese)
[50] 王芳, 卫保国, 李贵全, 李艳花. 大豆光敏雄性不育株88-428BY-827小孢子母细胞的细胞学观察. 中国农业科学, 2004, 37(8): 1110-1113.
WANG F, WEI B G, LI G Q, LI Y H. A cytological observation of the pollen mother cells of the photoperiod- sensitive male sterile soybean plant of 88-428BY-827., 2004, 37(8): 1110-1113. (in Chinese)
[51] 田福发, 徐跃进, 袁黎, 陈建军. 红菜薹雄性不育系花药败育的细胞形态学观察. 武汉植物学研究, 2004, 22(3): 269-272.
TIAN F F, XU Y J, YUAN L, CHEN J J. The cytom orphology study of anther abortion in male-sterile lines of Hong Cai-tai (L. ssp.LLee.).,2004, 22(3): 269-272. (in Chinese)
[52] 贺国良, 贺浩华, 刘宜柏. 光敏核不育水稻农垦58S细胞学研究. 江西农业大学学报, 2001, 23(1): 24-27.
HE G L, HE H H, LIU Y B. The cytological ctudy of photoperiod- sensitive genic sterile rice Nongken 58S.,2001, 23(1): 24-27. (in Chinese)
[53] HUANG L, YANG X, SUN P, TONG W, HU S. First Illumina-based de novo transcriptome sequencing and analysis of safflower flowers.2012, 7: e38653. doi: 10.1371/journal.pone.0038653 PMID: 22723874.
[54] YONEKURA-SAKAKIBARA K, NAKABAYASHI R, SUGAWARA S, TOHGE T, ITO T, KOYANAGI M, KITAJIMA M, TAKAYAMA H,SAITO K. A flavonoid 3--glucoside: 2"--glucosyltransferase responsible for terminal modification of pollen-specific flavonols in, 2014, 79(5): 769-782.
[55] CHEN L T, LIU Y G. Male sterility and fertility restoration in crops., 2014, 65(1): 579-606.
[56] LI J J, HAN S H, DING X L, HE T T, DAI J Y, YANG S P, GAI J Y. Comparative transcriptome analysis between the cytoplasmic male sterile line NJCMS1A and its maintainer NJCMS1B in soybean ((L.) Merr.)., 2015, 10(5): e126771.
[57] SHEMESH-MAYER E, BEN-MICHAEL T, ROTEM N, RABINOWITCH H D, DORON-FAIGENBOIM A, KOSMALA A, PERLIKOWSKI D, SHERMAN A, KAMENETSKY R. Garlic (L.) fertility: transcriptome and proteome analyses provide insight into flower and pollen development., 2015, 6: 271.
[58] MEI S Y, LIU T M, WANG Z W. Comparative transcriptome profile of the cytoplasmic male sterile and fertileral buds of radish (L),2016, 17(1): 42.
[59] AN H, YANG Z H, YI B, WEN J, SHEN J X, TU J X, MA C Z, FU T D. Comparative transcript profiling of the fertile and sterile flower buds ofCMS in.., 2014, 15(1): 258.
[60] QU C M, FU F Y, LIU M, ZHAO H Y, LIU C, LI J N, TANG Z L, XU X F, QIU X, WANG R, LU K. Comparative transcriptome analysis of recessive male sterility (RGMS) in sterile and fertilelines., 2015, 10(12): e0144118.
(责任编辑 赵伶俐)
Transcriptome and Cytological Researches on the Anther Abortion of a Thermo-sensitive Genic Male Sterile Line GS-19 in Cauliflower
TAO XingLin1,2, HOU Dong1, ZHU HuiXia1, LIU MingXia1, ZHANG JinWen2, HU LiMin1
(1Institute of Vegetable, Gansu Academy of Agricultural Science/Lanzhou Research Station of Horticultural Crop Biology and Germplasm Enhancement, Ministry of Agriculture, Lanzhou 730070;2Gansu Key Lab of Crop Improvement & Germplasm Enhancement/Gansu Agricultural University, Lanzhou 730070)
【Objective】In order to clarify the mechanism of cellular and molecular sterility characteristics, the flower morphology, anther abortion period and molecular mechanism of the thermos-sensitive male sterile line of cauliflower were studied, thus laying a theoretical foundation for further study of the male sterility. 【Method】The thermo-sensitive male sterile line GS-19 was used as the experimental material, using morphological, cytological and high-throughput sequencing techniques, the morphological, cytological and molecular mechanism were studied with treatment at different temperatures (15℃ and 20℃). 【Result】The fertility conversion of the thermo-sensitive male sterile line GS-19 was controlled by temperature, sterility at high temperature (20℃), and fertility at low temperature (15℃).The flower difference between sterile and fertile plants reached a significant level in GS-19, the flower was significantly smaller than that of fertile plants. The anthers abortive stages and manners were different between sterile and fertile plants of GS-19by the microstructureobservation.The anther development of GS-19had differentiation of pollenmother cell, formed normal pollen sac, did not produce pollen grains or produce trace ofpollen grains withoutviability, the developmentof antherswas blocked from pollen mother cell to the tetradstage. The pollen mother cells could not pass the meiosis, with no dyads and tetrads formed in GS-19, insteading of some “pseudo microspores”, belong to an abortive type of pollen mother cell. The pollen exines of the “pseudo microspores” were abnormal. The “pseudo microspores” were decayed gradually and only empty shells remained at last. A total of 67 930 unigenes were generated in GS-19 alabastrum by sequence, Nt database compared to the largest number of similar sequences, for the 52 191, Nr database to similar sequence of times (46 447), KOG database than similar sequence of the least (13 198). By GO database the 25 336 unigenes were divided into 3 categories containing 55 function groups; by KOG databases the 13 198 unigenes were grouped into 26 functional categories; by KEGG database the 14 778 unigenes were divided into 19 metabolism pathways.Gene differential expression analysis revealed that there were 2 170 differentially expressed genes in the bud of GS-19 male sterile line and fertile plants, 1 078 genes up-regulated and 1 092 genes down regulated. 【Conclusion】The fertility conversion of the thermo-sensitive male sterile line GS-19 is controlled by temperature, sterility at high temperature. The flower is significantly smaller than that of fertile plants. The filaments are significantly shortened, the anthers shrank, and dried. The developmentof anthersis blocked from pollen mother cell to the tetradstage, belonging to an abortive type of pollen mother cell. A total of 67 930 unigenes were generated in GS-19 alabastrum by transcriptome analysis. Gene differential expression analysis reveals that there are 2 170 differentially expressed genes in the bud of GS-19 male sterile and fertile plants.
cauliflower (L.); thermo-sensitive genic male sterile; anther abortion; cytology; transcripiome analysis
2016-12-15;接受日期:2017-04-13
国家自然科学基金(31460519)、农业部园艺作物生物学与种质创制西北地区科学观测试验站项目(2015-A2621-620321-G1203-066)、现代农业产业技术体系(CARS-25-G-48)、甘肃省农科院科技创新工程学科团队(2014GAAS07)
陶兴林,E-mail:taoxinglin77@126.com

