柑橘响应溃疡病菌转录因子CsBZIP40的克隆及功能分析
贾瑞瑞,周鹏飞,白晓晶,陈善春,许兰珍,彭爱红,雷天刚,姚利晓,陈敏,何永睿,李强
柑橘响应溃疡病菌转录因子CsBZIP40的克隆及功能分析
贾瑞瑞,周鹏飞,白晓晶,陈善春,许兰珍,彭爱红,雷天刚,姚利晓,陈敏,何永睿,李强
(西南大学柑桔研究所/中国农业科学院柑桔研究所/国家柑桔工程技术研究中心,重庆400712)
【目的】分析柑橘BZIP转录因子家族并克隆柑橘溃疡病菌相关的转录因子CsBZIP40,对其进行亚细胞定位并研究外源激素及机械损伤对该基因的诱导表达,确定其诱导表达模式,分析其与溃疡病菌侵染的关系。【方法】基于全基因组公共数据库,对柑橘BZIP转录因子进行综合专业注释以获得柑橘中BZIP家族的所有成员信息,并根据染色体定位对其进行命名;利用MEME分析其结构域;利用MEGA 6.0分析柑橘BZIP与拟南芥BZIP的系统发育关系,并根据系统发育关系对该基因家族进行分类,确定本研究关注的CsBZIP40所属的类型;结合染色体定位和系统发育树确定该家族的基因复制情况;利用实时荧光定量PCR(qRT-PCR)方法验证感染溃疡病菌前后由柑橘转录组筛选出的表达模式;分析、启动子元件(plantCARE)和核定位信号(cNLSmapper),构建GFP融合载体,用洋葱表皮进行亚细胞定位分析,来对预测的核定位信息进行验证;利用qRT-PCR技术分析水杨酸(SA)、茉莉酸甲酯(MeJA)、乙烯利(ET)以及机械损伤(wounding)对该基因的诱导表达模式,揭示该转录因子与激素代谢途径的关系。【结果】从柑橘(甜橙)全基因组数据库中共注释到47个,这些基因位于9号染色体之外的所有染色体上,其中3号染色体基因密度最大为4.5×10-7个/Mb,2号染色体上的基因密度最小,仅占所有基因的2%;柑橘BZIP基因家族含有较少的基因复制事件,所以相对其他已测序物种其BZIP家族较小;基因全长5 756 bp,开放阅读框1 530 bp,编码509个氨基酸;经BZIP家族染色体定位、结构域和系统发育分析结果显示基因序列特异性较好,且与拟南芥中属于同源基因,属于柑橘10个亚家族中参与病菌防御的D亚类;上游启动子元件含多个与植物逆境或激素应答相关的顺式作用元件,例如Box-W1、HSE、ERE等;此基因含有核定位信号,亚细胞定位表明此蛋白定位于细胞核,具备转录因子发挥作用的前提;外源水杨酸并不会使四季橘和纽荷尔脐橙中的表达水平显著上调,纽荷尔脐橙在茉莉酸甲酯诱导后有明显的差异表达,但乙烯利可以使在四季橘和纽荷尔脐橙中均有较明显的差异表达;柑橘溃疡病菌侵染可诱导抗病品种四季橘中此基因上调表达,而在感病品种纽荷尔脐橙中,该基因对柑橘溃疡病菌侵染没有响应。【结论】CsBZIP40是响应溃疡病菌侵染的一个转录因子,该基因可作为柑橘抗溃疡病菌分子育种的一个候选基因来进行进一步功能性验证,具有潜在的分子育种价值。
柑橘溃疡病;BZIP;转录因子;亚细胞定位
0 引言
【研究意义】柑橘溃疡病(citrus bacterial canker,CBC)由柑橘黄单胞杆菌柑橘亚种(subsp.,)引起,该病传播快、发病高。目前,只能通过喷洒铜制剂农药或集中销毁果苗加以控制,但其造成的经济损失较大。因此,寻找潜在的抗病基因并进行分子育种显得尤为重要。转录因子(transcription factors,TF)是分子育种实践中被广泛利用的候选基因,它是能够与真核基因启动子区域中顺式作用元件发生特异性互作而影响下游基因表达的一类反式作用因子[1]。转录因子中,BZIP(basic leucine zipper)是一个进化上十分古老的亚类。在目前已经完成全基因组测序的植物中,BZIP类转录因子在总数上占较大比重。这个家族中的成员参与多种生物学过程,包括植物生长、花发育、种子成熟、衰老、光信号、损伤、病菌防御以及对各种环境胁迫的响应等[2]。若能获得有潜力的BZIP候选基因用于柑橘抗溃疡病分子育种,将会有很大的现实指导意义。【前人研究进展】Jakoby等[3]对拟南芥基因组全序列进行分析,根据碱性结构域及其他保守的结构域,将拟南芥的73个BZIP类转录因子基因家族成员分为A、B、C、D、E、F、G、H、I和S类共10个亚家族。不同家族成员其行使的功能也不相同,A亚族主要参与ABA和逆境胁迫的调控表达;C亚族作用于种子发育和逆境胁迫;D亚族在抗氧化和病菌防御方面起重要作用;E亚族与I亚族亮氨酸拉链结构相似性很高,但功能研究较少;G亚族在光信号转导和种子成熟过程中发挥作用;H亚族在光合作用过程起关键作用;I亚族参与赤霉素代谢;S亚族参与逆境胁迫和糖类信号代谢,而B亚族和F亚族报导很少。除拟南芥外,其他植物BZIP转录因子的分类也大致如此[4]。不同的植物含有的BZIP类转录因子家族成员数量不同。现在拟南芥、大豆、水稻、玉米、葡萄、大麦、黄瓜、白菜中鉴定出的BZIP转录因子数分别为75[3]、100[5]、89[6]、125[7]、55[8]、89[9]、64[10]、136[11]。目前,有关BZIP蛋白的研究主要集中在模式植物的ABA信号通路及一些非生物胁迫方面,如ABI5和ABFs是ABA的响应元件,在拟南芥中通过参与转录水平的蛋白磷酸化和泛素化来稳定相关蛋白从而调节ABA的信号途径[12];从枳壳中分离的PtrABF转到烟草中可通过清除活性氧或者增强其对活性氧的耐性来调节逆境应答,抵御干旱胁迫[13]。此外,BZIP转录因子与其他信号通路间的关系也有报道,如ABF2是糖代谢途径的一个重要组成部分,该基因的过表达可以增强植物对多重胁迫的抗性[14],而DREB2C可以与ABF2互作,调节与ABA响应相关基因的表达[15]。【本研究切入点】目前也有BZIP转录因子在植物病害方面的研究,主要涉及D类BZIP成员,但在柑橘溃疡病方面还鲜有研究,因此,以柑橘为材料针对BZIP转录因子进行研究具有一定的价值。【拟解决的关键问题】探索CsBZIP40对溃疡病菌侵染、外源激素和物理创伤的响应模式,分析其抗病育种价值。
1 材料与方法
1.1 材料与试剂
试验材料为纽荷尔脐橙及四季橘()叶片,分别取自于西南大学柑橘研究所温网室和资源育种室苗圃。试验开始于2016年1月,柑橘叶片材料采自9月期间,在中国农业科学院柑桔研究所改良课题实验室完成。溃疡病菌由国家柑橘苗木脱毒中心提供,是亚洲种A株系,其对野生锦橙发病率是91%,病斑面积是4.5 mm2,病斑总面积是90.4 mm2,病斑所含病原菌数量是2.99×106cfu/mm2,病情指数73.3%。
植物总RNA提取试剂盒购自Aidlab公司;实时荧光染料购自BIO-RAD公司;胶回收试剂盒及质粒提取试剂盒购自Omega公司;克隆载体pGEM-T easy、反转录试剂盒和大肠杆菌()DH5感受态细胞购买自TaKaRa公司;GFP融合载体由本实验室构建和保存;根癌农杆菌EHA105感受态细胞由笔者实验室制备和保存。
1.2 数据挖掘、注释与信息学分析
柑橘(甜橙,)的基因组和蛋白组数据下载于公共数据库Phytozome(https://phytozome.jgi. doe.gov)和华中农业大学甜橙基因组数据库CAP[16](http://citrus.hzau.edu. cn/cgi-bin/orange/)。采用三步法综合注释流程对BZIP家族进行了专业注释[17],首先以拟南芥的BZIP家族73条完整序列与上述来源的蛋白质组数据进行比对初步获得甜橙中的BZIP蛋白序列;然后去掉其中的错误注释和重复序列,并且从NCBI数据库中检测EST数据支持并对上述错误的注释进行校正,最终得到的BZIP蛋白序列进行SCIPIO[18]分析,获得相应的染色体定位数据、基因结构数据、DNA和CDS序列以及上述两数据库中未注释的BZIP成员,自此,便完成了数据挖掘和注释。将得到的BZIP成员按照染色体定位进行命名,如:Cs为缩写,BZIP是基因家族的缩写,01是根据在染色体上的位置给这个成员的序号。
最大似然(maximum-likelihood)系统发育树采用PhyML-aLRT 3.0[19]进行分析并用Mega 6.0[20]进行进化树展示。构建进化树使用了甜橙全部的全长BZIP蛋白序列,序列对比和编辑采用MAFFT和Bioedit V7.2[21]。基因的染色体定位和基因复制关系(全基因组复制、片段复制、随机复制)的图形展示使用Mapchart软件[22]。
经过注释,笔者从转录组中获得的一个与溃疡病相关基因被命名为,根据基因序列设计引物F:5′-ATGGCGAGTCACAGAATTGGA-3′、R:5′-TCAAAAGTTCGAGAAATGATT-3′,以纽荷尔脐橙叶片cDNA为模板进行PCR扩增,反应条件:94℃预变性5 min;94℃ 15 s,57℃ 30 s,72℃ 2 min,35个循环;72℃延伸3 min;4℃保存。回收PCR产物,连接pGEM-T easy载体,重组质粒转化DH5感受态细胞,蓝白斑筛选,挑取阳性克隆,PCR验证后送上海英骏公司测序。用ProtParam程序(http://web. expasy.org/protparam/)对氨基酸序列的分子量、理论等电点(pI)、氨基酸含量、不稳定指数、亲水性进行预测;利用在线软件CELLO[23](http://cello.life.nctu. edu.tw/)进行亚细胞定位预测;用cNLS Mapper[24-25](http://nls-mapper.iab.keio.ac.jp/cgi-bin/NLS_Mapper_form.cgi)进行核定位信号预测;利用MEME[26]在线软件(http://meme-suite.org/)分析CsBZIP的结构域。
根据基因组数据库中基因序列设计特异引物F:5′-AAATTAAACAAATGTAAAGAAGA T-3′、R:5′-AGCTCCAATTCTGTGACTCGCCAT-3′,以基因组DNA为模板,扩增得到基因启动子并测序,利用网站PlantCARE[27]数据(http:// bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线分析预测启动子序列的顺式作用元件。
1.3 亚细胞定位
根据核苷酸序列设计去除了终止子并且两端都含有HⅠ酶切位点和保护碱基的引物F:5′-CGCGGATCCATGGCGAGTCACAGAATTGG-3′、R:5′-CGCGGATCCAAAGTTCGAGAAATGATTTT-3′,以测序正确的DNA为模板(连有pGEM-T easy载体),进行PCR扩增,其产物回收后连接在FJ905222(Binary vector pCX-DG)双元载体上,构建出::重组载体转化大肠杆菌,筛选阳性克隆提取质粒,进行PCR及酶切验证,将验证正确的质粒转化农杆菌,再进行上述阳性克隆子检测,验证农杆菌中是否含有上述质粒。将含重组质粒pCX-DG–::-CaMV-nos和作为对照的空载体pCX-DG--CaMV-nos农杆菌菌液配成OD600=0.1的菌悬液,参照Xu等[28]的方法将菌悬液注射在洋葱表皮细胞下两三层叶肉组织中,平均每1 cm2的表皮注射200 µL,28℃暗箱培养48 h,然后撕取表皮制成装片,荧光显微镜明、暗视野下观察表达情况,并拍照记录。
1.4 溃疡病菌侵染对的诱导表达
将采集的纽荷尔脐橙和四季橘叶片用75%无水乙醇的棉花擦净后自来水冲净,再用无菌水清洗两次后摆放到灭菌的培养皿中。将OD600=0.5的溃疡病菌液稀释1 000倍,用针刺法分别接种到荷尔脐橙和四季橘叶片上。28℃光照培养0、1、3、5 d后,切取病斑备用,以未接种溃疡病菌的叶片作对照。从切下含病斑的叶片中提取总RNA并反转录成cDNA,利用实时荧光定量PCR(qRT-PCR)分析各样品中的表达量。
1.5 外源激素及机械损伤对的诱导表达
将纽荷尔脐橙和四季橘叶片清洗干净,用打孔器将叶片打成直径为7 mm的叶圆片,然后将叶圆片分别浸泡在浓度为100 μmol·L-1茉莉酸甲酯(MeJA)、10 μmol·L-1水杨酸(SA)、10 μmol·L-1乙烯利(ET)溶液中。分别在0、6、12、24 h取样,提取总RNA并反转录为cDNA,qRT-PCR检测各诱导环境下不同时段的表达量。以75%无水乙醇处理的叶圆片为茉莉酸甲酯的对照组,以水处理的叶圆片为水杨酸和乙烯利处理的对照组。将纽荷尔脐橙和四季橘叶片清洗干净后用手术刀在叶片两侧各划一刀,以未处理的叶片作对照,然后分别在0、6、12、24 h打孔取样(叶圆片中间有划痕),提取RNA后反转录为cDNA,qRT-PCR检测的表达量。
1.6 实时荧光定量PCR与统计分析
利用NCBI在线软件设计基因定量引物F:5′-AGTTCCCTTTGGGCATCTCG-3′、R:5′-ACCATTTGCAGATCCGTCGT-3′,内参为甜橙,引物序列为F:5′-CATCCCTCAGCACCTTC C-3′、R:5′-CCAACCTTAGCACTTCTCC-3′。在ABI 7500荧光定量PCR仪上检测该基因表达量。采用12 µL的PCR反应体系:6 µL 2X荧光染料、4.4 µL H2O、0.3 µL 10 mol·L-1引物、1 µL cDNA。反应程序:95℃ 10 min,95℃ 15 s,60℃ 1 min,40个循环。每个处理进行3次生物学重复和3次平行样重复。相对表达量采用2-ΔΔCt法计算(ΔCt=CtCsBZIP40-CtActin),使用Excel软件进行数据统计分析,使用Origin软件进行绘图,使用SPSS 20进行差异显著性分析,<0.05表示差异显著。
2 结果
2.1 BZIP基因家族注释
经过注释总计从参考基因组挖掘到了47个(附表1)。跟其他物种相比,柑橘的数量较少,这些基因位于9号染色体之外的所有染色体上,其中3号染色体上有13个,占所有的27%,其基因密度最大为4.5×10-7个/Mb,2号染色体上的基因密度是3.2×10-8个/Mb,其基因密度最小,仅占所有的2%(图1)。该家族中有15对基因发生了全基因组重复,与属于随机重复,在所有染色体上均没有节段重复事件发生,没有发生染色体复制。基因组复制事件比其他物种少,这也是柑橘BZIP家族相对较小的原因。为得到较原始的BZIP进化数据,对这47个蛋白质序列与73个拟南芥BZIP蛋白数据进行进化分析,系统进化树将柑橘BZIP分为了10个亚家族,其中A亚家族10个,B亚家族1个,C亚家族5个,D亚家族7个,E亚家族3个,F亚家族1个,G亚家族4个,H亚家族3个,I亚家族5个,S亚家族8个(图2)。本试验中的在柑橘中没有与之相近的同源基因,特异性较好,但与拟南芥中基因的同源,它们均属于在病菌防御方面发挥作用的D亚家族。
CsBZIP转录因子家族的结构域分析结果显示motif 1的序列为QKTLAQNREAARKSRLRKKAYVQ QLE,motif 5的序列为KLTQLEQELQRARQQ,二者共同组成CsBZIP转录因子的核心元件,其他结构域的位置和数量所存在的差异造成CsBZIP间的功能差异(附图1)。根据柑橘BZIP家族的结构域差异进行分类,其结果与系统进化树分类结果相符。
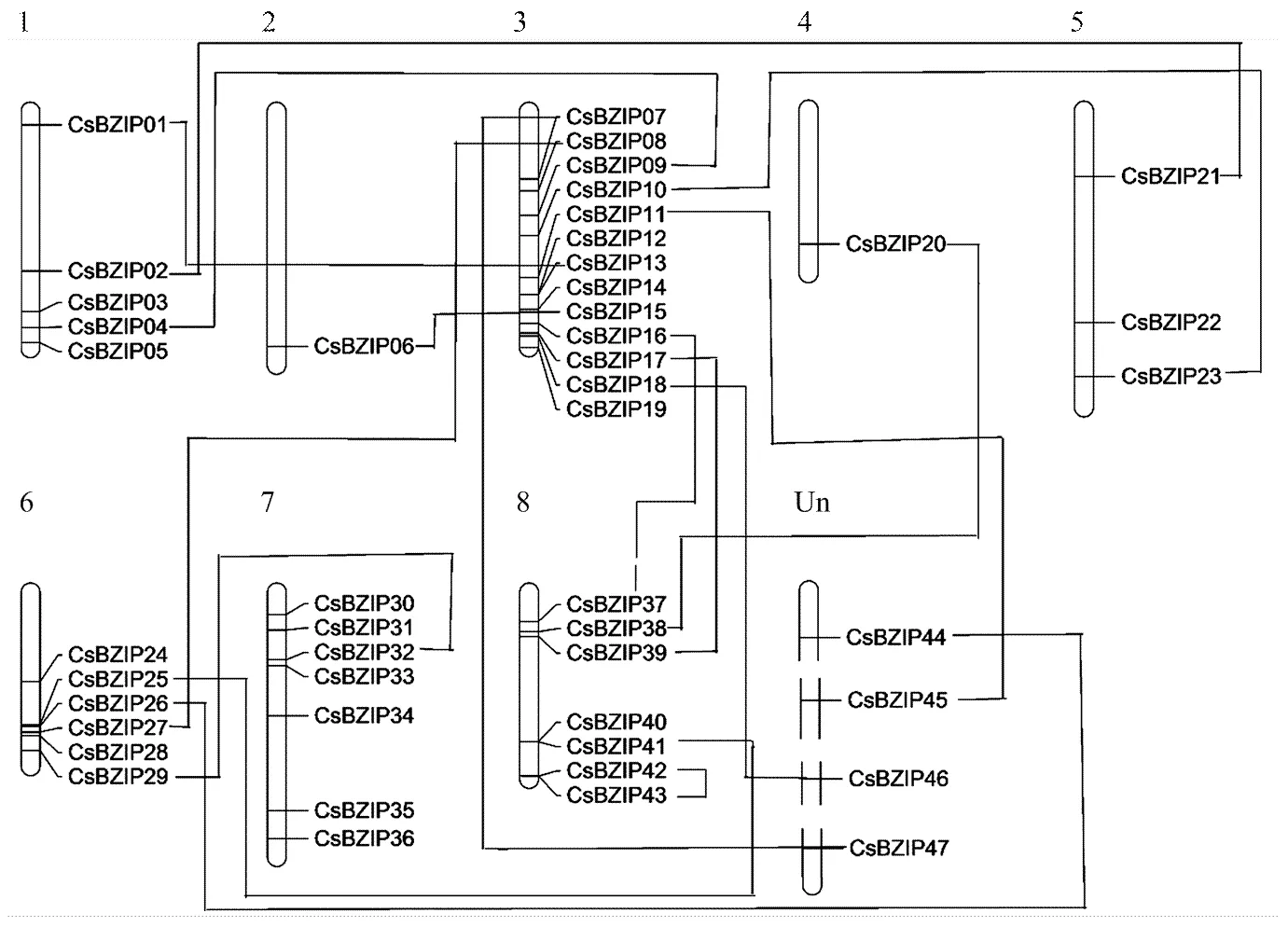
相互连接的两个基因表示一个基因复制事件The links between genes represented gene duplication events
2.2及其启动子的克隆与生物信息学分析
测序结果及序列分析得到cDNA全长为5 756 bp,开放阅读框长度为1 530 bp,编码509个氨基酸。CsBZIP40蛋白分子量为125 601.06,等电点是4.98,主要编码丙氨酸、半胱氨酸、谷氨酸、苏氨酸,含量分别为30.5%、22.5%、23.5%、23.6%,不稳定指数为42.66,脂肪酸系数为30.46,亲水指数为0.851,该蛋白整体表现为亲水的不稳定蛋白。
克隆测序了的核心启动子序列,DNA片段有1.5 kb。该启动子含有参与逆境和植物激素应答相关的顺式作用元件Box-W1、HSE、ERE等(表1)。
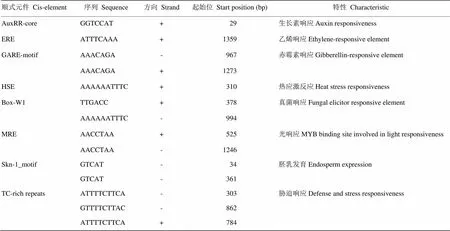
表1 PLACE预测CsBZIP40启动子区顺式作用元件

图2 柑橘中的BZIPs与拟南芥中的BZIPs系统进化分析
2.3 CsBZIP40核定位信号预测及亚细胞定位
亚细胞定位结果显示CsBZIP40定位于细胞核的预测分值显著高于其他位置,预测CsBZIP40在细胞核优势表达。cNLS Mapper结果显示,CsBZIP40的氨基酸序列中特定位点核定位分值较高,预测这些氨基酸序列为核定位信号(表2)。瞬时表达结果表明,空载体在整个细胞中均有表达,而融合蛋白在细胞核中定位,说明CsBZIP40是在细胞核中表达并发挥功能的转录因子,与亚细胞定位的预测结果一致(图3)。
2.4 抗/感品种中表达差异性
定量分析得知在叶片接种溃疡病菌0、1、3、5 d不同时期的表达水平存在差异,在柑橘高感病品种纽荷尔脐橙接种溃疡病菌后的表达变化上升幅度微小,随时间的变化幅度不明显,而在高抗病品种四季橘中的上调情况要明显高于纽荷尔脐橙,特别是在接种溃疡病菌3 d后的表达有一个显著的上升,证明该基因是高感病品种纽荷尔脐橙和高抗病品种四季橘感染溃疡病菌后的一个差异表达基因,与笔者实验室转录组测序结果分析一致(图4)。
2.5 外源激素及机械损伤对的诱导表达分析
SA处理后,纽荷尔脐橙和四季橘叶片中的表达没有显著性差异,可能由于此基因的启动子上没有与之相关的顺式作用元件(图5-A)。MeJA处理后,纽荷尔叶片的表达量明显上调,在12 h时表达量达到最高,但四季橘叶片中的表达没有显著变化。此基因启动子没有茉莉酸响应的顺式作用元件,但是纽荷尔中对茉莉酸甲酯有响应,可能与胁迫响应元件有关(图5-B)。经ET诱导后,纽荷尔和四季橘叶片的表达量上调,两个品种中表达量整体呈先升后降的趋势,在不同时间段的表达有显著差异,其中,四季橘在处理6 h后表达下降,而纽荷尔在6 h 后的表达趋势与四季橘相反,有明显的上调。两个品种对乙烯均有响应,这与启动子中乙烯顺式作用元件相关(图5-C)。在机械损伤后,纽荷尔中的表达量要高于四季橘,整体来看四季橘受机械损伤后表达量没有明显变化,而纽荷尔在损伤初期表达量有明显上升后趋于稳定(图5-D)。
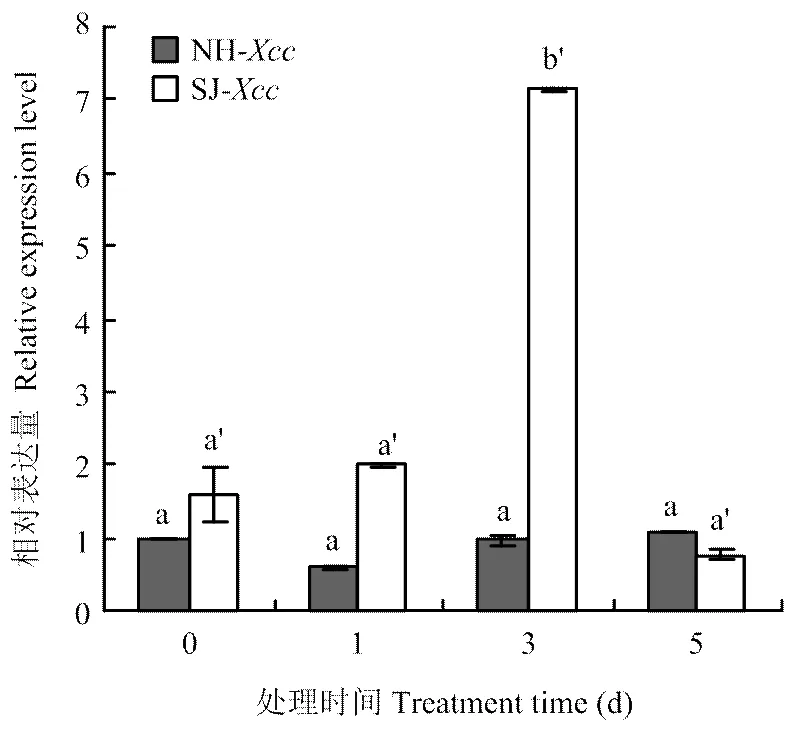
NH:纽荷尔脐橙Citrus junos;SJ:四季橘Calamondin。下同 The same as below
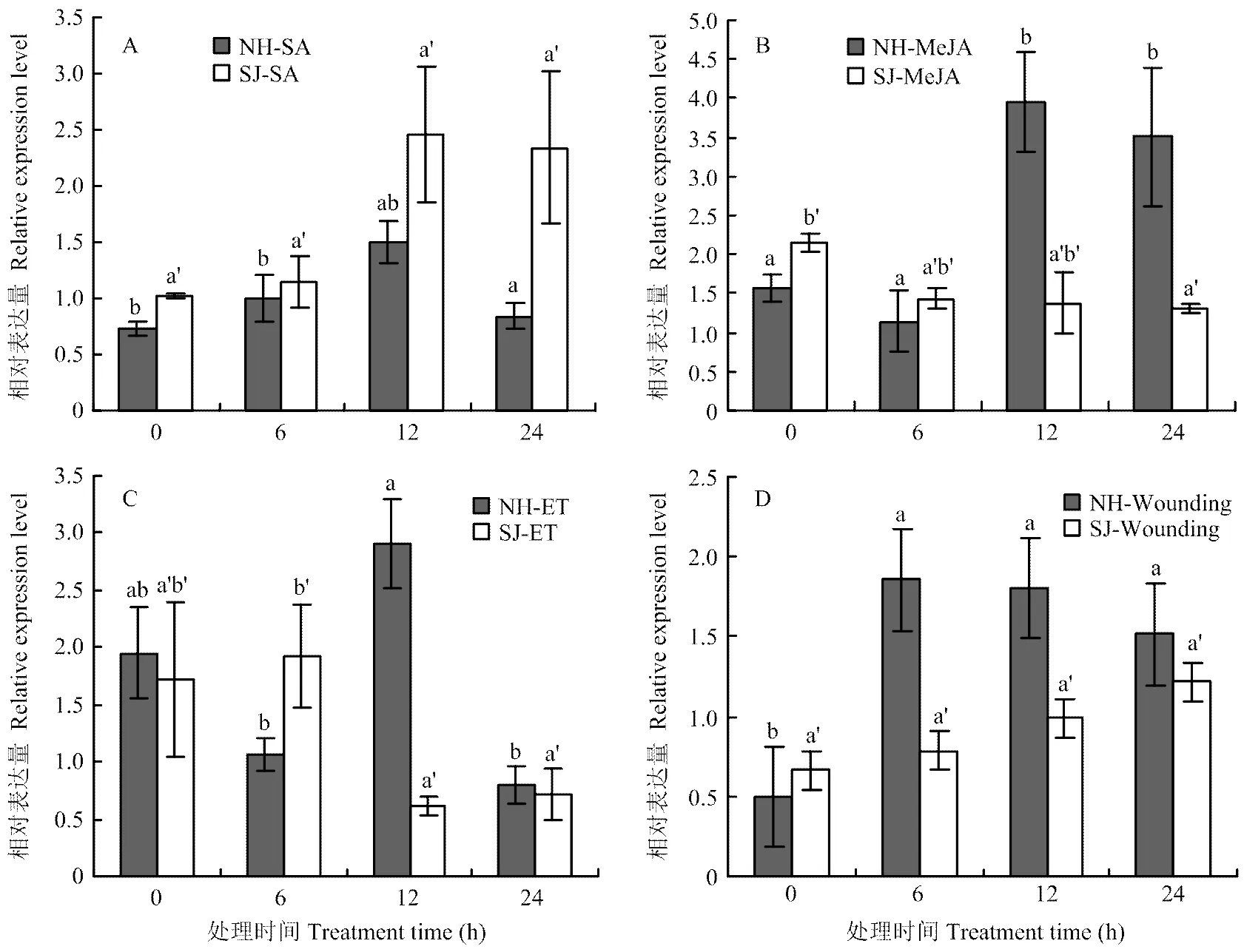
A:水杨酸SA;B:茉莉酸甲酯MeJA;C:乙烯利ET;D:机械损伤Wounding
3 讨论
植物在应对外界非生物胁迫过程中,不同基因启动子的顺式作用元件可与不同转录因子结合,然后激活或抑制相关抗逆基因的表达以使植物对胁迫作出针对性的调节反应。对进行启动子分析,发现其启动子区存在生长素响应元件AuxRR-core、乙烯响应元件ERE、赤霉素响应元件GARE-motif、胁迫响应元件TC-rich repeats及参与热激响应元件HSE等,这些元件的存在表明该转录因子可能参与转录调控,与激素的代谢途径相关,进而影响生物或非生物逆境的响应。因此推测可能参与植物的逆境响应。此外,该基因顺式作用元件中还含有与胚乳发育相关的Skn-1-motif及响应真菌诱导的作用元件Box-W1,推测其在植物生长发育和真菌入侵防御过程中也发挥相应作用。
每个转录因子家族成员的多少与染色体间的节段重复,随机重复发生的频率有直接联系,例如,拟南芥、水稻和高粱的基因组中片段重复的概率为53%—59%[10],黄瓜为37%[10],玉米为46%[7],而柑橘基因组中没有片段重复的;从随机复制角度来看,黄瓜中随机复制的概率为12%,拟南芥为73%,水稻为56%[10],而柑橘中仅有2%。从总体来看,柑橘中的基因家族发生基因随机重复和片段重复的概率都比其他几个物种要低很多,因此柑橘中的该基因家族成员较少。同时每条染色体上的基因密度小也是造成该基因家族成员较少的原因。
是笔者实验室转录组测序中得到的一个明显响应溃疡病菌侵染的基因,克隆纽荷尔中的转录因子CsBZIP40后,经氨基酸序列分析发现其具有D类BZIP亚家族的结构域,进化分析显示该基因与拟南芥中在病菌防御方面发挥作用的D亚家族AT1G08320同源,有研究证明拟南芥中的BZIP蛋白可以对昆虫危害和细菌感染作出应答[29],推测该基因可能也参与柑橘中的其他病害防御反应。
不同的激素种类或不同的环境刺激会诱导不同的抗性基因的表达,如CAM家族的CAM7与BZIP家族的HY5转录因子互作可以参与ABA应答[30];白菜中的BrABI5a和BrABI5b是ABA信号通路的正向调控因子[11];大麦HvRAF受水杨酸、乙烯、茉莉酸甲酯、高盐和病害的胁迫诱导[31],而本研究发现外源水杨酸并不会使四季橘和纽荷尔脐橙中的表达水平显著上调,纽荷尔在茉莉酸甲酯诱导后有明显的差异表达,但乙烯利可以使在四季橘和纽荷尔脐橙中均有较明显的差异表达,而且该基因也响应柑橘溃疡病菌。由此表明并不参与水杨酸的抗病信号途径,而参与乙烯和茉莉酸的信号响应。此外,在四季橘中乙烯的信号响应模式与溃疡病菌的响应有上升趋势,推测二者之间存在联系,关于与乙烯信号途径及乙烯信号途径与溃疡病抗性间的联系有待进一步研究。
植物通过抗病信号途径上调下游相关防卫基因表达,抵制病原菌侵染,从而产生抗病性。同一植物对不同类型病原微生物的抗病反应涉及的抗病信号途径不同。本试验表明抗性品种四季橘在感染溃疡病后表达量会上升,整体而言,在纽荷尔中的表达量要低于四季橘,说明是一个正向调节因子,在四季橘中,较高表达量的可以调控下游基因的表达,从而引起抗性。纽荷尔中同样有这个基因,但是它并没有在溃疡病菌侵染时提升表达量,可能因为在纽荷尔中缺少识别溃疡病菌侵染的因子或者缺少信号转导途径将侵染信号传递给转录因子CsBZIP40,导致没有更多的表达,从而无法更好地调节下游抗性基因的表达进而产生抗性。所以在四季橘和纽荷尔中,表达量决定了是否抗溃疡病。实践中,可以采用在纽荷尔中过表达的方式来提升对下游抗性基因的调控来进行分子育种,该基因对柑橘感染溃疡病后的抗性评价值得进一步研究。
4 结论
与拟南芥的同源,该基因在柑橘中没有同源基因,属于与病原菌抗性相关的D类BZIP转录因子,序列和结构特异性较好;CsBZIP40是一个在细胞核中表达并响应溃疡病病菌的转录因子,经外源乙烯利诱导后有一个较明显的上调表达;在柑橘的抗溃疡病病菌分子育种中,可作为一个很有潜力的候选基因来进行后期的功能性验证。
References
[1] 陈儒钢, 巩振辉, 逯明辉, 李大伟, 黄炜. 植物抗逆反应中的转录因子网络研究进展. 农业生物技术学报, 2010, 18(1): 126-134.
CHEN R G, GONG Z H, LU M H, LI D W, HUANG W. Research advance of the transcription factor networks related to plant adverse environmental stress., 2010, 18(1): 126-134. (in Chinese)
[2] 李红霞, 汪妤, 张战凤, 彭惠茹, 倪中福. 植物转录因子与作物抗逆胁迫关系的研究进展. 麦类作物学报, 2013, 33(3): 613-618.
LI H X, WANG Y, ZHANG Z F, PENG H R, NI Z F. Progress in relationship between plant transcription factors and crop stress tolerance., 2013, 33(3): 613-618. (in Chinese)
[3] Jakoby M, Weisshaar B, Dröge-Laser W, Vicente- Carbajosa J, Tiedemann J, Kroj T, Parcy F. bZIP transcription factors in,2002, 7(3): 106-111.
[4] 张计育, 渠慎春, 郭忠仁, 杜小丽, 都贝贝, 章镇. 植物bZIP转录因子的生物学功能. 西北植物学报, 2011, 31(5): 1066-1075.
ZHANG J Y, QU S C, GUO Z R, DU X L, DU B B, ZHANG Z. Biology function of BZIP transcription factors in plants., 2011, 31(5): 1066-1075. (in Chinese)
[5] JIN Z, XU W, LIU A. Genomic surveys and expression analysis ofgene family in castor bean (L.)., 2014, 239(2): 299-312.
[6] NIJHAWAN A, JAIN M, TYAGI A K, KHURANA J P. Genomic survey and gene expression analysis of the basic leucine zipper transcription factor family in rice., 2008, 146(2): 333-350.
[7] WEI K, CHEN J, WANG Y, CHEN Y, CHEN S, LIN Y, PAN S, ZHONG X J, XIE D X. Genome-wide analysis of bZIP-encoding genes in maize., 2012, 19(6): 463-476.
[8] LIU J Y, CHEN N N, FEI C B C, SILVIA D S, GIOVANNI B T, MARIO P, CHENG Z M. Genome-wide analysis and expression profile of the bZIP transcription factor gene family in grapevine ().,2014, 15: 281.
[9] POURABED E, GHANE GOLMOHAMADI F, SOLEYMANI MONFARED P, RAZAVI S M, SHOBBAR Z S. Basic leucine zipper family in barley: genome-wide characterization of members and expression analysis., 2015, 57(1): 12-26.
[10] BALOGLU M C, ELDEM V, HAJYZADEH M, UNVER T. Genome-wide analysis of the BZIP transcription factors in cucumber., 2014, 9(4): e96014.
[11] BAI Y L, ZHU W B, HU X C, SUN C C, Li Y L, WANG D D, WANG Q H, PEI G L, ZHANG Y F, GUO A G, ZHAO H X, LU H B, MU X Q, HU J J, ZHOU X N, XIE C G. Genome-wide analysis of the BZIP gene family identifies two ABI5-Like BZIP transcription factors, BrABI5a and BrABI5b, as positive modulators of ABA signalling in Chinese cabbage., 2016, 11(7): e0158966.
[12] WANG Y, LI L, YE T, LU Y, CHEN X, WU Y. The inhibitory effect of ABA on floral transition is mediated by ABI5 in., 2013, 64(2): 675-684.
[13] HUANG X S, LIU J H, CHEN X J. Overexpression ofgene, a BZIP transcription factor isolated from, enhances dehydration and drought tolerance in tobacco via scavenging ROS and modulating expression of stress-responsive genes., 2010, 10: 230.
[14] KIM S, KANG J Y, CHO D I, PARK J H, KIM S Y. ABF2, an ABRE-binding BZIP factor, is an essential component of glucose signaling and its overexpression affects multiple stress tolerance., 2004, 40(1): 75-87.
[15] LEE S J, KANG J Y, PARK H J, KIM M D, BAE M S, CHOI H I, KIM S Y. DREB2C interacts with ABF2, a BZIP protein regulating abscisic acid-responsive gene expression, and its overexpression affects abscisic acid sensitivity., 2010, 153(2): 716-727.
[16] XU Q, CHEN L L, RUAN X A, CHEN D J, ZHU A D, CHEN C L, BERTRAND D, JIAO W B, HAO B H, LYON M P, CHEN J J, GAO S, XING F, LAN H, CHANG J W, GE X H, LEI Y, HU Q, MIAO Y, WANG L, XIAO S X, BISWAS M K, ZENG W F, GUO F, CAO H B, YANG X M, XU X W, CHENG Y J, XU J, LIU J H, LUO J H, TANG Z H, GUO W W, KUANG H H, ZHANG H Y, ROOSE M, NAGARAJAN N, DENG X X, RUAN Y J. The draft genome of sweet orange ()., 2013, 45(1): 59-66.
[17] FAWAL N, LI Q, MATHÉ C, DUNAND C. Automatic multigenic family annotation: risks and solutions., 2014, 30(8): 323-325.
[18] KELLER O, ODRONITZD F, STANKE M, KOLLMAR M, WAACK S. Scipio: using protein sequences to determine the precise exon/ intron structures of genes and their orthologs in closely related species., 2008, 9: 278D.
[19] GUINDON S, DUFAYARD J F, LEFORT V, ANISIMOVA M, HORDIJK W, GASCUEL O. New algorithms and methods to estimate maximum-likelihood phylogenies: assessing the performance of PhyML 3.0.,2010, 59(3): 307-321.
[20] TAMURA K, STECHER G, PETERSON D, FILIPSKI A, KUMAR S. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0., 2013, 30(12): 2725-2729.
[21] TIPPMANN H F. Analysis for free: comparing programs for sequence analysis., 2004, 5(1): 82-87.
[22] VOORRIPS R E. MapChart: software for the graphical presentation of linkage maps and QTLs., 2002, 93(1): 77-78.
[23] YU C S, LIN C J, HWANG J K. Predicting subcellular localization of proteins for gram-negative bacteria by support vector machines based on-peptide compositions., 2004, 13(5): 1402-1406.
[24] KOSUGI S, HASEBE M, TOMITA M, YANAGAWA H. Systematic identification of yeast cell cycle-dependent nucleocytoplasmic shuttling proteins by prediction of composite motifs., 2009, 106(25): 10171-10176.
[25] KOSUGI S, HASEBE M, MATSUMURA N, TAKASHIMA H, MIYAMOTO-SATO E, TOMITA M, YANAGAWA H. Six classes of nuclear localization signals specific to different binding grooves of importin., 2009, 284(1): 478-485.
[26] BAILEY T L, BODÉN M, BUSKE F A, FRITH M, GRANT C E, CLEMENTI L, REN J, LI W W, NOBLE W S. MEME suite: tools for motif discovery and dearching., 2009, 37(Suppl. 2): W202-W208.
[27] LESCOT M, DÉHAIS P, THIJS G, MARCHALA K, MORESU Y, PEER Y V, ROUZÉ P, ROMBAUTS S. PlantCARE, a database of plant-acting regulatory elements and a portal to tools foranalysis of promoter sequences., 2002, 30(1): 325-327.
[28] XU K, HUANG X, WU M, WANG Y, CHANG Y, LIU K, ZHANG J, ZHANG Y, ZHANG F L, YI L M, LI T T, WANG R Y, TAN G X, LI C W. A rapid, highly efficient and economical method of-mediatedtransient transformation in living onion epidermis., 2014, 9(1): e83556.
[29] BARAH P, WINGE P, KUSNIERCZYK A, TRAN D H, BONES A M. Molecular signatures inin response to insect attack and bacterial infection., 2013, 8(3): e58987.
[30] ABBAS N, CHATTOPADHYAY S. CAM7 and HY5 genetically interact to regulate root growth and abscisic acid responses., 2014, 9(9): e29763.
[31] JUNG J, WON SY, SUH SC, KIM H, WING R, JEONG Y, HWANG I, KIM M. The barley ERF-type transcription factor HvRAF confers enhanced pathogen resistance and salt tolerance in., 2007, 225(3): 575-588.
(责任编辑 岳梅)
附表1 甜橙的BZIP基因家族
Table S1 The BZIP gene family in
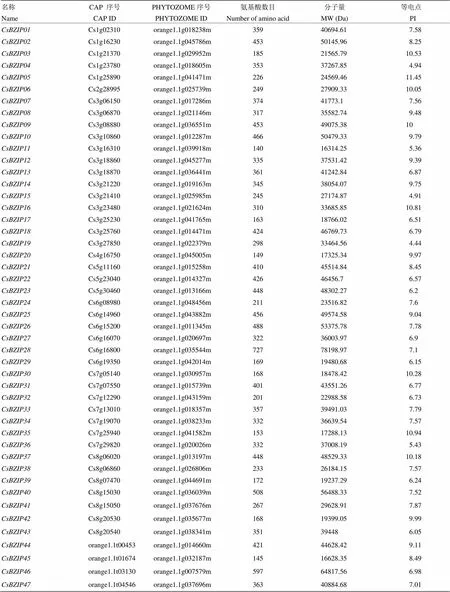
名称NameCAP 序号CAP IDPHYTOZOME序号PHYTOZOME ID氨基酸数目Number of amino acid分子量MW (Da)等电点PI CsBZIP01Cs1g02310orange1.1g018238m35940694.617.58 CsBZIP02Cs1g16230orange1.1g045786m45350145.968.25 CsBZIP03Cs1g21370orange1.1g029952m18521565.7910.53 CsBZIP04Cs1g23780orange1.1g018605m35337267.854.94 CsBZIP05Cs1g25890orange1.1g041471m 22624569.4611.45 CsBZIP06Cs2g28995orange1.1g025739m24927909.3310.05 CsBZIP07Cs3g06150orange1.1g017286m37441773.17.56 CsBZIP08Cs3g06870orange1.1g021146m31735582.749.48 CsBZIP09Cs3g08880orange1.1g036551m45349075.3810 CsBZIP10Cs3g10860orange1.1g012287m 46650479.339.79 CsBZIP11Cs3g16310orange1.1g039918m14016314.255.36 CsBZIP12Cs3g18860orange1.1g045277m 33537531.429.39 CsBZIP13Cs3g18870orange1.1g036441m36141242.846.87 CsBZIP14Cs3g21220orange1.1g019163m 34538054.079.75 CsBZIP15Cs3g21410orange1.1g025985m 24527174.874.91 CsBZIP16Cs3g23480orange1.1g021624m 31033685.8510.81 CsBZIP17Cs3g25230orange1.1g041765m16318766.026.51 CsBZIP18Cs3g25760orange1.1g014471m 42446769.736.79 CsBZIP19Cs3g27850orange1.1g022379m 29833464.564.44 CsBZIP20Cs4g16750orange1.1g045005m14917325.349.97 CsBZIP21Cs5g11160orange1.1g015258m41045514.848.45 CsBZIP22Cs5g23040orange1.1g014327m42646456.76.57 CsBZIP23Cs5g30460orange1.1g013166m44848302.276.2 CsBZIP24Cs6g08980orange1.1g048456m21123516.827.6 CsBZIP25Cs6g14960orange1.1g043882m 45649574.589.04 CsBZIP26Cs6g15200orange1.1g011345m 48853375.787.78 CsBZIP27Cs6g16070orange1.1g020697m 32236003.976.9 CsBZIP28Cs6g16800orange1.1g035544m72778198.977.1 CsBZIP29Cs6g19350orange1.1g042014m16919480.686.15 CsBZIP30Cs7g05140orange1.1g030957m16818478.4210.28 CsBZIP31Cs7g07550orange1.1g015739m40143551.266.77 CsBZIP32Cs7g12290orange1.1g043159m 20122988.586.73 CsBZIP33Cs7g13010orange1.1g018357m 35739491.037.79 CsBZIP34Cs7g19070orange1.1g038233m 33236639.547.57 CsBZIP35Cs7g25940orange1.1g041582m15317288.1310.94 CsBZIP36Cs7g29820orange1.1g020026m33237008.195.43 CsBZIP37Cs8g06020orange1.1g013197m 44848529.3310.18 CsBZIP38Cs8g06860orange1.1g026806m23326184.157.57 CsBZIP39Cs8g07470orange1.1g044691m 17219237.296.24 CsBZIP40Cs8g15030orange1.1g036039m50856488.337.52 CsBZIP41Cs8g15050orange1.1g037676m26729628.917.87 CsBZIP42Cs8g20530orange1.1g035677m16819399.059.99 CsBZIP43Cs8g20540orange1.1g038341m351394486.05 CsBZIP44orange1.1t00453orange1.1g014660m42144628.429.11 CsBZIP45orange1.1t01674orange1.1g032187m14516628.358.49 CsBZIP46orange1.1t03130orange1.1g007579m59764817.566.98 CsBZIP47orange1.1t04546orange1.1g037696m36340884.687.01
附图1 甜橙中BZIPs的结构域分析
Fig. S1 The motifs of BZIPs in
Gene Cloning and Expression Analysis of Canker-Related Transcription Factor CsBZIP40 in Citrus
JIA RuiRui, ZHOU PengFei, BAI XiaoJing, CHEN ShanChun, XU LanZhen, PENG AiHong, LEI TianGang, YAO LiXiao, CHEN Min, HE YongRui, Li Qiang
(Citrus Research Institute, Southwest University/Citrus Research Institute, Chinese Academy of Agricultural Sciences/National Citrus Engineering Research Center, Chongqing 400712)
【Objective】The objective of this study is to annotate the BZIP family and clone the citrus canker related transcription factor CsBZIP40. It is also aimed to confirm the subcellular localization and the expression profile reduced by exogenous hormone and mechanical damage and the relations betweenandsubsp.() infection. 【Method】Based on the public genome databases, the BZIP gene family was expertly and comprehensively annotated and named based on the chromosomal localization of all the members of BZIP; the motifs of the BZIPs were analyzed by MEME online tool. the phylogenetic tree of BZIPs inandwas constructed using software Mega 6.0 based on which the category of BZIP family was obtained. Canker-related transitional factorobtained from transcriptome data was also detected by qRT-PCR. Elements in the promoter and the nuclear localization signal were analyzed with database plantCARE and online tool cNLSmapper, respectively. And then the subcellular localization was confirmed by GFP fusion experiments in onion to confirm the prediction of nuclear localization analyzed with softwares. Expression profiles induced by salicylic acid (SA), jasmonic acid methyl ester (MeJA), ethylene (ET) and mechanical damage ofwere checked with qRT-PCR. 【Result】A total of 47genes were annotated from the whole genome ofand all theare located on every chromosome except the 9th one. Theconcentration on chromosome 3 are 4.5×10-7/Mb which is the highest while chromosome 2 is the lowest, contains only 2% of allin citrus. There were fewer gene duplication events detected from BZIP family of citrus compared with other plants, such as, grapevine and so on. That is why citrus has a smaller BZIP family size. The full-length ofis 5 756 bp with a 1 530 bp open reading frame which codes a protein containing 509 amino acids. It is closely related tobased on the evolutionary analysis. In citrus, the BZIPs have been annotated which can be divided into 10 different sub-families.belongs to sub-family D, which is always take part in the pathogen resistance in plants. The gene promoter contains multiple cis involved in plant adversity or hormone response, such as Box-W1, HSE, ERE and so on. Subcellular localization results confirmed the prediction of protein localization in nucleus. Based on the qPCR data, the exogenous salicylic acid cannot induce the different expression of, in contrast, jasmonic acid methyl ester, mechanical damage and ethylene can induce significant differences in gene expression level.attack can significantly increase the expression level ofCalamondin but no difference in Newhall navel orange. 【Conclusion】CsBZIP40 would be an important transcription factor which is closely associated with the resistance of citrus canker. This gene should be a potential candidate in the molecular breeding to improve the canker resistance of citrus.
citrus canker; BZIP; transcription factors; subcellular localization
2017-01-09;接受日期:2017-02-27
国家现代农业柑桔产业技术体系(CARS-27)、中央高校基本科研业务费(XDJK2015C089,SWU115025,XDJK2014A08)
贾瑞瑞,E-mail:jiarui0678@foxmail.com。通信作者李强,E-mail:liqiang@cric.cn。通信作者何永睿,E-mail:heyongrui@cric.cn

