小麦锌指转录因子TaDi19A对低温的响应及其互作蛋白的筛选
茹京娜,于太飞,陈隽,陈明,周永斌,马有志,徐兆师,闵东红
小麦锌指转录因子TaDi19A对低温的响应及其互作蛋白的筛选
茹京娜1,2,于太飞2,陈隽2,陈明2,周永斌2,马有志2,徐兆师2,闵东红1
(1西北农林科技大学/旱区作物逆境生物学国家重点实验室,陕西杨凌712100;2中国农业科学院作物科学研究所/农作物基因资源与基因改良国家重大科学工程/农业部麦类生物学与遗传育种重点实验室,北京100081)
【目的】锌指类转录因子在植物逆境信号转导和非生物胁迫响应中发挥重要的作用。通过对小麦锌指转录因子基因的耐冷性能进行鉴定,利用酵母双杂交技术筛选并获得与TaDi19A互作的候选蛋白,以解析介导的抗逆调控机制。【方法】通过对低温处理的小麦转录组测序结果进行分析,获得一个锌指类转录因子。利用生物信息学的方法分析的分子特性,用SMART在线工具进行蛋白结构分析;用GSDS和PHYRE2在线工具分别对结构和蛋白三级结构进行分析;用NetPhos 2.0 Server数据库预测TaDi19A蛋白磷酸化位点。以低温处理的小麦cDNA作为模板,通过SYBR Green染料法进行实时荧光定量PCR,检测在低温处理不同时间段的表达模式。构建植物表达载体pBI121-,通过花序侵染法转化拟南芥,用T3代拟南芥进行耐冷性鉴定,分析低温处理对转基因拟南芥的根长、鲜重和存活率的影响。检测转拟南芥中抗逆相关基因表达变化,分析调控植物耐冷性的作用机制。构建诱饵载体pGBKT7-,验证自激活活性;利用酵母双杂交技术,将诱饵载体pGBKT7-和小麦cDNA文库共转化酵母AH109感受态细胞,通过SD/-Trp/-Leu/-His/-Ade和X-α-gal显蓝反应筛选得到阳性克隆,测序和BLAST分析获得候选蛋白。【结果】小麦编码区全长747 bp,编码248个氨基酸,分子量为28.03 kD,等电点为4.74,基因含4个外显子,3个内含子。TaDi19A蛋白靠近N-端包含锌指结合结构域,C端为Di19结构域,预测的TaDi19A蛋白三级结构包含2个α螺旋结构。磷酸化位点分析结果显示TaDi19A蛋白含有12个丝氨酸、9个苏氨酸和3个酪氨酸磷酸化位点。实时荧光定量PCR结果显示,受低温胁迫诱导表达。正常生长条件下,转基因和野生型拟南芥没有明显差异,低温处理下,转基因拟南芥的根长明显大于野生型拟南芥,并且耐冷性强于野生型拟南芥。下游基因检测结果表明,低温处理后,、和等冷胁迫响应相关基因在野生型和转基因植株中表达量都升高,在转基因植株中的表达量显著高于野生型,表明可能通过调节下游冷胁迫响应相关基因的表达提高转基因植物的耐冷性。通过对酵母双杂交系统筛选到的候选互作蛋白进行初步分析表明,这些候选互作蛋白主要参与植物体的信号转导和非生物胁迫响应过程,表明在植物的逆境信号转导及非生物胁迫响应过程中发挥着重要作用。【结论】小麦受低温诱导表达,过表达能够提高转基因拟南芥的耐冷性;而功能的发挥可能需要其他蛋白的参与。
普通小麦;锌指转录因子;耐冷性;酵母双杂交;蛋白互作
0 引言
【研究意义】干旱、盐碱、高温、低温等非生物胁迫因子严重影响作物的产量和品质[1],其中低温是一个非常重要的环境因子。近年来气候变化异常,极端低温天气出现频繁,低温寒害已经成为农业生产中面临的严重自然灾害之一。低温通过影响植物细胞膜成分,气孔开度等生理、生化过程对植物造成伤害,限制作物的种植区域,影响作物的产量[2]。植物遭受冷胁迫时,从接收低温信号到引起生理生化反应,再到调节基因表达,最后产生耐冷能力,存在一个复杂的信号传导系统[3-4],其中低温胁迫相关转录因子的作用尤为关键,它可以诱导下游多个耐冷基因的表达从而提高植物的耐冷性[5]。小麦是世界重要的粮食作物之一,低温冻害和倒春寒对小麦生产造成了严重的威胁。因此,发掘小麦耐冷相关转录因子基因,研究其调控机制,对于完善低温胁迫应答的分子机制和利用分子手段改良作物耐冷性具有重要意义。【前人研究进展】植物对逆境胁迫应答反应是一个涉及多基因、多信号传导途径及多基因表达产物的复杂过程[6]。其中转录因子是植物体内一类重要的调节因子。转录因子(transcription factor,TF)也称反式作用因子,能够与基因启动子区域中顺式作用元件特异性结合,调节众多下游基因的表达,对植物的生长发育、形态建成、以及抵抗非生物胁迫起重要作用[7-9]。自植物中最早的转录因子在玉米中被报道以来[10],已从植物中分离鉴定出大量转录因子,根据DNA结构域的特点将转录因子分成若干个家族,包括WRKY、AP2/EREBP、MYB、bZIP和ZFPs等[11-12]。在植物对低温胁迫的响应过程中,转录因子通过调控下游抗逆相关基因的表达起着重要的作用[13]。低温能够诱导多种植物基因的表达,如、、或者等[14-16]。CBFs/DREBs转录因子能够与COR/KIN/LTI/RD基因启动子区的DRE/CRT顺式作用元件结合并调控其表达[17-18]。拟南芥中过表达和能调控下游冷诱导基因的表达,产生高水平的脯氨酸和可溶性糖,从而提高植物的耐冷性[19-21];冷处理下能够负向调控和的表达,从而调控下游基因表达及拟南芥的耐冷性[22]。编码一个MYC类bHLH 转录因子,位于CBFs上游,正向调控CBFs,过表达的同源基因同样能够提高拟南芥的耐冷性[23-24]。这些研究都表明CBF-依赖途径在植物低温胁迫中起着重要的作用。除了CBF-依赖途径,在植物的低温胁迫响应中还存在着多重的信号途径[25-27]。C2H2类锌指蛋白是真核生物中最大的转录因子家族之一,在植物非生物胁迫响应中起着重要作用[8, 28-29],其中一些C2H2类锌指蛋白对低温胁迫响应。例如大豆的锌指蛋白基因,能够提高bZIP类转录因子SGBF-1与ABRE的结合效率,调控转基因植物对低温的耐受性[30];另一个大豆的锌指蛋白基因能够被ABA、盐、干旱和低温诱导,增强转基因拟南芥对干旱和低温的耐受性[13]。据报道,水稻锌指蛋白基因//和沙冬青的锌指蛋白基因受多种非生物胁迫诱导,均提高了转基因植株对冷、干旱和盐胁迫的耐受性[11, 31-34]。虽然近几年生物技术发展迅速,但是植物C2H2类锌指蛋白的生理生化功能研究还很少。到目前为止,大部分被鉴定的植物胁迫相关的C2H2类锌指蛋白都在干旱和盐胁迫中起着重要作用,然而其中很少涉及到冷胁迫响应,尤其是在作物中[30-31]。【本研究切入点】小麦是世界重要的粮食作物之一,而低温冻害和倒春寒却限制了小麦的种植区域。本研究通过对低温处理的小麦转录组测序结果进行分析,获得一个Di19家族转录因子。Di19家族属于锌指蛋白中的一个小家族,包含zf-di19和di19_C结构域,涉及到植物非生物胁迫响应[35-37]。在拟南芥、水稻和大豆中分别鉴定出了7个成员[35, 38-39],而在小麦中的研究却很少。小麦中,LI等[40]发现对植物非生物胁迫响应起着重要作用,过表达能提高拟南芥在萌发期对盐胁迫、ABA和甘露醇的敏感性,根长试验表明过表达能够降低植株对盐胁迫的耐受性和对乙烯的敏感性,然而关于Di19在小麦冷胁迫响应中的研究尚未见报道。【拟解决的关键问题】本研究通过实时荧光定量PCR鉴定了在低温胁迫下的表达模式,以及转基因拟南芥对低温胁迫的响应;为了进一步研究的耐冷作用机制,利用酵母双杂交技术以pGBKT7-为诱饵筛选小麦cDNA文库,筛选可能与其互作的候选蛋白,为研究小麦Di19转录因子抗逆调控机制提供依据。
1 材料与方法
1.1 植物材料及胁迫处理
普通小麦(L.)农家品种小白麦是由中国农业科学院作物科学研究所景蕊莲研究员提供。将其播种在土中于22℃生长1周,然后对其进行低温胁迫处理:将小麦幼苗放入4℃继续生长,并于1、2、4、8、12和24 h分别取样。取2周大的野生型拟南芥(Columbia-0)和过表达的拟南芥进行下游胁迫相关基因的分析。将所取样品迅速放入液氮中,然后保存到-80℃冰箱中。
1.2 基因的生物信息学分析
小麦TaDi19A数据来源于EnsemblPlants(http:// plants.ensembl.org/index.html)数据库。小麦TaDi19A蛋白的分子量和等电点用在线工具 Compute pI/Mw tool(http://web.expasy.org/protparam/)计算。其余的生物信息学分析方法如下:利用SMART(http://smart. embl-heidelberg.de/)在线工具分析小麦TaDi19A蛋白的结构域;利用GSDS(http://gsds.cbi.pku.edu.cn/)制作小麦TaDi19A外显子-内含子结构示意图;利用PHYRE2(http://www.sbg. bio.ic.ac.uk/ phyre2.html)在线工具对TaDi19A蛋白三级结构进行分析[41]。利用NetPhos 3.1 Server数据库(http://www.cbs.dtu.dk/ services/NetPhos/)预测TaDi19A蛋白磷酸化位点。
1.3 RNA提取和实时荧光定量PCR(qRT-PCR)
用植物总RNA提取试剂盒(天根,北京)提取不同时间段低温处理的小麦RNA和拟南芥RNA,按照反转录试剂盒(TaKaRa,大连)说明书将提取的RNA反转录成单链cDNA。然后将反转录的cDNA模板均稀释到200 ng·μL-1,以SYBR Green染料法,在ABI 7500(Applied Biosystems,Foster City,CA)仪器上进行实时荧光定量PCR反应。反应体系及程序参见Feng等[38]。每个反应3次重复。按照基因相对表达分析2-ΔΔCT方法分析和拟南芥胁迫相关基因的相对表达量及其标准差。
1.4 转基因拟南芥的产生及低温鉴定
将的编码序列构建到带有CaMV35S启动子的pBI121表达载体上,转入GV3101农杆菌中,通过花序侵染法侵染开花期的野生型拟南芥。转基因拟南芥的筛选参照HE等[42],T3纯合转基因种子和野生型种子用于低温表型鉴定。
将野生型WT与T3转基因拟南芥种子用70%的酒精洗3 min,无菌水洗3次,0.7%的NaClO溶液泡15 min,无菌水再冲洗3次,晾干后点种于MS0培养基上。先在4℃春化3 d打破休眠,然后转移到16 h光照/8 h黑暗、60%相对湿度、22℃的培养箱中继续生长。将生长5 d的拟南芥幼苗移到新的MS0培养基上,将其分别放入22℃和4℃直立生长,观察转基因和野生型植株根部的生长状况,统计根长和鲜重。将生长10 d大的拟南芥幼苗转移到营养土中(蛭石﹕泥炭土=1﹕1),在适宜条件下(16 h光照/8 h黑暗、温度22℃、相对湿度60%)生长3周,随后进行低温处理:4℃放置3 h进行冷适应,转移到-10℃放置5 h,然后转移到4℃放置3 h,最后转移到正常生长条件(22℃)恢复生长5 d,观察表型,统计存活率并照相。采用检验方法,对所有数据进行显著性分析。≤0.05即为差异显著,用一颗黑色五星标注,≤0.01即为差异极显著,用两颗黑色五星标注。
1.5 小麦cDNA文库构建和诱饵载体构建
利用RNA提取试剂盒(天根,北京)提取小麦叶片的总RNA,将提取的RNA反转录合成cDNA第一链(TaKaRa,大连),以反转录合成的第一链cDNA为模板进行LD-PCR扩增,反应程序和后续反应按照于太飞等[43]的方法进行,最终得到小麦cDNA文库。
根据的序列以及诱饵载体pGBKT7(Clontech,美国)的限制性酶切位点设计特异引物,通过PCR技术扩增的编码序列。pGBKT7采用Ⅰ单酶切,将PCR产物及酶切产物切胶回收,然后通过In-Fusion技术(TaKaRa,大连)连接后转化入大肠杆菌TOP10感受态细胞中(天根,北京)。测序比对正确后提取质粒得到pGBKT7-重组质粒。
1.6 TaDi19A互作蛋白的筛选
酵母AH109的感受态细胞按照试剂盒说明书(Yeastmaker™ Yeast TransformationSystem 2 User Manual,Clontech)制备。自激活验证的方法参照于太飞等[43]的方法。首先将1 µg的pGBKT7-重组质粒加入50 µL新制备的酵母感受态细胞中,再加入500µL PEG/LiAc,混匀后30℃水浴30 min,每5min颠倒混匀一次;再加入20 µL DMSO,42℃水浴15 min,每5min颠倒混匀一次;8000r/min离心15 s,弃上清,将菌体重悬于1 mL YPD液体培养基中,30℃振荡培养90min;高速离心弃上清,将菌体重悬于0.9%的NaCl中,然后涂到SD/-Trp、SD/-Trp/-His/-Ade固体培养基上,验证pGBKT7-是否存在自激活。
将5 µg的诱饵载体pGBKT7-质粒及5 µg 的小麦cDNA文库质粒加入600 µL制备好的酵母感受态细胞中,再加入2.5 mL PEG/LiAc,混匀后30℃水浴45 min,期间每10 min颠倒混匀一次;再加入160 µL DMSO,混匀后42℃水浴20 min,每10 min颠倒混匀一次;200 r/min离心5 min弃上清,将菌体重悬于1 mL YPD液体培养基中,30℃震荡培养90 min;200 r/min离心5 min弃上清,将菌体重悬于0.9%的NaCl中,然后涂到SD/-Trp/-Leu/-His/-Ade固体培养基上,30℃倒置培养4 d左右;挑取直径大于2 mm的单克隆,重悬于0.9%的NaCl中,然后点涂到SD/-Trp/-Leu/-His/-Ade/X-gal显蓝板上避光培养,筛选蓝色阳性单克隆。
挑取筛选到的阳性菌落于1 mL YPDA液体培养基中,30℃,230 r/min振荡培养,待菌液摇混后进行PCR检测。PCR反应条件参照于太飞等[43]的方法。将插入片段大小在1 000 bp左右的酵母单克隆提取质粒并转化到大肠杆菌TOP10(天根,北京)中,测序,然后将测序结果在 NCBI 网站进行同源性BLAST分析。
2 结果
2.1生物信息学分析
通过对低温处理的小麦转录组测序结果进行分析,获得一个锌指类转录因子。小麦全长747 bp,编码248个氨基酸,分子量为28.03 kD,等电点为4.74,基因含有4个外显子和3个内含子(图1-A);TaDi19A蛋白靠近N-端包含锌指结合结构域,C端为Di19结构域(图1-B),预测的TaDi19A蛋白三级结构包含2个α螺旋结构(图1-C),有助于折叠成正确的蛋白结构,从而行使其生物学功能;磷酸化位点分析结果显示TaDi19A含有12个丝氨酸、9个苏氨酸和3个酪氨酸磷酸化位点,推测磷酸化作用可能与TaDi19A蛋白的活性调控有关。
2.2低温胁迫响应分析
为进一步研究对低温胁迫的响应,通过实时荧光定量PCR分析在低温处理不同时间段的表达模式。结果显示,在低温胁迫下,上调表达,在胁迫处理2 h时达到最大值,为对照的25倍,之后表达量迅速下降,处理后12 h后恢复到初始水平(图2)。
2.3 转拟南芥植株的耐冷性鉴定
为进一步研究对低温胁迫的响应,通过获得的转基因拟南芥(图3)分析其在低温胁迫下的根长和耐冷性。在正常生长条件下,野生型拟南芥与3个转基因株系的主根长、总根长和鲜重均没有显著差异。而在4℃处理后,野生型和转基因拟南芥的生长都受到抑制,野生型拟南芥受抑制的程度要比转基因植株严重,转基因拟南芥的主根长、总根长和鲜重都显著高于野生型拟南芥(图4)。例如,在低温处理20 d后,野生型拟南芥的主根长平均为2.4 cm左右,而转基因拟南芥达到2.9 cm左右。
为进一步检测野生型和转基因拟南芥的耐冷性,将植株种在土盆里于22℃生长4周,随后经4℃/3 h、-10℃/5 h和4℃/3 h低温处理,22℃/5 d恢复正常生长,发现大约60%野生型拟南芥存活,而大约90%的转基因植株存活,转基因植株的存活率明显高于野生型(图5)。无论是低温根长试验还是存活率都表明转基因植株的耐冷性强于野生型拟南芥,表明提高了转基因植株的耐冷性。
2.4 冷胁迫相关基因在转植株中的表达
为研究耐低温胁迫应的机制,检测正常生长情况下转基因和野生型拟南芥植株中冷胁迫响应有关基因的表达。结果显示,正常生长条件下,除了在转基因拟南芥中的表达量比野生型高之外,、和的表达量在野生型和转基因拟南芥中没有显著差异;4℃处理后,、、和在野生型和转基因拟南芥中表达量都有显著提高,但在转基因植株的表达量明显高于野生型,如在转基因拟南芥中的表达量是野生型的2倍多(图6)。结果表明,能正向调控、、和的表达,并通过调控冷胁迫相关基因的表达提高转基因植株的耐冷性。
2.5 诱饵载体的构建及自激活检测
将编码区全长构建到pGBKT7诱饵载体上,用PCR技术进行菌液检测,琼脂糖电泳得到与目的片段大小相符的单一条带约750 bp,经测序和序列比对,提取正确的重组质粒pGBKT7-。
为检测是否存在自激活活性,将pGBKT7-重组质粒转入酵母感受态细胞中,转化产物分别涂布于SD/-Trp、SD/-Trp/-His/-Ade的固体培养基上,30℃倒置培养3 d,结果只有在SD/-Trp培养基长出酵母菌落,而SD/-Trp/-His/-Ade平板上没有菌落长出(图7)。表明pGBKT7-成功转入酵母感受态细胞,且无自激活活性,可以用酵母双杂交系统筛选小麦cDNA文库。
2.6 小麦cDNA文库的筛选以及候选互作蛋白序列分析
为解析的抗性机理,利用酵母双杂交系统筛选其可能的互作候选蛋白。将诱饵载体pGBKT7-质粒与小麦cDNA文库质粒共转化酵母感受态细胞,转化后产物涂布于SD/-Trp/-Leu/-His/-Ade固体培养基上,30℃倒置培养4 d左右,挑取直径大于2 mm的单克隆,点涂于SD/-Trp/-Leu/-His/-Ade/X-gal显蓝板上培养,筛选蓝色阳性单克隆(图8)。
将显蓝的单克隆进行菌液PCR检测,结果表明不同克隆插入的片段大小不同,大部分集中在1 000 bp 左右(图9),大部分克隆扩增结果为1条带,但还有一些克隆扩增结果为2条带。将插入片段大小在1 000 bp左右的单克隆提质粒并转化到大肠杆菌TOP10(天根,北京)中,送达公司测序,然后将测序结果在NCBI网站进行同源性比对分析。通过序列比对分析结果(表1),发现筛选出的互作候选蛋白包括金属硫蛋白、PSBR蛋白、温度诱导的脂质运载蛋白、热激蛋白、低温诱导蛋白、核转运因子等,其中大多能够参与植物对逆境胁迫响应,还有的能介导细胞内代谢物质交换,还有一些编码功能未知蛋白。例如金属硫蛋白能够解除金属离子的毒害、维持细胞内环境的稳定、消除活性氧的危害,对植物抵御非生物胁迫有着重要作用[44];核转运因子能够协助运载物运进或运出细胞;温度诱导的脂质运载蛋白能够传递信号并调节植物抵御逆境[45];低温诱导蛋白和热激蛋白都能参与植物对逆境胁迫的响应等[46-48]。这些蛋白能参与植物的能量代谢以及对非生物胁迫的响应,对植物抵御逆境胁迫有着重要的作用。
3 讨论
干旱、盐碱、高温、低温等非生物胁迫因子严重影响植物的生长和发育。目前已经报道的参与逆境胁迫调控过程的蛋白主要分两类:一类是功能蛋白,主要参与逆境胁迫的直接调控,包括分子伴侣、离子通道蛋白等;另一类是调节蛋白,包括转录因子、蛋白激酶等信号分子[49]。其中转录因子能够与基因启动子区域中顺式作用元件特异性结合,是一大类转录调控因子。本研究从低温处理的小麦转录组测序结果中获得了一个转录因子基因。Di19蛋白编码一个小基因家族,包含保守的C2H2锌指结构域,属于锌指类转录因子,在植物的生长、发育和非生物胁迫响应中起着重要的作用[35-37]。拟南芥中Di19基因广泛的在不同组织中表达,包括幼苗、根、茎、花和果实中;和能够快速被干旱胁迫诱导,和在高盐的诱导下表达量增加,而与光信号的调控有关,对非生物胁迫无响应[50-51]。拟南芥能结合、、启动子的TACA(A/G)T元件,增强其表达,过表达能提高转基因拟南芥的抗旱性[35]。另外拟南芥Di19家族成员能够以Ca2+依赖的方式被CPK11和CPK3磷酸化[50]。qRT-PCR和芯片数据分析表明,水稻7个Di19家族成员能够大量在营养器官中表达,但在生殖器官中表达量很少,一些能显著被非生物胁迫和外源激素诱导[37]。过表达通过增强ROS的清除活性提高转基因水稻的抗旱性,并且转基因水稻对ABA高度敏感,敲除表现出对ABA敏感性降低[37,39]。与互作并磷酸化,ABA处理后的磷酸化作用增强,提高了调控下游ABA相关基因的能力[39]。大豆中共鉴定出了7个Di19基因,每个Di19基因对盐、干旱、氧化、ABA胁迫有着特定的响应。在非生物胁迫中起着负调的作用,过表达提高了转基因拟南芥对盐、干旱、氧化和ABA胁迫的敏感性;GmDi19-5与GmLEA3.1互作,通过调控胁迫相关基因的表达参与ABA和SOS信号通路[38]。
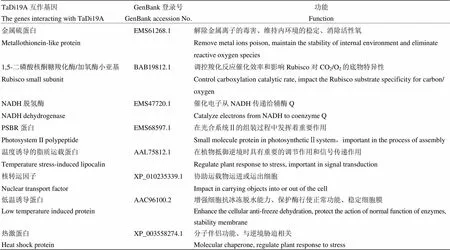
表1 候选基因的BLAST分析结果及其功能推测
小麦在植物对非生物胁迫的响应中起着重要作用,过表达提高了拟南芥在萌发期对盐、ABA和甘露醇的敏感性,过表达降低了拟南芥在苗期对盐胁迫的耐受性和对乙烯的敏感性[40]。FAN等[52]发现能被多种胁迫诱导,过表达提高了转基因拟南芥的耐盐性。这些研究都表明Di19在植物非生物胁迫响应中起着重要的作用。
本研究从低温处理的小麦转录组测序结果中获得了。实时荧光定量PCR结果表明受低温诱导;低温处理的根长试验,转基因和野生型拟南芥的耐冷性鉴定(图4和图5)都表明过表达能提高转基因植株的耐冷性。为研究耐冷胁迫响应机制,通过检测正常和低温处理情况下转基因和野生型拟南芥中冷胁迫响应相关基因的表达,表明能正向调控、、和的表达,说明可能通过调控冷胁迫相关基因的表达提高转基因植株的耐冷性。为进一步研究调控植物冷胁迫响应的作用机制,本研究通过酵母双杂交技术筛选到一些可能与TaDi19A互作的候选蛋白,其中括金属硫蛋白、PSBR蛋白、温度诱导的脂质运载蛋白、热激蛋白、低温诱导蛋白、核转运因子等,其中大多能够参与植物对逆境胁迫响应,比如热激蛋白。热激蛋白广泛分布于真菌、动物和植物细胞中,研究发现,热激蛋白在高温、低温、干旱、过氧化等逆境下均能大量表达,通过作为分子伴侣促进其他蛋白合成、折叠、稳定、运输和降解等来维持植物内环境的稳定,在植物抵御逆境及适应环境中发挥重要作用[53-54]。据报道,HSP90、HSP70家族和一些小的HSPs能在低温响应中积累,通过保护细胞膜、蛋白质的重新折叠等抵御低温胁迫[53]。当植物遭遇低温胁迫时,表达量上升,热激蛋白积累量增多,植物抵御低温能力增强,TaDi9A可能通过与热激蛋白相互作用提高转基因拟南芥的耐冷性。
另外,有研究表明温度诱导的脂质运载蛋白涉及非生物胁迫响应[55-57]。温度诱导的脂质运载蛋白是一种膜蛋白,在低温胁迫下大量积累[57]。拟南芥中缺失突变体对光和冷敏感,与野生型相比,过氧化氢和活性氧的积累增多;而过表达植株对冷和强光胁迫的耐受性增强[58]。小麦和苜蓿都响应低温胁迫,转烟草通过促进活性氧的清除和调控下游耐冷相关基因的表达提高转基因植株的耐冷性[56-57]。本研究通过酵母双杂交技术筛选出的脂质运载蛋白、热激蛋白、低温诱导蛋白等都是和温度胁迫相关的蛋白,它们可能通过与TaDi9A相互作用共同调控植物对低温胁迫的响应,这可能部分解释了转基因拟南芥的耐冷性提高。
4 结论
小麦受低温胁迫诱导表达,过表达提高了转基因拟南芥的耐冷性;TaDi19A可能通过与其他蛋白相互作用参与植物对低温的响应过程。
References
[1] Boyer J S, Plant productivity and environment., 1982, 218(4517): 443-448.
[2] Thomashow M F. Plant cold acclimation: Freezing tolerance genes and regulatory mechanisms.,1999, 50(50): 571-599.
[3] Xiong L, Schumaker K S, Zhu J K. Cell signaling during cold, drought, and salt stress., 2002, 14(Suppl): s165-s183.
[4] Zhu J, Dong C H, Zhu J K. Interplay between cold-responsive gene regulation, metabolism and RNA processing during plant cold acclimation., 2007, 10(3): 290-295.
[5] 冯勋伟, 才宏伟. 结缕草基因的同源克隆及其转基因拟南芥的抗寒性验证. 作物学报, 2014, 40(9): 1572-1578.
Feng X W, Cai H W. Cloning of zoysiagrass CBF gene and validation of cold tolerance in transgenic., 2014, 40(9): 1572-1578. (in Chinese)
[6] 裴丽丽, 郭玉华, 徐兆师, 李连城, 陈明, 马有志. 植物逆境胁迫相关蛋白激酶的研究进展. 西北植物学报, 2012(5): 1052-1061.
Pei L L, Guo Y H, Xu Z S, Li L C, Chen M, Ma Y Z. The research progress of stress related protein kinase in plants., 2012(5): 1052-1061. (in Chinese)
[7] Chen W J, Zhu T. Networks of transcription factors with roles in environmental stress response., 2004, 9(12): 591-596.
[8] Sakamoto H, Maruyama K, Sakuma Y, Meshi T, Iwabuchi M, Shinozaki K,Yamaguchi-Shinozaki K.Cys2/His2-type zinc-finger proteins function as transcription repressors under drought, cold, and high-salinity stress conditions., 2004, 136(1): 2734-2746.
[9] Yamaguchi-Shinozaki K, Shinozaki K. Organization of cis-acting regulatory elements in osmotic- and cold-stress-responsive promoters., 2005, 10(2): 88-94.
[10] Pazares J, Ghosal D, Wienand U, Peterson P A, Saedler H. The regulatory c1 locus ofencodes a protein with homology to myb proto-oncogene products and with structural similarities to transcriptional activators., 1987, 6(12): 3553-3558.
[11] Xu D Q, Huang J, Guo S Q, Yang X, Bao Y M, Tang H J, Zhang H S. Overexpression of a TFIIIA-type zinc finger protein gene ZFP252 enhances drought and salt tolerance in rice (L.)., 2008, 582(7): 1037-1043.
[12] Xu Z S, Chen M, Li L C, Ma Y Z. Functions and application of the AP2/ERF transcription factor family in crop improvement., 2011, 53(7): 570-585.
[13] Luo X, Bai X, Zhu D, Li Y, Ji W, Cai H, Wu J, Liu B, Zhu Y. GsZFP1, a new Cys2/His2-type zinc-finger protein, is a positive regulator of plant tolerance to cold and drought stress., 2012, 235 (6): 1141-1155.
[14] Medina J, Bargues M, Terol J, Pérez-Alonso M, Salinas J. TheCBF gene family is composed of three genes encoding AP2 domain-containing proteins whose expression is regulated by low temperature but not by abscisic acid or dehydration., 1999, 119(2): 463-470.
[15] Nordin K, Vahala T, Palva E T. Differential expression of two related, low-temperature-induced genes in(L.) Heynh., 1993, 21(2): 641-653.
[16] Welin B V, Olson A, Palva E T. Structure and organization of two closely related low-temperature-induced dhn/lea/rab-like genes inL. Heynh., 1995, 29(2): 391-395.
[17] Stockinger E J, Gilmour S J, Thomashow M F.CBF1 encodes an AP2 domain-containing transcriptional activator that binds to the C-repeat/DRE, a cis-acting DNA regulatory element that stimulates transcription in response to low temperature and water deficit., 1997, 94(3): 1035-1040.
[18] Yamaguchi-Shinozaki K, Shinozaki K. A novel cisacting element in angene is involved in responsiveness to drought, low-temperature, or high-salt stress., 1994, 6(2): 251-264.
[19] Gilmour S J, Sebolt A M, Salazar M P, Everard J D, Thomashow M F. Overexpression of theCBF3 transcriptional activator mimics multiple biochemical changes associated with cold acclimation., 2000, 124(4): 1854-1865.
[20] Jaglo-Ottosen K R, Gilmour S J, Zarka D G, Schabenberger O, Thomashow M F.CBF1 overexpression induces COR genes and enhances freezing tolerance., 1998, 280(5360): 104-106.
[21] Liu Q, Kasuga M, Sakuma Y, Abe H, Miura S, Yamaguchi-Shinozaki K, Shinozaki K. Two transcription factors, DREB1 and DREB2, with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought- and low-temperature responsive gene expression, respectively, in., 1998, 10(8): 1391-1406.
[22] Novillo F, Alonso J M, Ecker J R, Salinas J. CBF2/DREB1C is a negative regulator of CBF1/DREB1B and CBF3/DREB1A expression and plays a central role in stress tolerance in., 2004, 101(11): 3985-3990.
[23] Chinnusamy V, Ohta M, Kanrar S, Lee B H, Hong X, Agarwal M, Zhu J K. ICE1: a regulator of cold-induced transcriptome and freezing tolerance in., 2003, 17(8): 1043-1054.
[24] Fursova O V, Pogorelko G V, Tarasov V A. Identification of, a gene involved in cold acclimation which determines freezing tolerance in., 2009, 429(1/2): 98-103.
[25] Dong C H, Pei H. Over-expression of miR397 improves plant tolerance to cold stress in., 2014, 57(4): 209-217.
[26] Matsui A, Ishida J, Morosawa T, Okamoto M, Kim J M, Kurihara Y, Kawashima M, Tanaka M, To T K, Nakaminami K, Kaminuma E, Endo T A, Mochizuki Y, Kawaguchi S, Kobayashi N, Shinozaki K, Toyoda T, Seki M.tiling array analysis to identify the stress-responsive genes., 2010, 639: 141-155.
[27] Xin Z, Mandaokar A, Chen J, Last R L, Browse J.ESK1 encodes a novel regulator of freezing tolerance., 2007, 49(5): 786-799.
[28] Chinnusamy V, Zhu J K, Sunkar R. Gene regulation during cold stress acclimation in plants., 2010, 639: 39-55.
[29] Davletova S, Schlauch K, Coutu J, Mittler R. The zinc-finger protein Zat12 plays a central role in reactive oxygen and abiotic stress signaling in., 2005, 139(2): 847-856.
[30] Kim J C, Lee S H, Cheong Y H, Yoo C M, Lee S I, Chun H J, Yun D J, Hong J C, Lee S Y, Lim C O, Cho M J. A novel cold-inducible zinc finger protein from soybean, SCOF-1, enhances cold tolerance in transgenic plants., 2001, 25(3): 247-259.
[31] Huang J, Sun S J, Xu D Q, Yang X, Bao Y M, Wang Z F, Tang H J, Zhang H. Increased tolerance of rice to cold, drought and oxidative stresses mediated by the overexpression of a gene that encodes the zinc finger protein ZFP245., 2009, 389(3): 556-561.
[32] Liu K, Wang L, Xu Y, Chen N, Ma Q, Li F, Chong K. Overexpression of, a putative cold inducible zinc finger protein, increased tolerance to chilling, salt and drought, and enhanced proline level in rice., 2007, 226(4): 1007-1016.
[33] Mukhopadhyay A, Vij S, Tyagi A K. Overexpression of a zinc-finger protein gene from rice confers tolerance to cold, dehydration, and salt stress in transgenic tobacco., 2004, 101(16): 6309-6314.
[34] 智冠华, 史军娜, 赵晓鑫, 刘胜利, 陈玉珍, 卢存福. 转沙冬青锌指蛋白基因烟草非生物胁迫抗性分析. 园艺学报, 2013, 40(4): 713-723.
Zhi G H, Shi J N, Zhao X X, Liu S L, Chen Y Z, Lu C F. The abiotic stress resistance analysis of Zinc-finger protein genein tobacco., 2013, 40(4): 713-723. (in Chinese)
[35] Liu W X, Zhang F C, Zhang W Z, Song L F, Wu W H, Chen Y F.Di19 functions as a transcription factor and modulates,, andexpression in response to drought stress., 2013, 6(5): 1487-1502.
[36] Milla M A, Townsend J, Chang I F, Cushman J C. Thegene family encodes a novel type of Cys2/His2 zinc-finger protein implicated in ABA-independent dehydration, high-salinity stress and light signaling pathways., 2006, 61(1/2): 13-30.
[37] Wang L, Yu C, Chen C, He C, Zhu Y, Huang W. Identification of rice Di19 family revealsinvolved in drought resistance., 2014, 33(12): 2047-2062.
[38] Feng Z J, Cui X Y, Cui X Y, Chen M, Yang G X, Ma Y Z, He G Y, Xu Z S. The soybeaninteracts with GmLEA3.1 and increases sensitivity of transgenic plants to abiotic stresses., 2015, 6: 179.
[39] Wang L, Yu C, Xu S, Zhu Y, Huang W. OsDi19-4 acts downstream of OsCDPK14 to positively regulate ABA response in rice., 2016, 39 (12): 2740-2753.
[40] Li S, Xu C, Yang Y, Xia G. Functional analysis of, a salt-responsive gene in wheat., 2010, 33(1): 117-129.
[41] Kelley L A, Mezulis S, Yates C M, Wass M N, Sternberg M J. The Phyre2 web portal for protein modeling, prediction and analysis., 2015, 10(6): 845-858.
[42] He G H, Xu J Y, Wang Y X, Liu J M, Li P S, Chen M, Ma Y Z, Xu Z S. Drought-responsive WRKY transcription factor genes1 andfrom wheat confer drought and/or heat resistance in, 2016, 16(1): 116.
[43] 于太飞, 徐兆师, 李盼松, 陈明, 李连城, 张俊华, 马有志. 小麦蛋白激酶TaMAPK2互作蛋白的筛选与验证. 中国农业科学, 2014, 47(13): 2494-2503.
Yu T F, Xu Z S, Li P S, Chen M, Li L C, Zhang J H, Ma Y Z. Screening and identification of proteins interacting with TaMAPK2 in wheat., 2014, 47(13): 2494-2503. (in Chinese)
[44] 张艳, 杨传平. 金属硫蛋白的研究进展. 分子植物育种, 2006(S1): 73-78.
zhang Y, Yang C P. The research progress of metallothionein., 2006(S1): 73-78. (in Chinese)
[45] 丁安琪, 冯莹, 朱里莹, 徐世荣, 秦军, 潘东明. 水仙温度诱导脂质运载蛋白基因的克隆与表达分析. 园艺学报, 2016, 43(1): 161-167.
Ding A Q, Feng Y, Zhu L Y, Xu S R, Qin J, Pan D M. Cloning and expressional analysis of narcissus temperature stress-induced lipocalin gene., 2016, 43(1): 161-167. (in Chinese)
[46] 栗振义, 龙瑞才, 张铁军, 杨青川, 康俊梅. 植物热激蛋白研究进展. 生物技术通报, 2016(2): 7-13.
Li Z Y, Long R C, Zhang T J, Yang Q C, Kang J M. The research progress of plant heat shock proteins., 2016(2): 7-13. (in Chinese)
[47] 齐妍, 徐兆师, 李盼松, 陈明, 李连城, 马有志. 植物热激蛋白70的分子作用机理及其利用研究进展. 植物遗传资源学报, 2013(3): 507-511.
Qi Y, Xu Z S, Li P S, Chen M, Li L C, Ma Y Z. The molecular mechanism and research progress of plant heat shock protein 70., 2013(3): 507-511. (in Chinese)
[48] 杨玉珍, 雷志华, 彭方仁. 低温诱导蛋白及其与植物的耐寒性研究进展. 西北植物学报, 2007(2): 421-428.
Yang Y Z, Lei Z H, Peng F R. The research progress of low temperature induced protein and cold tolerance in plants., 2007(2): 421-428. (in Chinese)
[49] Shinozaki K, Yamaguchi-Shinozaki K. Gene networks involved in drought stress response and tolerance., 2007, 58(2): 221-227.
[50] Kang X, Chong J, Ni M. HYPERSENSITIVE TO RED AND BLUE 1, a ZZ-type zinc finger protein, regulates phytochrome B-mediated red and cryptochrome-mediated blue light responses., 2005, 17(3): 822-835.
[51] Milla M A R, Townsend J, Chang I F, Cushman J C. Thegene family encodes a novel type of Cys2/His2 Zinc-finger protein implicated in ABA-independent dehydration, high-salinity stress and light signaling pathways., 2006, 61(1/2): 13-30.
[52] Fan Y, Zhang S, Meng Y, Huang Z. Increase in salt tolerance ofby., 2015, 35(1): 163-171.
[53] Timperio A M, Egidi M G, Zolla L. Proteomics applied on plant abiotic stresses: role of heat shock proteins (HSP)., 2008, 71(4): 391-411.
[54] Wang W, Vinocur B, Shoseyov O, Altman A. Role of plant heat-shock proteins and molecular chaperones in the abiotic stress response., 2004, 9(5): 244-252.
[55] Abo-Ogiala A, Carsjens C, Diekmann H, Fayyaz P, Herrfurth C, Feussner I, Polle A. Temperature-induced lipocalin (TIL) is translocated under salt stress and protects chloroplasts from ion toxicity., 2014, 171(3/4): 250-259.
[56] Charron J B, Ouellet F, Pelletier M, Danyluk J, Chauve C, Sarhan F. Identification, expression, and evolutionary analyses of plant lipocalins., 2005, 139(4): 2017-2028.
[57] He X, Sambe M A, Zhuo C, Tu Q, Guo Z. A temperature induced lipocalin gene from() confers tolerance to cold and oxidative stress., 2015, 87(6): 645-654.
[58] Charron J B, Ouellet F, Houde M, Sarhan F. The plant apolipoprotein D ortholog protectsagainst oxidative stress., 2008, 8: 86-98.
(责任编辑 李莉)
Response of Wheat Zinc-finger Transcription Factor TaDi19A to Cold and its screening of interacting proteins
RU JingNa1,2, YU TaiFei2, CHEN Jun2, CHEN Ming2, ZHOU YongBin2, MA YouZhi2, XU ZhaoShi2, MIN DongHong1
(1Northwest A & F University/State Key Laboratory of Crop Stress Biology for Arid Areas, Yangling 712100, Shaanxi;2Institute of Crop Science, Chinese Academy of Agricultural Sciences/National Key Facility for Crop Gene Resources and Genetic Improvement/ Key Laboratory of Biology and Genetic Improvement of Triticeae Crop, Ministry of Agriculture, Beijing 100081)
【Objective】Zinc-finger transcription factors play an important role in stress signal transduction and abiotic stress response in plants. In this study, the function ofwas identified under low temperature stress and its interacting proteins were screened by yeast two-hybrid system to explore the regulation mechanism of.【Method】gene was isolated from the cold-treated wheat transcriptome profile. Bioinformatics method was used to analyze the molecular properties of thegene, SMART online tools were used for protein structure analysis; GSDS and PHYRE2 online tools were used to analyze gene structure and tertiary structure ofTaDi19A protein; NetPhos 2.0 Server database was used to predict phosphorylation sites ofTaDi19A protein. The quantitative real-time PCR (qRT-PCR), conducted using the cold-treated wheat cDNA based on SYBR Green technology, was used to analyze the expression pattern ofunder cold temperature stress treatment in different time periods.was fused with PBI121 to transform into wild-type (WT)plants (Columbia-0) mediated by the floral dip method, homozygous T3seeds of transgenic lines and WT were used for cold tolerance analysis which the root length, fresh weight, and survival rate were measured before and after cold treatment. The expressions of four stress-response genes were investigated in transgenic lines and WT under normal and low temperature conditions to analyze the cold-resistant regulation mechanism of. Bait plasmid pGBKT7-was constructed and the self-activation was detected. The pGBKT7-and wheat cDNA library was co-transformed into yeast cell AH109 by two-hybrid system, and the positive clones were screened via SD/-Trp/-Leu/-His/-Ade and SD/-Trp/-Leu/-His/-Ade/X-α-gal plate and these single clones were sequenced and analyzed by BLAST to obtain the interaction candidate proteins.【Result】The full length ofgene was 747 bp with 4 exons, encoding 248 amino acids, and the protein molecular weight and isoelectric point of were 28.03 kDa and 4.74, respectively. TaDi19A protein included Zinc-finger binding domain, Di19 domain and the predicted tertiary structure contained 2 alpha helix. Phosphorylation site analysis showed that there were 12 serine, 9 threonine, and 3 tyrosine phosphorylation sites in TaDi19A protein. qRT-PCR analysis showed thatwas induced by low temperature. The root length and cold tolerance assays revealed thattransgenicincreased the cold tolerance. the expression of several cold-stress-responsive genes was monitored through PCR analysis, the expression of genes,,andshowed elevated levels in both WT and transgenicplants under cold-stress condition, and the expression levels in transgenic plants were significantly higher than those in WT. analysis of candidate proteins screened by yeast two-hybrid system revealed that those proteins mainly affected the signal transduction and abiotic stress response, which demonstrated thatis critical to stress signal transduction and abiotic stress response in plants. 【Conclusion】Cold-inducibleimproved cold tolerance in transgenic;might work via interacting with other proteins.
; zinc-finger transcription factor; cold tolerance; yeast two-hybrid; protein interaction
2017-01-23;接受日期:2017-03-07
国家转基因生物新品种培育科技重大专项(2014ZX08009-016B)、国家自然科学基金(31371620)、西北农林科技大学唐仲英育种基金
茹京娜,E-mail:rujingna1993@163.com。通信作者闵东红,E-mail:mdh2493@126.com。通信作者徐兆师,E-mail:xuzhaoshi@caas.cn

