右美托咪定对缺血性脑卒中行颈动脉内膜剥脱术患者脑氧代谢的影响
司建洛,杨木强,贾新安,马孝武,邢群智,郑 伟
右美托咪定对缺血性脑卒中行颈动脉内膜剥脱术患者脑氧代谢的影响
司建洛,杨木强,贾新安,马孝武,邢群智,郑 伟
目的 观察右美托嘧定对颈动脉内膜剥脱术患者脑氧代谢及血清S100β和神经元特异性烯醇化酶(NSE)含量的影响。方法 选择2015年3月至2017年4月46例美国麻醉医师协会(ASA)Ⅱ~Ⅲ级缺血性脑卒中择期行颈动脉内膜剥脱术患者,随机分为观察组(n=23)和对照组(n=23),观察组诱导前静脉注射右美托咪定1.0μg·kg-1,随后静脉泵入右美托咪定0.3μg·kg-1·h-1至手术结束前40 min,对照组同时注射等容量等速度的生理盐水。分别在颈动脉阻断前10 min(T1)、颈动脉开放后10 min(T2)、颈动脉开放后3 h(T3)和颈动脉开放后24 h(T4)采集颈内静脉球部和动脉血,测定各时点颈内静脉球部血氧分压(PjvO2)和血氧饱和度(SjvO2)、脑动—静脉血氧含量差(Ca-jvDO2)、血清S100β和NSE的含量。结果 观察组PjvO2和SjvO2呈升高趋势,Ca-jvDO2呈降低趋势,与对照组比较差异有统计学意义(均P<0.05)。两组血清 S100β和 NSE的含量在 T2、T3、T4均有升高,但对照组比观察组升高更为显著,差异有统计学意义(均P<0.05)。结论 右美托嘧定能降低颈动脉内膜剥脱术患者脑氧代谢率,降低血清S100β和NSE的含量,具有一定的脑保护作用。
右美托咪定;颈动脉内膜剥脱术;全身麻醉;S100β蛋白;神经元特异性烯醇化酶
Abstract:Objective To evaluate cerebral oxygen metabolism and observe the serum concentration of S100βprotein and neuron specific enolase(NSE)in patients with cerebral ischemic stroke undergoing carotid endarterectomy with dexmedetomidine treatment. Methods Forty-six American Society of Anesthesiologists(ASA)Ⅱ ~Ⅲ patients scheduled for carotid endarterectomy were randomly divided into the observation group(n=23)and control group(n=23)from March 2015 to April 2017.In observation group,a bolus of dexmedetomidine(1.0μg·kg-1)was administered before induction followed by 0.3μg·kg-1·h-1until the end of surgery.In control group,0.9%saline infusion was given in the same volume at the same rate.The internal jugular venous bulbar zone partial pressure of oxygen(PjvO2),oxyhemoglobin saturation(SjvO2),arteriovenous oxygen content difference of brain(Ca-jvDO2),the serum concentration of S100β and NSE were detected at 10 min before carotid clipped(T1),10 min after carotid released(T2),3 h after carotid released(T3),24 h after carotid released(T4). Results The PjvO2and SjvO2increased,however Ca-jvDO2decreased in the observation group at different time,and compared with control group the difference were statistical significance(all P<0.05).The S100βand NSE were raised after carotid clipped,moreover it was increased more significantly in control group than that of observation group (all P <0.05).Conclusion Intraoperative infusion of dexmedetomidine had neuroprotective effects,it could reduce cerebral oxygen metabolism,the serum concentration of S100βand NSE in patients with cerebral ischemicstroke undergoing carotid endarterectomy.
Key words:dexmedetomidine;carotid endarterectomy;general anesthesia;S100βprotein;neuron specific enolase
颈动脉内膜剥脱术(carotid endarterectomy,CEA)是目前治疗缺血性脑卒中最有效的外科手段。由于多种因素(长期缺血、动脉硬化、糖尿病、术中颈动脉临时阻断等)均可造成患者脑功能下降,因而优化术中脑保护策略越来越被临床所重视。右美托咪定是一种新型高度选择性ɑ2肾上腺素受体激动剂,具有镇静、镇痛功能的麻醉辅助药物。动物实验显示在多种脑缺血模型中,其可能具有神经保护作用[1],但应用于 CEA是否能使患者受益尚不确定。本研究通过观察右美托咪定对CEA患者脑氧代谢和血清 S100β和神经元特异性烯醇化酶(neuron specific enolase,NSE)含量的影响,探讨其脑保护作用的有效性和安全性,现报道如下。
1 资料与方法
1.1 一般资料 选择2015年3月至2017年4月我院46例按美国麻醉医师协会分级(american society of anesthesiologists,ASA)Ⅱ ~Ⅲ级缺血性脑卒中择期行CEA患者(均为单侧,经影像学证实缺血性脑卒中有症状颈内动脉狭窄程度>50%,或无症状狭窄程度 >70%),其中男 31例,女 15例;年龄(65.3±7.2)岁,体质量(65.4±6.9)kg,左侧 26例,右侧20例。排除标准:脑卒中后遗症者,合并严重冠心病、高血压病者,窦性心动过缓、房室传导阻滞、低血压者,严重肝、肾功能障碍者,过度肥胖者,急性脑梗死者,术中使用颈动脉转流管者,全身麻醉药物过敏者。按随机数字表分为观察组和对照组各23例。两组间年龄、性别、阻断时间、手术时间、苏醒时间比较,差异无统计学意义(P>0.05),见表 1。本研究经河南科技大学第一附属医院伦理委员会批准,患者均签署知情同意书。
1.2 研究方法 两组均选用全身麻醉,无麻醉前用药。入室后开放静脉通路,监测心电图和脉搏氧饱和度,局麻下桡动脉置管有创监测动脉压,手术对侧颈内静脉逆行置管至颈内静脉球部。观察组诱导前10 min静脉注射右美托咪定(江苏恒瑞医药股份有限公司,批号:14091932)1.0μg·kg-1,随后静脉泵入右美托咪定0.3μg·kg-1·h-1至手术结束前40 min,诱导采用咪达唑仑 0.02 mg·kg-1、舒芬太尼0.2μg·kg-1、丙泊酚 1.5~2.0 mg·kg-1、罗库溴铵0.8 mg·kg-1,插入气管导管后接麻醉机(Datex Ohmeda S/5,美国)控制呼吸,维持呼气末二氧化碳分压在4.0~5.3 kPa。麻醉维持采用丙泊酚、顺式阿曲库铵、瑞芬太尼,间断吸入七氟醚。用脑电双频指数(bispect ral index,BIS,Medtronic Inc,美国)行麻醉深度监测,维持BIS值在40~60;对照组同时刻静脉注射等容量和等速度的生理盐水,其他麻醉诱导和维持用药同观察组。

表1 两组一般资料比较(n=23,x±s)
1.3 监测指标 分别在颈动脉阻断前10 min(T1)、颈动脉开放后 10 min(T2)、颈动脉开放后 3 h(T3)和颈动脉开放后24 h(T4)采集动脉血和颈内静脉球部血各1 mL,行血气分析,监测并计算动脉血氧分压(arterial partial pressure of oxygen,PaO2),颈内静脉球部血氧分压(internal jugular venous bulbar zone partial pressure of oxygen,PjvO2),颈内静脉球部血氧饱 和 度 (internal jugular venous bulbar zone oxyhemoglobin saturation,SjvO2),脑动—静脉血氧含量差(arteriovenous oxygen content difference of brain,Ca-jvDO2);采集颈内静脉球部血3 mL,离心3 000 r·min-1,10 min后取上清液,用酶联免疫吸附测定法按说明书操作测定各时点血清S100β和NSE的含量,试剂盒由上海森雄科技实业有限公司提供,在DNM-9602A型酶标仪监测。
1.4 统计学方法 应用 SPSS 17.0统计软件,计量资料以均数±标准差表示,采用重复测量方差分析,以P<0.05为差异有统计学意义。
2 结果
与T1相比,观察组 PjvO2和 SjvO2均有升高趋势,Ca-jvDO2呈降低趋势,与对照组比较差异有统计学意义(均 P<0.05),见表2。与 T1相比,两组血清S100β和NSE在T2,T3和T4均有增加,但对照组增加更为显著,差异有统计学意义(均P<0.05),见表3。注:①与 T1比较,P<0.05;②与观察组比较,P<0.05。NSE:神经元特异性烯醇化酶。T1:颈动脉阻断前 10 min;T2:颈动脉开放后 10 min;T3:颈动脉开放后 3 h;T4:颈动脉开放后 24 h。
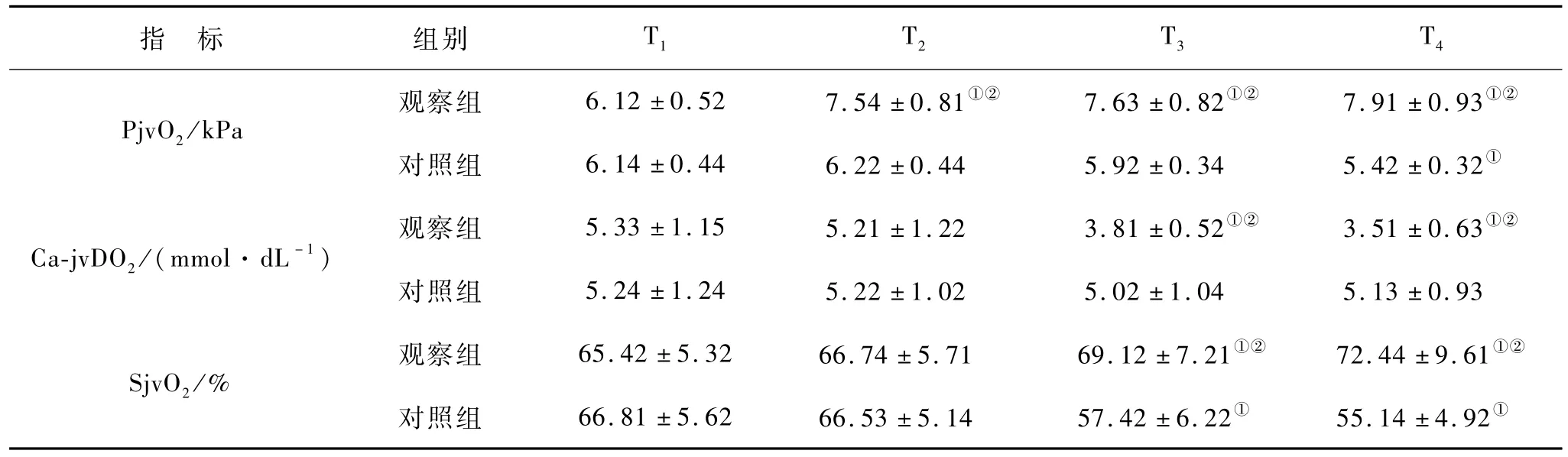
表2 两组不同时点脑氧代谢比较(n=23,x±s)

表3 两组血清S100β和 NSE变化比较(n=23,x±s)
3 讨论
CEA可以采取颈丛神经阻滞或全身麻醉,前者可保持患者清醒,易发现术中脑缺血征像,安全性较高,但患者精神紧张难以配合或抗凝药物的应用常使该方法受到限制;后者舒适易为患者所接受,但对术中麻醉管理,尤其是脑功能的保护要求甚高,也是关乎手术成败的关键环节之一。常用的综合措施包括:①选用具有脑保护功能的药物;②术中阻断颈动脉时主动提高脑灌注压,促进侧枝灌注;③开放颈动脉时主动降低平均动脉压,防止高灌注综合征;④提高手术技巧,缩短阻断时间;⑤经颅多普勒超声动态监测脑血流,一旦发现脑灌注流量明显减少,及时应用颈动脉转流管[2-3]。这些综合措施的应用为减少手术并发症、提高手术安全性起到了重要作用,但目前对具有可靠脑保护作用的药物应用仍存在较多的争议[4-5]。
本研究结果显示,观察组患者颈动脉开放后PjvO2和 SjvO2显著升高,Ca-jvDO2明显下降,提示局部脑血流增加,氧供增加,但脑组织代谢率降低,氧摄取率下降,保持脑氧供需平衡[6]。S100β蛋白存在于神经胶质细胞和朗格汉斯细胞内,NSE存在于神经元和神经内分泌细胞中,均具有高度的脑特异性。当脑组织缺血缺氧损伤后均可透过血脑屏障进入外周血液,其含量与脑损伤程度成正相关,因此可成为评价脑损伤的敏感特异性指标之一[7]。在本研究中,两组患者CEA术中均采用了一系列脑保护措施(阻断时间<45 min、诱导性高血压和控制性降压、过度通气),但颈动脉阻断后,血清S100β和NSE仍有显著升高,且不随脑血流的恢复立即改善,提示脑功能受损与缺血继发性脑损害有关。与对照组相比,观察组的血清 S100β和 NSE升高并不显著,证实了右美托咪定对CEA患者脑代谢率有一定的抑制功能,具有脑保护作用。
右美托咪定脑保护作用可能通过以下机制:①与肾上腺素能ɑ2受体介导的中枢性抗交感通路或核因子κB抗炎通路有关:通过调节肾上腺素释放,一方面抑制交感神经活性,提高迷走神经张力,使胆碱能抗炎通路激活,从而减少炎性因子的释放,抑制炎症反应,减轻脑组织损伤[8-9]。另一方面解除局部微血管的痉挛,改善脑灌注,降低细胞通透性,减轻脑水肿,降低颅内压;②阻断缺血再灌注的脑细胞膜 Na+、K+、Ca2+通道,降低 Na+、Ca2+进入细胞,减轻脂质过氧化反应[10],抑制脑代谢率,阻断 Na+—K+交换,减少ATP的消耗,对缺氧的神经细胞起到保护作用。③增强抗凋亡蛋白Mdm-2的表达,降低神经细胞对兴奋性氨基酸敏感性,对抗谷氨酸受体激动剂诱导的神经细胞死亡[11]。
右美托咪定作用于脑干蓝斑核可以产生类似生理性睡眠的镇静作用[12],而且无呼吸抑制风险。随着持续的泵注可能会出现药物蓄积,从而影响苏醒,需要手术结束前40 min左右停药,因此两组苏醒时间无明显差异。右美托咪定与其他全身麻醉药物之间具有协同作用,因此在使用麻醉药物时应注意加强麻醉深度监测,本研究保持术中 BIS值在40~60之间,可保持患者生命体征平稳。右美托咪定可能引起心动过缓、低血压,因此术前要仔细评估,慎用于窦性心动过缓、房室传导阻滞的患者。本研究局限性在于仅证明右美托咪定可以降低CEA患者脑代谢率,减轻缺血性脑损伤,但不同剂量是否具有不同的效应,不同给药时机是否影响脑保护功能,都需要进一步大样本研究。
综上所述,CEA患者术中静脉注射右美托咪定可以降低术中及术后脑氧代谢率、S100β和 NSE水平,有效减轻缺血、缺氧性脑损伤,不影响麻醉苏醒,是较为理想的脑保护用药。
[1] Rajakumaraswamy N,Ma D,Hossain M,et al.Neuroprotective interaction produced by xenon and dexmedetomidine on in vitro and in vivo neuronal injury models[J].Neurosci Lett,2006,409(2):128-133.
[2] 李攀峰,王兵,崔文军,等.对侧颈动脉狭窄程度对颈动脉内膜剥脱术中转流管应用的影响[J].实用医学杂志,2015,31(10):1639-1641.
[3] 赵婉,韩如泉.颈动脉狭窄手术及介入治疗的围术期管理[J].国际麻醉学与复苏杂志,2015,36(3):247-251.
[4] 彭宇明,周晓莉,吉勇,等.利多卡因对幕上肿瘤切除患者术中脑氧代谢和脑能量代谢的影响[J].临床麻醉学杂志,2014,30(1):5-9.
[5] 刘世乐,邢祖民,李凤仙,等.乌司他丁对幕上肿瘤切除术患者血清S100β蛋白和神经元特异性烯醇化酶的影响[J].临床麻醉学杂志,2016,32(4):325-327.
[6] Page VJ,McAuley DF.Sedation/drugs used in intensive care sedation[J].Curr Opin Anaesthesiol,2015,28(2):139-144.
[7] Zhang YE,Fu SZ,Li XQ,et al.PEP-1-SOD1 protects brain from ischemic insult following asphyxial cardiac arrest in rats[J].Resuscitation,2011,82(8):1081-1086.
[8] Benggon M,Chen H,Applegate R,et al.Effect of dexmedetomidine on brain edema and neurological outcomes in surgical brain injury in rats[J].Anesth Analg,2012,11(5):154-159.
[9] Kose EA,Bakar B,Kasimcan O,et al.Effects of intracisternal and intravenous dexmedetomidine on ischemia-induced brain injury in rat:a comparative study[J].Turk Neurosurg,2013,23(2):208-217.
[10]郭培培,吴会生,严虹,等.右美托咪定对大鼠全脑缺血再灌注时氧化应激反应的影响[J].中华麻醉学杂志,2015,35(3):377-379.
[11]Degos V,Charpentier TL,Chhor V,et al.Neuroprotctive effects of dexmedetomidine against glutamate agonist-induced neuronal cell death are related to increased astrocyte brain-derived neurotrophic factor expression[J].Anesthesiology,2013,118(5):1123-1132.
[12] Su F,Gastonguay MR,Nicolson SC,et al.Dexmedetomidine pharmacology in neonates and infants after open heart surgery[J].Anesth Analg,2016,122(5):1556-1566.
Neuroprotective Effects of Dexmedetomidine on Cerebral Oxygen Metabolism in Carotid Endarterectomy of Patients with Cerebral Ischemic Stroke
SI Jian-luo,YANG Mu-qiang,JIA Xin-an,MA Xiao-wu,XING Qun-zhi,ZHENG Wei
(1.Department of Anaesthesiology,First Affiliated Hospital,and College of Clinical Medicine of Henan University of Science and Technology,Luoyang 471003,China;2.Medical College,Henan University of Science and Technology,Luoyang 471023,China)
R614.2;R743.3
B
1672-688X(2017)03-0189-04
10.15926/j.cnki.issn1672-688x.2017.03.009
2017-05-22
1.河南科技大学临床医学院,河南科技大学第一附属医院,河南洛阳471003
2.河南科技大学医学院,河南洛阳 471023
司建洛(1972—),男,河南洛阳人,副主任医师,从事临床
麻醉工作。

