鸭瘟病毒强弱毒株PCR检测方法的建立
谢丽基,黄 莉,谢芝勋*,王 盛,黄娇玲,张艳芳,范 晴,罗思思,谢志勤,邓显文,钟传德
(1.广西壮族自治区兽医研究所广西兽医生物技术重点实验室,广西南宁 530001; 2.广西玉林市动物疫病预防控制中心,广西玉林 537000)
鸭瘟病毒强弱毒株PCR检测方法的建立
谢丽基1,黄 莉1,谢芝勋1*,王 盛1,黄娇玲1,张艳芳1,范 晴1,罗思思1,谢志勤1,邓显文1,钟传德2
(1.广西壮族自治区兽医研究所广西兽医生物技术重点实验室,广西南宁 530001; 2.广西玉林市动物疫病预防控制中心,广西玉林 537000)
根据基因库中鸭瘟病毒强毒株和弱毒株UL2基因保守区设计特异性引物,优化PCR反应的引物浓度和退火温度等,初步建立了可同时鉴别鸭瘟病毒强毒株和弱毒株的PCR检测方法,并对建立的方法进行了敏感性、特异性验证和临床样品检测。该PCR检测方法最低能检出1 pg的鸭瘟病毒强毒和弱毒DNA模板。对鸭瘟病毒强毒和弱毒模板的检测,得到了与试验设计相符的827 bp(强毒)和299 bp(弱毒)的扩增条带,而对鸭副黏病毒、鸭坦布苏病毒、鸭圆环病毒、番鸭细小病毒、鸭Ⅰ型肝炎病毒、禽流感病毒和小鹅瘟病毒等病原体的检测均为阴性。说明建立了一种敏感性高、特异性好的鉴别鸭瘟病毒强毒和弱毒的PCR检测方法。
鸭瘟病毒;强毒;弱毒; 聚合酶链反应
目前,常用鸭瘟弱毒疫苗预防鸭瘟的发生,但根据实际生产中本地区鸭瘟发生的情况及国内其他学者的报道[4],近年来发生的由鸭瘟强毒引起的鸭瘟,常用的鸭瘟疫苗不能预防该病的发生,鸭瘟强毒和弱毒/疫苗弱毒存在共感染现象。传统的检测鸭瘟病毒方法(病毒分离鉴定、血清中和试验、免疫扩散试验、PCR、LAMP和荧光定量PCR等[5-10])或存在诊断时间长、操作繁锁、敏感性和特异性较差的特点,或不能区分感染的鸭瘟病毒是强毒株还是弱毒株/疫苗株。本研究基于鸭瘟病毒强毒株和弱毒株UL2基因的差异,设计了1对特异性引物,建立了能鉴别鸭瘟病毒强毒株和弱毒株的PCR快速检测方法,为鸭瘟的防控提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 试剂 病毒RNA/DNA快速纯化试剂盒、2×PCR Mix和DNA片段胶回收试剂盒,北京全式金生物技术有限公司产品;pMD18-T试剂盒,宝生物工程(大连)有限公司产品。
1.1.2 毒株 鸭瘟病毒强毒株(Yulin2016-30D株、Yulin2016-60D、DPVGuangxi01和DPVGuangxi02)均由广西壮族自治区兽医研究所生物技术室分离纯化并保存;鸭副黏病毒、鸭坦布苏病毒、鸭圆环病毒、番鸭细小病毒、鸭Ⅰ型肝炎病毒、H9亚型禽流感病毒和小鹅瘟病毒等由广西壮族自治区兽医研究所生物技术室保存;鸭瘟弱毒AV18株购自中国兽医药品监察所;4种鸭瘟病毒弱毒苗分别购自广西丽原生物制品股份有限公司、上海海利生物技术股份有限公司、辽宁益康生物股份有限公司和哈药集团生物疫苗有限公司。
1.2 方法
1.2.1 PCR方法的建立
1.2.1.1 核酸制备 根据病毒RNA/DNA快速纯化试剂盒说明书,提取鸭瘟病毒、鸭副黏病毒、鸭坦布苏病毒、鸭圆环病毒、番鸭细小病毒、鸭Ⅰ型肝炎病毒、H9亚型禽流感病毒和小鹅瘟病毒的RNA/DNA。测定核酸的浓度和纯度[11],置于-20℃保存。
实施依法治理,是自然资源事业改革发展的根本保障。我省坚持把法治理念贯穿自然资源管理全过程,基本构建起立法、普法、执法相衔接,专业执法、公众参与、立体监督相结合的自然资源执法监督体系。
1.2.1.2 引物设计 参照鸭瘟病毒强毒株和弱毒株的UL2基因序列,利用MEGA4生物分析软件找到保守区,设计1对特异性引物(表1)。引物由深圳华大基因科技服务有限公司合成。

表1 试验所使用引物
1.2.1.3 PCR方法建立 反应总体积为50 μL,包括2×PCR Mix 25 μL,上游引物和下游引物适量,模板1 μL,以ddH2O补足50 μL。对PCR各循环参数(退火温度50℃~60℃,反应时间40 s~60 s等)和各引物浓度(0.2 μmol/L~1 μmol/L)等进行优化,以确定最佳的PCR模式。
1.2.2 PCR特异性试验 提取鸭瘟病毒强毒株和弱毒株的核酸样品, 以及其他对照病原体(鸭副黏病毒、鸭坦布苏病毒、鸭圆环病毒、番鸭细小病毒、鸭Ⅰ型肝炎病毒、H9亚型禽流感病毒和小鹅瘟病毒) 的核酸样品,用建立的鉴别鸭瘟病毒强毒和弱毒PCR检测方法进行检测,确定建立的PCR检测方法的特异性。
1.2.3 PCR敏感性试验 测定鸭瘟病毒强毒株和弱毒株的DNA模板浓度后,将其混合作10倍递进稀释。用建立的鉴别鸭瘟病毒强毒和弱毒PCR检测方法进行检测,确定该方法的敏感性。
1.2.4 克隆测序 将50 μL PCR产物进行琼脂糖凝胶电泳,切胶经DNA片段胶回收试剂盒纯化回收。纯化的PCR产物克隆至pMD-18T载体,并转化DH5α大肠埃希菌。挑取白色菌落扩大培养后,用PCR方法进行快速鉴定。将鉴定为阳性的重组克隆菌送深圳华大基因科技服务有限公司进行测序,测序结果进行Blast同源性比对分析。
1.2.5 临床样品检测 利用建立的鉴别鸭瘟病毒强毒株和弱毒株PCR检测方法,对发生鸭瘟强毒感染的鸭群病料(广西玉林某鸭场,2份鸭肝脏,2份鸭脾脏)、注射鸭瘟疫苗的鸭群样品(广西桂林某鸭场,1份鸭肝脏,1份鸭脾脏)及正常鸭的1份肝脏和1份脾脏进行检测,并将PCR产物克隆到pMD18-T载体后进行测序分析,对该方法进行实用性验证。
2 结果
2.1 PCR方法的建立
对退火温度、反应时间和引物浓度等进行优化的结果显示,PCR反应中DPlague 299/827-1和DPlague 299/827-2引物的最佳工作终浓度为0.5 μmol/L, PCR的最佳反应条件为:94 ℃ 3 min; 94 ℃ 45 s,55 ℃ 45 s,72 ℃ 45 s, 35个循环;72 ℃ 10 min。
2.2 PCR特异性试验结果
该方法对4株鸭瘟病毒强毒株(Yulin2016-30D、Yulin2016-60D、DPVGuangxi01和DPVGuangxi02 )均能扩增出与预期大小相符的827 bp条带,5种弱毒株(AV18株和4种鸭瘟病毒弱毒苗)均能扩增出与预期大小相符的299 bp的条带,而对照病原体在相同位置均无特异性扩增条带(图1)。
2.3 PCR敏感性试验结果
该PCR方法,对稀释至1 pg 的鸭瘟病毒DNA模板进行检测仍出现扩增条带(图2),即该PCR方法最低能同时检测到1 pg的鸭瘟病毒强毒和鸭瘟病毒弱毒。
2.4 测序结果分析
对测序结果进行分析,鸭瘟病毒强毒株和弱毒株的PCR扩增产物,大小分别为827 bp和299 bp,与试验设计大小相符。序列经BLAST比对分析,与引物设计模板的对应片段同源性为100%。
2.5 临床样品检测
利用建立的PCR检测方法,对4份发生鸭瘟强毒感染的鸭群病料或2份注射鸭瘟弱毒苗的鸭群样品进行检测,结果均能扩增出特异性PCR条带(图3)。PCR产物序列分析结果表明, 扩增产物为鸭瘟病毒强毒和疫苗弱毒的特异性片段。
3 讨论
目前,我国主要是靠接种弱毒疫苗来预防鸭瘟,所以免疫鸭瘟弱毒苗的养殖场出现鸭瘟病毒诊断阳性时,现有的检测方法很难快速判断,该鸭场呈现的阳性是因感染鸭瘟病毒强毒还是因注射鸭瘟疫苗造成的。因此,迫切需要建立一种能鉴别检测鸭瘟病毒强毒和弱毒的检测方法,为鸭瘟病毒的防控提供技术支撑。

M.DNA标准1 000; 1~4.鸭瘟病毒强毒株(Yulin2016-30D、Yulin2016-60D、DPVGuangxi01和DPVGuangxi02); 5~9. 5种鸭瘟病毒弱毒;10.鸭副黏病毒; 11.鸭坦布苏病毒; 12.鸭圆环病毒; 13.番鸭细小病毒; 14.鸭Ⅰ型肝炎病毒; 15.H9亚型禽流感病毒; 16.小鹅瘟病毒; 17.dH2O; 18.鸭瘟病毒强毒+鸭瘟病毒弱毒
M.DNA Marker 1 000; 1-4.Duck plague virus virulent strain (Yulin2016-30D,Yulin2016-60D,DPVGuangxi01 and DPVGuangxi02); 5-9.Five duck plague virus attenuated strains; 10.Duck paramyxovirus; 11.Duck Tembusu virus; 12.Duck circoviru,13.Muscovy duck parvovirus; 14.Duck hepatitis virus type I; 15.Avian influenza virus; 16.Gosling plague virus; 17.dH2O; 18.Duck plague virus virulent strain+ Duck plague virus attenuated strain
图1 PCR特异性试验
Fig.1 Specificity test of PCR
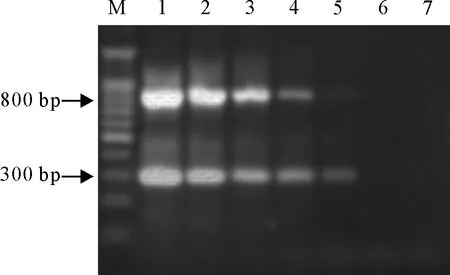
M.DNA Marker 1 000; 1.1ng; 2.100 pg; 3.10 pg; 4.1 pg; 5.100 fg; 6.10 fg; 7.1 fg
图2 PCR敏感性试验
Fig.2 Sensitivity test of PCR

M.DNA标准1 000; 1、2.感染鸭瘟病毒强毒鸭的肝脏和脾脏;3、4.感染鸭瘟病毒强毒鸭的肝脏和脾脏;5、6.接种鸭瘟弱毒苗鸭的肝脏和脾脏;7、8.正常鸭的肝脏和脾脏
M.DNA Marker 1 000; 1,2.Liver and spleen samples of duck infected DPV virulent strain; 3,4.Liver and spleen samples of duck infected DPV virulent strain; 5,6.Liver and spleen samples of duck injected DPV attenuated vaccine strain;7,8.Normal liver and spleen
图3临床样品检测结果
Fig.3 PCR detection results of clinical samples
本研究下载了GenBank中所有鸭瘟病毒序列,通过基因序列比对发现,鸭瘟病毒弱毒(包括弱毒VAC:GenBank Accession Number EU082088,四川弱毒株1:GenBank Accession Number JQ347517,四川弱毒株2:GenBank Accession Number JQ347518,弱毒 K:GenBank Accession Number KF487736,疫苗弱毒C-KCE :GenBank Accession Number KF263690, 疫苗弱毒clone-03 :GenBank Accession Number EF449516等)与鸭瘟病毒强毒株(包括广西株30D:GenBank Accession Number KX925439 ,广西株60D:GenBank Accession Number KX925440 ,德国株2085:GenBank Accession Number JF99965, 四川株Chv:GenBank Accession Number EU885419,CV株:GenBank Accession Number JQ673560,江苏株LH2011:GenBank Accession Number KC480262,四川株LS:GenBank Accession Number JQ248598,四川株N1:GenBank Accession Number JQ043216,四川株N2:GenBank Accession Number JQ248596,四川株N3:GenBank Accession Number JQ248597等 )比较,UL2基因均缺失了528 bp的片段(缺失的片段位于强毒株的198-725位核苷酸),这个发现与之前Wang J等[12]和Yang C等[13]的报道(比较的是少量的强毒株和弱毒株)一致。
基于这个差异,本研究初步建立了能鉴别检测鸭瘟病毒强毒株和弱毒株的PCR检测方法。该方法全程(包括核酸提取、PCR扩增,凝胶电泳)仅需约4 h,最低能同时检出1 pg的鸭瘟病毒强毒株和弱毒株DNA模板。该方法对鸭瘟病毒强毒和弱毒的检测,均得到了与试验设计相符的827 bp(强毒)和299 bp(弱毒)的扩增条带,而对对照病原体的检测全为阴性。研究建立的鉴别鸭瘟病毒强毒和弱毒PCR检测方法,具有快速、敏感和特异的优点,从试验结果可见,该方法可以同时进行鸭瘟病毒强、弱毒株的检测,可用于临床鸭瘟感染的检测,这对于在鸭瘟发病早期提供准确的诊断,切断其传播途径有重要意义。
本研究初步建立了鉴别鸭瘟病毒强、弱毒株PCR检测方法,虽然比较了GenBank中所有的鸭瘟病毒的UL2基因序列,并应用该方法实际检测了4株强毒株(Yulin2016-30D、Yulin2016-60D、DPVGuangxi01和DPVGuangxi02 )和5种弱毒株(AV18株和4种鸭瘟病毒弱毒苗),但临床上的毒株可能千变万化,因此,在今后的工作中有必要继续关注更多的鸭瘟病毒强毒株和弱毒株的UL2基因,并对更多的强毒株和弱毒株进行检测,以进一步证实和确保本方法的实用性。
[1] 甘孟侯.中国禽病学[M].北京:中国农业出版社,1999:109-119.
[2] 王红海,胡薛英,苏敬良,等.商品肉鸭鸭瘟病毒的分离与鉴定[J].中国预防兽医学报,2006,28(1):105-108.
[3] Wozniakowski G,Samoreksalamonowicz E.First survey of the occurrence of duck enteritis virus (DEV) in free-ranging Polish water birds.[J].Arch Virol,2014,159(6):1439-1444.
[4] 刁有祥,吕桂霞,郑福英,等.一种新型鸭瘟病原的分离鉴定及其特性[J].中国兽医学报,2006,26(2):136-139.
[5] 殷 震,刘景华.动物病毒学[M].2版.北京:科学出版社出版,1997.
[6] Plummer P J T,Alefantiis,S Kaplan,et al.Detection of duck enteritis virus by polymerase chain reaction[J].Avian Dis,1998,42:554-564.
[7] 谢芝勋,谢志勤,刘加波,等.用聚合酶链反应检测鸭瘟病毒的研究[J].中国兽药杂志,2000,34(4) :10-12.
[8] 张艳芳,谢芝勋,谢丽基,等.鸭坦布苏病毒与鸭瘟病毒二重RT-PCR检测方法的建立[J].南方农业学报,2014(2):314-317.
[9] 于新友,李天芝,王金良,等.鸭瘟病毒SYBR Green I荧光定量PCR检测方法的建立[J].水禽世界,2014(6):31-34.
[10] 马丽丽,吴 双,胡 成,等.鸭瘟病毒环介导等温扩增检测方法的建立及应用[J].动物医学进展,2015,36(4):27-31.
[11] Sambrook J,Fritsh E T,Maniatis T.Molecular cloning:a laboratory manuel [M].New York:Cold Spring Harbor.Cold Spring Harbor Laboratory Press,1989.
[12] Wang J,Höper D,Beer M,et al.Complete genome sequence of virulent duck enteritis virus (DEV) strain 2085 and comparison with genome sequences of virulent and attenuated DEV strains[J].Virus Res,2011,160(1-2):316-325.
[13] Yang C,Li Q,Li J,et al.Comparative genomic sequence analysis between a standard challenge strain and a vaccine strain of duck enteritis virus in China[J].Virus Genes,2014,48(2):296-303.
Abstract:According to the conserved sequence of duck plague virus (DPV) UL2 gene,the specific primers were designed,the primer concentration and annealing temperature were optimized.A polymerase chain reaction assay was developed to simultaneously detect DPV virulent strains and attenuated strains.The experiments about sensitivity and specificity were conducted.As little as 1pg of DPV virulent strain and attenuated strain DNA could be detected.Samples containing DPV virulent strain and attenuated strain could be amplified into the specific bands,827 bp for DPV virulent strain and 299 bp for DPV attenuated strain.No specific bands of the same sizes were amplified from duck paramyxovirus,duck Tembusu virus,duck circovirus,Muscovy duck parvovirus,duck hepatitis virus type I,avian influenza virus and gosling plague virus.The PCR assay with high sensitivity and good specificity for DPV detection was successfully established.
Keywords:Duck plague virus; virulent strain; attenuated strain; polymerase chain reaction
DevelopmentofaPolymeraseChainReactionAssayforDifferentiationofDuckPlagueVirusVirulentStrainsfromAttenuatedStrains
XIE Li-ji1,HUANG Li1,XIE Zhi-xun1,WANG Sheng1,HUANG Jiao-ling1,ZHANG Yan-fang1, FANG Qing1,LUO Si-si1,XIE Zhi-qin1,DENG Xian-wen1,ZHONG Chuan-de2
(1.GuangxiVeterinaryResearchInstitute,GuangxiKeyLaboratoryofVeterinaryBiotechnology,Nanning,Guangxi,530001,China; 2.YulinCityAnimalDiaeasePreventionandControlCenter,Yulin,Guangxi,537000,China)
S852.659.1;S858.32
A
1007-5038(2017)08-0019-04
2016-11-11
广西科技项目(桂科攻10100014-5);国家”万人计划”领军人才专项 (2016-37);广西特聘专家专项(2011B020)
谢丽基(1981-),女,广西灵山人,硕士,主要从事动物传染病病原分子生物学研究。*

