辣蓼黄酮对脂多糖诱导下RAW264.7细胞活性氧及炎性因子分泌的影响
罗文涓,陶俊宇,杨 剑,曾 芸,韦英益,胡庭俊*
(1.广西大学动物科学技术学院,广西南宁 530005;2.广西医科大学基础医学院,广西南宁 530021)
研究论文
辣蓼黄酮对脂多糖诱导下RAW264.7细胞活性氧及炎性因子分泌的影响
罗文涓1,陶俊宇2△,杨 剑1,曾 芸1,韦英益1,胡庭俊1*
(1.广西大学动物科学技术学院,广西南宁 530005;2.广西医科大学基础医学院,广西南宁 530021)
采用酶解-超声偶联法提取辣蓼全草中的总黄酮,并经过萃取分离结合大孔树脂纯化富集获得辣蓼乙酸乙酯部分黄酮(FEA)与辣蓼正丁醇部分黄酮(FNB),并通过MTT法测定药物安全浓度。采用不同剂量的FEA与FNB作用于脂多糖(LPS)刺激所诱导的RAW264.7细胞炎症体外模型,测定细胞内活性氧(ROS)、一氧化氮(NO)及炎症因子TNF-α、IL-1β、IL-6、IL-8、IL-10水平。结果表明,FEA与FNB能明显减少LPS诱导的ROS释放量;不同浓度的FEA与FNB可以抑制LPS诱导的RAW264.7细胞分泌NO水平的升高。FEA与FNB均能减少LPS刺激所诱导的促炎因子TNF-α、IL-1β、IL-6、IL-8释放,FEA能促进抗炎因子IL-10的生成。说明一定浓度的FEA和FNB具有显著的抗炎效果,且其抗炎作用的产生可能与抗氧化途径有关。
辣蓼黄酮;脂多糖;细胞;炎性因子
辣蓼(PolygonumhydropiperLinn)是蓼科蓼属一年生草本植物[1],其植物资源丰富,主要产于长江以南,包括广东、广西、湖南等省。中国古代许多医书有相关的描述,《别录》:“蓼叶,归舌,除大小肠邪气,利中益志。”《本草拾遗》:“蓼叶,主痃癖,每日取一握煮服之;又霍乱转筋,多取煮汤及热捋脚;叶捣敷狐刺痣;亦主小儿头疮。” 其味辛,温,具有祛风利湿,散瘀止痛,解毒消肿,驱虫止痒等功效。《全国中草药汇编》中记载,辣蓼主要用于痢疾、肠胃炎、腹泻、风湿关节痛、脚气、跌打肿痛、功能性子宫出血,外用于治疗毒蛇咬伤、皮肤湿疹等。辣蓼主要含黄酮类,倍半萜类、蒽醌类、挥发油类、蓼酸等,具有抗微生物、抗氧化、抗病毒、抗肿瘤、杀虫等生物活性[2]。研究表明,黄酮类化合物的生理活性较为广泛,前期试验用酶解-超声偶联法提取辣蓼全草中的总黄酮,并经过萃取分离杂质,结合大孔树脂纯化富集获得辣蓼乙酸乙酯部分黄酮(flavonoids of ethyl acetate fromPolygonumhydropiper,FEA)和辣蓼正丁醇部分黄酮(flavonoids of butanol fromPolygonumhydropiper,FNB),经高效液相色谱法对两者芦丁、槲皮苷、槲皮素含量进行测定,结果表明FEA与FNB中这3种指标成分存在差异。有研究表明,芦丁、槲皮苷、槲皮素都有一定体外抗炎效果,为了进一步研究FEA与FNB的抗炎效果,本试验选用不同剂量的FEA与FNB作用于脂多糖( lipopolysaccharide,LPS)刺激所诱导的RAW264.7细胞炎症体外模型,了解其对炎症反应下活性氧(ROS)、一氧化氮(NO)及炎症因子TNF-α、IL-1β、IL-6、IL-8、IL-10的调节作用。
1 材料与方法
1.1 材料
1.1.1 主要仪器 EnSpire多功能荧光酶标仪,PerkinElmer公司产品;制冰机,SANYO公司产品;微量离心机(TYPE1-14),SIGMA公司产品;超声波清洗机(DTDN),宁波新芝生物科技有限公司产品;TS100倒置显微镜,Nikon公司产品。
1.1.2 试剂和细胞 脂多糖(LPS),Sigma公司产品;相关炎症因子用ELISA试剂盒测定,新博盛公司产品;ROS活性氧探针,北京普利莱公司产品;MTT,北京普利莱公司产品;RAW264.7细胞,购自XX微生物保存中心。
1.1.3 FEA和FNB 辣蓼生药购自南宁市山草堂,经酶解-超声偶联法提取后滤液经过石油醚、氯仿、乙酸乙酯及正丁醇萃取。收集乙酸乙酯部分与正丁醇部分,经XDA-8大孔吸附树脂分离纯化,得辣蓼乙酸乙酯部分黄酮(FEA)与辣蓼正丁醇部分黄酮(FNB)。FEA为淡黄色粉末,FNB为棕黄色粉末。
1.2 方法
1.2.1 FEA与FNB安全浓度的测定 通过MTT法筛选出体外抗炎试验安全剂量。取对数生长期状态良好的RAW264.7细胞(2×105个/mL)铺在96孔细胞板上,每孔100 μL,40 mL/L FBS的DMEM维持培养液培养过夜。用一定量DMSO和维持培养液稀释FEA和FNB(DMSO终浓度小于5 mL/L),配成系列浓度的药液(400、300、200、150、120、80、60 、40 、20 μg/mL),空白对照组加入100 μL维持培养液;药物组分别加入由维持培养液稀释的不同浓度的FEA或FNB 100 μL。培养20 h后每孔加入10 μL 的5 mg/mL MTT,继续培养4 h。培养结束后,吸弃上清,加入100 μL DMSO,轻轻振荡,避光反应10 min后在酶标仪上测定OD 490 nm的吸光值并记录结果。
1.2.2 ROS的测定 对数生长期状态良好的RAW264.7细胞(2×105个/mL)铺在96孔细胞板上,每孔100 μL,40 mL/L FBS的DMEM维持培养液培养过夜。弃去上清,空白组加入维持培养基,模型组加入含LPS终浓度为1 μg/mL的维持培养基,药物处理组先加入含80、40、20 μg/mL的FNB或FEA的维持培养基与细胞孵育1 h之后弃去上清,再加入含LPS终浓度为1 μg/mL的维持培养基。LPS刺激12、24、48 h后分别弃上清,每孔加入200 μL 10 μmol/L DCFH-DA荧光探针,37℃,体积分数为5% CO2孵育30 min,每10 min轻轻摇匀1次。孵育完毕后弃上清,PBS洗3次,于激光共聚焦显微镜以激发波长488 nm和发射波长525 nm观察绿色荧光,用荧光酶标仪读取各组吸光值。
1.2.3 NO的测定 LPS刺激12、24、48 h后取细胞上清液100 μL,加入等量的Griess试剂,振荡混匀,室温避光反应10 min,酶联免疫检测仪检测OD 550 nm值,根据NaNO2标准曲线计算RAW264.7细胞在LPS刺激12、24、48 h后NO的含量。
1.2.4 炎症因子的测定 参照“1.2.2”中的方法,LPS刺激24 h后取上清液,采用ELISA试剂盒测定,按说明书要求操作,在酶标仪上检测各孔OD 450 nm值。
2 结果
2.1 不同浓度的FEA与FNB对RAW264.7活性的影响
由图1可知,与空白组相比,FEA在400 μg/mL~ 40 μg/mL浓度范围对RAW264.7细胞的活性无显著影响,20 μg/mL的FEA能显著增加RAW264.7细胞的活性;与空白组相比,FNB在浓度为400 μg/mL时极显著的抑制了RAW264.7细胞的活性,300 μg/mL~60 μg/mL浓度范围对RAW264.7细胞的活性无显著影响,40 μg/mL的FNB能显著增加RAW264.7细胞的活性,20 μg/mL的FNB能极显著增加RAW264.7细胞的活性。
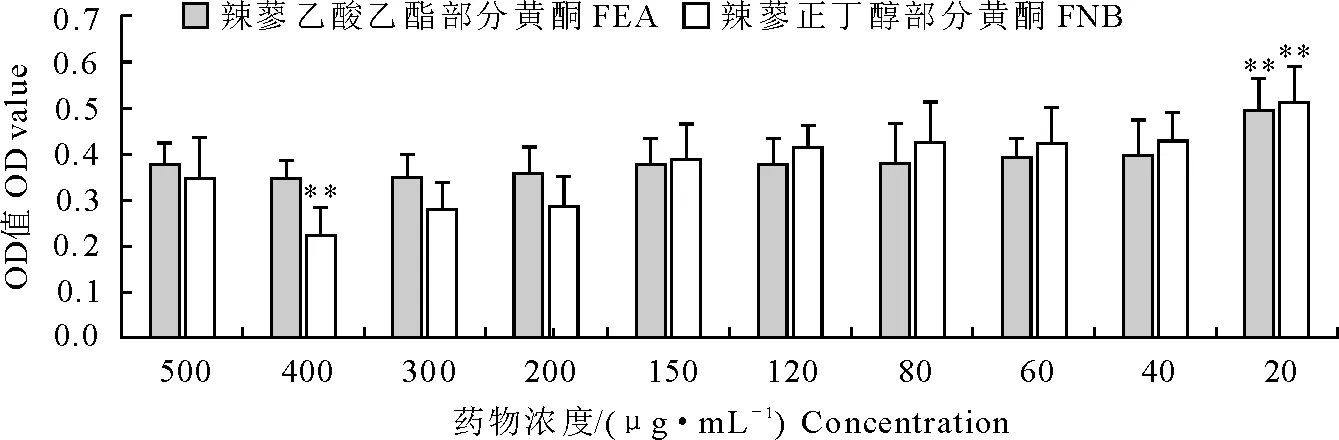
“**”表示与空白对照组相比差异极显著(P<0.01) “**” indicates extremely significant difference compared with negative control group (P<0.01)
2.2 不同浓度的FEA与FNB对LPS刺激RAW264.7细胞所产生的ROS的调节作用
由图2和图3可知,与空白组相比,在终浓度为1 μg/mL的LPS刺激12、24、48 h之后RAW264.7细胞的ROS含量极显著升高。与LPS模型组相比,用80、40、20 μg/mL的FEA或FNB作用于RAW264.7细胞1 h,再用终浓度为1 μg/mL的LPS刺激,12、24、48 h后药物组的ROS含量均极显著的低于模型组。

“**”表示与空白对照组相比差异极显著(P<0.01);“##”表示与LPS组相比差异极显著(P<0.01)
“**” indicates extremely significant difference compared with negative control group (P<0.01);“##” indicates extremely significant difference compared with LPS group (P<0.01)
图2不同浓度的FEA对LPS刺激RAW264.7细胞所产生的ROS的调节作用
Fig.2 Effect of FEA on LPS-induced ROS production in RAW 264.7 macrophages
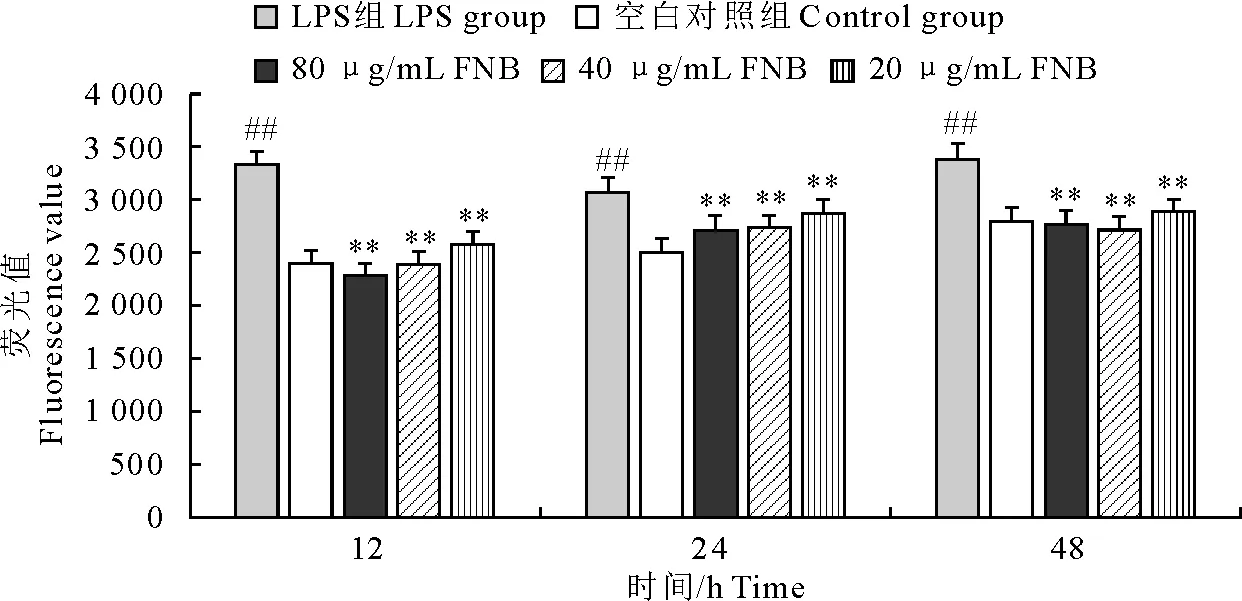
“**”表示与空白对照组相比差异极显著(P<0.01);“##”表示与LPS组相比差异极显著(P<0.01)
“**” indicates extremely significant difference compared with negative control group (P<0.01);“##” indicates extremely significant difference compared with LPS group (P<0.01)
图3不同浓度的FNB对LPS刺激RAW264.7细胞所产生的ROS的调节作用
Fig.3 Effect of FNB on LPS-induced ROS production in RAW 264.7 macrophages
2.3 不同浓度的FEA与FNB对LPS刺激RAW264.7细胞所产生的NO的调节作用
由图4和图5可知,与空白组相比,在终浓度为1 μg/mL的LPS刺激12、24、48 h之后RAW264.7细胞的NO释放量极显著升高。与LPS模型组相比,用80、40、20 μg/mL的FEA作用于RAW264.7细胞1 h,再用终浓度为1 μg/mL的LPS刺激,12、24、48 h后药物组的NO量均极显著的低于模型组。用80、40、20 μg/mL的FNB作用于RAW264.7细胞1 h,再用终浓度为1 μg/mL的LPS刺激,12 h后药物处理组与模型组相比无显著差异,24 h后药物组的NO量均极显著的低于模型组,48 h后,80 μg/mL和40 μg/mL浓度组的NO量均极显著的低于模型组。
2.4 不同浓度的FEA与FNB对LPS刺激RAW264.7细胞所产生的炎症因子的调节作用
由图6可知,与空白组相比,在终浓度为1 μg/mL的LPS刺激下RAW264.7细胞的TNF-α分泌量显著升高。用80 μg/mL和40 μg/mL FNB作用于RAW264.7细胞1 h,能极显著降低LPS诱导的TNF-α分泌量升高;用80、40、20 μg/mL FEA作用于RAW264.7细胞1 h,均能极显著降低LPS诱导的TNF-α分泌量升高。由图7可知,与空白组相比,在终浓度为1 μg/mL的LPS刺激下RAW264.7细胞的IL-10升高,用80、40、20 μg/mL的FNB处理RAW264.7细胞1 h后再用LPS刺激,药物组的IL-10含量与LPS组相比差异不显著;用80、40、20 μg/mL的FEA处理RAW264.7细胞1 h后,处理组IL-10含量极显著高于LPS组。与空白组相比,在终浓度为1 μg/mL的LPS刺激下RAW264.7细胞的IL-8显著升高;用80 μg/mL FNB处理RAW264.7细胞1 h后能极显著的降低IL-8的含量;用80、40、20 μg/mL的FEA处理RAW264.7细胞1 h后,处理组IL-8含量极显著低于LPS组。与空白组相比,在终浓度为1 μg/mL的LPS刺激下RAW264.7细胞的IL-6显著升高;用80、40、20 μg/mL的FNB或FEA处理RAW264.7细胞1 h后,处理组IL-6含量极显著低于LPS组。与空白组相比,在终浓度为1 μg/mL的LPS刺激下RAW264.7细胞的IL-1β显著升高;用80 μg/mL、40 μg/mL的FNB处理RAW264.7细胞1 h后,处理组IL-1β含量极显著低于LPS组;80、40、20 μg/mL的FEA处理RAW264.7细胞1 h后,处理组IL-1β含量极显著低于LPS组。

“**”表示与空白对照组相比差异极显著(P<0.01);“##”表示与LPS组相比差异极显著(P<0.01)
“**” indicates extremely significant difference compared with negative control group (P<0.01);“##” indicates extremely significant difference compared with LPS group (P<0.01)
图4不同浓度的FEA对LPS刺激RAW264.7细胞所产生的NO的调节作用
Fig.4 Effect of FEA on LPS-induced NO production in RAW 264.7 macrophages

“**”表示与空白对照组相比差异极显著(P<0.01);“##”表示与LPS组相比差异极显著(P<0.01)
“**” indicates extremely significant difference compared with negative control group (P<0.01);“##” indicates extremely significant difference compared with LPS group (P<0.01)
图5不同浓度的FNB对LPS刺激RAW264.7细胞所产生的NO的调节作用
Fig.5 Effect of FNB on LPS-induced NO production in RAW 264.7 macrophages
3 讨论
黄酮对炎症因子具有一定调节作用。本试验研究了FEA与FNB对LPS诱导的RAW264.7细胞产生炎症因子水平的调节作用,结果显示在FEA与FNB预处理1h后均能减少LPS刺激所诱导的促炎因子TNF-α、IL-1β、IL-6、IL-8释放,降低此类因子的释放而有助于降低炎症损伤,此外FEA预处理1 h后能促进抗炎因子IL-10的生成,表明一定浓度的FEA和FNB具有显著的抗炎效果。本试验结果与Jin J H等[3]有关苦参黄酮的抗炎研究结果相似。黄酮类物质具有ROS清除作用。有学者研究了异戊烯黄酮artelastind对LPS诱导下J774巨噬细胞ROS的调节作用,结果表明artelastind对氧自由基与活性氧ROS均有高效的清除作用[4]。芫花黄酮对LPS诱导的NO释放的调节作用研究发现,芫花黄酮能显著抑制LPS诱导下RAW264.7细胞的NO释放[5],类似作用在干漆黄酮上也有报道[6]。
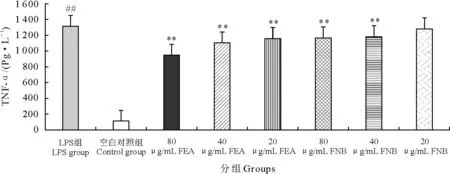
“**”表示与空白对照组相比差异极显著(P<0.01);“##”表示与LPS组相比差异极显著(P<0.01)
“**” indicates extremely significant difference compared with negative control group (P<0.01);“##” indicates extremely significant difference compared with LPS group (P<0.01)
图6不同浓度的FEA与FNB对LPS刺激RAW264.7细胞产生的TNF-α调节作用
Fig.6 Effect of FEA and FNB on LPS-induced TNF-αproduction in RAW 264.7 macrophages
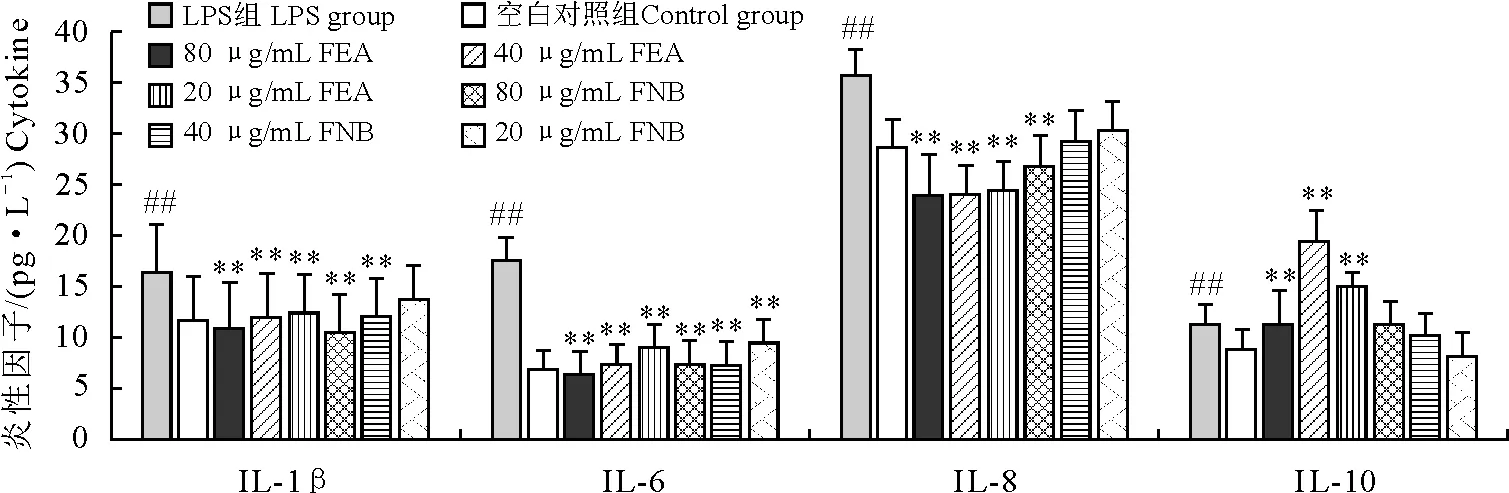
“**”表示与空白对照组相比差异极显著(P<0.01);“##”表示与LPS组相比差异极显著(P<0.01)
“**” indicates extremely significant difference compared with negative control group (P<0.01);“##” indicates extremely significant difference compared with LPS group (P<0.01)
图7不同浓度的FEA与FNB对LPS诱导的RAW264.7细胞炎症因子的调节作用
Fig.7 Effect of FEA and FNB on LPS-induced cytokine production in RAW 264.7 macrophages
为进一步探讨FEA和FNB抗炎作用与抗氧化途径之间的相关性,我们考察了FEA与FNB对LPS诱导的RAW264.7细胞的ROS、NO的调节作用,结果表明在RAW264.7受到LPS刺激,ROS的释放急剧增多,但经FEA与FNB预处理1 h能明显减少LPS诱导的ROS释放量;不同浓度的FEA与FNB可以抑制LPS诱导的RAW264.7细胞分泌NO水平的升高。曹志方[7]研究发现牛大力抗炎机理为其通过总黄酮增强机体抗氧化能力,抑制有害ROS的大量释放发挥抗炎协同作用。结合本研究的FEA与FNB的抗炎作用结果发现,笔者认为FEA与FNB的抗炎作用可能通过抗氧化途径发挥体外抗炎作用,具体表现为一定浓度的FEA与FNB通过显著抑制LPS刺激所诱导的ROS及NO水平的升高,对LPS刺激所诱导的促炎因子TNF-α、IL-1β、IL-6、IL-8释放水平产生抑制作用,促进抗炎因子IL-10的生成,从而发挥抗炎作用。而FEA与FNB的抗炎作用机制与抗氧化途径之间的分子机制需从蛋白、基因表达、信号通路水平进一步深入探讨。
当然,许多学者研究证明黄酮对炎症因子的调节作用也与其他多种信号通路有关。高良姜素对LPS诱导下的THP-1巨噬细胞中TNF-α、IL-1β、IL-6的释放有抑制作用,进一步研究表明该抑制作用是因为高良姜素抑制了TNF-α、IL-1β、IL-6的蛋白表达,抑制了LPS诱导的NF-kB激活[8]。杨晓露等[9]研究发现甘草乙酸乙酯部位部分通过丝裂原活化蛋白激酶(MAPKs)中的细胞外信号调节激酶信号通路抑制iNOS和COX-2基因和蛋白的表达而达到抗炎效果。笔者认为,探讨抗炎、抗氧化及相关信号通路三者间的相关性及分子机制研究将有助于抗炎药物的开发与应用。
黄酮类化合物具有生物抗氧化性、清除自由基作用、免疫、抗炎、抗菌等功能。本研究结果表明FNB与FEA可通过对ROS、NO水平产生抑制作用,抑制LPS刺激所诱导RAW264.7细胞分泌IL-10、IL-6、IL-8、IL-1β、TNF-α水平从而发挥抗炎作用,且抗炎作用的产生可能与抗氧化途径有关。
[1] 王国强.全国中草药汇编[M].北京:人民卫生出版社,2014.
[2] 黄红泓,甄汉深.中草药辣蓼近年来的研究进展[J].中国民族民间医药,2013,22(1):38-40.
[3] Jin J H,Ju S K,Kang S S,et al.Anti-inflammatory and anti-arthritic activity of total flavonoids of the roots ofSophoraflavescens[J].J Ethnopharmacol,2010,127(3):589-595.
[4] Cerqueira F,Cidade H,Ufford L V,et al.The natural prenylated flavone artelastin is an inhibitor of ROS and NO production[J].Int Immunopharmacol,2008,8(4):597-602.
[5] Jiang C P,He X,Yang X L,et al.Anti-rheumatoid arthritic activity of flavonoids from Daphne genkwa[J].Phytomed Int J Phytother Phytopharmacol,2014,21(6):830-837.
[6] Chang H J,Ji H K,Hong M H,et al.Phenolic-rich fraction fromRhusvernicifluaStokes (RVS) suppress inflammatory response via NF-κB and JNK pathway in lipopolysaccharide-induced RAW 264.7 macrophages[J].J Ethnopharmacol,2007,110:490-497.
[7] 曹志方.牛大力多糖和总黄酮抗炎作用及机制的研究[D].海南海口:海南大学,2016.
[8] Hu K,Yang Y,Tu Q,et al.Alpinetin inhibits LPS-induced inflammatory mediator response by activating PPAR-γ in THP-1-derived macrophages[J].Eur J Pharmacol,2013,721:96-102.
[9] 杨晓露,刘 朵,卞 卡,等.甘草总黄酮及其成分体外抗炎活性及机制研究[J].中国中药杂志,2013,38(1):99-104.
Abstract:Total flavonoids in the whole plant ofPolygonumhydropiperumLinn.were extracted by enzymolysis-ultrasonic coupling method.The FEA and FNB parts of the flavonoids were obtained by extracting and separating,followed with macroporous resin purification and enrichment.The safe ranges of concentration of the two flavonoids to RAW264.7 cells were determined.The different doses of FEA or FNB were used to treat RAW264.7 cellsinvitroinduced by lipopolysaccharide (LPS).The values of intracellular reactive oxygen species (ROS),nitric oxide (NO) and the levels of TNF-α,IL-1β,IL-6,IL-8 and IL-10 were determined by ELISA method.The result showed that FEA and FNB could significantly reduce the amount of ROS induced by LPS.Different concentrations of FEA and FNB could inhibit the increase of NO secretion induced by LPS in RAW264.7 cells.Both FEA and FNB could reduce the release of proinflammatory factor TNF- alpha,IL-1 beta,IL-6 and IL-8 induced by LPS,and FEA could promote the production of anti-inflammatory factor IL-10.The results showed that the certain concentrations of FEA and FNB had significant anti-inflammatory effect,and the anti-inflammatory effect was related to the antioxidant pathway.
Keywords:Polygonumflavonoids; lipopolysaccharide; cells; inflammatory factors
EffectsofFlavonoidsfromPolygonumhydropiperonLevelsofReactiveOxygenSpeciesandInflammatoryFactorsinRAW264.7CellsInducedbyLipopolysaccharide
LUO Wen-juan1,TAO Jun-yu2,YANG Jian1,ZENG Yun1,WEI Ying-yi1,HU Ting-jun1
(1.CollegeofAnimalScienceandTechnology,GuangxiUniversity,Nanning,Guangxi,530005,China; 2.SchoolofPreclinicalMedicine,GuangxiMedicalUniversity,Nanning,Guangxi,530021,China)
S853.76
A
1007-5038(2017)08-0001-06
2016-12-05
国家自然科学基金项目(31560708); 2016年广西研究生创新创业教育暨联合培养基地示范建设项目-兽医学研究生联合培养基地项目(20160976)
罗文涓(1992-),女,四川泸州人,硕士研究生,主要从事兽医药理与毒理学研究。
△共同第一作者*

