陕西林麝肺源致病性大肠埃希菌分离鉴定及药敏试验
张慧慧,仇薪鑫,王兴龙,杨增岐
(西北农林科技大学动物医学院,陕西杨凌 712100)
陕西林麝肺源致病性大肠埃希菌分离鉴定及药敏试验
张慧慧,仇薪鑫,王兴龙*,杨增岐*
(西北农林科技大学动物医学院,陕西杨凌 712100)
为分析致林麝肺炎的病原菌,从发病死亡的林麝肺脏进行细菌分离,对分离所得细菌进行微生物学和生化特性鉴定及动物试验。细菌分离结果显示,病死林麝肺脏主要为2种不同菌落形态的细菌,经挑纯后,测定其16 S rRNA 序列,发现2株细菌均为大肠埃希菌,菌株1与EscherichiacoliO104:H4序列同源性均为100%,菌株2与EscherichiacoliO78序列同源性为100%。用2株菌进行动物试验,发现2株大肠埃希菌对小鼠的致死率均为75%;药敏试验结果表明,头孢类(头孢唑啉、头孢曲松)和单环β内酰胺类(氨曲南)对2株林麝肺部致病性大肠埃希菌均敏感;氨基糖苷类(链霉素)对其均中度敏感;对其他类别抗生素均呈现不同程度的耐药性。
肺炎;大肠埃希菌;16 S rRNA;药敏试验;林麝
林麝为国家一级保护动物,其麝香为传统的名贵中药材和高级动物香料,具有重要的社会价值和经济价值[1]。人工养殖情况下,疾病是导致林麝死亡的重要原因,圈养林麝常见疾病包括消化道疾病、呼吸道疾病及寄生虫造成的林麝疾病。其中,消化道疾病及寄生虫疾病为驯养林麝的高发疾病,但是致死率不高。而呼吸系统,尤其是肺部疾病则是人工养殖林麝的高致死疾病[2-3]。其中报道较多的是致病性大肠埃希菌(Extraintestinal pathogenicEscherichiacoli,ExPEC)引起的肺炎。
肠外致病性大肠埃希菌能引起人类和动物肠外组织感染,可致使不同宿主发生呼吸道感染、泌尿道感染、脑膜炎和败血症等,而且有研究表明其耐药性明显高于其他菌群[4-6]。目前已在人、牛、鸡、狗、猫等体内分离到ExPEC,由于林麝研究受到条件限制,国内关于ExPEC引起林麝疾病的报道很少,本研究在患病死亡林麝肺内成功分离到,2株ExPEC,并对其进行了药敏试验,为林麝临床防控和用药提供依据。
1 材料与方法
1.1 材料
1.1.1 病料 采集自陕西省宝鸡市凤县林麝养殖基地,病料样品为发病林麝的肺脏。
1.1.2 实验动物 昆明小鼠12只,体重20 g~22 g,购自第四军医大学实验动物中心。
1.1.3 细菌培养基和分子检测试剂 普通营养琼脂培养基、LB培养基、绵羊血琼脂培养基、麦康凯琼脂培养基、三糖铁琼脂、糖发酵管(包括乳糖、蔗糖、麦芽糖、葡萄糖)、蛋白胨水培养基(吲哚试验)、葡萄糖蛋白胨水培养基(甲基红MR和VP试验)和枸橼酸盐利用培养基,购自杨凌宝鑫生物技术有限公司;DNA Marker DL 2 000、2×TaqMasterMix,南京诺唯赞生物科技有限公司产品。
1.1.4 药敏纸片 药敏纸片:青霉素类(氨苄西林)、头孢类(头孢唑啉、头孢曲松)、单环β-内酰胺类(氨曲南)、喹诺酮类(氧氟沙星)、氨基糖苷类(链霉素、阿米卡星)、大环内酯类(红霉素)、林可酰胺类(克林霉素)、叶酸代谢途径抑制剂(复方新诺明)、酰胺醇类/氯霉素类(氯霉素)、四环素类(四环素),所用药敏纸片均购自杭州滨河微生物试剂有限公司。
1.1.5 引物设计与合成 16 S rRNA扩增通用引物:27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-TACGGTTACCTTGTTACGACTT-3′)。
1.2 方法
1.2.1 采集病料 剖检死亡林麝,并无菌采集肺脏病料,观察其病理变化。
1.2.2 病原菌的分离与鉴定
1.2.2.1 细菌的分离培养 将采集的林麝肺脏样品立即无菌接种于鲜血琼脂培养基, 37 ℃恒温培养箱内培养24 h后,观察菌落种类及相对数量,记录菌落特征。挑取单个菌落进行革兰染色并镜检,观察疑似病原菌菌体的形态,并划线接种于普通琼脂、麦康凯琼脂和鲜血琼脂, 37 ℃恒温培养箱内培养24 h后,观察并记录菌落特征,同时挑取单菌落进行革兰染色镜检,观察其菌体形态。
将分离培养得到的典型菌落,挑取单菌落划线接种于三糖铁琼脂斜面,进行纯化培养,取单菌落接于于LB液体培养基,37 ℃、200 r/min摇床进行过夜培养增菌,保菌备用。
1.2.2.2 生化试验 将菌液接种于普通培养基和麦康凯培养基,37 ℃恒温培养箱内培养24 h后,挑取单菌落分别进行糖发酵试验(葡萄糖、蔗糖、芽糖、乳糖)、MR试验、VP试验、靛基质试验、柠檬酸盐利用试验,每个试验分别重复3次。根据《伯杰氏细菌鉴定手册》判定试验结果[7]。
1.2.2.3 16 S rRNA PCR鉴定 取1 mL菌液,沸水加热10 min,冷却15 min,12 000r/min离心2min,取上清液作为PCR反应的DNA模板。依据罗燕等报道的用16 S rRNA PCR的通用引物27F和1492R进行PCR扩增[8]。PCR产物送西安擎科泽西生物科技有限责任公司进行测序。
1.2.3 动物试验 将试验小鼠分为3组,对照组(C组)、试验组(G1)和试验组(G2)。试验前禁食、禁水24 h。G1组小鼠腹腔注射菌株1菌液1 mL/只(约含细菌2×109CFU)。G2组小鼠同方法同剂量注射菌株2菌液。C组小鼠同方法注射生理盐水1 mL/只。
攻菌后,各组分笼饲养,每天观察记录各组小鼠的食欲、精神状况等临床表现,连续观察1周,并记录各组小鼠的发病和死亡情况。对死亡小鼠剖检,观察记录病理变化,采集肺脏涂片,革兰染色镜检。
1.2.4 药敏试验 将分离鉴定出的致病菌株进行药敏试验。采用KB法,将含药敏纸片的琼脂培养基在37℃恒温培养箱中培养18 h[9]。根据CLSI的标准判读试验结果。
2 结果
2.1 林麝发病临床表现及剖检病理变化
发病林麝死亡前无明显临床发病症状,突然倒地,伸颈,呼吸困难,口鼻流出少量液体;剖检可见胸腔积液、心包积液,心包壁浑浊;主要病理变化见于肺脏,可见肺脏的充血、出血,及大面积的肺脏淤血(图1)。

图1 死亡林麝及肺脏病理变化
2.2 细菌分离
从林麝肺脏中分离得到2株细菌,分别为菌株1和菌株2。菌株1为表面光滑,半透明,直径3 mm左右的灰白色菌落,镜检呈革兰阴性短杆菌,两端钝圆,成对或散在;菌株2为表面光滑,边缘整齐,半透明,直径1 mm左右的灰白色菌落,镜检呈革兰阴性杆菌,聚集成堆。
2.3 病原菌的鉴定
2.3.1 形态学观察结果 挑取生长于三糖铁琼脂斜面的分离菌的纯培养物,经革兰染色镜检,菌株1为革兰阴性短杆菌,两端钝圆,散在或成对,0.5 μm×2 μm;菌株2为革兰阴性短杆菌,两端钝圆,聚集成堆,0.5 μm×1 μm。
2.3.2 生化试验结果 经糖发酵试验(葡萄糖、蔗糖、麦芽糖、乳糖)、MR试验、VP试验、靛基质试验、柠檬酸盐利用试验共5项生化试验鉴定,根据《伯杰氏细菌鉴定手册》判断标准,可以确定该株菌为大肠埃希菌。结果见表1。
2.3.3 分离菌株的16 S rRNA PCR分子鉴定 分离菌株进行16 S rRNA PCR检测,所得产物经琼脂糖凝胶电泳,每株菌可见1条1.6 kb左右的特异性条带(图2)。

表1 分离菌株的生理生化鉴定结果
注:糖发酵试验:“+”表示产酸产气;“- ”表示不发酵。其他试验:“+”表示阳性;“- ”表示阴性。
Note:In pentasaccharides fermentation test,“+ ”stands for production of gas and acid; “- ”stands for no fermentation.In other tests,“+ ”stands for positive;and “- ”stands for negative.

M.DNA标准DL 2 000;1、2.菌株1;3.阴性对照;4、5.菌株2
M.DNA Marker DL 2 000;1,2.Strain 1;3.Negative control;4,5.Strain 2
图2分离菌株的16 S rRNA PCR产物电泳结果
Fig.2 Electrophoresis products of 16 S rRNA PCR results of isolated strains
将所测得的基因序列与GenBank中已有的序列进行比对,选取同源性高的菌株并结合菌株的生理生化特性对所测菌株进行鉴定。菌株1与EscherichiacoliO104:H4序列同源性达100%,菌株2与EscherichiacoliO78序列同源性达100%,两者均为致病性大肠埃希菌。
2.4 分离菌株的小鼠致病性试验结果
小鼠在接种后先后表现出不同程度的精神沉郁,被毛散乱,食欲降低。C组小鼠精神状态表现良好,食欲饮欲等正常。1 d后,G1组1只小鼠死亡;2 d后,G2组2只小鼠死亡,G1组1只小鼠死亡;3 d后,G1组和G 2组各有1只小鼠发生死亡。死亡统计结果见表2。
死亡小鼠剖检后,肺脏均有少量出血淤血症状,其他无明显病理变化。G1组和G2组的死亡小鼠肺脏中分离细菌进行回归检测,阳性率为100%。小白鼠致病试验表明2株由林麝肺脏分离的大肠埃希菌能引起小鼠发病死亡,并从小鼠肺脏中能分离到大肠埃希菌(结果未显示)。
2.5 药敏试验结果
以抑菌圈直径大小作为判断敏感性高低的标准。细菌对该药的敏感性越高则产生的抑菌圈直径越大。根据不同的抑菌圈直径分为高度敏感,中度敏感和耐药。各菌株的药敏试验结果见表3。

表2 小鼠腹腔注射结果
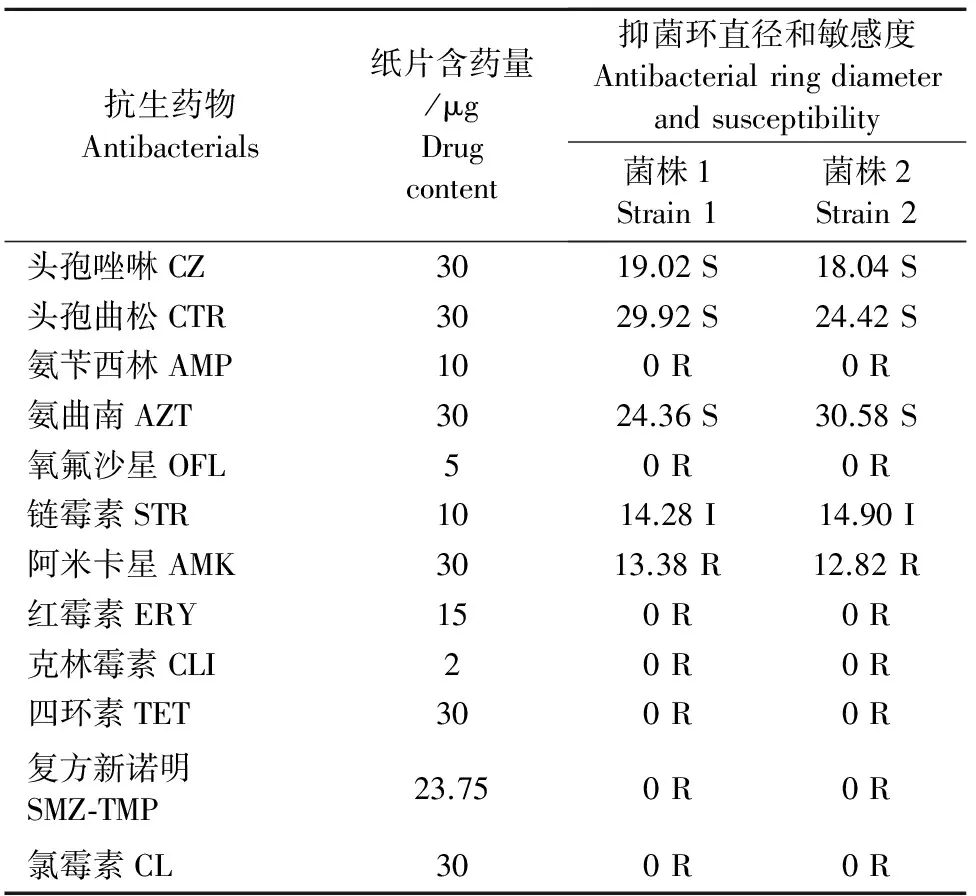
表3 药敏试验结果
注:抑菌环直径,单位:mm;S.敏感;I.中介;R.耐药。
Note:Antibacterial ring diameter,mm ; “S” represents sensitive; “I” represents intermediary; “R” represents resistance.
从表3可见,在12种抗生素中,头孢类抗生素对2株林麝肺部致病性大肠埃希菌的抑菌作用最强。头孢类(头孢唑啉、头孢曲松)和单环β内酰胺类(氨曲南)对2株菌均敏感;氨基糖苷类(链霉素)对其均中度敏感,两株分离菌对其他几种药物均呈现耐药性。
3 讨论
本试验从林麝肺脏组织中分离得到2株细菌,分别为菌株1、菌株2。经分离培养与纯培养、染色镜检后,初步怀疑菌株1和菌株2均为大肠埃希菌,且菌株1菌落比菌株2略大。通过生化试验鉴定,结果均基本符合《伯杰氏细菌鉴定手册》所描述的大肠埃希菌典型生化特征。
小鼠致病性试验中,感染小鼠病程短,死亡快,试验组小鼠死亡率均为75%,且出现了较明显的临床发病症状,虽然实质器官病理变化不明显,但都能从死亡小鼠的肺脏中分离到攻菌菌株,因此可以认定为是致病性大肠埃希菌。
扩增分离菌株的16 S rRNA序列,将所得序列与GenBank中已知序列比对,结果发现,菌株1与EscherichiacoliO104:H4序列同源性达100%,菌株2与EscherichiacoliO78序列同源性达100%,两者均为致病性大肠埃希菌。其中,EscherichiacoliO104:H4为肠出血性大肠埃希菌,肠出血性大肠埃希菌感染是一种人畜共患病,并且传染性较强[10-11]。EscherichiacoliO78是禽致病性大肠埃希菌,可导致各年龄段家禽感染,也有从牛、羊、鹿等组织中分离出禽致病性大肠埃希菌的报道[12-13]。由此可以推测,林麝对常见家养畜禽致病病原也有较高的敏感性,因此建议林麝饲养应与家养畜禽保持一定距离。而药敏试验结果显示,分离菌对常用预防和治疗用抗菌药物均有耐药性,更进一步提示分离菌可能来源于家养畜禽。
[1] 汪 松.中国濒危动物红皮书[M].北京:科学出版社,1998:237-240.
[2] 许 珂,卜书海,梁宗锁.林麝研究进展[J].黑龙江畜牧兽医,2014(4):147-150.
[3] 姜海瑞,陆祎玮.陕西凤县林麝野生资源调查记[J].大自然,2015(4):68-69.
[4] Sanchez-Sosa S, Aguirre-Lombardo M, Jimenez-Brito G,et al.Characterization of extraintestinal pathogenicEscherichiacoliisolated from retail poultry meats from Alberta,Canada.[J].Int J Food Microbiol,2014,177:49-56.
[5] 张 桃,苏战强,夏利宁,等.牛源大肠杆菌O157:H7分离与鉴定及其毒力基因检测[J].中国人兽共患病学报,2015,31(12):1136-1141.
[6] 徐引弟,王治方,朱文豪,等.肠外致病性大肠杆菌的研究进展[J].畜牧兽医科技信息,2011(7):21-23.
[7] Buchanan R R,Gibbons N E.Bergey’s Manual of determinative bacteriology,eight [M].Baltimore:Williams and Wikins,1974:385-389.
[8] 罗 燕,王 朋,赵洪明,等.林麝肺源致病性大肠杆菌分离鉴定及毒力基因PCR检测[J].中国预防兽医学报,2012,34(8):615-618.
[9] 林亚军,季建莉,赵红琼,等.新疆地区牛和新引进牛大肠埃希菌耐药性比较[J].动物医学进展,2016,37(11):126-128,129.
[10] Radosavljevic V,Finke E J,Belojevic G.Analysis ofEscherichiacoliO104:H4 outbreak in germany in 2011 using differentiation method for unusual epidemiological events.[J].Central European Journal of Public Health,2016,24(1):9-15.
[11] Vladan R,Ernst-Juergen F,Goran B,et al.EscherichiacoliO104:H4 outbreak in Germany-clarification of the origin of the epidemic[J].Eur J Public Health,2015,25(1):125-129.
[12] Zhao Kelei,Tian Yongqiang,Yue Bisong,et al.Virulence determinants and biofilm production amongTrueperellapyogenesrecovered from abscesses of captive forest musk deer.[J].Arch Microbiol,2013,195(3):203-209.
[13] Zhang L Y, Lv S, Wu S C, et al.Inhibitory effects of α-cyperone on adherence and invasion of avian pathogenicEscherichiacoliO78 to chicken type Ⅱ pneumocytes[J].Vet Immunol Immunopathol,2014,159(1/2):50-57.
Abstract:To isolate and identify the pathogenicEscherichiacolifrom lungs of dead forest musk deer,bacterial culture,biochemical assays and pathogenic test were used.Two different colony morphology of bacteria in forest musk deer were isolated and identified.16 S rRNA PCR test result showed that two strains of bacteria wereEscherichiacoli.Strain 1 was 100% similar withE.coliO104:H4,Strain 2 was 100% similar withE.coliO78.The two isolates could cause death in mice.The death rate of mice was 75%.12 kinds of commonly used antibacterials were used to measure their drug sensitivity,cephalosporins have the strongest effect against bacteria among the 12 kinds of antibacterials.Cephalosporins (cefazolin,ceftriaxone) and monocyclic β- lactam (aztreonam) are sensitive to the two strains of pathogenicE.coli; aminoglycosides (streptomycin) was moderately sensitive to them; they were resistant to other categories of antibacterials.The findings in the research provided important information for the prevention and control of forest musk deer pneumonia.
Keywords:musk deer; pneumonia;Escherichiacoli; 16 S rRNA PCR; drug susceptibility test
Isolation,IdentificationandDrugSusceptibilityTestofPathogenicEscherichiacolifromMuskDeerLungsinShannxi
ZHANG Hui-hui,QIU Xin-xin,WANG Xing-long,YANG Zeng-qi
(CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi,712100,China)
S852.612;S865.41
B
1007-5038(2017)08-0118-04
2016-12-08
张慧慧(1989-),女,山东滨州人, 硕士研究生,主要从事动物传染病的检测研究。*

