阿魏酸酯酶在体外模拟猪胃肠道中的稳定性
梅胜, 王镇发, 罗云, 陈培钦, 李夏兰
(1. 华侨大学 化工学院, 福建 厦门 361021;2. 漳州市龙文区环境保护监测站, 福建 漳州 363005)

阿魏酸酯酶在体外模拟猪胃肠道中的稳定性
梅胜1, 王镇发2, 罗云1, 陈培钦1, 李夏兰1
(1. 华侨大学 化工学院, 福建 厦门 361021;2. 漳州市龙文区环境保护监测站, 福建 漳州 363005)
模拟了胃(肠)液中pH值、蛋白酶、进食量和微量金属离子等对阿魏酸酯酶(FAE)酶活稳定性的影响.结果表明:模拟胃液环境对阿魏酸酯酶酶活影响显著,模拟肠液环境对阿魏酸酯酶稳定性影响较小;蛋白酶酶活的增加不利于阿魏酸酯酶稳定性,但影响不显著;混合金属离子对阿魏酸酯酶稳定性影响不显著;进食量增加可以保护阿魏酸酯酶通过胃液环境,进入小肠发挥作用.在模拟胃液中,阿魏酸酯酶的酶活迅速降低,1 h时,酶活为25%左右,调整为小肠环境时,对阿魏酸酯酶有瞬时激活作用;5 h时,酶活为30%左右;胃肠道pH值是影响阿魏酸酯酶酶活的主要因素,胃蛋白酶、肠道中的金属离子对阿魏酸酯酶酶活影响较小,进食量对肠道中阿魏酸酯酶有保护作用,模拟肠液对经过模拟胃液处理的阿魏酸酯酶有瞬时激活作用.
阿魏酸酯酶; 饲用酶; 胃肠道; 酶活
Abstract: In this paper, we simulated the influence of pH, protease, food-intake and trace metal ions in the gastrointestinal fluid on the stability of ferulic acid esterase (FAE) activity. The results showed the simulated gastric fluid environment had significant effects on the activity of FAE, whereas the intestinal juice had subtle effects on the stability of FAE. The increasing activity of protease was unfavorable to the stability of FAE, which was not obvious. Similarly, the effect of mixed metal ions on the stability of FAE was not significant. The increasing food-intake could protect FAE from degradation in the gastric environment and make it work in the small intestine. Furthermore, the activity of FAE in the simulated gastric fluid decreased rapidly, which was about 25% of the initial activity in one hour. As for the intestine environment, it had a transient activation to FAE with 30% of the initial activity in five hours. In summary, the pH of the gastrointestinal tract is the key factor that affects the activity of FAE. Both the protease and the metal ions in intestine have a little influence on the activity of FAE. Besides, the food-intake plays a protective role in FAE. And the simulated intes-tinal juice has instant activation on the FAE treated with the simulated gastric juice.
Keywords: ferulic acid esterase; feed enzyme; gastrointestinal tract; enzyme activity
阿魏酸酯酶(EC 1.1.73,feruloyl esterase,FAE)是降解木质纤维的关键酶之一.研究表明,单一的FAE作用木质纤维时,效果并不明显,只有当FAE与其他木质纤维降解酶协同作用,才能显著提高细胞壁的降解效率[1-3].在饲料工业中,利用阿魏酸酯酶和半纤维素酶处理植物性的原材料,可以水解木质纤维中半纤维素之间,以及半纤维素与木质素之间的阿魏酸酯键,释放阿魏酸和低聚木糖,同时,提高饲料的利用效率[4-6].作为饲用酶制剂不仅要在饲料加工和发酵过程中保持活性,还需经受肠道环境,才能与内源性消化酶共同作用消化食糜,从而降低肠道粘性,降解抗营养因子,促进营养物质的消化吸收[7-8].目前,尚未见FAE在动物胃肠道中的稳定性研究.本文从pH值、金属离子、蛋白酶和进食量等胃肠道环境对FAE酶活力的影响,探讨畜禽消化道对FAE的影响.
1 材料与方法
1.1试验材料
胃蛋白酶(美国Sigma试剂公司,优级纯,货号为P7000,酶活力为38 841.1 nkat·mg-1);胰蛋白酶(美国Sigma试剂公司,优级纯,货号为93614,酶活力为166 866.7 nkat·mg-1);UV-6100型紫外可见光分光光度计(上海美谱达仪器有限公司);透析袋(MWCO 3500,上海通善生物科技有限公司).
1.2FAE粗酶液的制备
菌种:黑曲霉,实验室自行筛选并保藏.种子培养基:马铃薯葡萄糖琼脂(PDA)培养基,于37 ℃,200 r·min-1下培养2 d.固态发酵培养基:麸皮与次粉(质量比为1∶1)混合物为39.30%, 硫酸镁为0.06%,硫酸铵为2.44%,水为58.20%.采用白瓷盘固体发酵,33 ℃培养6 d.粗酶液的制备:发酵结束后,在固体发酵料中,加入8倍体积的蒸馏水,于33 ℃,180 r·min-1下抽提2.5 h,用8层纱布过滤,滤液再经超滤浓缩.
1.3FAE酶活的测定方法
FAE酶活的测定方法参照文献[9-10]建立的分光光度计法.
1.4模拟胃(肠)液的配制
根据美国药典中模拟胃(肠)液进行配制[11].模拟胃液:NaCl 2.0 g,胃蛋白酶3.2 g,浓盐酸7 mL,双蒸水定容于1 000 mL,pH值约为3.0.模拟肠液:将6.8 g的KH2PO4溶于250 mL双蒸水,振荡,完全溶解后加190 mL,0.2 mol·L-1的NaOH和400 mL的双蒸水;然后,加入胰蛋白酶10.0 g,混匀,用0.2 mol·L-1的NaOH调节pH值到7.0.
2 结果与分析
2.1FAE在模拟胃(肠)液中的稳定性
在猪肠道中影响饲用酶制剂稳定性的主要因素为胃肠的pH值和蛋白酶类.实验测得酶化发酵饲料中纤维素占干质量的质量分数大于17%.因此,选择胃中进食时,pH=3.0;空腹时,pH=1.2,排空时间1 h;小肠pH=7.0,排空时间4 h.与FAE最稳定pH值(pH=6.0)中FAE酶活变化做对比,研究FAE在胃肠道中稳定性.
2.2消化时间对FAE稳定性的影响
在装有5 mL模拟胃(肠)液的透析袋中,加入5 mL FAE浓缩液,调整pH值为3.0(或7.0).然后,将透析袋置于不含蛋白酶的模拟胃(肠)液中,在37 ℃下,保温4 h,间隔一定时间取样0.1 mL,迅速滴入0.9 mL,pH值为6.0的柠檬酸缓冲溶液中,于50 ℃水浴锅中保温5 min.再次,加入2 mL,50 ℃保温5 min的200 μmol阿魏酸甲酯(MFA),于50 ℃反应10 min.最后,加入3 mL体积分数为10%的冰醋酸灭酶,振荡混匀,参照文献[9-10]检测FAE酶活,每次取样测3次酶活,取平均值,每组重复3次.
FAE在模拟胃(肠)液中酶活(Ar)随时间的变化,如图1所示.由图1可知:反应之初,酶活下降迅速;反应1 h后,模拟胃液中的酶活余20%左右;反应4 h时后,FAE几乎全部失活;而模拟肠液反应4 h后,FAE仍具有70%左右的酶活.由此可知,模拟胃液对FAE酶活影响显著,模拟肠液对FAE稳定性影响较小.
2.3pH值对FAE稳定性的影响
猪肠胃中的pH值在不同的进食量和进食的不同阶段会发生规律性波动.进食时,pH=3.0;从进食到胃排空期间,pH>3;当胃中食糜排空后,pH值降到3以下[12].因为胃的排空时间随食糜中纤维素和水的质量分数的不同而发生变化[12].配制不加蛋白酶的模拟胃(肠)液,分别用盐酸或氢氧化钠调节pH值为1.2,3.0,6.0,7.0,取5 mL于透析袋中,将透析袋置于不含蛋白酶的模拟胃(肠)液中,再加入5 mL FAE浓缩液,于37 ℃下保温4 h.间隔一定时间取样,参照文献[9-10]检测FAE酶活,每次取样测3次酶活,取平均值,每组重复3次.
不加胃蛋白酶的模拟胃(肠)液时,pH值对FAE稳定性的影响,如图2所示.由图2可知:在4 h时,FAE在pH值为6.0,7.0的环境中,能维持80%以上的活性;在pH值为1.2,3.0的环境中,前30 min,酶活分别降到5%,30%,之后下降缓慢;在pH值为1.2的环境中,保持1 h,FAE全部失活;在pH值为3.0的环境中,还有25%的活性.由此可知,小肠的pH值为7.0时,对FAE的稳定性影响较小,而胃的酸性pH值对酶活的影响剧烈.
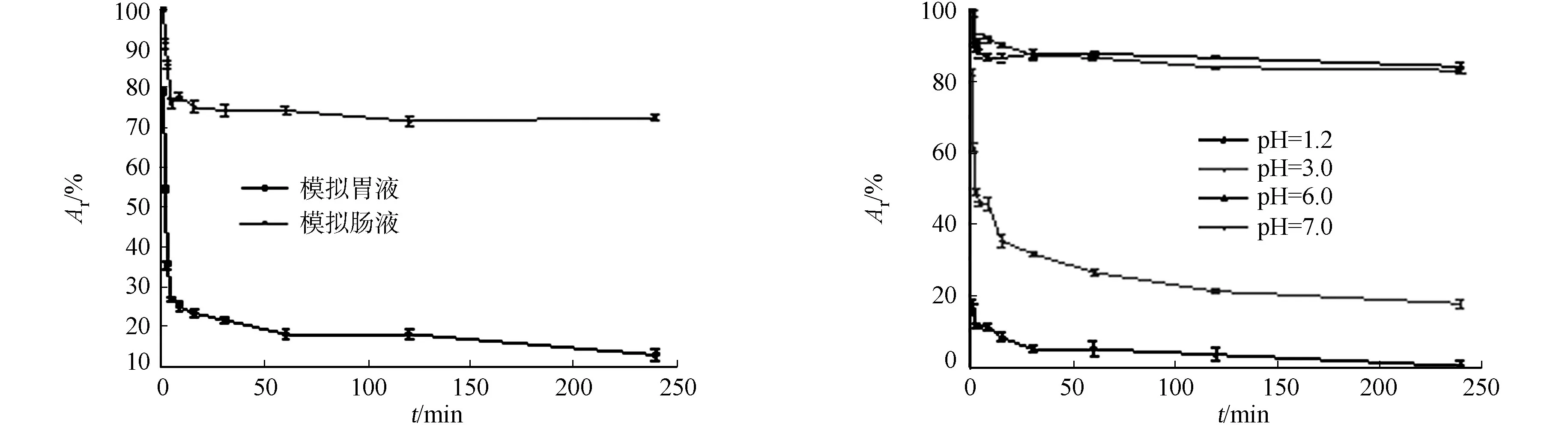
图1 消化时间对FAE稳定性的影响 图2 pH值对FAE稳定性的影响 Fig.1 Effect of digestion time on stability of FAE Fig.2 Effect of pH on stability of FAE
2.4蛋白酶量对FAE稳定性的影响
分别取5 mL含0.5,1.0和2.0倍胃蛋白酶量(或胰蛋白酶量)的模拟胃(肠)液于透析袋中,分别加入5 mL FAE浓缩液,调整pH值为3.0(或7.0).将透析袋置于不含蛋白酶的模拟胃(肠)液中,于37 ℃下保温4 h.间隔一定时间取样,参照文献[9-10]检测FAE酶活,每次取样测3次酶活,取平均值,每组重复3次.
蛋白酶浓度为模拟胃(肠)液中蛋白浓度的0.5,1.0,2.0倍,FAE的稳定性,如图3所示.由图3可知:随着蛋白酶浓度的增加,FAE酶活的降低速度和残余酶活力随胃蛋白酶浓度的增加而缓慢降低.由此可知,胃蛋白酶酶量和胰蛋白酶酶量增加不利于FAE的稳定性.
2.5胃肠中混合金属离子对FAE稳定性的影响
参照文献[13]模拟胃肠中的金属离子浓度.取5 mL含混合金属离子(2 mmol·L-1的Ca2+,0.01 mmol·L-1的Cu2+,Zn2+,Mn2+,Fe2+)的模拟胃(肠)液于透析袋中,分别加入5 mL FAE浓缩液,调整pH值为3.0(或7.0).将透析袋置于含混合金属离子,不含蛋白酶的模拟胃(肠)液中,37 ℃下保温4 h.间隔一定时间取样,参照文献[9-10]检测FAE酶活,每次取样测3次酶活,取平均值,每组重复3次.
杨道秀[14]报导Fe2+,Cu2+,Zn2+,Ca2+,Mn2+等金属离子对FAE酶活有抑制作用.根据肠胃中存在的金属离子种类和浓度,检测模拟胃(肠)液中 Ca2+,Cu2+,Zn2+,Mn2+和Fe2+对FAE酶活的影响[13],如图4所示.由图4可知:添加了金属离子的模拟胃(肠)液中FAE的残余酶活力和无添加金属离子的胃(肠)液的残余酶活力相似.这可能是FAE浓缩液中含有其他的蛋白质或酶,减弱了金属离子对FAE酶活的影响.
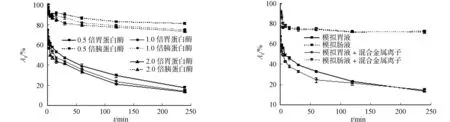
图3 胃蛋白酶和胰蛋白酶对FAE稳定性影响 图4 金属离子对FAE稳定性的影响Fig.3 Effect of pepsin and trypsin on Fig.4 Effect of metal ions on stability of FAE stability of FAE
2.6进食量对FAE稳定性的影响
分别将20 g质量比分别为2∶4∶4,4∶3∶3,5.0∶2.5∶2.5,6∶2∶2,8∶1∶1的酶化发酵饲料、模拟胃(肠)液和FAE浓缩液混合物放置于锥形瓶之中,在37 ℃,50 r·min-1下振荡4 h.间隔一定时间取样,参照文献[9-10]检测FAE酶活,每次取样测3次酶活,取平均值,每组重复3次.
进食量与液体(或肠液)的质量比分别为2∶8,4∶6,5∶5,6∶4,8∶2时,FAE在模拟胃(肠)液中残余酶活力随时间的变化,如图5所示.胃肠中食糜的质量分数对食糜的排空时间、胃肠pH值的下降速率,以及胃液、肠液与食糜中外源性酶的接触有一定影响.由图5可知:随着进食量的增加,在模拟胃环境中反应0,2,4 h后,FAE的相对酶活力也明显提高;在进食量与胃液的质量比为8∶2时,2 h后,FAE相对酶活力为70%,4 h后,仍有60%左右.由图5还可知:随着进食量的增加,在模拟小肠环境中反应0,2,4 h后,FAE的相对酶活力相应地提高,但相对酶活力在70%以上;当进食量与胃液质量比为8∶2时,4 h后,FAE相对酶活力为85%以上.
2.7模拟胃(肠)液连续作用对FAE的影响
取5 mL模拟胃液于透析袋中,加入5 mL FAE浓缩液,调整pH值为3.0,37 ℃下,保温1 h,然后,将模拟反应液调节pH值至7.0,加入10 mL模拟肠液,37 ℃再保温4 h.间隔一定时间取样,参照文献[9-10]检测FAE酶活,每次取样测3次酶活,取平均值,每组重复3次.
胃和肠是串联系统,部分蛋白酶从胃的酸性环境转入小肠的中性环境中,酶活有一定的恢复[13].将FAE在模拟胃液中保温1 h,再加入模拟肠液,保温4 h,检测FAE酶活变化,如图6所示.由图6可知:在模拟胃液中,FAE的酶活随时间而减少,在1 h时,酶活为25%左右;加入模拟肠液,并调节pH值至7.0,FAE的酶活有一定恢复;随着在模拟肠液中的反应,FAE的酶活继续降低,5 h时,酶活约为30%.
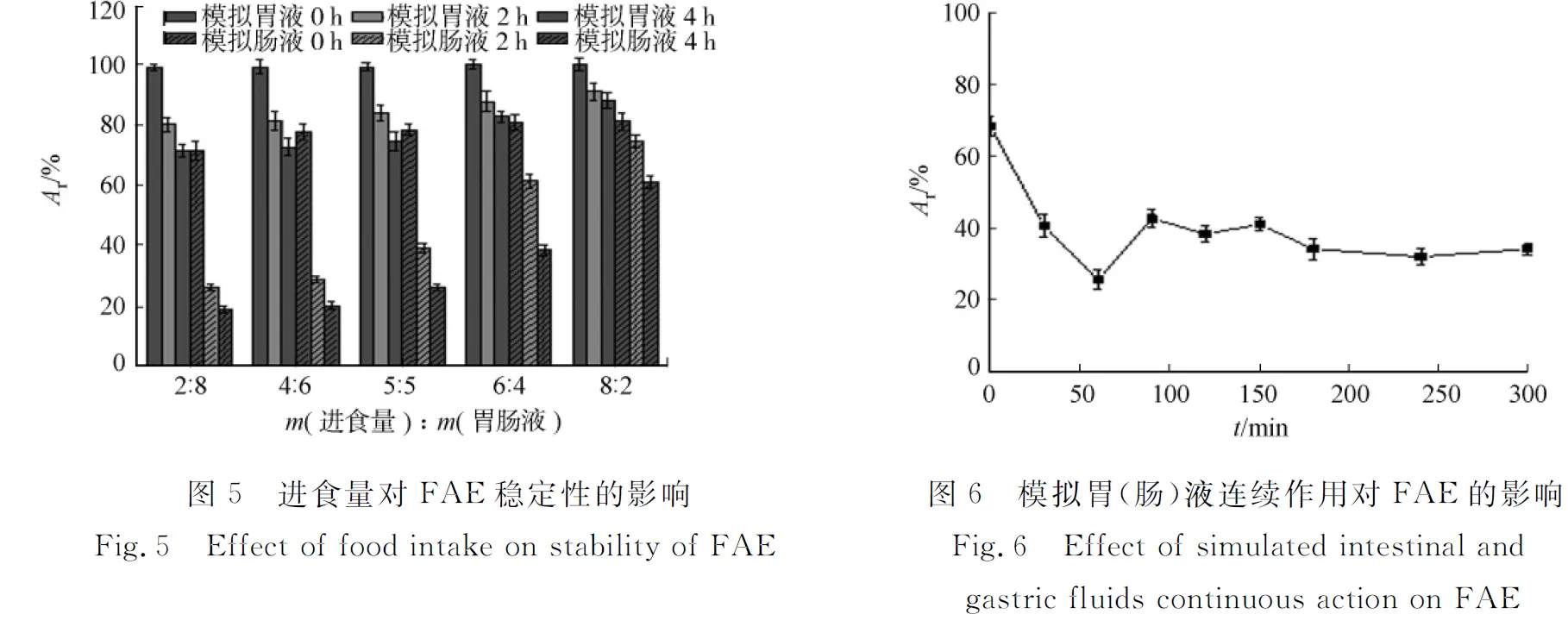
3 讨论
孙建义等[13]通过研究在体外模拟动物肠胃条件下β-葡聚糖酶稳定性发现,酶活的降低主要是由低pH值引起的,胃蛋白酶对酶活性无显著影响,且β-葡聚糖酶在胃内的活性较低,但能在小肠中恢复部分酶活,这与文中的研究结果相似.但孙建义等[13]发现在模拟胃条件下,金属离子混合液对酶活有促进作用,而在模拟小肠条件下,金属离子混合液对酶活有抑制作用,这与文中的研究结果有差别.
文中研究表明:随着进食量的增加,FAE的相对酶活力也相应提高.其原因可能是加大进食量有利于保护FAE通过胃液的酸性环境.此外,肠液中的中性环境,对经过胃液的FAE有短暂的激活作用.与Morgavi等[15]研究发现糖苷酶、纤维素酶和木聚糖酶在胃蛋白酶和酸性(pH=3.0)条件下会部分失活,在胰蛋白酶溶液和中性(pH=7.0)条件下,呈现瞬时增加的现象相吻合.
胃肠道pH值是影响FAE酶活的主要因素,胃蛋白酶、肠道中的金属离子对FAE酶活影响较小,进食量增加对肠道中FAE有保护作用,模拟肠液对经过模拟胃液处理的FAE有一定激活作用.因此,FAE作为饲用酶制剂在饲料中应用时,一方面,可以考虑加大三元猪的采食量,减少FAE酶活在胃液低pH中的损失;另一方面,将FAE应用于胃酸分泌量不多(pH为4.0左右)的断奶仔猪的饲喂,推断FAE在断奶仔猪肠胃中的酶活稳定性应更好.
[1] BRAGA C M,DELABONA P S,LIMA D J,etal.Addition of feruloyl esterase and xylanase produced on-site improves sugarcane bagasse hydrolysis[J].Bioresource Technology,2014,170(5):316-324.
[2] BARTOLOME B,GOMEZ C C,SANCHO A I,etal.Growth and release of hydroxycinnamic acids from Brewer′s spent grain by streptomyces avermitilis CECT 3339[J].Enzyme and Microbial Technology,2007,32(1):140-144.
[3] SELIG M J,KNOSHAUG E P,ADNEY W S,etal.Synergistic enhancement of cellobiohydrolase performance on pretreated corn stover by addition of xylanase and esterase activities[J].Bioresource Technology, 2008,99(11):4997-5005.
[4] 杨道秀,李夏兰,陈培钦,等.新型复合酶在肉鸡饲料中的应用[J].食品与生物技术学报,2013,32(4):410-416.
[5] MATHEW S,ABRAHAM T E.Studies on the production of feruloyl esterase from cereal brans and sugar cane bagasse by microbial fermentation[J].Enzyme and Microbial Technology,2005,36(4):565-570.
[6] 杨红建,黎大洪,谢春元,等.阿魏酸酯酶处理对草、玉米秸、稻秸及麦秸瘤胃体外发酵特性的影响[J].动物营养学报,2010,22(1):207-211.
[7] 郝志敏.饲用酶制剂的开发应用及存在的问题[J].饲料与畜牧,2010(11):25-27.
[8] 张伟,詹志春.饲用酶制剂研究进展与发展趋势[J].饲料工业,2011(增刊1):11-19.
[9] YUE Q,YANG H J,LI D H,etal.A comparison of HPLC and spectrophotometrical methods to determine the activity of ferulic acid esterase in commercial enzyme products and rumen contents of steers[J].Anim Feed Sci Tech,2009,153(3/4):169-177.
[10] MATHEW S,ABRAHAM T E.Studies on the production of feruloyl esterase from cereal brans and sugar cane bagasse by microbial fermentation[J].Enzyme Microb Tech,2005,36(4):565-570.
[11] MILLER L C.The United States pharmacopeia[M].Rockville: United States Pharmacopeial Convention, 1983:510-530.
[12] STRUBE M L,MEYER A S,BOYE M.Minireview: Basic physiology and factors influencing exogenous enzymes activity in the porcine gastrointestinal tract[J].Animal Nutrition and Feed Technology,2013(13):441-459.
[13] 孙建义,李卫芬,顾赛红.体外模拟动物肠胃条件下β-葡聚糖酶稳定性的研究[J].中国畜牧志,2002,38(1):18-19.
[14] 杨道秀.阿魏酸酯酶在麦糟酶化饲料中的应用[D].厦门:华侨大学,2013:20-23.
[15] MORGAVI D P,BEAUCHEMIN K A,NSEREKO V L,etal.Resistance of feed enzymes to proteolytic inactivation by rumen microorganisms and gastrointestinal proteases[J].Journal of Animal Science,2001,79(6):1621-1630.
(责任编辑: 钱筠英文审校: 刘源岗)
StabilityofFerulicAcidEsteraseinSimulatedGastrointestinalTractofPigs
MEI Sheng1, WANG Zhenfa2, LUO Yun1, CHEN Peiqin1, LI Xialan1
(1. College of Chemical Engineering, Huaqiao University, Xiamen 361021, China;2. Longwen District Environmental Protection Monitoring Station of Zhangzhou, Zhangzhou 363005, China)
10.11830/ISSN.1000-5013.201608020
2016-08-19
李夏兰(1965-),女,教授,博士,主要从事生物化工的研究.E-mail:xialan@hqu.edu.cn.
福建省发改委投资项目(2013-886)
Q 95.33
A
1000-5013(2017)05-0659-05

