miR-146a靶向调控RhoA对肺癌细胞增殖的影响
谭音玲,郭丽艳,王金兰
(潍坊市益都中心医院,山东潍坊262500)
miR-146a靶向调控RhoA对肺癌细胞增殖的影响
谭音玲,郭丽艳,王金兰
(潍坊市益都中心医院,山东潍坊262500)
目的探讨微小RNA-146a(miR-146a)靶向调控RhoA对肺癌细胞增殖的影响。方法采用脂质体转染法将miR-146a mimics转染肺癌细胞NCI-H520,建立高表达miR-146a的肺癌细胞NCI-H520,采用CCK-8法检测过表达miR-146a对肺癌细胞NCI-H520增殖活性的影响。通过生物信息学软件TargetScan、Pictar和miRanda筛选miR-146a的靶基因,并采用双荧光素酶报告基因验证靶基因。采用qRT-PCR法和Western blotting法检测肺癌细胞NCI-H520过表达miR-146a对其靶基因mRNA和蛋白表达的影响。采用CCK-8法检测特异性敲低RhoA表达对肺癌细胞NCI-H520增殖活性的影响。结果过表达miR-146a能明显抑制肺癌细胞NCI-H520增殖活性(P均<0.01)。经双荧光素酶报告基因验证,miR-146a的靶基因可能为RhoA。过表达miR-146a能明显降低肺癌细胞NCI-H520 RhoA mRNA和蛋白表达(P均<0.01)。特异性敲低RhoA表达能够明显抑制肺癌细胞NCI-H520增殖活性(P均<0.01)。结论miR-146a可能通过负向调控其靶基因RhoA的表达而抑制肺癌细胞的增殖活性。
肺癌;微小RNA-146a;RhoA;细胞增殖
微小RNA(miRNA)是一类长度为18~25 nt的内源性非编码小分子RNA,可通过降解靶基因mRNA或阻止其蛋白翻译,参与基因转录后的调控活动[1,2]。研究发现,miRNA可参与调控人体内约30%的编码基因[3]。miR-146a是首个被发现具有免疫调节作用的miRNA。有研究已证实,miR-146a表达下调与肺癌的发生、发展密切相关[4,5]。RhoA是小分子G蛋白Rho家族成员之一,主要参与细胞骨架组装、细胞分裂、细胞黏附等多种细胞功能调节。研究发现,RhoA表达上调与肺癌的侵袭和转移有关[6,7]。2009年1月~2010年12月,我们观察了过表达miR-146a对肺癌细胞增殖的影响,并探讨miR-146a与RhoA的关系。现报告如下。
1 材料与方法
1.1 材料 人肺癌细胞NCI-H520(以下称肺癌细胞),美国ATCC公司。miR-146a、RhoA及内参U6、β-actin引物,由广州锐博生物公司设计合成。TRIzol试剂、LipofectamineTM2000,美国Invitrogen公司;RNA逆转录试剂盒、qRT-PCR试剂盒,宝生物工程(大连)有限公司;双荧光素酶检测试剂盒、pmirGLO载体,美国Promega公司;miR-146a mimics、阴性对照mimics-NC和RhoA siRNA质粒(si-RhoA)、阴性对照siRNA质粒(si-NC),上海吉玛制药技术有限公司;鼠抗人RhoA单克隆抗体、HRP标记的兔抗鼠单克隆抗体及兔抗人GAPDH单克隆抗体,美国Abcam公司;CCK-8试剂盒,上海碧云天生物技术有限公司;LightCycler 96荧光定量PCR仪,瑞士Roche公司。
1.2 细胞培养及miR-146a转染 将肺癌细胞接种于含10% FBS的高糖DMEM培养基中,置于37 ℃ 5% CO2细胞培养箱中常规培养,每2~3天按1∶3传代1次。取对数生长期细胞,接种于细胞培养板,随机分为miR-146a mimics组、mimics-NC组,待细胞贴壁超过80%时分别转染miR-146a mimics和mimics-NC(按LipofectamineTM2000试剂盒说明书操作)。
1.3 miR-146a表达检测 采用qRT-PCR法检测两组细胞转染后miR-146a表达。结果显示,miR-146a mimics组转染后miR-146a相对表达量为5.11±0.08,mimics-NC组为0.99±0.03。miR-146a mimics组转染后miR-146a相对表达量明显高于mimic-NC组﹙P<0.01﹚。
1.4 细胞增殖活性检测 采用CCK-8法。取两组转染后细胞接种于96孔板,37 ℃、5% CO2细胞培养箱中常规培养。两组分别于培养24、48、72、96 h加入10 μL CCK-8试剂,继续培养2 h。酶标仪450 nm波长处检测各孔吸光度(A)值。以A450值代表细胞增殖活性。每个时间设3个复孔,实验重复3次,取平均值。
1.5 靶基因预测及双荧光素酶报告基因验证 通过生物信息学软件TargetScan、Pictar和miRanda筛选miR-146a的靶基因极可能为RhoA,并采用双荧光素酶报告基因验证靶基因。委托上海吉玛制药技术有限公司构建野生型pmirGLO-RhoA-WT和突变型pmirGLO-RhoA-MT,将测序验证正确的pmirGLO-RhoA-WT或pmirGLO-RhoA-MT转染入miR-146a mimics组或mimics-NC组细胞,转染48 h。收集细胞,按照双荧光素酶活性检测试剂盒说明检测萤火虫荧光素酶活性值和海肾荧光素酶活性值。以海肾荧光素酶基因作为内参,计算相对荧光酶活性。相对荧光酶活性=萤火虫荧光素酶活性值/海肾荧光素酶活性值。
1.6 RhoA表达检测 ①RhoA mRNA表达:采用qRT-PCR法。取miR-146a mimics组、mimics-NC组转染后的肺癌细胞,按照TRIzol试剂盒说明书法提取细胞总RNA,采用核酸蛋白测定仪检测,OD260/OD280在1.8~2.0之间,琼脂糖凝胶电泳鉴定总RNA完整,符合实验要求。按逆转录试剂盒说明书逆转录得到cDNA,然后进行PCR扩增。引物设计:miR-146a上游引物:5′-GGGTGAGAACTGAATTCCA-3′,下游引物:5′-CAGTGCGTGTCGTGGAGT-3′;RhoA上游引物:5′-TGATTGTTGGTGATGGAGCCT-3′,下游引物:5′-ACTCTACCTGCTTTCCATCCAC-3′。PCR反应体系共25 μL:SYBR® Premix Ex TaqTMⅡ(2×)12.5 μL,cDNA 2 μL,上下游引物各1 μL,无酶水8.5 μL;PCR反应条件:94 ℃ 2 min,94 ℃ 20 s,60 ℃ 30 s,共40个循环。以β-actin作为内参基因,采用2-ΔΔCt法计算目的基因mRNA相对表达量。实验重复3次,取平均值。②RhoA蛋白表达:采用Western blotting法。取miR-146a mimics组、mimics-NC组转染后的肺癌细胞,用蛋白裂解液提取细胞总蛋白,BCA法蛋白定量。取40 μg蛋白上样,行SDS-聚丙烯酰胺凝胶电泳,并转印至PVDF膜上;5%脱脂奶粉室温封闭2 h,分别加入鼠抗人RhoA单克隆一抗(1∶1 000)和兔抗人GAPDH单克隆一抗(1∶2 000),4 ℃孵育过夜;次日洗膜后,加入辣根过氧化物酶标记的二抗,室温孵育2 h,ECL发光,凝胶成像系统显影。以RhoA蛋白条带灰度值与GAPDH蛋白条带灰度值的比值计算RhoA蛋白相对表达量。
1.7 特异性敲低RhoA后细胞增殖活性检测 取肺癌细胞常规培养,随机分为si-RhoA组、si-NC组,分别转染si-RhoA和si-NC(按LipofectamineTM2000试剂盒说明书操作)。采用qRT-PCR法检测两组RhoA表达,si-RhoA组、si-NC组RhoA mRNA的相对表达量分别为0.29±0.06、0.99±0.03,两组比较P<0.01。证实特异性敲低细胞RhoA成功。采用CCK-8法检测转染si-RhoA后细胞增殖活性,具体操作同1.4。
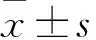
2 结果
2.1 miR-146a mimics组与mimics-NC组细胞增殖活性比较 见表1。

表1 miR-146a mimics组与mimics-NC组培养不同时间细胞增殖活性比较
注:与mimics-NC组同时间点比较,*P<0.01。
2.2 miR-146a的靶基因RhoA验证结果 转染pmirGLO-RhoA-WT的miR-146a mimics组相对荧光素酶活性为0.38±0.03,转染pmirGLO-RhoA-WT的mimics-NC组为1.02±0.01,两组比较P<0.01;转染pmirGLO-RhoA-MT的miR-146a mimics组相对荧光素酶活性为0.99±0.02,转染pmirGLO-RhoA-MT的mimics-NC组为1.04±0.03,两组比较P>0.05。
2.3 过表达miR-146a对RhoA mRNA和蛋白表达的影响 miR-146a mimics组和mimic-NC组RhoA mRNA相对表达量分别为0.34±0.06、1.01±0.02,RhoA蛋白相对表达量分别为0.26±0.05、0.97±0.08,两组比较P均<0.01。
2.4 特异性敲低RhoA对肺癌细胞增殖活性的影响 见表2。

表2 si-RhoA组和si-NC组培养不同时间细胞增殖活性比较
注:与si-NC组同时间点比较,*P<0.01。
3 讨论
目前,肺癌发生、发展的分子机制尚不完全清楚。近年研究发现,miRNA在多种恶性肿瘤中异常表达,在肿瘤细胞增殖、凋亡及侵袭、迁移等方面具有重要作用,已成为当前肿瘤研究和基因治疗的热点[8]。
Zheng等[9]研究发现,miR-129b在肺癌细胞中低表达,其过表达可抑制肺癌细胞增殖。Zhang等[10]研究发现,miR-635可通过靶向调节YY1,抑制肺癌细胞的恶性生物学行为。罗湘玉等[11]研究发现,miR-222与非小细胞肺癌细胞的增殖和侵袭有关。以上研究说明,多种miRNA可能参与肺癌发生、发展过程。miR-146a定位于人类5号染色体的LOC285628基因第2个外显子区域。目前关于miR-146a的研究主要集中在免疫调节方面[12]。近年研究发现,miR-146a在多种恶性肿瘤细胞中表达下调[13~16]。已有研究证实,miR-146a在肺癌组织及细胞中表达降低,并与肺癌的发生、发展密切相关[4,5]。本研究通过脂质体转染法将miR-146a mimics转染肺癌细胞,建立过表达miR-146a的肺癌细胞,结果发现,过表达miR-146a能明显抑制肺癌细胞的增殖活性。证实miR-146a在肺癌具有抑癌基因作用,提高miR-146a表达能够抑制肺癌细胞增殖。
miRNA可参与调控多个靶基因,每个靶基因又受到miRNA调控。miRNA的功能主要取决于其下游靶基因的生物学效应。Kumaraswamy等[17]研究发现,miR-146a能够通过靶向BRCA1调控乳腺癌细胞的增殖和侵袭。Liu等[18]报道,在食管鳞状细胞癌中miR-146a能够通过靶向IRS2调控食管癌细胞的生物学行为。本研究通过常用生物信息学软件TargetScan、Pictar、miRanda预测miR-146a的靶基因可能为RhoA,并采用双荧光素酶报告基因验证靶基因;结果发现,共转染野生型pmirGLO-RhoA-WT和miR-146a mimics的肺癌细胞荧光素酶活性明显低于共转染野生型pmirGLO-RhoA-WT和mimics-NC的肺癌细胞,而共转染突变型pmirGLO-RhoA-MT和miR-146a mimics的肺癌细胞荧光素酶活性与共转染突变型pmirGLO-RhoA-MT和mimics-NC的肺癌细胞比较无统计学差异。证实miR-146a能够特异性结合RhoA mRNA的3′UTR,继而使荧光蛋白表达降低,而结合RhoA mRNA的突变3′UTR则无此作用,说明RhoA是miR-146a直接调控的靶基因。进一步研究发现,miR-146a mimics组RhoA mRNA和蛋白相对表达量均低于mimics-NC组。提示过表达miR-146a能够负性调控RhoA表达,进一步证实miR-146a可直接调控RhoA基因。
RhoA属于小分子G蛋白Rho家族成员之一,该家族包括Rho、Rac、Cdc42三个亚家族。近年研究发现,在肺癌、肝癌、胃癌等多种恶性肿瘤组织中RhoA表达均升高,可能参与恶性肿瘤的发生、发展过程,并与患者不良预后有关[7,19,20]。有研究发现,RhoA在肺癌组织中表达升高,并与肿瘤的侵袭和转移密切相关[6,7]。本研究观察了敲低RhoA表达对肺癌细胞增殖活性的影响,结果发现,敲低RhoA后肺癌细胞增殖活性明显降低。说明下调RhoA表达能明显抑制肺癌细胞的增殖能力;miR-146a可通过抑制RhoA的表达来抑制肺癌细胞增殖。
综上所述,miR-146a能够抑制肺癌细胞增殖活性,其作用靶点可能为RhoA。本研究为肺癌的靶向治疗提供了新方向,但miR-146a是否还调控其他靶基因来影响肺癌细胞的增殖活性尚需进一步研究。
[1] Ridge CA, Mcerlean AM, Ginsberg MS. Epidemiology of lung cancer[J]. Semin Intervent Radiol, 2013,30(2):93-98.
[2] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004,116(2):281-297.
[3] Farh KK, Grimson A, Jan C, et al. The widespread impact of mammalian microRNAs on mRNA repression and evolution[J]. Science, 2005,310(5755):1817-1821.
[4] Cornett AL, Lutz CS. Regulation of COX-2 expression by miR-146a in lung cancer cells[J]. RNA, 2014,20(9):1419-1430.
[5] Chen G, Umelo IA, Lv S, et al. miR-146a inhibits cell growth, cell migration and induces apoptosis in non-small cell lung cancer cells[J]. PLoS One, 2013,8(3):e60317.
[6] Zhang D, Zhang JY, Dai SD, et a1. Co-expression of delta-catenin and RhoA is significantly associated with a malignant lung cancer phenotype[J]. Int J Clin Exp Pathol, 2014,7(7):3724-3732.
[7] 徐宝宁,姜文军,田大力.人肺腺癌中RhoA的表达及临床意义[J].中国医科大学学报,2014,43(1):49-51.
[8] Pereira DM, Rodrigues PM, Borralho PM, et al. Delivering the promise of miRNA cancer therapeutics[J]. Drug Discov Today, 2013,18(5-6):282-289.
[9] Zheng L, Qi YX, Liu S, et al. miR-129b suppresses cell proliferation in the human lung cancer cell lines A549 and H1299[J]. Genet Mol Res, 2016,15(4):1-8.
[10] Zhang Y, Sun Z, Zhang Y, et al. The microRNA-635 suppresses tumorigenesis in non-small cell lung cancer[J]. Biomed Pharmacother, 2016(84):1274-1281.
[11] 罗湘玉,罗卫民,张军,等.miR-222基因转染对人非小细胞肺癌细胞增殖与侵袭的影响[J].山东医药,2016,55(31):14-16.
[12] Hou Z, Zhang J, Han Q, et al. Hepatitis B virus inhibits intrinsic RIG-I and RIG-G immune signaling via inducing miR146a[J]. Sci Rep, 2016(6):26150.
[13] Yao Q, Cao Z, Tu C, et al. MicroRNA-146a acts as a metastasis suppressor in gastric cancer by targeting WASF2[J]. Cancer Lett, 2013,335(1):219-224.
[14] Hurst DR, Edmonds MD, Scott GK, et al. Breast cancer metastasis suppressor 1 up-regulates miR-146, which suppresses breast cancer metastasis[J]. Cancer Res, 2009,69(4):1279-1283.
[15] Lin SL, Chiang A, Chang D, et al. Loss of miR-146a function in hormone-refractory prostate cancer[J]. RNA, 2008,14(3):417-424.
[16] Li Y, Vandenboom TG 2nd, Wang Z, et al. miR-146a suppresses invasion of pancreatic cancer cells[J]. Cancer Res, 2010,70(4):1486-1495.
[17] Kumaraswamy E, Wendt KL, Augustine LA, et al. BRCA1 regulation of epidermal growth factor receptor (EGFR) expression in human breast cancer cells involves microRNA-146a and is critical for its tumor suppressor function[J]. Oncogene, 2015,34(33):4333-4346.
[18] Liu H, Ren G, Zhu L, et al. The upregulation of miRNA-146a inhibited biological behaviors of ESCC through inhibition of IRS2[J]. Tumour Biol, 2016,37(4):4641-4647.
[19] Duan JT, Wang XM, Zhang SQ, et al. Effect of RhoA gene silencing on proliferation and migration of gastric MGC-803 cells[J]. Int J Clin Exp Med, 2015,8(8):14410-14415.
[20] Dulong C, Fang YJ, Gest C, et al. The small GTPase RhoA regulates the expression and function of the sodium channel Nav1.5 in breast cancer cells[J]. Int J Oncol, 2014,44(2):539-547.
10.3969/j.issn.1002-266X.2017.32.013
R734.2
A
1002-266X(2017)32-0045-04
2017-01-09)

