基于SNP标记的桃矮化基因精细定位
鲁振华,牛良,张南南,姚家龙,崔国朝,曾文芳,潘磊,王志强
(1中国农业科学院郑州果树研究所/国家桃葡萄品种改良中心/农业部果树育种技术重点实验室,中国郑州 450009;2新西兰植物与食品研究所,新西兰 Auckland 1142)
园艺
基于SNP标记的桃矮化基因精细定位
鲁振华1,牛良1,张南南1,姚家龙2,崔国朝1,曾文芳1,潘磊1,王志强1
(1中国农业科学院郑州果树研究所/国家桃葡萄品种改良中心/农业部果树育种技术重点实验室,中国郑州 450009;2新西兰植物与食品研究所,新西兰 Auckland 1142)
【目的】矮化型桃树体矮小、节间短,是盆栽观赏和砧木育种的重要遗传资源。明确矮化性状形成的遗传机制并对桃矮化基因进行精细定位,是建立目标性状分子辅助选种体系和遗传改良的前提,可为有目标的选育矮化观赏桃和砧木品种奠定基础。【方法】以‘05-2-144’(‘97矮’ב鸳鸯垂枝’桃)套袋自交获得的395个后代单株构建的分离群体为材料。参考桃基因组信息并基于Sanger技术开发的SNP标记对亲本和后代单株进行分析,在扩大群体单株中进行连锁关系分析,确定连锁的SNP标记,初步定位目标基因。在定位区域内基于二代测序技术开发更多的基因型和表型一致的SNP标记,对后代单株进行基因分型,完成目标性状的精细定位。然后在精细定位区域内开发SNP标记,即杂交群体双亲均为Aa杂合基因型,对‘10-7’ב96-5-1’杂交后代89个单株进行分子鉴定,以验证基因定位结果的准确性。【结果】通过对桃单株‘05-2-144’自交后代实生苗表型鉴定表明,普通型和矮化型单株数分别为300株和95株,性状分离比例接近3∶1(P值为0.67;χ2为0.19),符合孟德尔遗传规律,桃矮化性状受隐性单基因控制。用于分子鉴定的单株来源于‘10-7’(普通型)ב96-5-1’(普通型)杂交组合,共获得89个后代单株,其中普通型66株;矮化型23株(P值为0.854;χ2为0.034)。基于Sanger测序技术开发了SNP标记,在桃基因组数据库Pp06上25 230 425 bp和27 191 090 bp处获得了连锁的SNP标记,且目标基因位于这两个标记的右侧,初步获得了连锁的SNP分子标记。在此基础上,对亲本进行66.89X深度测序,继续开发符合Aa杂合基因型的SNP标记位点。根据参考基因组和物理距离区间共设计了15对SNP引物,其中12对引物与重测序结果中SNP的类型一致,3对引物与重测序结果中SNP的类型不一致,连锁标记的基因分型成功率为80.0%。通过基于SNP基因分型分析,最终完成了目标性状的精细定位,位点位于Pp06的28 712 165 bp(引物为JXSNP-5)和28 899 661 bp(引物为JXHRM-SNP-3)之间,遗传距离分别为0.38 cM和0.13 cM,物理距离约为277 kb,精细定位区域内有54个已知转录本。在定位区域内桃基因组Pp06的28 108 436 bp处和29 247 763 bp处开发 SNP标记用于杂交后代表型的鉴定,结果表明所有后代单株基因型和表型鉴定结果完全一致,鉴定准确率为100%。【结论】本研究精细定位了桃矮化基因,物理距离约为277 kb,为基因克隆、亲本早期筛选以选育矮化观赏桃和砧木品种等奠定了基础。
桃;矮化基因;SNP;精细定位
Abstract:【Objective】 Dwarfing peach, due to the small trees, shorter internodes, is an important genetic resources in ornamental and rootstock breeding program. The fine mapping of peach dwarfing genes and explication of the genetic mechanism will provide a basis for the establishment of a molecular-assisted selection system and desired variety improvement, which could be used in breeding dwarf ornamental peach and rootstock varieties. 【Method】 Based on the results of genetic analysis in this study, 395 individuals generated from a self-pollinated population of 05-2-144 were selected for fine mapping the dwarfing gene in peach (Prunus persica (L.) Batsch). By referencing the peach genome sequence, SNP markers were developed in the parents and progenies to generate markers linked to the locus and used to map the gene based on Sanger sequencing. Subsequently, the parent was resequenced to generate SNP markers in the mapping region and acquire heterozyous SNPs for fine mapping. Within the fine mapping region, SNP primers were designed to verify the phenotype of 89 individuals generated from the F1segregation population of 10-7×96-5-1.【Result】The segregating population of 05-2-144 was generated to assess the genetic characteristics,resulting in observed 3:1 (300 standard type and 95 dwarfing type individuals) Mendelian ratio fitting with the expected ratio for a monogenic recessive genetic control (P=0.67, χ2=0.19). Moreover, the ratio of standard type to dwarf type corresponded to the expected 3:1 (66 standard type and 23 dwarfing type individuals) segregation (P=0.854, χ2=0.034) for molecular detection. Based on Sanger sequencing results, the linked SNP markers were identified in the position 25 230 425 bp and 27 191 090 bp on Pp06 of peach genome and the locus were on the right side of these two markers. For fine mapping, the parent of this segregation population was resequenced with 66.89X depth and identified the heterozygous SNP to develop SNP markers. Totally, fifteen SNP primers were designed and 12 SNPs (80.0%) were consistent with resequencing data. The dwarfing locus of this type was narrowed on Pp06 between the position 28 712 165 bp and 28 899 661 bp with genetic distances of 0.38 cM and 0.13 cM. The physical region of fine mapping was 277 kb containing 54 known transcripts. Within 28 108 436bp and 29 247 763 bp on Pp06,SNP markers were developed and detected the progeny phenotype of a segregation population of 10-7×96-5-1 with 100%accuracy, constituted of 89 individuals. 【Conclusion】 The dwarfing gene was fine mapped on Pp06 within a physical distance 277 kb. The results of this study will be helpful to clone dwarfing gene and select parents for breeding dwarfing ornamental peach and rootstock varieties.
Key words:peach; dwarfing gene; SNP; fine mapping
0 引言
【研究意义】桃[Prunus persica (L.)Batsch]是中国栽培面积较大的落叶果树之一。2014年中国桃栽培面积约799 500 hm2,居世界桃栽培第一位(FAO)。其中,矮化型桃因其节间短、成花好是观赏桃和砧木育种的发展方向之一。通过对桃矮化基因进行精细定位是建立目标性状分子辅助选种体系和品种改良的基础。【前人研究进展】中国是桃起源中心,具有丰富的遗传资源。作为重要的农艺性状之一,树型种类多样,包括普通生长型(Standard type)、柱型(Pillar type)、半矮生型(Semi-dwarf type)、垂枝型(Weeping type)、直立型(Upright type)、短枝型(Spur type)和矮化型(Dwarf type)等几类[1]。其中,矮化型桃的明显特征是节间长度极短、树冠密。LAMMERTS[2]最早报道了来源中国的矮化桃遗传资源,之后多位科研人员开始了一系列的研究[3],并育成了不少矮化桃品种,如‘Bonfire’‘Leprechaun’等[4]。国内育种家同步选育了矮化观赏型桃品种,宗学普等[5]开展了桃矮化品种的选育,选出的矮化油桃新品系‘矮丽红’。YAMAMOTO等[6]是最早开展桃矮化基因的定位工作,将控制桃矮化的 dw定位在连锁群 6的前端。HOLLENDER等[7]采用重测序的方法将来源日本观赏桃的 dw进行定位,获得了编码赤霉素受体的候选基因(GID1c)。【本研究切入点】矮化型桃有多种类型,由于树体矮小,是盆栽观赏和砧木的重要育种资源。虽然,我国拥有重要的矮化性状遗传资源,但是桃矮化基因定位研究工作开展较少,相关的分子辅助选种体系还没有建立。【拟解决的关键问题】本研究以来源中国的矮化桃品种为材料,通过构建杂交群体对控制桃矮化性状基因进行精细定位,获得紧密连锁的SNP标记,为建立目标性状的分子鉴定体系,有目的选育矮化观赏桃和砧木品种奠定基础。
1 材料与方法
田间试验于 2014—2016年在中国农业科学院郑州果树研究所新乡试验基地(河南新乡)进行,室内试验在中国农业科学院郑州果树研究所农业部果树育种技术重点实验室(河南郑州)进行。
1.1 研究材料
根据该矮化性状的遗传特征,以单株‘05-2-144’为亲本自交构建分离群体,其中‘05-2-144’来源于2005年‘97矮’(矮化型)ב鸳鸯垂枝’桃(非矮化型)杂交单株。于 2014年和 2015年分别以‘05-2-144’为亲本自交,共获得 395个后代单株。用于分子鉴定的亲本为‘10-7’(普通型)ב96-5-1’(普通型),双亲均来源于97矮毛桃,共获得89个后代单株;2个组合的后代桃核经自然干燥后用锤子将外壳敲开,取种子进行包衣(包衣剂,先正达),晾干后,放于湿润的粗砂中进行层积处理,次年1月取出萌发的种子,种植于穴盘中用于表型观察和后续研究。
1.2 基因组DNA的提取
基因定位亲本和自交后代单株叶片基因组 DNA的提取采用 CTAB法[8],略作修改。获得沉淀 DNA后,加入200 μL体积的0.1×TE溶解沉淀DNA,同时加入0.5 μL的RNase,去除RNA污染(长期保存在-20℃冰箱,常用则存于4℃冰箱)。采用NanoDrop 1000 spectrophotometer(Themo)和1%的琼脂糖胶检测DNA的纯度浓度和完整度,稀释成工作液浓度(25 ng·μL-1)备用。自交亲本提取DNA纯化后送样建库。
1.3 基于Sanger测序SNP标记的开发
参考桃基因组序列信息(Genome Database for Rosaceae数据库Version 2.0)中桃基因组Pp 01—08,采用 primer3Web Version 4.0(http://primer3.ut.ee/)设计引物,约每1—2 Mb设计1对引物,引物退火温度在 59—63℃,引物长度20—23 bp,引物扩增片段长度为1 600 bp或750 bp左右。基于Sanger测序开发基因型和表型一致的SNP标记,用于目标基因的定位。
1.4 基于二代测序SNP标记的开发
构建好文库后对亲本‘05-2-144’进行深度测序,在仪器HiSeq 4000(Illumina,CA)上进行,测序深度约为70X。在定位区域内采用Integrative Genomics Viewer 2.3(IGV)对Bam格式数据进行分析[9],确定目标区域内基因型为Dwdw的SNP,以设计候选标记,用于连锁SNP标记的开发。
1.5 基于HRM技术的SNP基因分型
根据深度测序的结果设计引物。采用HRM master mix(Roche)试剂进行 PCR 扩增,反应总体积为 15 μL。其中含15 ng模板DNA、0.17 μmol·L-1正/反引物和1μL HRM master荧光染料(Roche)。在罗氏LightCycler 480II定量PCR仪(Roche)进行PCR扩增和HRM分析。高分辨率熔解曲线分析采用Gene Scanning软件(version1.50),具体参考鲁振华等[10]。
1.6 矮化性状的精细定位与验证
根据表型鉴定结果,在矮化型和普通型各两个子代和亲本中寻找连锁的 SNP标记。具体基因型表现为,自交亲本单株‘05-2-144’基因型为Dwdw,矮化型子代基因型为 dwdw,普通型子代基因型为 DwDw和Dwdw,在4个子代中获得连锁的SNP标记后,扩大至分离后代各20个单株中,确定连锁后进一步扩大至全部样品,完成初步定位。同时结合亲本二代测序结果开发的 SNP标记,在群体所有后代单株中进行SNP分析,确定交换单株并获得紧密连锁的 SNP标记。遗传距离的计算采用 JoinMap(3.0)[11],以 F2群体方法进行遗传距离计算,参数设置为默认。
2 结果
2.1 杂交群体表型鉴定和遗传特征分析
通过对‘05-2-144’自交后代实生苗观察,2014年得到102株杂种苗,其中普通型和矮化型分别为78株和24株,二者比例接近3∶1(P值为0.732;χ2为0.118)。为进一步对目标基因进行精细定位,于2015年进行了自交,共得到293株自交后代单株,对其进行目测观察,区分普通型和矮化型幼苗分开定植。其中普通型222株,矮化型71株,二者比例接近3∶1(P值为0.761;χ2为0.092)。用于分子鉴定的单株来源于‘10-7’(普通型)ב96-5-1’(普通型)杂交组合,共获得89个后代单株,其中普通型 66株;矮化型 23株(P值为 0.854;χ2为0.034)。目标性状分离比例符合孟德尔遗传规律,矮化性状受隐性单基因控制。同时对定植2年后植株表型进行了再鉴定,幼苗与定植后2年植侏表型观察结果一致(图1)。
2.2 矮化基因的初步定位
参考桃基因组(https://www.rosaceae.org/gb/gbrowse/prunus_persica_v2.0.a1/ Version 2.0)序列信息,设计了桃基因组Pp 01—08的引物,约每1—2 Mb设计1对引物,引物扩增片段长度为1 600 bp或750 bp左右(表1)。基于Sanger测序法获得SNP标记,并根据子代基因型和表型确定候选SNP标记,并在杂交群体后代单株中(普通型和矮化型各 4株)进行序列测定获得多态性的SNP标记进行初步分析。在Pp06的25 230 425 bp和27 191 090 bp处找到了可能连锁的SNP标记。在获得可能的 SNP标记后扩大了杂交群体,在普通型和矮化型各20个后代单株中进一步验证连锁关系,进而在全部样品中验证。通过扩大群体分析,在 Pp06 上 25 230 425 bp(LG6-25.2)和 27 191 090 bp(LG6-27)处获得了与dw连锁的SNP标记,根据重组单株以及重组单株数目的变化表明,目标基因位于获得的两个标记右侧。

图1 普通型桃(左)和矮化型桃(右)植株表型Fig. 1 Phenotype of standard type (left) and dwarf type (right)peach
2.3 矮化基因的精细定位
在初步获得连锁的SNP分子标记后,对亲本进行深度测序。根据亲本‘05-2-144’基因型和表型开发更多Aa基因型的SNP标记。后扩大分离群体进行连锁关系验证,以获得紧密连锁的 SNP标记。亲本‘05-2-144’测序共产生Raw data 17.956 Gb,过滤后的Clean data 17.098 Gb,测序质量较高,其中Q20≥94.9%,Q30≥88.57%,全基因组GC含量为39.04%。参考基因组大小为227 411 381 bp,所有样本的比对率为 96.71%,对参考基因组(排除 N区)的平均覆盖深度为66.89X,1X覆盖度(至少有一个碱基的覆盖)在98.77%以上,可用于后续的变异检测及相关分析。根据开发的SNP标记,在参考基因组(Version 2.0)30.003191 Mb处获得了另一侧连锁的SNP标记。基于重测序数据和定位区间,共设计了15对SNP引物,其中12对引物与重测序SNP基因型一致,3对引物与重测序SNP基因型不一致成功率为80.0%(表1)。利用其中SNP标记进行了目标性状的精细定位,在桃基因组Pp06的28 712 165 bp(JXSNP-5)和28 989 661 bp(JXHRM-SNP-3)之间,物理距离区间约为277 kb(图2)。

图2 桃矮化基因的遗传距离分析Fig. 2 Linkage map of dwarfing gene for peach
2.4 精细定位区域的候选基因
参考桃基因组数据库(Version 2.0)在精细定位区域277 kb内,包含已知转录本54个,具体如表2所示。精细定位区域内基因包括螺旋-环-螺旋(bHLH)、DHHC类锌指蛋白、GAG反转座子、信号肽酶、受体类激酶、赤霉素受体(GA不敏感矮化型)、未知功能蛋白等(表2)。其中,GIDC基因可能是候选基因,这与HOLLENDER等[7]报道一致。
2.5 植株表型的分子鉴定
根据已经获得的紧密连锁的 SNP标记的物理位置,并基于参考桃基因组数据在新的亲本(‘10-7’X‘96-5-1’)中开发基因型和表型一致的 SNP标记用于分子鉴定,在精细定位目标基因两翼分别设计1对SNP引物,验证分子标记对杂交后代单株表型鉴定的准确性。其中引物YZ-SNP260k1位于Pp06的28 108 436 bp处,SNP类型为C/T;引物YZ-SNP260k2位于Pp06的29 247 763 bp处,SNP类型为G/A。通过标记基因型和表型比较,89株后代单株的验证符合率为100%(图3)。

表1 本研究所用引物信息Table 1 Primers information used in this study
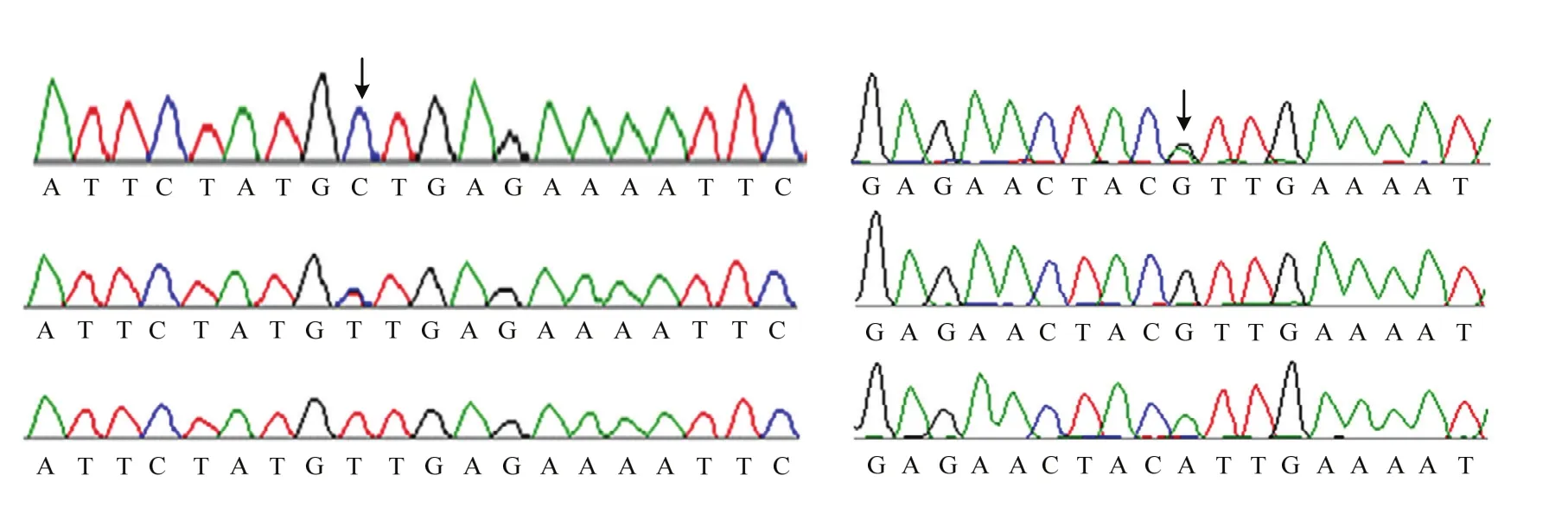
图3 基于SNP标记桃矮化性状的分子鉴定Fig. 3 Dwarfing trait detection for peach based on SNP Marker

表2 精细定位区域内候选基因Table 2 Candidate genes in fine mapping region

续表2 Continued table 2
3 讨论
在遗传图谱构建方面,SNP标记优势突出[12-13]。近年来随着生物技术的进步,特别是基于二代测序的标记技术加速了作物基因的精细定位和分子辅助选种体系的建立[14-17]。建立桃树分子辅助选种体系是实现目标性状早期鉴定的关键环节,可加速育种进程,实现多个优良性状的聚合,提高果树的经济价值。如何准确鉴定目标性状是育种者关心的科学问题。精细定位和克隆目标性状基因是关键,在精细定位区域内开发与目标性状紧密连锁的分子标记,包括 SSR、SNP和 Indel等,而克隆到目标基因是实现对目标性状直接鉴定的重要途径。在桃中,已完成红肉性状[18]、黄/白肉[19-20]、果皮颜色亮度[21]、肉质类型[22]、分枝角度[23]和矮化性状[7]等基因的直接分子鉴定。以上研究为加快桃遗传改良进程奠定了基础。
果树树型性状与果实性状不同,在苗期即可实现部分性状的表型鉴定,但对于隐性单基因和多基因控制的树体性状,很难实现早期的表型鉴定,仍需通过基因定位建立辅助选种体系[22]。果树作物中,苹果最先在生产中利用了柱型性状,实现了高产、高密栽培,兼顾省时和省力[23-27]。对桃树型研究主要集中在株高和节间长度方面[28-30]。YAMAMOTO等[6]将控制桃株高矮化基因定位在 LG6上;张妤艳等[31]采用 Fl杂交分离群体共 123个单株,获得了与矮化性状连锁的SRAP标记,遗传距离3.2 cM。最近,HOLLENDER等[7]采用BSA-seq重测序的方法对来源于日本矮化品种‘Juseito’的BD(Brachytic dwarfism)性状的dw位点进行了定位,获得了候选基因赤霉素受体(GID1c),并验证了基因的功能。尽管功能验证表明GID1c与株高表型有关,但该矮化基因是从900 Kb的定位区间内筛选的候选基因,本研究则提供了进一步的数据支持。本研究定位的 dw基因与日本的矮化品种‘Juseito’的dw位于同一区域,但二者是否存在不同的变异形式以及来源是否相同,仍需进一步研究。
4 结论
本研究对来源‘97矮’桃单株的矮化性状基因进行了精细定位,目标性状位点位于Pp06的28 712 165—28 899 661 bp,物理距离约为277 kb,包含54个已知转录本。在精细定位目标基因两翼分别设计 1对SNP引物,89株后代单株的分子鉴定符合率为100%,研究结果为揭示桃矮化性状的遗传机制并建立目标性状的分子辅助选种体系奠定了基础。
[1]BASSI D, DIMA A, SCORZA R. Tree structure and pruning response of six peach growth forms. Journal of the American Society for Horticultural Science, 1994, 119(3): 378-382.
[2]LAMMERTS W E. The breeding of ornamental edible peaches for mild climates.I. inheritance of tree and flower characters. AmericanJournal of Botany, 1945, 32: 53-61.
[3]SCORZA R. Characterization of four distinct peach tree growth types.Journal of the American Society for Horticultural Science, 1984,109(4): 455-457.
[4]MOORE J N, ROM R C, BROWN S A, KLINGAMAN G L.‘Bonfire’ dwarf peach, ‘Leprechaun’ dwarf nectarine, and ‘Crimson Cascade’ and ‘Pink Cascade’ weeping peaches. Hortscience, 1993,28(8): 854.
[5]宗学普, 张贵荣, 王志强, 刘淑娥. 矮化型油桃新品种-矮丽红. 落叶果树, 1997(2): 26.ZONG X P, ZHANG G R, WANG Z Q, LIU S E. Dwarf nectarine variety - ‘Ailihong’. Deciduous Fruits, 1997(2): 26. (in Chinese)
[6]YAMAMOTO T, SHIMADA T, IMAI T, YAEGAKI H, HAJI T,MATSUTA N, YAMAGUCHI M, HAYASHI T. Characterization of morphological traits based on a genetic linkage map in peach.Breeding Science, 2001, 51: 271-278.
[7]HOLLENDER C A, HADIARTOT, SRINIVASAN C, SCORZA R,DARDICK C. A brachytic dwar fi sm trait (dw) in peach trees is caused by anonsense mutation within the gibberellic acid receptor PpeGID1c.New Phytologist, 2015, 210(1): 227-239.
[8]DOYLE J J, DOYLE J L. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochemical Bulletin, 1987, 19:11-15.
[9]ROBINSON J T, THORVALDSDÓTTIR H, WINCKLER W,GUTTMAN M, LANDER E S, GETZ G, MESIROV J P. Integrative genomics viewer. Nature Biotechnology, 2011, 29: 24-26.
[10]鲁振华, 牛良, 张南南, 崔国朝, 潘磊, 曾文芳, 王志强. 基于HRM获得与桃Tssd紧密连锁的SNP标记. 中国农业科学, 2017,50(8): 1505-1513.LU Z H, NIU L, ZHANG N N, CUI G C, PAN L, ZENG W F, WANG Z Q. SNP marker tightly linked to Tssd for peach using high resolution melting analysis. Scientia Agricultura Sinica, 2017, 50(8):1505-1513. (in Chinese)
[11]VAN OOIJEN J W, VOORRIPS R E. JionMap version 3.0: Software for the calculation of genetic linkage maps. Plant Research International,Wageningen, The Netherlands, 2001.
[12]BALL A, STAPLEY J, DAWSON D, BIRKHEAD T, BURKE T,SLATE J. A comparison of SNPs and microsatellites as linkage mapping markers: Lessons from the zebra finch (Taeniopygia guttata).BMC Genomics, 2010, 11(1): 218.
[13]MARTÍNEZ-GARCÍA P J, PARFITT D E, OGUNDIWIN E A,FASS J, CHAN H M, AHMAD R, LURIE S, DANDEKAR A,GRADZIEL T M, CRISOSTO C H. High density SNP mapping and QTL analysis for fruit quality characteristics in peach (Prunus persica L.). Tree Genetics and Genomes, 2013, 9: 19-36.
[14]TAKAGI H, ABE A, YOSHIDA K, KOSUGI S, NATSUME S,MITSUOKA C, UEMURA A, UTSUSHI H, TAMIRU M, TAKUNO S, INNAN H, CANO L M, KAMOUN S, TERAUCHI R. QTL-seq:rapid mapping of quantitative trait loci in rice by whole genome resequencing of DNA from two bulked populations. The Plant Journal, 2013, 74: 174-183.
[15]ABE A, KOSUGI S, YOSHIDA K, NATSUME S, TAKAGI H,KANZAKI H, MATSUMURA H, YOSHIDA K, MITSUOKA C,TAMIRU M, INNAN H, CANO L, KAMOUN S, TERAUCHI R.Genome sequencing reveals agronomically important loci in rice using MutMap. Nature Biotechnology, 2012, 30(2): 174-179.
[16]李娜, 王吉明, 尚建立, 李楠楠, 徐永阳, 马双武. 西瓜枯萎病生理小种 1抗性 QTL精细定位与 InDel标记开发. 中国农业科学,2017, 50(1): 131-141.LI N, WANG J M, SHANG J L, LI N N, XU Y Y, MA S W.Fine-mapping of QTL and development of InDel markers for Fusarium oxysporum race 1 resistance in watermelon. Scientia Agricultura Sinica, 2017, 50(1): 131-141. (in Chinese)
[17]LU Z H, NIU L, CHAGNÉ D, CUI GG C, PAN L, FOSTER T,ZHANG R P, ZENG W F, WANG Z Q. Fine mapping of the temperature-sensitive semi-dwarf (Tssd) locus regulating the internode length in peach (Prunus persica). Molecular Breeding, 2016, 36: 20.DOI: 10.1007/s11032-016-0442-6.
[18]SHEN Z J, CONFOLENT C, LAMBERT P, POËSSEL J-L,QUILOT-TURION B, YU M L, MA R J, PASCAL T. Characterization and genetic mapping of a new blood-flesh trait controlled by the single dominant locus DBF in peach. Tree Genetics and Genomes,2013, 9: 1435-1446.
[19]ADAMI M, FRANCESCHI P D, BRANDI F, LIVERANI A,GIOVANNINI D, ROSATI C, DONDINI L, TARTARINI S.Identifying a carotenoid cleavage dioxygenase (ccd4) gene controlling yellow/white fruit flesh color of peach. Plant Molecular Biology Reporter, 2013, 31(5): 1166-1175.
[20]MA J J, LI J, ZHAO J B, ZHOU H, REN F, WANG L, GU C, LIAO L,HAN Y P. Inactivation of a gene encoding carotenoid cleavage dioxygenase (CCD4) leads to carotenoid-based yellow coloration of fruit flesh and leaf midvein in Peach. Plant Molecular Biology Reporter, 2014, 32(4): 246-257.
[21]BRETÓ M P, CANTÍN C M, IGLESIAS I, ARÚS P, EDUARDO I.Mapping a major gene for red skin color suppression (highlighter) in peach. Euphytica, 2017, 213: 14. DOI: 10.1007/s10681-016-1812-1.
[22]PAN L, ZENG W F, NIU L, LU Z H, WANG X B, LIU H, CUI G C,ZHU Y Q, CHU J F , LI W P, FANGWC, CAI Z G, LI G H, WANG Z Q. PpYUC11, a strong candidate gene for the stony hard phenotype in peach (Prunus persica L. Batsch), participates in IAA biosynthesis during fruit ripening. Journal of Experimental Botany, 2015. Doi:10.1093/jxb/erv400.
[23]DARDICK C, CALLAHAN A, HORN R, RUIZ KB, ZHEBENTYAYEVA T, HOLLENDER C, WHITAKER M, ABBOTT A, SCORZA R.PpeTAC1 promotes the horizontal growth of branches in peach trees and is a member of a functionally conserved gene family found in diverse plants species. The Plant Journal, 2013, 75: 618-630.
[24]OTTO D, PETERSEN R, BRAUKSIEPE B, BRAUN P, SCHMIDT E R. The columnar mutation (‘Co gene’) of apple (Malus × domestica)is associated with an integration of a Gypsy-like retrotransposon.Molecular Breeding, 2013, 33(4): 863-880.
[25]MORIYA S, OKADA K, HAJI T, YAMAMOTO T, ABE K. Fine mapping of Co, a gene controlling columnar growth habit located on apple (Malus × domestica Borkh.) linkage group 10. Plant Breeding,2012, 131(5): 641-647.
[26]OGNJANOV V, VUJANIC-VARGA D, GASIC K. Breeding columnar apples in Novi Sad. Acta Horticulturae, 1999, 484: 207-209.
[27]MORIYA S, IWANAMI H, KOTODA N, TAKAHASHI S,YAMAMOTO T, ABE K. Development of a marker-assisted selection system for columnar growth habit in apple breeding. Journal of the Japanese Society for Horticultural Science, 2009, 78: 279-287.
[28]VERDE I, BASSIL N, SCALABRIN S, GILMORE B, LAWLEY C T.Correction: Development and evaluation of a 9K SNP array for peach by internationally coordinated SNP detection and validation in breeding germplasm. PLoS ONE, 2012, 7(6): e35668. DOI: 10.1371/journal.pone.0035668.
[29]CANTÍNA C M, CRISOSTOB C H, OGUNDIWINB E A,GRADZIELB T, TORRENTSC J, MORENOA M A, GOGORCENA Y. Chilling injury susceptibility in an intra-speci fi c peach [Prunus persica (L.) Batsch]progeny. Postharvest Biology and Technology,2010, 58: 79-87.
[30]VERDE I, QUARTA R, CEDROLA C, DETTORI M T. QTL analysis of agronomic traits in a BC1 peach population. Acta Horticulturae, 2002,592: 291-297.
[31]张妤艳, 俞明亮, 马瑞娟, 蔡志翔, 沈志军, 许建兰. 与桃树性高/矮性状相关的SRAP标记. 果树学报, 2011, 28(4): 586-590.ZHANG Y Y, YU M L, MA R J, CAI Z X, SHEN Z J, XU J L.Identification of SRAP markers linked to peach gene with the character of tall normal/brachytic dwarf. Journal of Fruit Science,2011, 28 (4): 586-590. (in Chinese)
(责任编辑 赵伶俐)
Fine Mapping of Dwarfing Gene for Peach Based on SNP Markers
LU ZhenHua1, NIU Liang1, ZHANG NanNan1, YAO JiaLong2, CUI GuoChao1, ZENG WenFang1,PAN Lei1, WANG ZhiQiang1
(1Zhengzhou Fruit Research Institute, Chinese Academy of Agricultural Sciences/National Peach and Grape Improvement Center/Key Laboratory of Fruit Breeding Technology of Ministry of Agriculture, Zhengzhou 450009, China;2The New Zealand Institute for Plant & Food Research Limited, Auckland 1142, New Zealand)
2017-05-02;接受日期:2017-07-25
国家自然科学基金(31500558)、中国农业科学院创新工程(CAAS-ASTIP-2017-ZFRI)、中央级科研院所基本科研业务费专项(1610192017702)
联系方式:鲁振华,Tel:0371-55001909;E-mail:luzhenhua@caas.cn。通信作者王志强,Tel:0371-65330988;E-mail:wangzhiqiang@caas.cn

