过敏性鼻炎合并哮喘患者血液嗜酸性粒细胞富集群中IL-18、IL-18BP及IL-18R的表达*
王 玲,胡雅琳,杨蕊铭,王君灵,张慧云,何韶衡#
1)锦州医科大学附属第一医院变态反应与临床免疫研究中心 辽宁锦州 121001 2)苏州市相城人民医院中心实验室 江苏苏州 215100
过敏性鼻炎合并哮喘患者血液嗜酸性粒细胞富集群中IL-18、IL-18BP及IL-18R的表达*
王 玲1),胡雅琳1),杨蕊铭1),王君灵1),张慧云1,2)#,何韶衡1)#
1)锦州医科大学附属第一医院变态反应与临床免疫研究中心 辽宁锦州 121001 2)苏州市相城人民医院中心实验室 江苏苏州 215100
过敏性鼻炎合并哮喘;嗜酸性粒细胞;IL-18;IL-18BP;IL-18R
目的:检测过敏性鼻炎合并哮喘(AR+AS)患者血液嗜酸性粒细胞富集群中IL-18、IL-18BP和IL-18R的表达。方法采集13例AR+AS患者和14名健康人(正常对照组)外周静脉血,用流式细胞术检测静息状态下和过敏原(大籽蒿花粉、尘螨和梧桐花粉过敏原粗提液)刺激后嗜酸性粒细胞富集群中IL-18+、IL-18BP+和IL-18R+细胞比例及平均荧光强度(MFI),分析其相关性。结果与正常对照组相比,静息状态下AR+AS患者嗜酸性粒细胞富集群中IL-18+和IL-18BP+细胞比例分别升高了5.821倍(P=0.001)和44.1%(P=0.048),IL-18+细胞MFI增强了29.1%(P=0.001),IL-18BP+细胞MFI降低了32.3%(P<0.001),而IL-18R+细胞比例及MFI无明显变化(P>0.05)。过敏原刺激对AR+AS患者嗜酸性粒细胞富集群中IL-18、IL-18BP及IL-18R的表达无影响(P>0.05)。AR+AS患者血液嗜酸性粒细胞富集群中IL-18+和IL-18BP+细胞比例呈中度相关(r=0.622,P<0.001)。结论嗜酸性粒细胞源的IL-18和IL-18BP可能在AR+AS中起重要作用。
支气管哮喘和过敏性鼻炎均为呼吸道常见的过敏性疾病,二者常常同时存在并相互影响,严重威胁人类健康。嗜酸性粒细胞是终末分化的粒细胞,在过敏性疾病的发病机制中起重要作用[1-2]。研究[3]发现,肺组织嗜酸性粒细胞募集可直接诱导炎症反应、器官功能障碍和组织重塑。此外,也有嗜酸性粒细胞参与鼻炎发病机制的报道[4],提示嗜酸性粒细胞在哮喘和鼻炎中起重要作用。白细胞介素(interleukin,IL)-18是IL-1超家族的成员[5]。研究[6]报道,IL-18可诱导嗜酸性粒细胞产生强效趋化因子IL-8进而诱导过敏反应的发生;致死性哮喘患者的肺部高表达IL-18和IL-18受体(IL-18R)[7];儿童哮喘患者血清IL-18水平显著升高[8];过敏性鼻炎患者血浆IL-18水平升高[1]。IL-18结合蛋白(IL-18 binding protein,IL-18BP)是IL-18的内源性拮抗剂,可抑制IL-18与其受体结合[9]。目前尚未开展过敏原对AR+AS患者嗜酸性粒细胞IL-18、IL-18R和IL-18BP表达影响的相关研究。作者观察了过敏性鼻炎合并哮喘(AR+AS)患者静息状态下和过敏原刺激后外周血嗜酸性粒细胞IL-18、IL-18R和IL-18BP表达的变化,为以后探讨二者在AR+AS中的作用提供方向。
1 材料与方法
1.1材料主要试剂:PE/Cy7-CD14、PerCP-CD16、Zombie Aqua Fixable Viability Kit、BV510-驴抗兔IgG抗体、FcR阻断剂、红细胞裂解液、布雷非德菌素A(BFA)购自Biolegend(USA),PE-IL-18、APC-IL-18R购自R&D Systems(USA),兔抗人IL-18BP购自Abcam(UK),大籽蒿花粉、尘螨和梧桐花粉过敏原粗提液购自北京新华联协和药业有限责任公司(中国),PBS购自Solarbio(USA),Cytofix/CytopermTM固定/透膜试剂盒购自BD Biosciences Pharmigen(USA),皮肤点刺试验过敏原购自ALK-ABELLO(Denmark),其他常用化学试剂均为分析纯。主要仪器:低温高速离心机(Thermo Scientific, USA),水浴锅(精宏,中国),FACSVerse流式细胞仪(BD Biosciences, USA)。
1.2研究对象和样本采集13例AR+AS患者,其中女11例,男2例,中位年龄51 (9~61)岁,发病中位年龄38(3~55)岁,中位病史3(0.2~30.0) a;大籽蒿花粉过敏原粗提液阳性9例,尘螨过敏原粗提液阳性10例,梧桐花粉过敏原粗提液阳性5例。正常对照为体检健康者14人,男3人,女11人,中位年龄26(23~29)岁。研究获得了锦州医科大学附属第一医院伦理委员会的批准,每位志愿者均签订了知情同意书。2组研究对象均进行皮肤点刺试验。AR的诊断符合2015年美国耳鼻咽喉头颈外科学会专家组发布的临床实践指南[10],AS的诊断符合2015年全球哮喘防治创议(Global Initiative for Asthma, GINA)诊断标准。所有患者至少2周前停止服用抗过敏药物,至少1个月内无呼吸道感染的症状。每位研究对象均采集10 mL外周静脉血,加入到含EDTA抗凝剂的采血管中,用于以下试验。
1.3血液嗜酸性粒细胞富集群IL-18、IL-18BP和IL-18R的检测全血分别加入BFA、大籽蒿花粉、尘螨和梧桐花粉过敏原粗提液(终质量浓度为1.0 mg/L),37 ℃水浴振荡孵育1 h;1 400 r/min离心后弃上清液,加入死细胞去除染料和FcR阻断剂,混匀后,避光孵育15 min,加入抗CD14、CD16和IL-18R抗体,避光孵育15 min后裂解红细胞,离心后用固定/透膜液固定细胞,然后加入抗IL-18和抗IL-18BP抗体孵育,透膜洗液清洗后加入BV510-驴抗兔IgG抗体,最后上流式细胞仪检测IL-18+、IL-18BP+和IL-18R+细胞比例及平均荧光强度(MFI)。
1.4统计学处理用SPSS 13.0 分析数据。用非参数Kruskal-WallisH检验分析静息状态和不同过敏原刺激后2组研究对象血液嗜酸性粒细胞富集群中IL-18+、IL-18BP+和IL-18R+细胞的比例和MFI的差异,组间差异有统计学意义者用Mann-WhitneyU进一步比较。用秩相关系数分析AR+AS患者嗜酸性粒细胞富集群中IL-18+、IL-18BP+和IL-18R+细胞比例之间的相关性。检验水准α=0.05。
2 结果
2.1 2组嗜酸性粒细胞富集群中IL-18+、IL-18BP+及IL-18R+细胞比例的比较结果见表1~3。与正常对照组比较,AR+AS患者静息状态下嗜酸性粒细胞富集群中IL-18+细胞比例升高了约5.821倍,IL-18BP+细胞的比例升高约44.1%,IL-18R+细胞比例无明显变化。而过敏原刺激不影响AR+AS患者和正常对照组血液嗜酸性粒细胞富集群IL-18+、IL-18BP+及IL-18R+细胞比例。
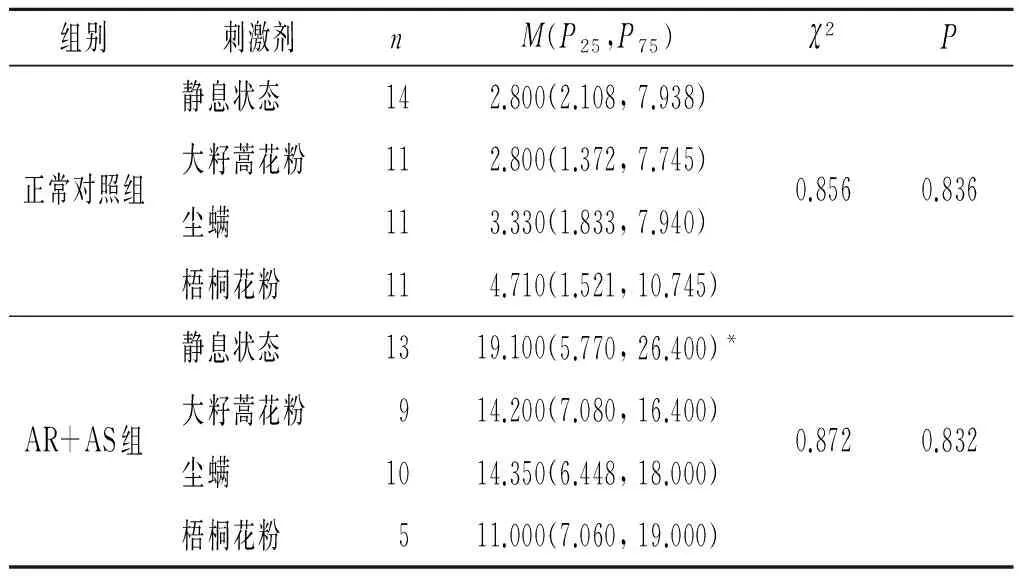
表1 2组静息状态和过敏原刺激后嗜酸性粒细胞富集群中IL-18+细胞的比例 %
*:与正常对照组静息状态相比,P=0.001。
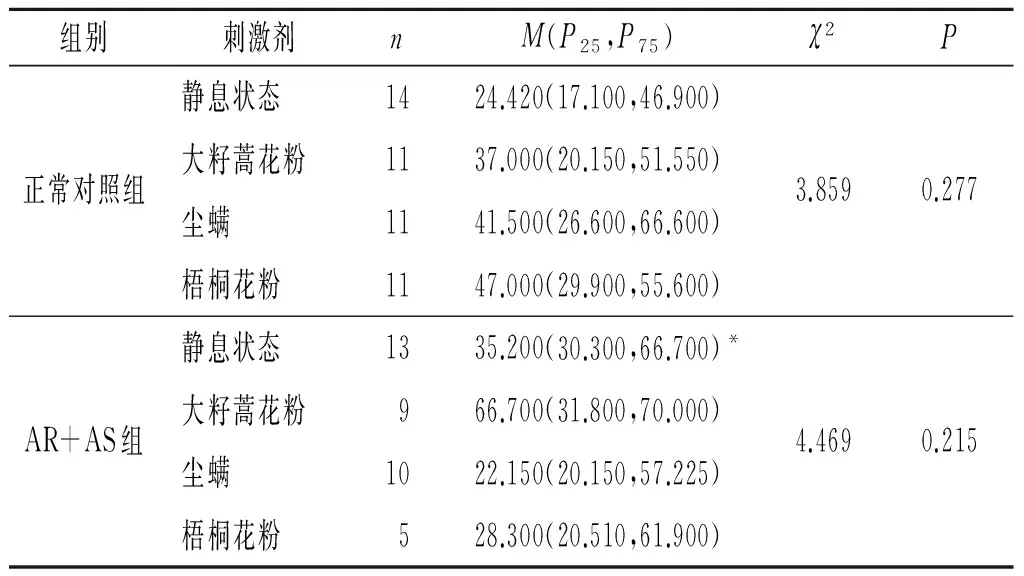
表2 2组静息状态和过敏原刺激后嗜酸性粒细胞富集群中IL-18BP+细胞的比例 %
*:与正常对照组静息状态相比,P=0.048。
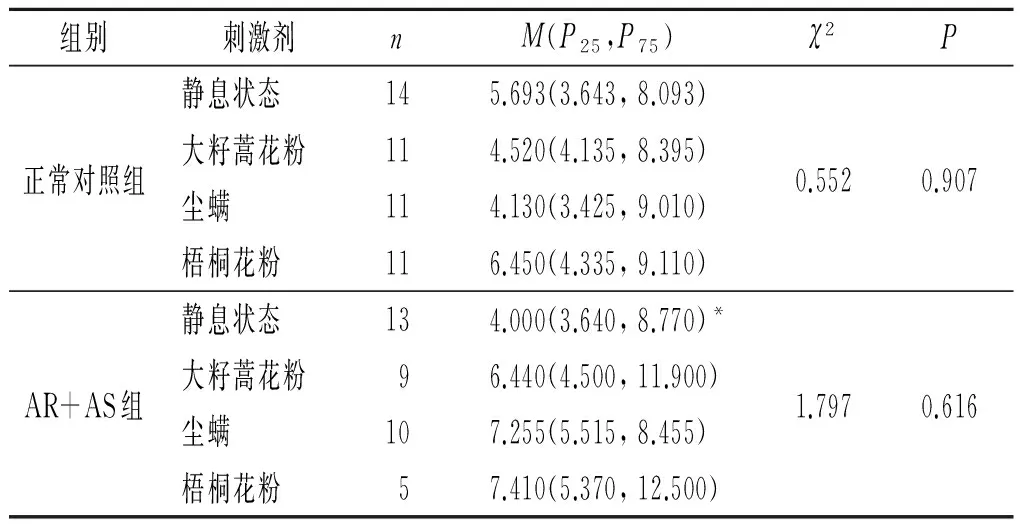
表3 2组静息状态和过敏原刺激后嗜酸性粒细胞富集群中IL-18R+细胞的比例 %
*:与正常对照组静息状态相比,P>0.05。
2.2 2组嗜酸性粒细胞富集群中IL-18+、IL-18BP+及IL-18R+细胞MFI比较结果见表4~6。与正常对照组比较,AR+AS患者静息状态下嗜酸性粒细胞富集群中IL-18+细胞的MFI升高了约29.1%,IL-18BP+细胞的MFI降低了约32.3%,而IL-18R+细胞的MFI无明显变化。此外,大籽蒿花粉、尘螨和梧桐花粉过敏原粗提液均可诱导正常对照组IL-18BP+细胞的MFI降低。
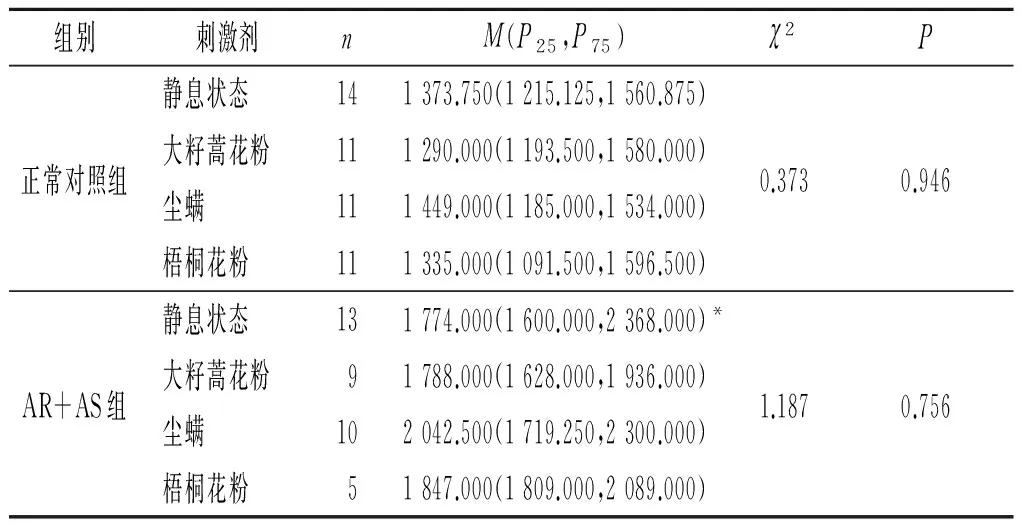
表4 2组静息状态和过敏原刺激后嗜酸性粒细胞富集群中IL-18+细胞的MFI
*:与正常对照组静息状态相比,P=0.001。
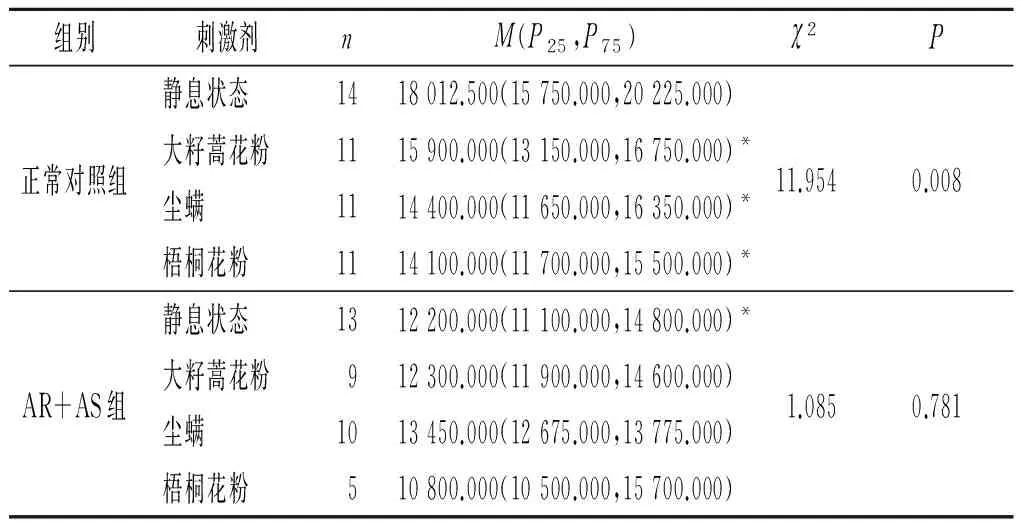
表5 2组静息状态和过敏原刺激后嗜酸性粒细胞富集群中IL-18BP+细胞的MFI
*:与正常对照组静息状态相比,P<0.001。
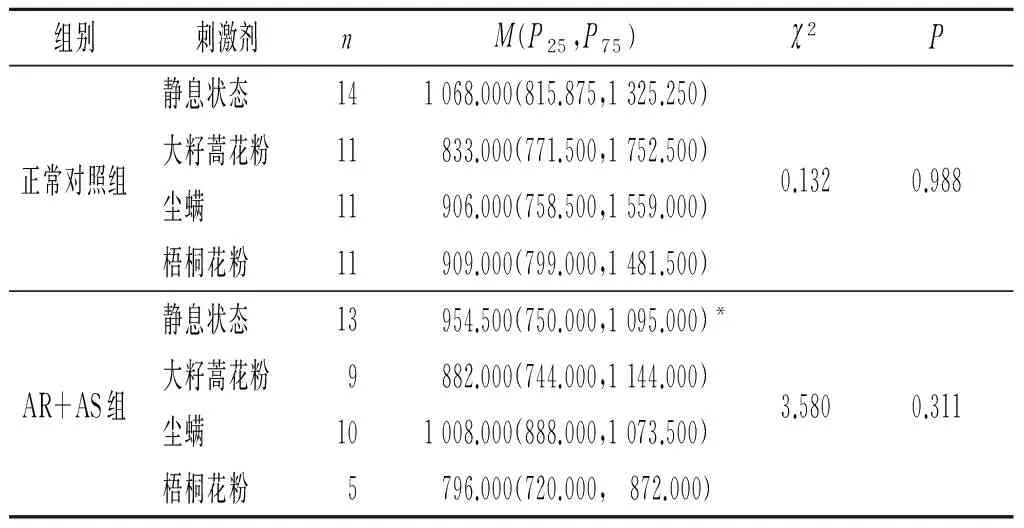
表6 2组静息状态和过敏原刺激后嗜酸性粒细胞富集群中IL-18R+细胞的MFI
*:与正常对照组静息状态相比,P>0.05。
2.3AR+AS患者嗜酸性粒细胞群富集群中IL-18+细胞比例和IL-18BP+细胞比例的关系静息状态下,AR+AS患者嗜酸性粒细胞富集群中IL-18BP+和IL-18+细胞比例呈中度相关,r=0.662,P<0.001。
3 讨论
AR+AS是一种累及上下呼吸道的气道炎症性疾病。有研究[1]报道过敏性鼻炎患者血浆IL-18水平升高,此外哮喘患者血浆IL-18水平升高[11],结合研究中AR+AS患者血液嗜酸性粒细胞富集群中IL-18+阳性细胞的比例升高,提示气道炎症性疾病患者血浆IL-18水平的升高可能与嗜酸性粒细胞有关。IL-18作为一种炎性细胞因子,可诱导嗜酸性粒细胞产生强效趋化因子IL-8[6]进而诱导过敏反应的发生[12];高水平的IL-18可上调特异性IgE生成,并可诱导Th2细胞因子如IL-4、IL-5和IL-13等的分泌;IL-18水平与过敏性疾病的严重程度高度相关[13-14]。
IL-18通过与细胞表面的IL-18R相互作用在机体防御及致病过程发挥其生物学功能。研究[15]报道儿童哮喘患者肺组织中嗜酸性粒细胞增多并伴有IL-18R表达增加。有研究[16]发现OVA致敏鼠腹腔注射IL-18可诱导肥大细胞表达IL-18R。然而,该研究发现与正常对照相比,AR+AS患者血液嗜酸性粒细胞IL-18+阳性细胞的比例虽升高,但嗜酸性粒细胞IL-18R+阳性细胞的比例与正常对照组相比,差异并无统计学意义,提示嗜酸性粒细胞分泌的IL-18可能通过组织的肥大细胞和嗜酸性粒细胞表面的IL-18R在AR+AS中起重要作用,其具体机制尚需进一步研究。
IL-18BP是IL-18的内源性拮抗剂[9],可与IL-18结合而降低自身的生物学活性。该研究发现AR+AS患者血液IL-18BP+嗜酸性粒细胞的比例较正常对照组升高,但远低于IL-18的升高水平;同时AR+AS患者嗜酸性粒细胞富集群中IL-18+细胞MFI增强,IL-18BP+细胞MFI降低,提示IL-18和IL-18BP表达之间的不平衡可能诱导AR+AS,进而为AR+AS的治疗提供了新思路。此外,研究还发现AR+AS患者嗜酸性粒细胞富集群中IL-18+阳性细胞比例和IL-18BP+阳性细胞比例中度相关(r=0.662),提示高水平的IL-18可诱导嗜酸性粒细胞合成IL-18BP。
综上所述,嗜酸性粒细胞源的IL-18和IL-18BP可能在AR+AS中起重要作用。
[1] LUCAS CD,DORWARD DA,SHARMA S,et al.Wogonin induces eosinophil apoptosis and attenuates allergic airway inflammation[J].Am J Respir Crit Care Med,2015,191(6):626
[2] GANGWAR RS,FRIEDMAN S,SEAF M.Mast cells and eosinophils in allergy: Close friends or just neighbors[J].Eur J Pharmacol,2016,778:77
[3] FULKERSON PC,ROTHENBERG ME.Targeting eosinophils in allergy, inflammation and beyond[J].Nat Rev Drug Discov,2013,12(2):117
[4] EL-SHAZLY AE,RONCARATI P,LEJEUNE M,et al.Tyrosine kinase inhibition is an important factor for gene expression of CRTH2 in human eosinophils and lymphocytes: A novel mechanism for explaining eosinophils recruitment by the neuro-immune axis in allergic rhinitis[J].Int Immunopharmacol,2017,45:180
[5] KAWAYAMA T,OKAMOTO M,IMAOKA H,et al.Interleukin-18 in pulmonary inflammatory diseases[J].J Interferon Cytokine Res,2012,32(10):443
[6] WANG W,TANAKA T,OKAMURA H,et al.Interleukin-18 enhances the production of interleukin-8 by eosinophils[J].Eur J Immunol,2001,31(4):1010
[7] XU D,CHAN WL,LEUNG BP,et al.Selective expression and functions of interleukin 18 receptor on T helper (Th) type 1 but not Th2 cells[J].J Exp Med,1998,188(8):1485
[8] SIMS JE,SMITH DE.The IL-1 family: regulators of immunity[J].Nat Rev Immunol,2010,10(2):89
[9] SAWADA M,KAWAYAMA T,IMAOKA H,et al.IL-18 induces airway hyperresponsiveness and pulmonary inflammation via CD4+T cell and IL-13[J].PLoS One,2013,8(1):e54623
[10]SEIDMAN MD,GURGEL RK,LIN SY,et al.Clinical practice guideline: allergic rhinitis executive summary[J].Otolaryngol Head Neck Surg,2015,152(2):197
[11]BLOM L,POULSEN LK.IL-1 family members IL-18 and IL-33 upregulate the inflammatory potential of differentiated human Th1 and Th2 cultures[J].J Immunol,2012,189(9):4331
[12]PORTER LM,COWBURN AS,FARAHI N,et al.Hypoxia causes IL-8 secretion, Charcot Leyden crystal formation, and suppression of corticosteroid-induced apoptosis in human eosinophils[J].Clin Exp Allergy,2017,47(6):770
[13]DINARELLO CA,NOVICK D,KIM S,et al.Interleukin-18 and IL-18 binding protein[J].Front Immunol,2013,4:289
[14]SANDERS NL,MISHRA A.Role of interleukin-18 in the pathophysiology of allergic diseases[J].Cytokine Growth Factor Rev,2016,32:31
[15]WANG J,ZHANG H,ZHENG W,et al.Correlation of IL-18 with tryptase in atopic asthma and induction of mast cell accumulation by IL-18[J].Mediators Inflamm,2016,2016:4743176
[16]VERHAEGHE B,GEVAERT P,HOLTAPPELS G,et al.Up-regulation of IL-18 in allergic rhinitis[J].Allergy,2002,57(9):825
(2017-04-09收稿 责任编辑徐春燕)
Expressions of IL-18, IL-18BP and IL-18R in blood eosinophil-enriched populations from patients with allergic rhinitis complicated with asthma
WANGLing1),HUYalin1),YANGRuiming1),WANGJunling1),ZHANGHuiyun1,2),HEShaoheng1)
1)AllergyandClinicalImmunologyResearchCenter,theFirstAffiliatedHospital,JinzhouMedicalUniversity,Jinzhou,Liaoning121001 2)CentralLaboratory,SuzhouXiangchengPeople'sHospital,Suzhou,Jiangsu215100
allergic rhinitis complicated with asthma;eosinophil;IL-18;IL-18BP;IL-18R
Aim: To investigate expressions of IL-18, IL-18BP and IL-18R in blood eosinophil-enriched populations from patients with allergic rhinitis complicated with asthma(AR+AS) as well as the correlation among them. Methods: Blood samples were collected from 13 AR+AS patients and 14 healthy controls. Proportions and MFI of IL-18+, IL-18BP+and IL-18R+cells in blood eosinophil-enriched populations from 2 groups were detected by flow cytometry. Results: Compared with healthy controls, proportions of IL-18+and IL-18BP+cells in eosinophil-enriched populations from AR+AS patients were increased by 5.821 folds(P=0.001) and 44.1%(P=0.048) when cultured with medium only, MFI of IL-18+cells in eosinophil-enriched populations from AR+AS patients was increased by 29.1%(P=0.001), and MFI of IL-18BP+cells was decreased by 32.3%(P<0.001); while the proportion and MFI of IL-18R+cells did not change significantly(P>0.05). Proportions of IL-18+and IL-18BP+eosinophils were correlated moderately(r=0.622,P<0.001) in eosinophil-enriched populations from AR+AS patients. Conclusion: IL-18+and IL-18BP+eosinophils are likely to play a key role in AR+AS.
10.13705/j.issn.1671-6825.2017.05.020
R392.8
*国家自然科学基金资助项目 81471592;81472016
#通信作者:张慧云,女,1971年5月生,博士,教授,研究方法:过敏性疾病,E-mail:zhanghuiyun2003@126.com;何韶衡,男,1957年4月生,博士,教育部长江学者,研究方向:过敏性疾病,E-mail:shoahenghe@hotmail.com

