AAV9介导的CTRP9过表达对糖尿病大鼠心肌纤维化的抑制作用*
肖明洋,刘淑珍,宋恒良,谢艳辉,万大国#
1)郑州大学第二附属医院心血管内科 郑州 450014 2)郑州大学第二附属医院急诊科 郑州 450014
AAV9介导的CTRP9过表达对糖尿病大鼠心肌纤维化的抑制作用*
肖明洋1),刘淑珍2),宋恒良1),谢艳辉1),万大国1)#
1)郑州大学第二附属医院心血管内科 郑州 450014 2)郑州大学第二附属医院急诊科 郑州 450014
心肌纤维化;C1q/肿瘤坏死因子相关蛋白9;转化生长因子β1/Smads信号通路;糖尿病;大鼠
目的:探讨AAV9介导的CTRP9过表达对糖尿病大鼠心肌纤维化的作用及其机制。方法45只6周龄健康SD大鼠分为对照组、GFP组和CTRP9组,每组15只。GFP组和CTRP9组腹腔注射链脲佐菌素(STZ)造模,对照组腹腔注射生理盐水;2周后,GFP组和CTRP9组分别经尾静脉缓慢注射携带GFP和CTRP9基因的AAV9,对照组同法给予生理盐水。转染12周后检测血糖及血清CTRP9水平,进行心肌Masson染色并计算胶原容积分数(CVF)以评价大鼠心肌纤维化程度,应用RT-PCR和Western blot分别检测3组大鼠心肌TGF-β1/Smads通路中各因子mRNA和蛋白水平。结果转染12周后,与GFP组相比,CTRP9组大鼠血清CTRP9上升,血糖降低,CVF也降低(P<0.05);同时TGF-β1、Smad2和Smad3 mRNA表达水平降低,Smad7 mRNA表达水平升高(P<0.05),α-SMA、TGF-β1和p-Smad2/3蛋白表达水平降低,Smad7蛋白表达升高(P<0.05)。结论AAV9介导的CTRP9过表达可能通过调节TGF-β1/Smads信号通路来抑制糖尿病大鼠的心肌纤维化。
糖尿病心肌纤维化是糖尿病常见的一种心脏病理变化,严重影响糖尿病患者的长期预后。心肌纤维化指心肌成纤维细胞在心肌细胞间质合成大量的胶原蛋白,并诱导其相互交联聚合,使心室壁变硬、顺应性下降,严重者可致心力衰竭。C1q/肿瘤坏死因子相关蛋白9(CTRP9)是一种主要由心肌组织和脂肪组织分泌的细胞因子,与心血管活动密切相关,具有调节细胞代谢、稳定斑块、改善胰岛素抵抗和抗动脉粥样硬化的作用[1-2]。既往研究[3-4]发现,TGF-β1/Smads通路激活是心肌发生纤维化的主要机制。体外研究[5]提示CTRP9可能具有抑制心肌纤维化的作用,并且可能与TGF-β1相关。9型腺相关病毒(AAV9)与体内心肌组织的亲和性较高,多用作体内心肌转染过表达目的基因的载体。因此,该研究利用链脲佐菌素(STZ)构建糖尿病心肌纤维化大鼠模型,以AAV9为载体转染CTRP9基因,观察CTRP9过表达对糖尿病大鼠心肌纤维化的作用及机制。
1 材料与方法
1.1材料与试剂兔抗鼠α平滑肌肌动蛋白(α-SMA)多克隆抗体、兔抗鼠TGF-β1多克隆抗体、兔抗鼠p-Smad2/3多克隆抗体和羊抗鼠Smad7多克隆抗体均购自美国Abcam公司,TGF-β1、α-SMA、p-Smad2/3及Smad7二抗购自金斯瑞生物科技公司,Trizol试剂盒购自联硕生物科技公司,质粒AAV9-mCMV-eGFP、菌株DH5α购自深圳百恩维生物科技有限公司,RT-PCR所用引物购自宁波康贝生化有限公司,CTRP9 ELISA试剂盒购自江莱生物科技公司。
1.2AAV9载体的构建与包装于GenBank获取大鼠CTRP9 mRNA序列,反转录为cDNA并进行PCR扩增、琼脂糖凝胶电泳,利用凝胶回收试剂盒进行胶回收。将回收的CTRP9基因片段与腺病毒相关质粒AAV9-CTRP9-eGFP分别酶切,T4连接酶连接,再把产物转化至DH5α菌株,筛选阳性克隆鉴定并测序,抽提质粒。将冻存的293T细胞复苏并传代培养24 h,细胞密度达80%~90%时,将AAV9-CTRP9-eGFP和辅助包装质粒(AAV9 pHelper)加入到DMEM培养基中,共转染293T细胞,转染前更换培养液。同时以空载体和AAV9 pHelper共转染293T细胞作为对照,48 h后收集上清液,2 400 r/min离心10 min,滤去细胞碎片,测定病毒滴度并于-80 ℃冰箱中冻存。
1.3动物模型的制作与分组45只6周龄健康雄性SD大鼠,160~180 g,购自河南省实验动物中心。随机分为对照组、GFP组和CTRP9组,每组15只。禁食12 h后,GFP组和CTRP9组大鼠腹腔注射10 g/L STZ(60 mg/kg)构建糖尿病心肌纤维化模型[6],对照组注射1 mL的生理盐水。3 d后采用剪尾法测血糖,1次/d,连续2次,随机血糖大于16.7 mmol/L则模型构建成功。2周后,CTRP9组和GFP组分别经尾静脉缓慢注射AAV9-CTRP9和AAV9-eGFP(250 μL,滴度1×1012vg/mL);对照组经尾静脉注射250 μL的生理盐水。转染2周内对照组死亡1只,GFP组死亡1只,CTRP9组死亡2只。
1.4病毒转染效率观察病毒转染4、8周后,每组分别处死1只大鼠,分离心室肌、OCT包埋、冰冻切片,荧光显微镜下观察心肌组织中的绿色荧光强度,评估病毒转染情况。病毒转染12周后,取处死大鼠的部分心室肌,同法测病毒转染效率。
1.5血清CTRP9和血糖的测定转染12周后经尾静脉采血2 mL,静置2 h后离心取血清,于-80 ℃冰箱保存,采用酶联免疫法测定血清CTRP9。应用强生血糖仪剪尾法测血糖。
1.6病理观察尾静脉采血后,麻醉并处死大鼠,经胸骨正中切开取出心脏,分离心室肌,清洗并用滤纸吸干水分。沿左心室中线将心脏分为2部分,在心尖部取出厚度约2 mm的心肌,体积分数10%甲醛固定,石蜡包埋,5 μm厚切片,Masson染色并制成病理切片。在显微镜下(×400)可观察到呈红色的心肌纤维和呈蓝色的胶原纤维,每张切片选取3个视野,使用Image Pro Plus软件处理并计算心肌胶原容积分数(CVF),CVF=胶原纤维面积/视野总面积×100%。
1.7RT-PCR法测定心肌组织中TGF-β1/Smads信号通路各因子mRNA的表达水平应用Trizol试剂盒提取大鼠心肌组织总RNA,反转录成cDNA并进行PCR扩增(引物序列见表1)。PCR反应体系:94 ℃预变性10 min,94 ℃变性15 s,57 ℃退火45 s,72 ℃延伸75 s,40个循环。按照2-ΔΔCt法计算出相对定量结果。

表1 引物序列
1.8Westernblot法测定心肌组织中TGF-β1/Smads信号通路各因子蛋白表达水平处死大鼠后收集心室肌标本并剪碎,RIPA裂解液裂解、匀浆,离心后获得心肌组织总蛋白,应用BCA试剂盒检测总蛋白浓度。将样品进行PAGE凝胶电泳分离并转至PVDF膜上。50 g/L脱脂牛奶封闭2 h,加一抗(α-SMA、TGF-β1、p-Smad2/3、Smad7多克隆抗体),4 ℃摇床孵育过夜。TBST洗膜3次,每次5 min,然后加二抗,室温下孵育1.5 h,洗膜后显影。应用凝胶成像系统处理图像,将目的蛋白和内参β-actin蛋白条带灰度值的比值作为目的蛋白的相对表达水平。
1.9统计学处理采用SPSS 17.0处理数据。采用单因素方差分析比较3组大鼠血清CTRP9、血糖水平、CVF以及TGF-β1/Smads通路中各因子mRNA和蛋白表达水平的差异,两两比较采用LSD-t检验,检验水准α=0.05。
2 结果
2.1 3组大鼠病毒体内转染情况观察病毒转染4、8、12周,对照组无明显荧光表达,GFP组和CTRP9组4周后即可观察到微弱绿色荧光,8周后荧光强度明显增强,12周后荧光强度较前下降。
2.2 3组大鼠血清CTRP9和血糖水平的比较与对照组相比,GFP组血糖升高;与GFP组相比,CTRP9组CTRP9水平上升,血糖下降,见表2。
2.3 3组大鼠心肌组织病理结果比较Masson染色显示,对照组心肌间质中胶原纤维纤细,数量较少;GFP组心肌细胞排列紊乱,间质中粗大的胶原纤维显著增多,CVF升高;与GFP组比较,CTRP9组心肌间质中胶原纤维较纤细,CVF降低。见图1、表2。
2.4 3组大鼠心肌组织中TGF-β1/Smads信号通路各因子mRNA表达水平的比较与对照组比较,GFP组TGF-β1、Smad2、Smad3 mRNA表达水平升高,Smad7 mRNA表达水平下降;CTRP9组TGF-β1、Smad2、Smad3 mRNA表达水平较GFP组降低,Smad7 mRNA表达水平升高,见表3。
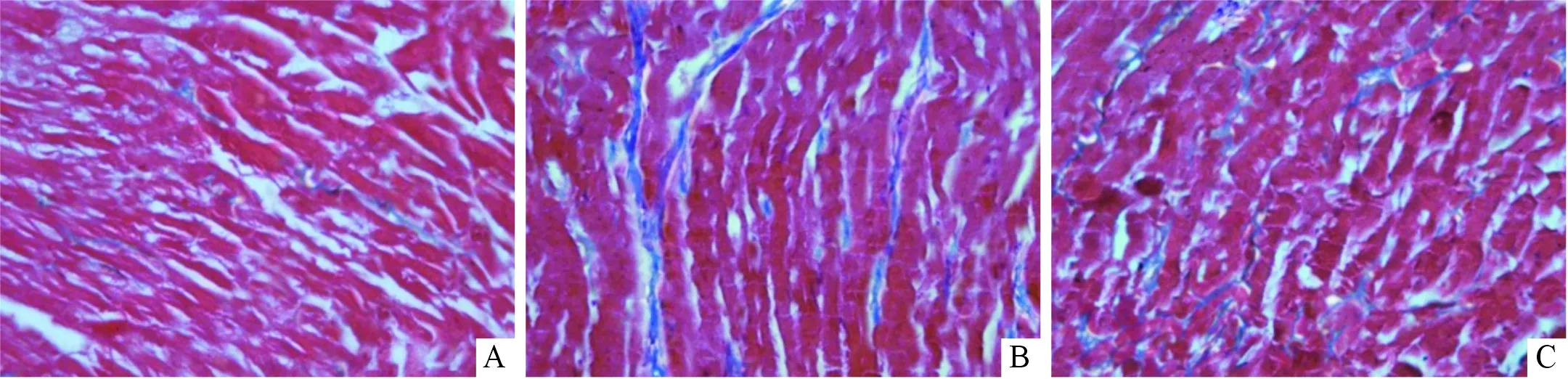
A:对照组;B:GFP组;C:CTRP9组。 图1 3组大鼠心肌标本Masson染色(×400)

组别nρ(CTRP9)/(μg·L-1)c(血糖)/(mmol·L-1)CVF/%对照组12121.8±21.76.7±2.82.5±1.3GFP组12122.6±22.122.5±4.7*7.9±2.1*CTRP9组11146.2±22.5*#18.6±4.2*#5.0±1.9*#F4.46750.44228.205P0.019<0.001<0.001
*:与对照组比较,P<0.05;#:与GFP组比较,P<0.05。
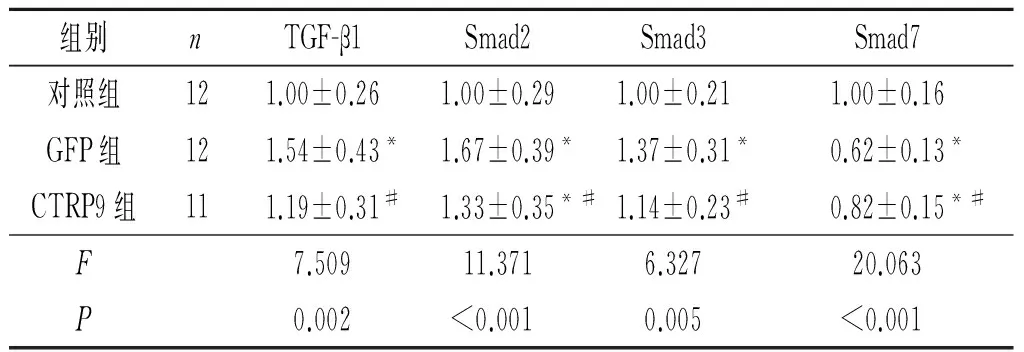
表3 3组大鼠心肌组织中TGF-β1、Smad2、Smad3、Smad7 mRNA表达水平比较
*:与对照组比较,P<0.05;#:与GFP组比较,P<0.05。
2.5 3组大鼠心肌组织中TGF-β1/Smads信号通路各因子蛋白表达水平的比较与对照组比较,GFP组α-SMA、TGF-β1、p-Smad2/3表达水平升高,Smad7蛋白表达水平下降;CTRP9组α-SMA、TGF-β1、p-Smad2/3表达水平较GFP组下降,Smad7蛋白表达水平升高,见图2、表4。

1~3:分别为对照组、GFP组和CTRP9组。 图2 3组大鼠心肌组织中α-SMA、 TGF-β1、p-Smad2/3和Smad7蛋白表达水平比较
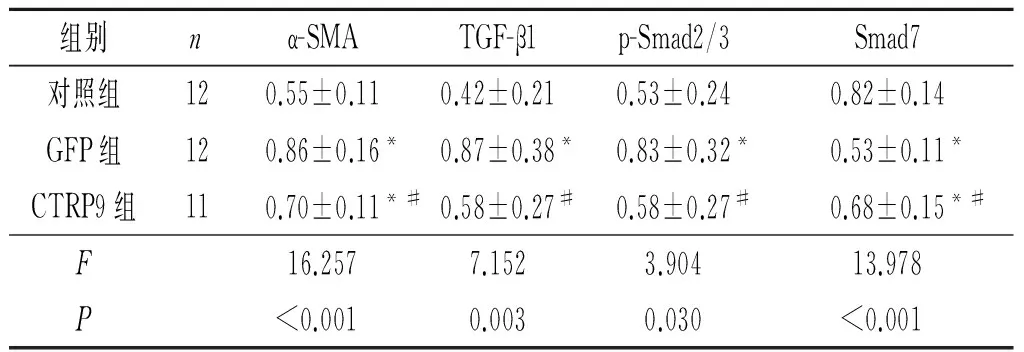
组别nα-SMATGF-β1p-Smad2/3Smad7对照组120.55±0.110.42±0.210.53±0.240.82±0.14GFP组120.86±0.16*0.87±0.38*0.83±0.32*0.53±0.11*CTRP9组110.70±0.11*#0.58±0.27#0.58±0.27#0.68±0.15*#F16.2577.1523.90413.978P<0.0010.0030.030<0.001
*:与对照组比较,P<0.05;#:与GFP组比较,P<0.05。
3 讨论
近年来,CTRPs在心肌纤维化发生中的作用引人关注。其中,脂肪因子CTRP3和CTRP6已经被证实可以通过抑制TGF-β1诱导Ras基因家族RhoA的活化,来进一步抑制心肌成纤维细胞分泌细胞外基质(ECM),减少胶原纤维的产生,最终抑制心肌梗死后的心肌纤维化[7-8]。CTRP9是一种主要由心肌组织和脂肪组织分泌的细胞因子,在心肌组织中高表达,与脂联素受体1结合发挥信号转导作用[9]。既往研究[2,10]发现CTRP9具有调节糖脂代谢、改善胰岛素抵抗、稳定斑块和预防再灌注损伤的作用。体外动物实验[5]显示,输注CTRP9蛋白可以有效改善小鼠心肌纤维化和恢复心脏舒缩功能。但既往研究均未明确CTRP9发挥抗心肌纤维化作用的具体机制。TGF-β1/Smads通路的激活是包括糖尿病在内的许多因素导致心肌发生纤维化的主要途径[3]。因此,该实验以转染携带CTRP9基因的AAV9为干预措施,通过观察转染小鼠心肌组织中TGF-β1/Smad通路相关因子的表达水平,来研究脂肪因子CTRP9抗心肌纤维化的作用及机制。
Sun等[5]的研究发现大鼠心肌梗死后血清CTRP9水平下降,补充外源性CTRP9可以抑制TGF-β1因子的活化,从而抑制心肌梗死后心肌纤维化的发生,证实CTRP9与心肌纤维化有关。该实验Masson染色显示糖尿病大鼠心肌纤维化水平上升,过表达CTRP9干预后,心肌纤维化程度下降。既往研究[3]显示,包括糖尿病在内的诸多因素致心肌纤维化的关键在于TGF-β1/Smads传导通路的激活。TGF-β1能够诱导心肌成纤维细胞发生分化,使胶原纤维合成增多并大量沉积在细胞间质,最后形成心肌纤维化。Smads蛋白作为胞内信息转导递质将TGF-β1信息转至细胞核内。TGF-β1受体分3型,其中Ⅰ型、Ⅱ型受体以二聚体形式存在,TGF-β1与Ⅱ型受体胞外段结合同时激活受体胞内段丝氨酸/苏氨酸激酶,Ⅰ型受体与之结合并被活化,下游Smad2和Smad3蛋白表达上调并发生磷酸化,p-Smad2/3与Smad4结合成寡聚复合物并转位进入胞核内,调控相应靶基因转录[11]。另一方面,Smad7起着负反馈调节的作用,其通过与TGF-β1竞争性地结合TGF-β1Ⅰ型受体抑制下游信号转导。该实验结果表明糖尿病心肌纤维化与TGF-β1/Smads通路激活密切相关,经CTRP9过表达干预后, TGF-β1、Smad2、Smad3 mRNA及TGF-β1、p-Smad2/3蛋白表达水平均明显降低,Smad7 mRNA和蛋白水平明显升高,这说明CTRP9可能通过调节TGF-β1/Smads信号通路发挥抗心肌纤维化的作用。
α-SMA是心肌成纤维细胞中微丝的结构蛋白,也是其特有的标志蛋白。心肌纤维化过程中,肌成纤维细胞生成胶原纤维并诱导其聚集,是机体分泌ECM最主要的效应细胞[12]。既往研究[13]表明,Smad7可以通过抑制Smad2、Smad3的磷酸化来降低α-SMA蛋白的表达,抑制心肌纤维化的发生。该实验结果显示,过表达CTRP9干预后α-SMA表达量下调,说明CTRP9可以通过抑制肌成纤维细胞来减少胶原纤维的产生,这同Masson染色结果一致。研究[4,14]表明,CTRP9还可能通过调节基质金属蛋白酶-2(MMP2)和MMP9的活性,促进ECM降解,从而抑制心肌纤维化。
综上所述,CTRP9可能通过调节TGF-β1/Smads传导通路的活化抑制糖尿病心肌纤维化。然而目前发现还有其他机制影响心肌纤维化[15],该研究仅从CTRP9调节TGF-β1/Smads传导通路的角度来阐述其机制,该通路是否与其他通路存在相互作用目前仍不明确,未来需要多机制研究,从而为糖尿病心肌纤维化的治疗提供依据。
[1] 刘天骄,郭媛,李婷婷,等.血清CTRP9、APN水平与急性冠脉综合征的相关性[J].山东大学学报(医学版),2014,52(9):58
[2] WEI Z,LEI X,PETERSEN PS,et al.Targeted deletion of C1q/TNF-related protein 9 increases food intake, decreases insulin sensitivity, and promotes hepatic steatosis in mice[J].Am J Physiol Endocrinol Metab,2014,306(7):E779
[3] 李同,刘婵,石耿辉.转化生长因子β1/Smads表达在高盐饮食致Wistar大鼠心肌纤维化中的作用及替米沙坦干预[J].中华高血压杂志,2013,21(7):648
[4] 刘根林,袁风菊,陆慈溧,等.银杏叶提取物对Ⅰ型糖尿病心肌病大鼠心肌TGF-β1和collagen表达及间质纤维化的影响[J].中国病理生理杂志,2013,29(11):2017
[5] SUN Y,YI W,YUAN Y,et al.C1q/tumor necrosis factor-related protein-9, a novel adipocyte-derived cytokine, attenuates adverse remodeling in the ischemic mouse heart via protein kinase A activation[J].Circulation,2013,128(11 Suppl 1):S113
[6] 张冬梅, 魏素文,段好刚,等.链脲佐菌素诱导制备糖尿病大鼠模型方法学考察[J].兰州大学学报(医学版),2008,34(3):17
[7] DOBACZEWSKI M,CHEN W,FRANGOGIANNIS NG.Transforming growth factor (TGF)-β signaling in cardiac remodeling[J].J Mol Cell Cardiol,2011,51(4):600
[8] 刘发金, 肖骅, 唐雪娇, 等.转化生长因子-β1对大鼠心房、心室成纤维细胞胶原表达的影响[J].解放军医学杂志,2015,40(7):540
[10]YI W,SUN Y,YUAN Y,et al.C1q/tumor necrosis factor-related protein-3, a newly identified adipokine, is a novel antiapoptotic, proangiogenic, and cardioprotective molecule in the ischemic mouse heart[J].Circulation,2012,125(25):3159
[11]ZHAI YS,GAO XR,WU QM,et al.Fluvastatin decreases cardiac fibrosis possibly through regulation of TGF-beta(1)/Smad 7 expression in the spontaneously hypertensive rats[J].Eur J Pharmacol,2008,587(1/3):196
[12]黄永亮,李恩,汪涛.瑞舒伐他汀对心肌梗死后大鼠心肌组织中α-SMA、TGF-β1表达的影响[J].郑州大学学报(医学版),2015,50(2):232
[13]WANG B,OMAR A,ANGELOVSKA T,et al.Regulation of collagen synthesis by inhibitory Smad7 in cardiac myofibroblasts[J].Am J Physiol Heart Circ Physiol,2007,293(2):H1282
[14]LI Y,GENG X,WANG H,et al.CTRP9 Ameliorates Pulmonary Arterial Hypertension Through Attenuating Inflammation and Improving Endothelial Cell Survival and Function[J].J Cardiovasc Pharmacol,2016,67(5):394
[15]KRENNING G,ZEISBERG EM,KALLURI R.The origin of fibroblasts and mechanism of cardiac fibrosis[J].J Cell Physiol,2010,225(3):631
(2016-11-26收稿 责任编辑徐春燕)
Effects of overexpression of CTRP9 mediated by AAV9 on myocardial fibrosis in diabetic rats
XIAOMingyang1),LIUShuzhen2),SONGHengliang1),XIEYanhui1),WANDaguo1)
1)DepartmentofCardiology,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014 2)DepartmentofEmergency,theSecondAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450014
myocardial fibrosis;C1q/TNF-related protein 9;transforming growth factor β1/Smads signal pathway;diabetes mellitus;rat
Aim: To investigate the effects of CTRP9 on myocardial fibrosis and the mechanism in diabetic rats. Methods: A total of 45 healthy SD rats were assigned into 3 groups: control group,GFP group and CTRP9 group,15 rats in each group. Streptozotocin at 60 mg/kg was intraperitoneally injected in rats of GFP group and CTRP9 group to make diabetic rat model, and normal saline was injected in control group. After 2 weeks, the GFP group and the CTRP9 group were infected with adeno-associated virus 9(AAV9) carrying GFP and CTRP9 gene through tail vein, respectively. Meanwhile control group was injected with normal saline. After 12 weeks, the blood glucose and serum CTRP9 were measured. Masson staining was used to assess myocardial fibrosis and to calculate the cardiac collagen volume fraction(CVF). RT-PCR and Western blot were amplied to detect the mRNA and protein levels of TGF-β1/Smads pathway- related factors in myocardial tissue of rats. Results: After 12 weeks, compared with GFP group, the level of CTRP9 increased and that of blood glucose as well as CVF decreased significantly in CTRP9 group(P<0.05), meanwhile, the mRNA expressions of TGF-β1, Smad2 and Smad3 and the protein levels of α-SMA, TGF-β1 and p-Smad2/3 were decreased significantly(P<0.05), and the mRNA and protein expressions of Smad7 were increased significantly(P<0.05). Conclusion: Overexpression of CTRP9 inhibits myocardial fibrosis by regulating the expression of TGF-β1/Smads signaling pathway in diabetic rats.
10.13705/j.issn.1671-6825.2017.05.013
R542.2
#通信作者,男,1965年7月生,硕士研究生,教授,研究方向:心内介入治疗,E-mail:xiaomingyangvip@sina.com
*河南省医学科技攻关计划项目 201503094

