食管鳞癌Eca109细胞中PI3K/AKT/mTOR信号通路对LSD1的调控作用*
凡 丞,鲁照明,张幸丽,田 菲,白一汝,赵 琦,彭柯峥,刘宏民,侯桂琴
郑州大学药学院 郑州 450001
食管鳞癌Eca109细胞中PI3K/AKT/mTOR信号通路对LSD1的调控作用*
凡 丞,鲁照明,张幸丽,田 菲,白一汝,赵 琦,彭柯峥,刘宏民,侯桂琴#
郑州大学药学院 郑州 450001
食管鳞癌;PI3K/AKT/mTOR通路;LSD1;H3K4me2
目的:探讨食管鳞癌Eca109细胞中PI3K/AKT/mTOR信号通路对LSD1的调控作用。方法用不同浓度的PI3K/Akt/mTOR信号通路抑制剂LY294002(0.5、1.0、5.0、10.0、20.0和50.0 μmol/L)、RAD001(0.05、0.50、5.00、10.00、20.00和50.00 μmol/L)分别处理Eca109细胞24、48 h,采用CCK-8实验检测细胞增殖;然后分别用0、10、20 μmol/L LY294002或RAD001处理Eca109细胞24 h或20 μmol/L LY294002或RAD001处理不同时间(0~72 h),采用Western blot检测PI3K/Akt/mTOR信号通路因子、LSD1及组蛋白H3K4me2表达的变化。结果LY294002、RAD001处理后,食管鳞癌细胞增殖受抑,且随浓度的增加,抑制作用有增强的趋势(P<0.05);LY294002抑制Eca109细胞中p-p70S6K的表达,上调Raptor、Rictor、p-Akt(Ser473)以及组蛋白H3K4me2的表达;而RAD001抑制了Raptor、Rictor、p-p70S6K表达,增加p-Akt(Ser473)的表达,并且下调LSD1表达,上调组蛋白H3K4me2的表达(P<0.05)。结论PI3K/AKT/mTOR信号通路对LSD1存在调控作用。
食管鳞癌是我国尤其是河南省高发的恶性肿瘤,其易发生耐药,复发率高且5 a生存率低,因此探索其发生的分子机制及寻找分子治疗靶点具有重要意义[1]。研究[2]认为,肿瘤的发生发展与组蛋白的甲基化和去甲基化水平的动态平衡关系密切,组蛋白赖氨酸特异性去甲基化酶1(lysine specific demethylase 1,LSD1)能够特异性去除组蛋白H3K4me1/2或H3K9me1/2的甲基化;LSD1作为一种特异性的去甲基化酶在恶性肿瘤的发生发展中扮演着重要的角色,并且在多种恶性肿瘤中都存在LSD1的高表达[3]。PI3K/AKT/mTOR信号通路激活能引起肿瘤细胞蛋白质的合成增加,促进肿瘤细胞的增殖、迁移,是肿瘤发生的主要调控通路之一[4]。肿瘤发生过程中PI3K/AKT/mTOR信号通路与LSD1之间是否存在调控关系尚不清楚。该研究以人食管鳞癌细胞株Eca109为研究对象,利用PI3K抑制剂LY294002和mTOR抑制剂RAD001分别抑制PI3K/AKT/mTOR信号通路,探讨PI3K/AKT/mTOR信号通路对LSD1的调控作用及对其功能的影响,为探讨食管鳞癌的分子发生机制提供实验依据。
1 材料与方法
1.1材料Eca109购自上海中科院细胞库。RPMI 1640培养基和胎牛血清购自以色列BI公司,LY294002、RAD001均购自美国MCE公司,LSD1抗体购自美国Abcam公司,H3K4me2、Raptor、Rictor、p-p70S6K、p-Akt(Ser473)及内参GAPDH和H3抗体均购自美国CST公司,组蛋白提取试剂盒购自美国EpIGENTEK公司。LY294002和RAD001均用DMSO配制成浓度为20 mmol/L的母液并于-20 ℃保存。
1.2细胞培养细胞用含体积分数10%胎牛血清的RPMI 1640培养基在37 ℃、含体积分数5%CO2的培养箱中培养。
1.3CCK-8实验将Eca109细胞接种于96孔板,6 000个/孔,过夜培养,然后分别用不同浓度的LY294002(0.5、1.0、5.0、10.0、20.0和50.0 μmol/L)或RAD001(0.05、0.50、5.00、10.00、20.00和50.00 μmol/L)处理,每个浓度设6个复孔。用未处理细胞作为空白组,并设置对照组(只含RPMI 1640培养基)以消除培养基干扰。继续培养24、48 h后每孔加入5 μL CCK-8,继续培养4 h,用酶标仪测定细胞在450 nm波长处的光密度值。计算细胞增殖抑制率,并进一步算出LY294002和RAD001的IC50。细胞增殖抑制率=1-(加药孔细胞光密度值-空白孔细胞光密度值)/(对照孔细胞光密度值-空白孔细胞光密度值)×100%。实验重复3次。
1.4Westernblot将Eca109细胞接种于6孔板,过夜培养后分别加入0、10和20 μmol/L的LY294002或RAD001处理24 h;或分别用20 μmol/L LY294002或RAD001处理细胞0、24、36、48和72 h。提取上述处理细胞及未处理细胞总蛋白及组蛋白,将40 μg蛋白(组蛋白为2 μg)经SDS-PAGE分离,电转至硝酸纤维素膜上,50 g/L脱脂牛奶室温封闭2 h,然后分别加入H3K4me2、Raptor、Rictor、p-p70S6K、p-Akt(Ser473)和LSD1一抗及内参GAPDH和H3抗体(按11 000稀释),4 ℃孵育过夜;第2天用PBST洗3遍,加入相应二抗(按110 000稀释),室温孵育2 h后PBST洗3遍,ECL化学底物发光液显影后暗室曝光,条带用Image J软件进行灰度分析。目的蛋白相对表达量用目的条带与内参条带灰度值的比值表示。实验均重复3次。
1.5统计学处理应用SPSS 21.0处理数据。采用单因素方差分析比较各组细胞增殖抑制率、mTOR通路相关信号分子、LSD1和组蛋白H3K4me2表达的差异,两两比较采用SNK-q检验,检验水准α=0.05。
2 结果
2.1LY294002、RAD001对Eca109细胞增殖的影响CCK-8结果显示,LY294002和RAD001处理24和48 h均能明显抑制Eca109细胞增殖,且随着药物浓度的增加,细胞增殖抑制率升高(表1、2)。LY294002在24 h和48 h的IC50分别为(45.618±3.219)和(19.167±3.142) μmol/L,RAD001分别为(49.868±4.488)和(18.263±5.621) μmol/L。
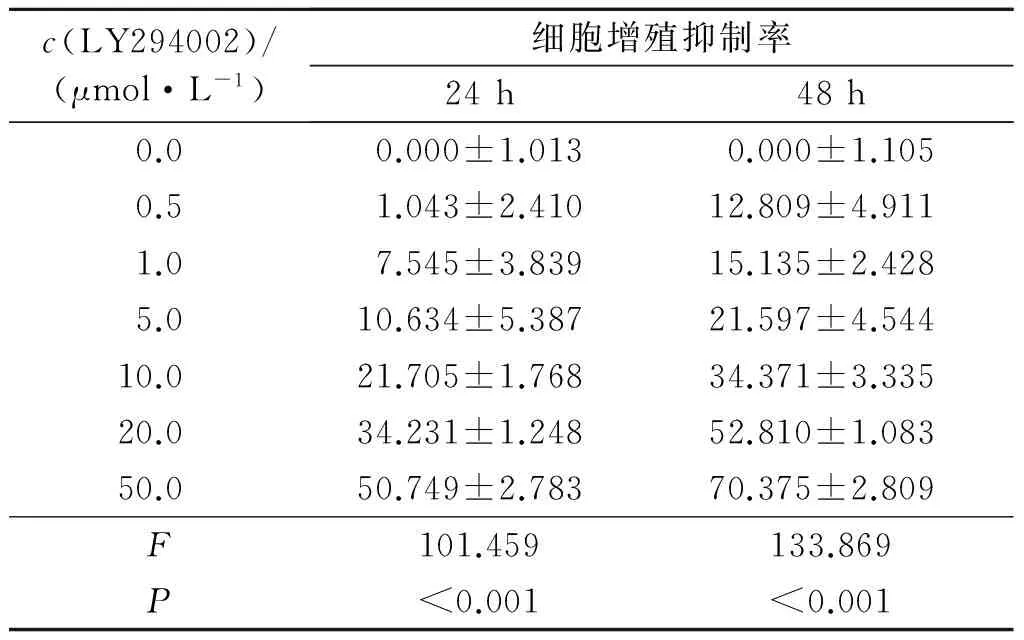
表1 LY294002对Eca109细胞增殖的抑制作用(n=3) %
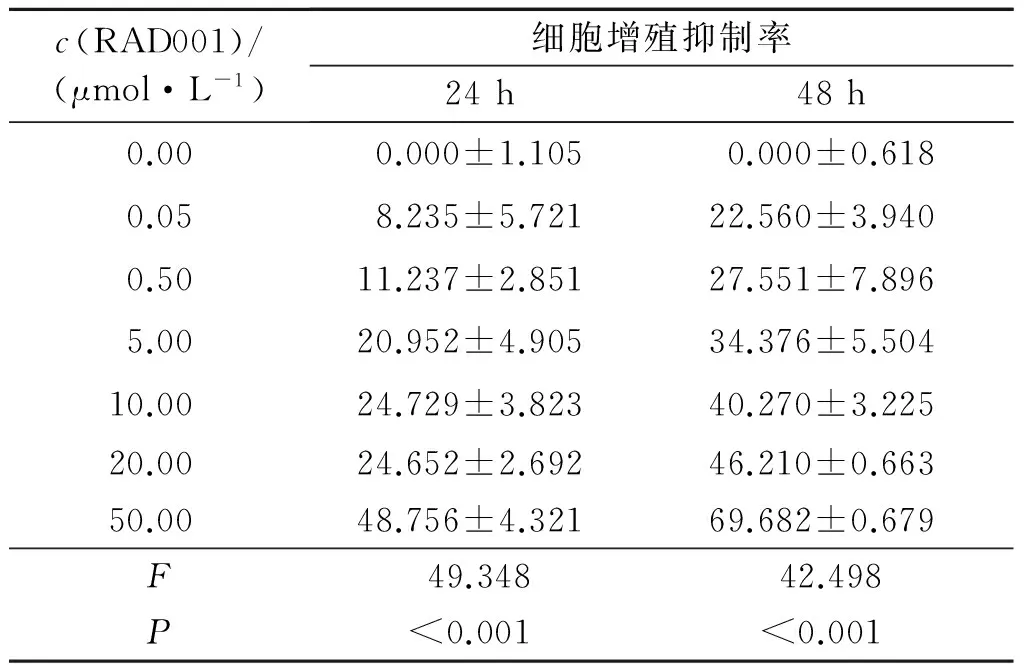
表2 RAD001对Eca109细胞增殖的抑制作用(n=3) %
2.2LY294002和RAD001对Eca109细胞中PI3K/Akt/mTOR通路相关信号分子表达的影响
LY294002处理后,Eca109细胞中p-p70S6K的表达下降,Raptor、Rictor、p-Akt(Ser473)的表达上调,且随着LY294002浓度的增加,这种变化更加明显;而RAD001处理Eca109细胞后,Raptor、Rictor、p-p70S6K的表达量随着RAD001浓度的增加有降低的趋势,而p-Akt(Ser473)的表达则有不同程度的增加。见图1,表3、4。
2.3LY294002和RAD001对Eca109细胞LSD1及组蛋白H3K4me2表达的影响LY294002可使H3K4me2的表达上调,且H3K4me2的表达随时间的延长和剂量的增大有升高的趋势,而LSD1的表达没有明显变化。RAD001能抑制LSD1的表达,升高H3K4me2的表达,且随时间的延长和剂量的增加,其作用更为显著。见图2、3及表5、6。
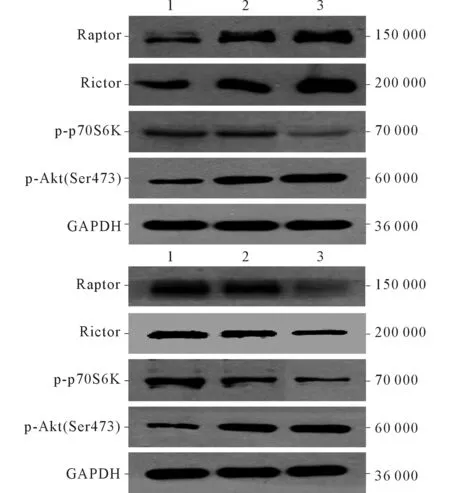
上:LY294002;下:RAD001;1~3:分别为0、10、20 μmol/L。 图1 不同浓度 LY294002和 RAD001对PI3K/Akt/mTOR通路相关蛋白表达的影响
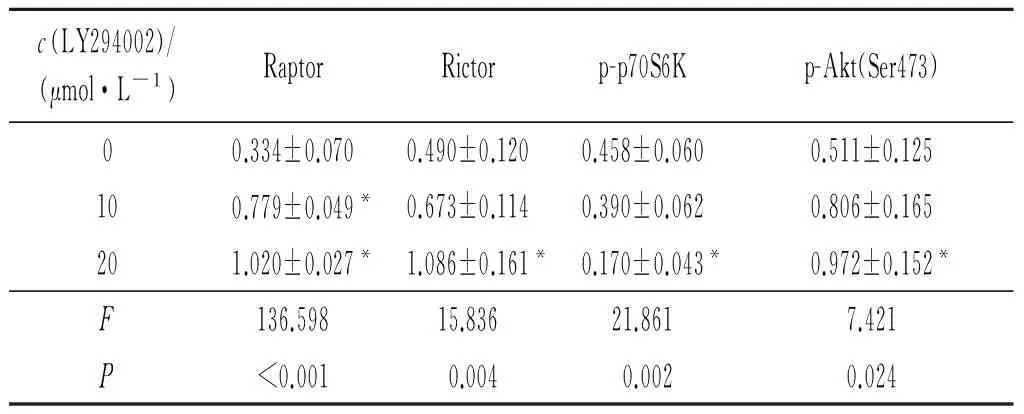
c(LY294002)/(μmol·L-1)RaptorRictorp-p70S6Kp-Akt(Ser473)00.334±0.0700.490±0.1200.458±0.0600.511±0.125100.779±0.049*0.673±0.1140.390±0.0620.806±0.165201.020±0.027*1.086±0.161*0.170±0.043*0.972±0.152*F136.59815.83621.8617.421P<0.0010.0040.0020.024
*:与0 μmol/L组相比,P<0.05。
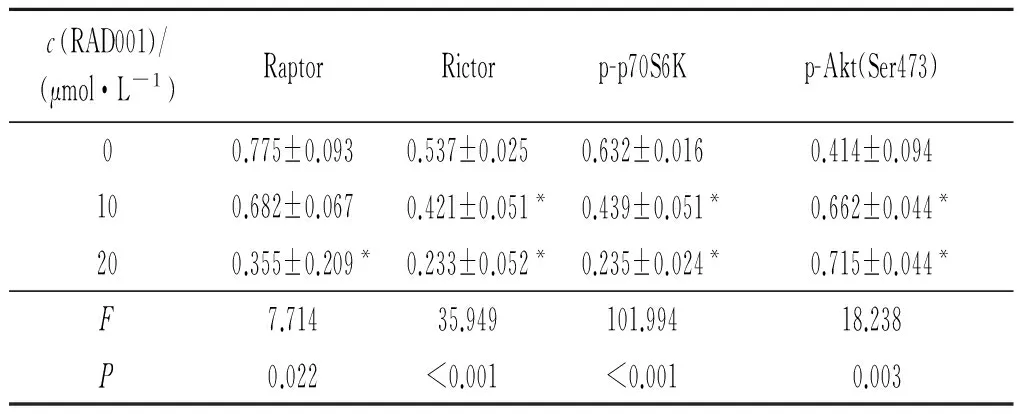
表4 RAD001对Eca109细胞中PI3K/Akt/mTOR通路相关蛋白表达的影响(n=3)
*:与0 μmol/L相比,P<0.05。
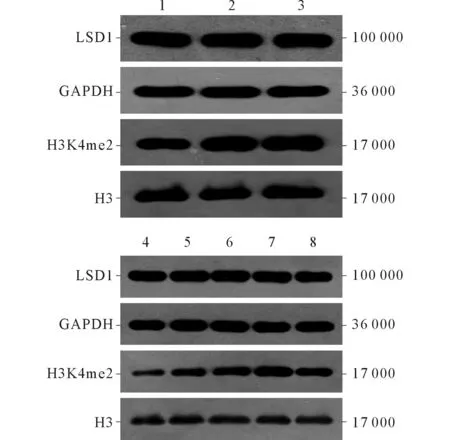
1~3:分别为0、10、20 μmol/L LY294002处理24 h;4~8:分别为20 μmol/L LY294002处理0、24、36、48、72 h。 图2 LY294002对Eca109细胞中LSD1及组蛋白H3K4me2表达的影响
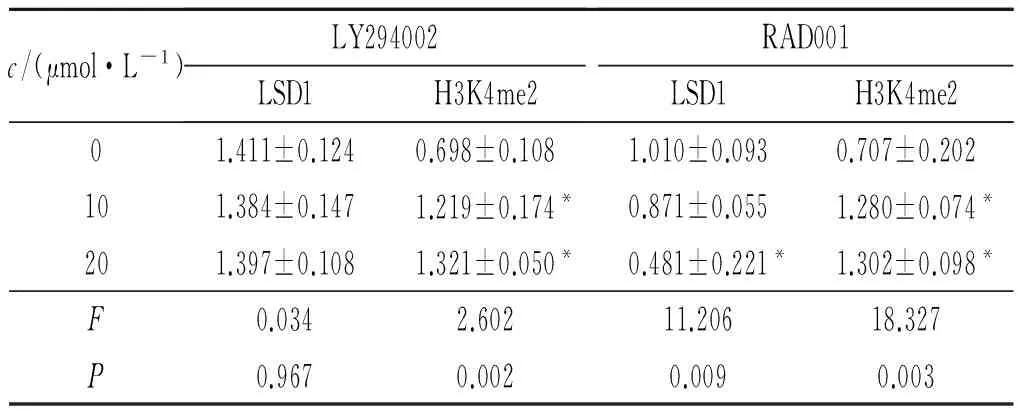
c/(μmol·L-1)LY294002LSD1H3K4me2RAD001LSD1H3K4me201.411±0.1240.698±0.1081.010±0.0930.707±0.202101.384±0.1471.219±0.174*0.871±0.0551.280±0.074*201.397±0.1081.321±0.050*0.481±0.221*1.302±0.098*F0.0342.60211.20618.327P0.9670.0020.0090.003
*:与0 μmol/L组相比,P<0.05。
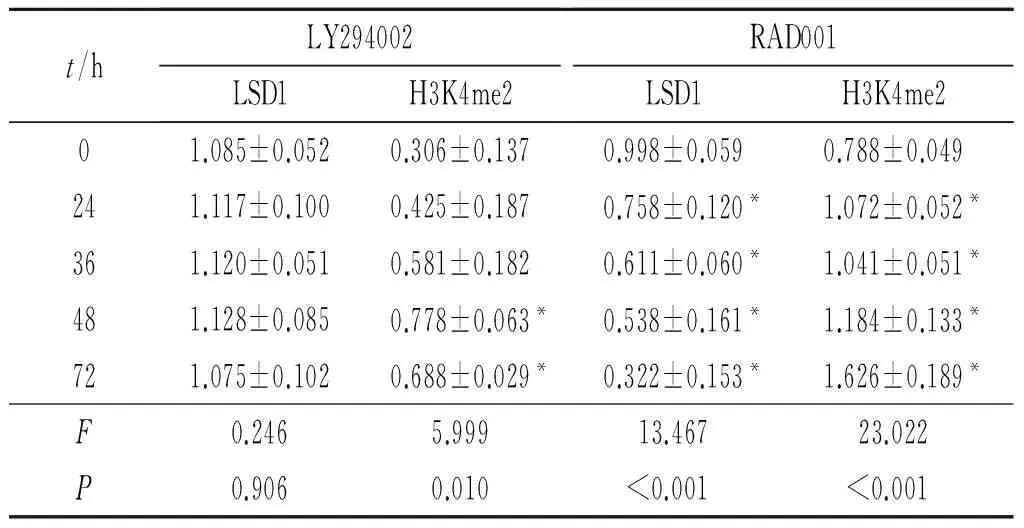
表6 20 μmol/L LY294002或RAD001作用不同时间对Eca109细胞 LSD1及H3K4me2表达的影响(n=3)
*:与0 h组相比,P<0.05。
3 讨论
LSD1是第一个发现的去甲基化酶,能够催化组蛋白H3K4me1/2和H3K9me1/2脱甲基,抑制或激活转录,其在许多类型的恶性肿瘤中高表达,并且与肿瘤发生过程中的致癌作用密切相关。然而,肿瘤中导致LSD1上调的机制目前仍不明确[5-7]。PI3K/Akt/mTOR信号通路在肿瘤细胞增殖和分化中起重要作用[8-10],但目前关于PI3K/AKT/mTOR信号通路与LSD1关系的研究很少,在恶性肿瘤发生发展过程中具体调控机制还不清楚。有报道[11-12]证实,LSD1能够和一些小分子形成共抑制复合物来调控PI3K/AKT/mTOR通路上游抑制子PTEN的转录。Yokoyama 等[13]的研究发现LSD1能够调控PTEN的表达,在LSD1被抑制的情况下,癌细胞的生长也明显被抑制。Shao等[14]发现在卵巢癌中EGFR能够通过PI3K/AKT通路调节LSD1的表达并能影响其功能,从而促进肿瘤细胞的转移。这些实验都证明LSD1与mTOR通路之间存在着某种调控关系。
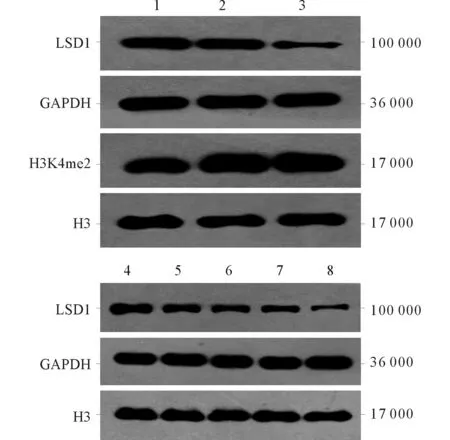
1~3:分别为0、10、20 μmol/L RAD001处理24 h;4~8:分别为20 μmol/L RAD001处理0、24、36、48、72 h。 图3 RAD001对Eca109细胞中 LSD1及组蛋白H3K4me2表达的影响
为了探讨食管鳞癌细胞中PI3K/AKT/mTOR信号通路对LSD1的调控作用,作者首先研究了PI3K/AKT/mTOR通路抑制剂LY294002和RAD001对Eca109细胞增殖的影响及其对PI3K/AKT/mTOR通路的抑制作用,然后观察抑制该通路后细胞中LSD1及组蛋白表达的变化。结果发现,LY294002和RAD001均能抑制Eca109细胞增殖,并且能够抑制PI3K/AKT/mTOR信号通路,且二者均能够通过调节LSD1的去甲基化功能从而上调组蛋白H3K4me2的表达,并且RAD001对LSD1的表达也具有抑制作用。由此,初步推断在食管鳞癌中LSD1可能处在PI3K/AKT/mTOR信号通路的下游,且受此信号通路的调控。
Djukom等[15]和Werzowa等[16]的研究发现,在治疗胰腺神经内分泌肿瘤和黑色素瘤时,单独应用RAD001或LY294002能够上调p-Akt(Ser473)的表达,促进恶性肿瘤的发生。该研究亦显示食管鳞癌细胞中也存在类似的情况,这可能因为mTOR通路存在多条反馈回路,当mTOR被抑制后能够引起该通路的负反馈激活[17]。这也可能是临床单独应用RAD001效果相对较差的原因,细胞增殖实验中食管鳞癌细胞对二者的敏感性不高(药物作用48 h其IC50仍接近20 μmol/L)也可能是因为Akt的负反馈激活。
总之,研究初步证实了Eca109细胞中PI3K/AKT/mTOR信号通路对LSD1存在调控作用,为从表观遗传学的角度治疗食管鳞癌提供了新思路。
[1] CHEN J,KWONG DL,CAO T,et al.Esophageal squamous cell carcinoma(ESCC):advance in genomics and molecular genetics[J].Dis Esophagus,2015,28(1):84
[2] FALKENBERG KJ,JOHNSTONE RW.Histone deacetylases and their inhibitors in cancer, neurological diseases and immune disorders[J].Nat Rev Drug Discov,2014,13(9):673
[3] SUN G,ALZAYADY K,STEWART R,et al.Histonedemethylase LSD1 regulates neural stem cell proliferation[J].Mol Cell Biol,2010,30(8):1997
[4] PRESNEAU N,SHALABY A,IDOWU B,et al.Potential therapeutic targets for chordoma: PI3K/AKT/TSC1/TSC2/mTOR pathway[J].Br J Cancer,2009,100(9):1406
[5] BURG JM,GONZALEZ JJ,MAKSIMCHUK KR,et al.Lysine-specific demethylase 1A(KDM1A/LSD1):product recognition and kinetic analysis of full-length histones[J].Biochemistry,2016,55(11):1652
[6] 翟曜耀,刘晓霞,赵越.赖氨酸特异性组蛋白去甲基化酶1作用机制及其生物学功能的研究进展[J].生命科学,2012,24(1):7
[7] LI Y,TIAN X,SUI CG,et al.Interference of lysine-specific demethylase 1 inhibits cellular invasion and proliferation in vivo in gastric cancer MKN-28 cells[J].Biomed Pharmacother,2016,82:498
[8] DUFFY MJ,MCGOWAN PM,GALLAGHER WM.Cancer invasion and metastasis: changing views[J].J Pathol,2008,214(3):283
[9] TOKER A.Achieving specificity in Akt signaling in cancer[J].Adv Biol Regul,2012,52(1):78
[10]FOLLO MY,MANZOLI L,POLI A,et al.PLC and PI3K/Akt/mTOR signalling in disease and cancer[J].Adv Biol Regul,2015,57:10
[11]LIN Y,KANG T,ZHOU BP.Doxorubicin enhances Snail/LSD1-mediated PTEN suppression in a PARP1-dependent manner[J].Cell Cycle,2014,13(11):1708
[12]YOKOYAMA A,TAKEZAWA S,SCHÜLE R,et al.Transrepressive function of TLX requires the histone demethylase LSD1[J].Mol Cell Biol,2008,28(12):3995
[13]YOKOYAMA A,IGARASHI K,SATO T,et al.Identification of myelin transcription factor 1(MyT1) as a subunit of the neural cell type-specific lysine-specific demethylase 1 (LSD1) complex[J].J Biol Chem,2014,289(26):18152
[14]SHAO G,WANG J,LI Y,et al.Lysine-specific demethylase 1 mediates epidermal growth factor signaling to promote cell migration in ovarian cancer cells[J].Sci Rep,2015,5:15344
[15] DJUKOM C, PORRO LJ, MRAZEK A, et al. Dual inhibition of PI3K and mTOR signaling pathways decreases human pancreatic neuroendocrine tumor metastatic progression[J]. Pancreas, 2014, 43(1):88
[16]WERZOWA J,CEJKA D,FUEREDER T,et al.Suppression of mTOR complex 2-dependent AKT phosphorylation in melanoma cells by combined treatment with rapamycin and LY294002[J].Br J Dermatol,2009,160(5):955
[17]EFEYAN A,SABATINI DM.mTOR and cancer: many loops in one pathway[J].Curr Opin Cell Biol,2010,22(2):169
(2016-12-05收稿 责任编辑徐春燕)
Regulation effects of PI3K/AKT/mTOR signaling pathway on LSD1 in Eca109 cells
FANCheng,LUZhaoming,ZHANGXingli,TIANFei,BAIYiru,ZHAOQi,PENGKezheng,LIUHongmin,HOUGuiqin
SchoolofPharmaceuticalSciences,ZhengzhouUniversity,Zhengzhou450001
esophageal squamous cell carcinoma;PI3K/AKT/mTOR signaling pathway;LSD1;H3K4me2
Aim: To explore the regulation effects of PI3K/AKT/mTOR signaling pathway on LSD1 in esophageal squamous cell carcinoma(ESCC) Eca109 cells. Methods: Eca109 cells were treated with PI3K/AKT/mTOR signaling pathway inhibitor LY294002 or RAD001 with different concentrations for 24, 48 h, then the proliferation of cells was detected by CCK-8 assay. Eca109 cells were treated with LY294002 or RAD001 with different concentration for 24 h,or treated with LY294002 or RAD001 at the same concentration for different time,then the expressions of proteins in PI3K/AKT/mTOR signaling pathway, LSD1 and histone H3K4me2 were detected by Western blot, respectively. Results: The proliferation of Eca109 cells was significantly inhibited by LY294002 or RAD001, and the inhibition effects increased along with the increase of the concentration(P<0.05); LY294002 inhibited the expression of p-p70S6K and promoted the expressions of Raptor, Rictor, p-Akt(Ser473) and histone H3K4me2; while RAD001 inhibited the expressions of Raptor, Rictor, p-p70S6K, up-regulated the expressions of p-Akt(Ser473) and histone H3K4me2, and down-regulated that of LSD1(P<0.05). Conclusion: The PI3K/AKT/mTOR signaling pathway has regulation effects on LSD1.
10.13705/j.issn.1671-6825.2017.05.004
R735.1
#通信作者,女,1977年6月生,博士,副教授,研究方向:肿瘤细胞分子生物学,E-mail:hougq@zzu.edu.cn
*国家自然科学基金重点项目 81430085;河南省基础与前沿技术研究计划项目 162300410122

