变态反应性支气管肺曲菌病误诊为肺结核三例
曾谊 张侠
·病例报告·
变态反应性支气管肺曲菌病误诊为肺结核三例
曾谊 张侠
变态反应性支气管肺曲菌病(allergic bronchopulmonary aspergillosis,ABPA)是机体对寄生于支气管内的曲霉菌产生的变态反应性炎症,以烟曲霉菌最为常见。ABPA的易患因素是:支气管哮喘、囊性纤维化(CF),以及各种原因所导致的结构性气道损伤[1]。由于ABPA在临床表现和病灶的多形态分布上与活动性肺结核有相似之处,如临床医生对ABPA的特征缺乏认识,易将ABPA误诊为肺结核。相关研究资料显示,早期ABPA患者中有40%~50%曾接受经验性抗结核药物治疗[2]。而肺结核和ABPA的治疗方案完全不同,如未能及时识别,病变晚期会导致不可逆性的肺损伤。现将3例初诊被拟诊为肺结核,给予诊断性抗结核药物治疗的ABPA患者的临床资料进行分析,并结合文献复习,以提高对该病的认识。
例1女,35岁。主诉“咯痰伴气喘2个月余”于2013年8月3日收住入我院。2个月前无明显诱因出现咳嗽,咯少许白黏痰并伴气喘不适,不伴发热畏寒,无咯血及痰血,至外院就诊,胸部CT检查(2013年5月31日),显示左肺上叶前段不规则肺实变影,围绕实变区可见斑片影及树芽征,实变区内可见圆形团块状的高密度影,伴纵隔淋巴结肿大(图1,2)。在当地医院临床诊断为“肺结核”。给予免费抗结核药物异烟肼(H)、利福平(R)、乙胺丁醇(E)、吡嗪酰胺(Z)治疗。治疗1.5个月后(入我院后),胸部CT(2013年8月 3日) 复查,显示左上肺实变病灶较前进展,周围可见浸润性阴影。左上叶前段疑似存在腔内的阻塞,病灶内高密度团块影的形态和位置较前有所变化,呈分支状改变(图3,4)。患者既往曾有接触花粉、刺激性气体或冷空气后会出现发作性的咳嗽、气喘症状,通常可自行缓解,未重视。入住我院后体格检查:体温36.7 ℃,心率80次/min,呼吸频率25次/min,血压125/76 mm Hg(1 mm Hg=0.133 kPa)。两肺呼吸音粗,左上肺呼吸音偏低。入院后暂停抗结核药物治疗。血常规:白细胞5.8×109/L,中性粒细胞比率0.50,嗜酸性粒细胞比率0.226,嗜酸性粒细胞计数1.3×109/L。结核感染T细胞斑点试验(T-SPOT.TB):早期分泌抗原靶-6(ESAT-6)为28(斑点数),培养滤液蛋白10(CFP-10)为7(斑点数),阳性。血结核抗体组合检测显示脂阿拉伯甘露糖(LAM)及38 kD(相对分子质量为38 000)抗体阳性。痰抗酸杆菌涂片:阴性(3次)。肺功能检查:第1秒钟用力呼气容积占预计值的百分比(FEV1%)为43.5%,呼气峰流量(PEF)占预计值的百分比为31%,第1秒钟用力呼气容积(FEV1)占用力肺活量(FVC)的百分比(FEV1/FVC比值)为69.96%,肺弥散功能(DLCO)降低。支气管镜检查:左肺上叶开口黏膜高度充血水肿,黏膜表面粗糙,前段见一个增生肉芽组织堵塞管口,反复钳夹。检查过程中发现患者气喘症状加重,左上叶前段开口出现明显狭窄、闭塞,给予甲强龙40 mg静脉推注后缓解(图5~7),提示气道高反应性。支气管镜活检病理学检查:支气管黏膜慢性炎伴鳞状上皮化生。支气管镜灌洗液真菌培养:生长烟曲霉菌(伏立康唑、伊曲康唑敏感,氟康唑耐药)。血清总IgE水平:1910.06 IU/ml(正常值:0~60 IU/ml);烟曲菌m3过敏原特异性IgE:6.81(3级) kU/L(正常值:0~0.35 kU/L)。最终诊断:ABPA。加用泼尼松30 mg/次,1次/d口服。并定期进行胸部CT复查及检测总IgE水平,1个月后患者喘息症状缓解,胸部CT(2013年9月5日)复查:实变病灶及高密度黏液栓消失,囊性中心性支气管扩张清晰(图8)。总IgE水平下降50%时将糖皮质激素减量至30 mg/次,隔日1次。之后按每2周减量5 mg逐步递减泼尼松的用量;每2个月进行一次胸部CT复查,病情稳定则减至5 mg/次,隔日1次,持续服用1个月。2014年4月10日(治疗8个月后)胸部CT复查,显示患者的肺部病灶完全吸收(图9),肺功能检查恢复正常,总IgE水平正常,遂停药观察。至今病情稳定未见复发。
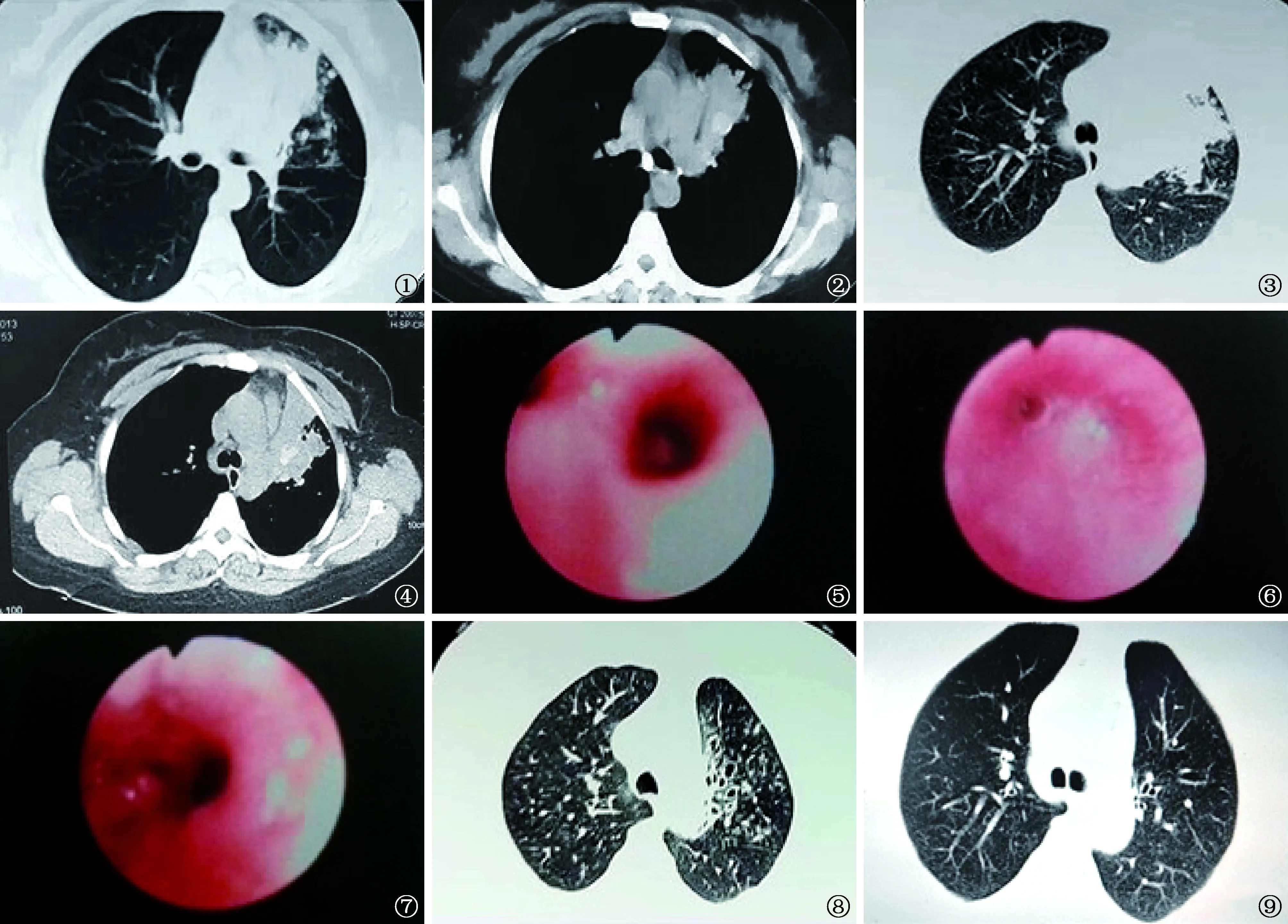
图1,2 胸部CT(2013年5月31日,入院前)检查:显示左肺上叶前段不规则肺实变影,密度较高,边缘不清;周围可见小叶中心性结节,实变病灶内可见高密度的类圆形团块状影,密度略低于肺结核病灶的普通钙化病灶。纵隔内气管隆突前可见肿大淋巴结,伴钙化 图3,4 胸部CT(2013年8月3日,入院时)检查:左上叶肺实变病灶较前进展,其内高密度团块影的位置和形态较前有明显的变化 图5~7 支气管镜检查:左肺上叶前段开口处见肉芽组织增生,在活检过程中该处支气管出现明显狭窄、闭塞,予甲强龙40 mg静脉推注后缓解 图8 胸部CT(2013年9月5日,用泼尼松治疗1个月后)复查,显示原实变病灶及高密度黏液栓消失,囊性中心性支气管扩张清晰可见 图9 胸部CT(2014年4月10日,治疗8个月后):中心性支气管扩张基本恢复正常
例2女,36岁。主诉“频繁发作咳喘、胸闷2年余” 于2016年4月22日收住入我院。患者近2年来反复发作咳喘症状,偶有低热,在当地诊断为“支气管哮喘”,间断口服糖皮质激素、长效β2受体激动剂、茶碱类药物治疗1年余,症状未见好转。入院前近5个月的胸部CT检查,两肺可见多发性斑片状阴影及肺实变病灶,沿支气管周围分布,边缘模糊,伴树芽征和小叶中心性结节及不同程度的柱状支气管扩张,受累及的支气管范围较长,主要为段及亚段支气管,末次胸部CT检查显示左肺下叶基底段出现分支状密度增高影(图10~15),从病灶的进展情况看有游走性的分布特点。因初诊时胸部CT检查显示右下肺背段有沿气道分布的小结节及斑片影,当地医院诊断为“继发性肺结核”,并给予“H-R-Z-E”标准化方案进行抗结核药物治疗2个月,临床症状仍未好转,遂怀疑“支气管结核”转来我院进一步诊治。患者既往曾有“支气管哮喘”病史10余年,长期吸入糖皮质激素治疗。体格检查:体温37.5 ℃,脉搏90次/min,呼吸频率26次/min,血压130/80 mm Hg。两肺呼吸音粗,可闻及哮鸣音,右下肺呼吸音低;心脏与腹部检查未见明显异常。入院后停用抗结核药物治疗。血常规:白细胞6.2×109/L,中性粒细胞比率0.53,嗜酸性粒细胞比率0.335,嗜酸性粒细胞计数3.5×109/L。T-SPOT.TB检测:ESAT-6为5(斑点数),CFP-10为0(斑点数),阴性。血结核抗体阴性。痰抗酸杆菌涂片阴性(3次),痰结核分枝杆菌荧光定量PCR检测阴性。肺功能检查:FEV1%为47.2%,PEF占预计值百分比为42%,FEV1/FVC比值为57.42%,DLCO降低。支气管镜检查所见,各叶段支气管黏膜充血水肿,右肺上叶及左下肺基底段开口处均可见黏液栓塞(图16,17),检查过程中予以吸除。血清总IgE水平>1000 IU/ml,烟曲菌m3过敏原特异性IgE为37.02(4级) kU/L。诊断:ABPA。因患者有长期应用糖皮质激素治疗的病史,故在口服30 mg泼尼松的同时加用了伊曲康唑200 mg/次,2次/d治疗。2个月后患者症状缓解,胸部CT复查显示病灶吸收,总IgE水平下降至550 IU/ml,遂将糖皮质激素逐步减量,伊曲康唑改为200 mg/次,1次/d治疗。总疗程12个月,现仍在随访观察。
例3女,52岁。主诉“咳嗽6个月余,气喘2个月”于2016年10月20日收住入我院。患者于6个月前始阵发性咳嗽,伴胸闷气急,时有低热,在当地医院就诊行胸部CT检查发现:两肺多发性斑片影和肺实变,病灶周围可见小叶中心性结节。外院γ-干扰素释放试验(IGRA)检测阳性。临床诊断为肺结核,给予诊断性抗结核药物治疗,采用H-R-Z-E方案治疗1个月后产生肝功能异常,丙氨酸氨基转移酶(ALT)升高至120 U/L,停用Z,其后4个月采用H-R-E方案进行抗结核药物治疗,并口服水飞蓟宾葡甲胺片(100 mg/次,3次/d)行保肝治疗。治疗期间患者咳喘症状时有反复,胸部CT(2016年10月16日)复查,右肺上叶前段、后段、中叶内侧段可见段性肺实变伴支气管扩张,病灶周围肺野可见树芽征,左肺舌段肺不张(图18~20)。遂来我院进一步诊治。体格检查:体温36.8 ℃,脉搏85次/min,呼吸频率23次/min,血压145/90 mm Hg。两肺呼吸音粗,未闻及干湿性啰音;心脏与腹部检查未见明显异常。入院后停用抗结核药物治疗。血常规:白细胞4.8×109/L,中性粒细胞比率0.55,嗜酸性粒细胞比率0.126,嗜酸性粒细胞计数2.4×109/L。T-SPOT.TB:ESAT-6为6(斑点数),CFP-10为0(斑点数),弱阳性;血结核抗体阴性。痰抗酸杆菌涂片:阴性(3次)。血清总IgE水平检测>1000 IU/ml;烟曲菌m3过敏原特异性IgE为10.67(3级) kU/L。肺功能检查:FEV1%为56.3%,PEF占预计值百分比为63%,FEV1/FVC为68.92%,DLCO正常。诊断:ABPA。给予泼尼松30 mg/次,1次/d,口服。定期进行胸部CT及总IgE水平复查,4个月后病灶明显吸收(图21~23),肺功能恢复正常,总IgE水平下降至正常水平。泼尼松逐步减量至5 mg/次,1次/隔日,维持至停药,总疗程6个月。患者目前病情稳定。
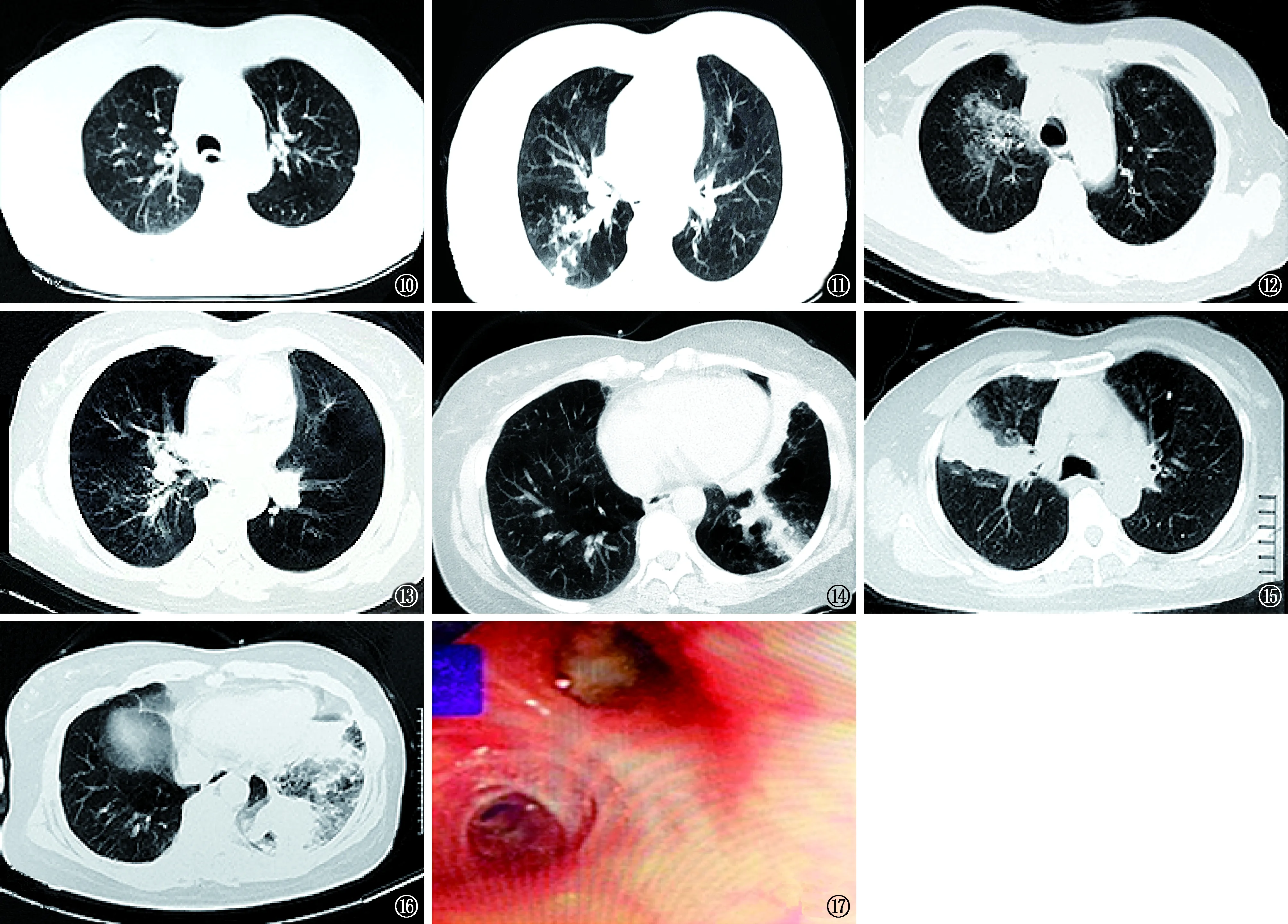
图10,11胸部CT(2015年12月15日)检查,右肺下叶背段见沿支气管分布的斑片状阴影及小叶中心性结节和树芽征图12~14胸部CT(2016年2月26日)检查,右上肺尖段出现斑片状阴影,右下叶背段小叶中心性结节似有吸收,但可见支气管扩张,扩张的支气管与CT扫描线平行呈柱状改变,表现为“轨道征”。左肺下叶基底段及左肺舌叶出现肺实变影图15,16胸部CT(2016年4月22日,入院时)检查,右上肺前段可见斑片状实变影,左肺下叶基底段扩张的支气管内有黏液栓形成,呈指套状改变图17支气管镜检查:左下叶基底段支气管腔内可见黏液栓形成
讨 论
ABPA的发病和病理学机制非常复杂,至今为止,其准确的机制还未完全明确[3]。目前认可度最高的是:支气管及分支内的烟曲霉作为抗原使机体产生过敏反应,易感个体吸入曲霉菌孢子,由于气道局部的清除能力下降使其能够成功定植。曲菌孢子在支气管黏液中生长出菌丝,刺激CD4+T细胞分化而产生IgE、IgG抗体,引起Ⅰ型和Ⅲ型变态反应,致敏肥大细胞释放的炎性介质引起支气管痉挛、水肿和嗜酸性粒细胞聚集[4]。烟曲霉菌的抗原决定部位与支气管上皮细胞的细胞质结构相似,互相竞争同一结合位点,可诱导针对支气管上皮的自体免疫反应的发生。在气道内持续存在的抗原刺激下,一方面支气管内产生大量分泌物,而烟曲霉菌在其中大量繁殖,形成黏液栓,阻塞相应节段支气管,引起支气管扩张及周围肺组织不张;另一方面嗜酸性粒细胞在局部肺组织内长期浸润,产生多种致纤维化的细胞因子,最终导致肺间质纤维化的产生[5]。
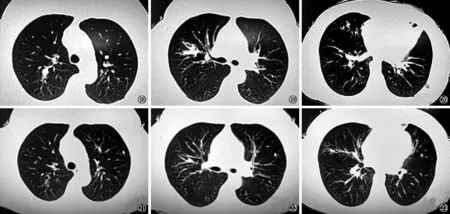
图18~20 女,52岁。胸部CT(2016年10月16日)检查,两肺病灶呈多发性,右肺上叶后段,前段、中叶内侧段可见段性柱状支气管扩张,伴黏液嵌塞征,周围肺野可见树芽征,左肺舌叶肺不张 图21~23 胸部CT(治疗4个月后)检查,显示肺不张及黏液嵌塞征较原来明显好转,中心性支气管扩张有所好转
ABPA的最典型影像学改变是中心性支气管扩张(central bronchiectasis,CB),表现为病灶限在中线内侧2/3肺野内,即近端支气管呈柱状或囊性扩张,远端支气管可正常。如果伴有黏液栓嵌塞,可表现为指套征、牙膏征、结节病灶,通常支气管扩张内的黏液栓为低密度[6-7]。但据文献报道约有18%~20%的黏液栓为高密度黏液栓(high attenuation mucus,HAM),CT值可高达108~168 HU,HAM的形成机制尚未完全阐明,可能与菌丝使黏液变稠、浓缩及钙盐、锰、铁离子的沉积等有关[8]。但得到公认的是[3,9],HAM的形成更容易发生支气管的嵌顿,局部炎症更为严重;HAM预示着更严重的免疫指标异常(包括外周血嗜酸性粒细胞、总IgE、烟曲霉特异性IgE);HAM的存在预示着复发的风险更高,但不影响疾病的完全缓解。近年来有研究表明,白细胞介素-10启动子的基因多态性、表面活性蛋白-A基因多态性与ABPA的易感性有关,故推测HAM的发生与基因异质性相关,但需要更多研究去证实[10]。ABPA的影像学改变还可以表现为肺实变,病灶多为段和亚段分布,与局部嗜酸性粒细胞、单核细胞浸润;气道壁及周围肺组织的炎症反应,引起支气管痉挛、腺体分泌增多有关[6,11]。支气管黏液栓的远端肺野和肺实变区的周围,还出现了树芽征和小叶中心分布结节,其形成的原因与小叶中心性支气管腔被黏液、非干酪性肉芽肿填塞引起的细支气管周围炎症有关。本组3例患者分别具有中心性支气管扩张、HAM、多发性游走性段性肺实变、树芽征和小叶中心性结节等ABPA的典型影像学表现。
2013年国际人和动物真菌学会工作组(International Society for Human and Animal Mycology Workgroup,ISHAM)提出了新的ABPA诊断标准,除支气管哮喘、CF为易患因素外,必备的两项条件是[12]:(1)血清总IgE水平升高(>1000 IU/ml);(2)Ⅰ型(速发型)曲霉皮肤试验阳性,或曲霉特异性IgE水平升高。其他3项次要条件中,最重要的就是ABPA的影像学改变和嗜酸性粒细胞总数的升高。本组3例符合ABPA的诊断标准,例1气道内肉芽肿活检病理为慢性炎症,未见坏死和菌丝,ABPA气道内分泌物也可检出曲霉菌,该例并未加用抗真菌药物治疗,仅以糖皮质激素治疗,预后较好,不支持曲霉菌气道侵袭的诊断。
本组3例患者之所以初诊被误诊为肺结核,是由于我国是结核病高负担国家,肺结核的发病率较高,相对而言ABPA 较为罕见,加之首诊医生对ABPA的认识不够,导致了误诊误治。现将本组3例患者误诊的原因做如下总结:(1)忽视了诊断ABPA的重要线索和临床特征:①本组3例患者虽有不同程度的呼吸道症状,但缺少肺结核典型的中毒症状,无咯血,痰抗酸杆菌涂片阴性,虽然影像学在初诊时有疑似肺结核的表现,但亦不能排除其他炎性肉芽肿性病变的可能,故初诊肺结核的依据并不充分。②3例患者均有不同程度的咳嗽、喘息等症状,肺功能检查显示以阻塞性为主的混合型通气功能障碍,均有外周血嗜酸性粒细胞增多,其中2例有“支气管哮喘”病史。在诊疗过程中对以上ABPA重要的诊断线索未加重视,将其误诊为肺结核、单纯哮喘。初治效果不佳,应考虑诊断是否正确,而不应将病情迁延归结为肺结核并发支气管结核,甚至耐药肺结核。③例1和例3虽然都有IGRA检测阳性的佐证,但是IGRA仅对活动性肺结核有辅助诊断的价值,不能区分结核潜伏感染(LTBI)和活动性结核病,检测结果应结合临床做综合判断。(2)对ABPA 典型影像学特征缺乏认识。①虽然影像上肺结核也可以出现肺实变区内的高密度钙化影,但是肺结核的钙化影相对位置比较固定,常表现为边缘性、层状、中心性和斑块样钙化。而例1的实变区内高密度影在随访过程中位置形态发生了变化,密度也要低于普通肺结核的钙化病灶,结合临床需要考虑到HAM的可能。②ABPA的支气管扩张表现为囊状、柱状及混合型的中心性支气管扩张,远端支气管无明显受累,主要发生于上叶肺组织,可能与该处血供较差、曲霉菌更容易定植有关[13]。ABPA的支气管扩张主要由于支气管腔内黏液栓充填、阻塞引起,经有效治疗,随着黏液栓的排出,囊状和柱状的支气管扩张会显示得更为清晰,除非到晚期一般无管壁破坏、纤维组织增生,一般轮廓较为柔和迂曲,为可逆性病变;而结核引起继发性支气管扩张因管壁平滑肌、弹性纤维破坏,周围组织牵拉等,形态更显僵硬,周围可见纤维条索影,且腔内黏液栓少见。③ABPA的病理学基础为嗜酸性粒细胞浸润和支气管非干酪性肉芽肿,其小叶中心性结节、斑片影和肺实变有多发性和游走性的特点。而结核则是在上皮样肉芽肿的基础上形成干酪样坏死,沿气道分布的斑片结节状影和肺实变影位置相对固定,且易伴有空洞形成。
ABPA主要的治疗方法是口服糖皮质激素,机制为控制曲霉菌引起的炎性反应。Agarwal 等[12]认为有糖皮质激素应用史的患者出现复发或加重应考虑加用抗真菌药物,伊曲康唑的疗效最为确切。例2有“支气管哮喘”病史,长期应用吸入性糖皮质激素,且曾间断口服糖皮质激素,故加用抗真菌药物治疗。近年来有报道证实[14],奥马珠单抗在减少ABPA急性加重及糖皮质激素依赖方面有一定作用,且安全性好,但仍需随机对照实验进一步证实。
通过对本组3例患者的诊治过程进行分析,我们对有喘息症状,诊断性抗结核治疗效果不满意,痰涂片抗酸染色阴性的首诊为肺结核的患者应予高度重视,如同时有典型的影像学改变,应高度警惕ABPA的可能,并给予相关的实验室检查明确之。早期发现、有针对性的治疗,部分ABPA患者的病程可逆,能够避免晚期可能会造成的纤维化和不可逆性的气道损伤而影响患者的长期生存质量。
[1] Agarwal R,Chakrabarti A, Shah A, et al.Allergic broncho-pulmonary aspergillosis:review of literature and proposal of new diagnosticand classification criteria.Clin Exp Allergy,2013,43(8):850-873.
[2] Agarwal R,Gupta D,Aggarwal AN,et al. Clinical significance of hyperattenuating mucoid impaction in allergic bronchopulmonary aspergillosis:an analysis of 155 patients.Chest,2007,132(4):1183-1190.
[3] Denning DW,Pashley C,Hartl D, et al.Fungal allergy in asthma-state of the art and research needs. Clin Transl Allergy,2014,4:1-23.
[4] 牟艳,龚颖,叶伶,等.变态反应性支气管肺曲霉病诊治的研究进展. 国际呼吸杂志,2012,32(24):1876-1880.
[5] 张鼎,胡建,廖纪萍,等.变应性支气管肺曲霉菌病的免疫机制与诊治. 中华临床免疫和变态反应杂志,2015,9(2):142-147.
[6] 张红梅,奚甘平.变态反应性支气管肺曲霉菌病的高分辨率 CT 表现. 实用医学影像杂志,2014,15 (5):341-343.
[7] 胡红,张丽,余丹阳,等. 变应性支气管肺曲霉病七例临床特点分析. 中华结核和呼吸杂志,2012,35(1):37-41.
[8] Phuyal S,Garg MK,Agarwal R,et al. High-attenuation mucus impaction in patients with allergic bronchopulmonary aspergillosis: objective criteria on high-resolution computed tomography and correlation with serologic parameters.Curr Probl Diagn Radiol,2016,45(3):168-173.
[9] Agarwal R,Khan A,Gupta D,et al. An alternate method of classifying allergic bronchopulmonary aspergillosis based on high-attenuation mucus. PLoS One,2010,5(12):e15346.
[10] Brouard J,Knauer N,Boelle PY,et al.Influence of interleukin-10 on Aspergillus fumigatus infection in patients with cystic fibrosis.J Infect Dis,2005,191(11):1988-1991.
[11] 王大鹏,左玉强. 变应性支气管肺曲霉菌病的HRCT表现. 临床影像技术杂志,2015,30(3):35-37.
[12] Agarwal R,Chakrabarti A,Shah A,et al. Allergic bronchopulmonary aspergillosis: review of literature and proposal of new diagnostic and classification criteria. Clinical Exp Allergy,2013,43(8):850-873.
[13] Agarwal R,Khan A,Garg M,et al. Pictorial essay:Allergic bronchopulmonary aspergillosis. Indian J Radiol Imaging,2011,21(4):242-252.
[14] Voskamp AL,Gillman A,Symons K,et al. Clinical efficacy and immunologic effects of omalizumab in allergic bronchopulmonary aspergillosis. J Allergy Clin Immunol Pract, 2015,3(2):192-199.
(本文编辑:范永德)
10.3969/j.issn.1000-6621.2017.10.023
211131 南京市公共卫生医疗中心结核科
张侠,Email:zhangxia365@sina.com
2017-06-26)
——曲霉菌

