肺结核患者外周血T淋巴细胞亚群检测结果与病情的相关性研究
杨铭 袁平 吴怀戈 王燕 田明 黄晓秋
·论著·
肺结核患者外周血T淋巴细胞亚群检测结果与病情的相关性研究
杨铭 袁平 吴怀戈 王燕 田明 黄晓秋
结核, 肺; T淋巴细胞亚群; 疾病严重程度指数; 统计学, 非参数; 数据说明, 统计
众所周知,肺结核的发病与细胞免疫功能密切相关,机体抗结核的免疫力主要由T淋巴细胞及巨噬细胞介导,尤其是CD4+T淋巴细胞具有主导作用,那么,在肺结核患者中进行外周血T淋巴细胞亚群检测,分析其中CD3+、CD4+和CD8+T淋巴细胞计数等主要指标与患病情况及临床特征的相关性,势必能为临床工作带来指导价值。为能具体了解外周血T淋巴细胞亚群与肺结核发病情况及其临床特征的关系,成都市公共卫生临床医疗中心搜集了2014年1月1日至2015年12月31日收治的新发涂阳成年肺结核患者的患病情况与外周血T淋巴细胞亚群水平资料,并进行了相关性分析,以期为临床诊治提供一定的参考。
资料和方法
一、 一般资料
1.一般情况:搜集 2014年1月1日至2015年12月31日在我院收治的具有痰涂片抗酸杆菌检查阳性结果,和外周血T淋巴细胞亚群检测结果的新发成年肺结核患者资料,并参照纳入及排除标准共入选1561例,其中男1074例(68.80%),女487例(31.20%);年龄18~95岁,平均年龄为(47.58±20.75)岁;抗酸杆菌痰涂片镜检结果:“+”者1081例(69.25%)、“++”者 211例(13.52%)、“+++”者103例(6.60%)、“++++”者166例(10.63%);并发肺外结核患者516例次(33.06%),包括支气管结核275例、结核性脑膜炎19例、骨结核18例、腹腔结核45例、淋巴结结核72例、泌尿系结核10例,并发2种及2种以上肺外结核77例;病变累及1个肺叶(段)者56例(3.59%),2个肺叶(段)162例(10.38%),≥3个肺叶段1343例(86.03%)。
2.患者纳入:每例搜集的患者均进行了胸部CT平扫、痰涂片抗酸染色检查,同时临床常规进行细胞免疫功能检测。肺结核诊断符合中华医学会《临床诊疗指南:结核病分册》标准[1],并排除并发HIV感染、肿瘤、免疫系统疾病,及3个月内使用免疫抑制剂和严重营养不良、孕妇等可能出现免疫功能受影响者。
3.分组:按照CD3+、CD4+和CD8+T淋巴细胞检测水平分为如下各组:CD3+降低组(876例,CD3+水平低于770个/μl者),CD3+正常组(666例,CD3+水平在770~2041个/μl者),CD3+升高组(19例,CD3+水平高于2041个/μl者);CD4+降低1组(99例,CD4+水平<100个/μl者),CD4+降低2组(173例,CD4+水平在100~199个/μl者),CD4+降低3组(267例,CD4+水平在200~299个/μl者),CD4+降低4组(264例,CD4+水平在300~413个/μl者),CD4+正常组(719例,CD4+水平在414~1123个/μl),CD4+升高组(39例,CD4+水平高于1123个/μl者);CD8+降低组(743例,CD8+水平低于238个/μl者),CD8+正常组(790例,CD8+水平在238~874个/μl者),CD8+升高组(28例,CD8+水平高于874个/μl者)。其中CD3+T淋巴细胞计数正常参考值:770~2041个/μl、CD4+T淋巴细胞计数正常参考值:414~1123个/μl、CD8+T淋巴细胞计数正常参考值:238~874个/μl。
二、研究方法
1.检测方法:对符合入选标准的1561例新发成年涂阳肺结核患者采集空腹静脉血5 ml,经过乙二胺四乙酸(EDTA)抗凝,采用流式细胞仪(贝克曼公司生产,型号FC500),以CD45+/CD4+/CD8+/CD3+T淋巴细胞检测试剂盒进行外周血T淋巴细胞亚群检测,检测方法为直接法的免疫荧光标记法[2]。
2.观察指标:对上述每组患者的痰涂片结果、受累肺叶与肺段数量和是否存在肺外结核以及并发肺外结核种类数量等临床患病特征进行统计学分析,其中痰涂片结果[萋-尼(Ziehl-Neelsen)染色法]判定标准[3]:①“+”:100个视野内发现3~9条抗酸杆菌;②“++”:10个视野内发现1~9条抗酸杆菌;③“+++”:每个视野内发现1~9条抗酸杆菌;④“++++”:每个视野内发现≥10条抗酸杆菌。病变累及范围以解剖位置的肺叶、肺段划分。
三、统计学分析
采用SPSS 17.0软件进行统计学分析,其中多分类计数资料(CD3+、CD4+、CD8+T淋巴细胞计数与肺外结核)采用χ2检验,双向有序分类计数资料(CD3+、CD4+、CD8+T淋巴细胞计数水平与不同痰涂片结果、肺叶和肺段受累数)采用Spearman相关系数(rs)分析其相关程度后,再采用线性趋势检验分析组间线性变化趋势,均以P<0.05为差异有统计学意义。
结 果
一、外周血CD3+T淋巴细胞计数分组与患病情况的相关性(表1)
1.CD3+T淋巴细胞各组计数水平情况:1561例患者中,CD3+降低组876例(56.12%),CD3+平均水平为(464.35±189.53)个/μl,平均年龄(51.65±19.71)岁;CD3+正常组666例(42.66%),CD3+平均水平为(1120.70±297.83)个/μl,平均年龄(42.10±18.37)岁;CD3+升高组19例(1.22%),CD3+平均水平为(2417.80±421.24)个/μl,平均年龄(51.95±14.53)岁。
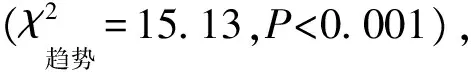
二、外周血CD4+T淋巴细胞计数分组与患病情况的相关性(表2)
1.CD4+T淋巴细胞各组计数水平情况:1561例患者中,下降者共计803例(51.44%),其中CD4+降低1组99例(6.34%),CD4+平均水平为(65.71±22.51)个/μl,平均年龄(57.08±20.62)岁;CD4+降低2组173例(11.08%),CD4+平均水平为(151.13±33.52)个/μl,平均年龄(55.49±19.60)岁;CD4+降低3组267例(17.11%),CD4+平均水平为(246.81±32.34)个/μl,平均年龄(52.85±19.94)岁;CD4+降低4组264例(16.91%),CD4+平均水平为(354.58±44.10)个/μl,平均年龄(46.17±18.63)岁。CD4+正常组719例(46.06%),CD4+平均水平为(613.38±161.52)个/μl,平均年龄(42.89±18.64)岁;CD4+升高组39例(2.50%),CD4+平均水平为(1334.82±192.01)个/μl,平均年龄(48.21±44.09)岁。


三、外周血CD8+T淋巴细胞计数分组与患病情况的相关性(表3)
1.CD8+T淋巴细胞各组计数水平情况:1561例患者中,CD8+降低组743例(47.60%),CD8+平均水平为(140.70±59.37)个/μl,平均年龄(52.18±19.35)岁;CD8+正常组790例(50.61%),CD8+平均水平为(394.09±131.24)个/μl,平均年龄(43.04±19.01)岁;CD8+升高组28例(1.79%),CD8+平均水平为(1049.10±220.56)个/μl,平均年龄(53.54±10.02)岁。

讨 论
当前我国结核病疫情仍然十分严峻,2010年全国第五次结核病流行病学抽样调查报告显示,全国活动性肺结核的患病率约为459/10万例,四川省活动性肺结核的患病率为598/10万例[4],结核病的防控仍是长期面临的一大挑战。
众所周知,肺结核发病与机体细胞免疫状况密切相关。T淋巴细胞亚群,特别是CD4+和CD8+T淋巴细胞在抗结核感染中发挥着重要作用[5-8]。目前为止,国内外有很多研究者已经研究了结核病患者外周血和支气管肺泡灌洗液中主要T细胞亚群的变化,但得出的结果并不完全一致。普遍认为结核病患者中存在CD3+、CD4+T淋巴细胞计数以及CD4+/CD8+比值的下降,也有一些研究表明,肺结核患者外周血中CD4+T淋巴细胞计数减少,但CD8+T淋巴细胞的变化是不一致的[9-10],其中石莲等[11]就在其研究中指出肺结核患者中CD8+T淋巴细胞减少或不改变,黄丽静等[12]则指出肺结核患者中CD8+T淋巴细胞增多。同时,一些对新诊断的肺结核患者治疗前淋巴细胞亚群的研究表明,患者外周血CD4+/CD8+比值明显降低,CD4+T淋巴细胞计数减少,而CD8+T淋巴细胞计数增加[13-14]。Yin等[15]所做的一项Meta分析也显示了多项研究所得结果并不完全一致。
目前,公认的抗结核免疫力主要由T淋巴细胞及巨噬细胞介导,其中CD3+T淋巴细胞主要起信号转导作用,能够激活T淋巴细胞,使机体产生细胞免疫,而CD4+T淋巴细胞具有主导作用,参与结核免疫的CD4+T淋巴细胞包括辅助T细胞、溶解T细胞、变态反应细胞、记忆T细胞等,它们有不同的表型和功能,介导不同的免疫反应,其中CD4+辅助T淋巴细胞则能够促进T细胞、B细胞等免疫细胞的增殖、分化,放大免疫反应使结核分枝杆菌的生长受到抑制,不同的CD4+辅助T淋巴细胞亚组协同控制感染的发展,上述观点已经在国内外多项权威研究中得到证实[16-21]。
对于结核分枝杆菌感染中CD8+T淋巴细胞作用的认识是相对较新的,这一细胞在控制结核感染时的作用也逐渐被重视。最近的研究已经显示CD8+T淋巴细胞可以更好地支持保护CD4+T淋巴细胞[22]。它们间的效应机制可有助于控制结核分枝杆菌感染,CD8+T淋巴细胞可发挥细胞毒作用,溶解受感染后失去免疫活性的靶细胞使之凋亡,在促使结核分枝杆菌暴露及病灶清除方面有重要作用[18,23]。Lin和Flynn[24]在其研究中指出,T细胞在结核感染宿主免疫应答中发挥重要作用。缺乏CD4+T淋巴细胞的患者,尤其是HIV感染患者,对原发和再发结核病的易感性均明显增加。虽然CD8+T淋巴细胞最初被认为是不太重要的,但现在已经认识到,它们在结核分枝杆菌的免疫应答中发挥了关键而复杂的作用。作为细胞内的生物,结核分枝杆菌抗原可被胞浆或者抗原处理依赖机制相关的转运蛋白、空泡或吞噬体清除[23]。CD8+T淋巴细胞同CD4+T淋巴细胞一样都能够产生IL-2、IFN-γ和TNF,这些细胞因子已经被确定在结核分枝杆菌感染中有着重要功能。更重要的是,CD8+T淋巴细胞具有细胞溶解的功能,可通过颗粒介导的作用(如通过穿孔素、颗粒酶、颗粒溶解素)杀死结核分枝杆菌或者Fas-Fas配体的相互作用诱导细胞凋亡。在人类中,CD8+T淋巴细胞可以产生颗粒溶解素,可以直接杀死结核分枝杆菌。CD8+T淋巴细胞通过以上几种机制潜在地介导对结核分枝杆菌感染的保护[25-28]。
正常生理情况下,T细胞及其亚群含量及分布相对稳定,并处于平衡状态,一旦失衡,可造成机体免疫功能紊乱。结核病患者多存在外周血T细胞亚群的异常改变,尤其是外周血CD4+辅助T淋巴细胞明显低于健康人群,随着机体CD4+T淋巴细胞数量的减少,机体对结核分枝杆菌的杀伤力也下降,从而导致疾病的进展和治疗的失败,此观点在多篇研究著作中已经有相关报道[29-32]。
本研究显示1561例患者中,初治涂阳成年肺结核患者T淋巴细胞亚群均有不同程度改变,存在不同程度的CD3+、CD4+和CD8+T淋巴细胞计数的改变,证实肺结核发病与细胞免疫密切相关。其中CD3+、CD4+T淋巴细胞计数出现下降者分别达到56.12%(876/1561)、51.44%(803/1561),与前述研究结果相符,但同时本项研究显示CD8+T淋巴细胞降低的比例也达到了47.60%(743/1561),而其升高者仅占极少比例,这就与以往许多报道所提到的“在结核病患者中往往存在CD8+T淋巴细胞的升高”不符,笔者进一步回顾了国外既往的一些相关研究,其中部分研究显示,在结核病患者中CD8+T淋巴细胞也会出现下降,其中Rodrigues等[33]就在其研究中提到外周血CD4+T淋巴细胞耗竭的肺结核患者在成功的化疗后恢复到正常水平,此点与其他研究相一致;而CD8+T淋巴细胞计数表现为明显下降,治疗后恢复。这种现象可能反映了在一些结核病患者中存在着一定程度的免疫缺陷,这一缺陷在特定的迟发型超敏反应(DTH反应)严重的情况下可能发生。Gao等[34]指出,在HIV阴性人群中,活动性结核病患者与潜伏性结核病患者或健康对照者相比,其T细胞亚群的绝对数量,包括 CD4+、CD8+T淋巴细胞在内的多项指标均明显下降。我国学者曹彦等[35]也在其研究中提到肺结核患者外周血CD8+T淋巴细胞表达下降,这些情况与文中前述提到的多项研究所得结果不完全一致,提示关于CD8+T淋巴细胞在结核病中的变化及其机制和作用有待进一步研究。
此外多项研究显示,肺结核患者不同病情严重程度间免疫功能受损程度存在差异[12,36-37]。本研究结果表明,外周血CD3+、CD4+、CD8+T淋巴细胞计数与其患病情况密切相关,其中临床患病情况与CD3+、CD4+、CD8+T淋巴细胞计数呈负相关,即随着CD3+、CD4+、CD8+T淋巴细胞计数降低越明显,肺结核患者的痰菌数量越高,病变累及范围越多,但均与并发肺外结核多少无关,由此可见T淋巴细胞的水平变化尤其是CD3+、CD4+、CD8+T淋巴细胞计数对肺结核病情严重程度能够起到一定预测作用,故而在肺结核患者中进行T淋巴细胞检测具有较大价值。
综上所述,对结核病患者进行外周血T淋巴细胞亚群,尤其是CD3+、CD4+和CD8+T淋巴细胞检测在患者的免疫功能状态判断、病情评估中都具有重要价值,值得推广;而且因其变化与肺结核病情严重程度呈负相关,故对结核病患者在有效抗结核治疗基础上进行免疫治疗干预有可能促进结核病的愈合,改善结核病的预后。此推论仍有待于进行更加深入的研究验证。
[1] 中华医学会.临床诊疗指南:结核病分册.北京:人民卫生出版社,2005.
[2] 中华人民共和国卫生部.WS/T360-2011流式细胞术检测外周血淋巴细胞亚群指南.北京:中国标准出版社,2011.
[3] 中国防痨协会.结核病诊断细菌学检验规程.中国防痨杂志,1996, 18(1):28-31.
[4] 全国第五次结核病流行病学抽样调查技术指导组,全国第五次结核病流行病学抽样调查办公室,中国疾病预防控制中心结核病预防控制中心.2010年全国第五次肺结核流行病学抽样调查报告.中国防痨杂志,2012,34(8):485-500.
[5] O’Garra A, Redford PS, McNab FW, et al. The immune response in tuberculosis. Annu Rev Immunol,2013,31:475-527.
[6] Jasenosky LD, Scriba TJ, Hanekom WA, et al. T cells and adaptive immunity toMycobacteriumtuberculosisin humans. Immunol Rev, 2015,264(1):74-87.
[7] Jasenosky LD,Scriba TJ,Hanekom WA, et al. T cells and adaptive immunity toMycobacteriumtuberculosisin humans. Immunol Rev, 2015, 264(1):74-87.
[8] 马玙,朱莉贞,潘毓萱.结核病.北京:人民卫生出版社,2006:46-58.
[9] Aguiar LM, Antonangelo L, Vargas FS, et al. Malignant and tuberculous pleural effusions: immunophenotypic cellular chara-cterization.Clinics(Sao Paulo),2008,63(5): 637-644.
[10] AI Majid FA, Abba AA.Immunophenotypic characterization of peripheral T lymphocytes in pulmonary tuberculosis.J Postgrad Med,2008,54(1): 7-11.
[11] 石莲,张丽华,孟萍,等.肺结核患者外周血T淋巴细胞亚群测定的临床研究.中国防痨杂志, 2009, 31(11): 673-675.
[12] 黄丽静,陈焯彬,韦永孜,等.肺结核患者病情严重程度与免疫功能受损程度的相关性研究.海南医学,2016,27(9):1424-1426.
[13] Fateminasab FD, Shahgasempour S, Mirsaeidi SM,et al.Increased activation and expression of a CD57+subset within peripheral CD8+T lymphocytes inMycobacteriumtuberculosis-infected patients.Arch Iran Med,2006,9(1): 53-57.
[14] Wu YE, Zhang SW, Peng WG, et al. Changes in lymphocyte subsets in the peripheral blood of patients with active pulmonary tuberculosis.J Int Med Res,2009, 37(6): 1742-1749.
[15] Yin Y,Qin J,Dai Y, et al.The CD4+/CD8+ratio in pulmonary tuberculosis: systematic and meta-analysis article. Iran J Public Health,2015, 44(2): 185-193.
[16] Ernst JD. The immunological life cycle of tuberculosis.Nat Rev Immunol, 2012,12(8):581-591.
[17] Kumar P. Adult pulmonary tuberculosis as a pathological mani-festation of hyperactive antimycobacterial immune response. Clin Transl Med,2016,5(1):38.
[18] Prezzemolo T, Guggino G, La Manna MP, et al. Functional signatures of human CD4 and CD8 T cell responses toMycobacteriumtuberculosis.Front Immunol,2014,5:180.
[19] Riou C,Strickland N,Soares AP. HIV skews the lineage-defining transcriptional profile ofMycobacteriumtuberculosis-specific CD4+T cells. J Immunol,2016,196(7):3006-3018.
[20] Jasenosky LD,Scriba TJ,Hanekom WA,et al. T cells and adaptive immunity toMycobacteriumtuberculosisin humans. Immunol Rev,2015,264(1):74-87.
[21] 周芬,杨玉婷,华彦珺,等.CD4+T细胞对肺结核诊断的ROC曲线分析.中国卫生检验杂志,2015,25(19):3280-3282.
[22] Silva BD, Trentini MM, da Costa AC, et al. Different phenotypes of CD8+T cells associated with bacterial load in active tuberculosis. Immunol Lett, 2014,160(1):23-32.
[23] Behar SM.Antigen-specific CD8+T cells and protective immunity to tuberculosis.Adv Exp Med Biol,2013, 783:141-163.
[24] Lin PL, Flynn JL. CD8 T cells andMycobacteriumtuberculosisinfection.Semin Immunopathol,2015,37(3): 239-249.
[25] Shang S,Siddiqui S,Bian Y,et al.Nonclassical MHC ib-restricted CD8+T cells recognizeMycobacteriumtuberculosis-derived protein antigens and contribute to protection against infection.PLoS Pathog, 2016, 12(6):e1005688.
[26] Lindestam Arlehamn CS, Lewinsohn D, Sette A, et al.Antigens for CD4 and CD8 T cells in tuberculosis. Cold Spring Harb Perspect Med, 2014,4(7):a018465.
[27] Caccamo N, Pietra G, Sullivan LC, et al.Human CD8 T lymphocytes recognizeMycobacteriumtuberculosisantigens presented by HLA-E during active tuberculosis and express type 2 cytokines. Eur J Immunol,2015,45(4):1069-1081.
[28] Rozot V,Patrizia A,Vigano S, et al.Combined use ofMycobacteriumtuberculosis-specific CD4 and CD8 T-cell responses is a powerful diagnostic tool of active tuberculosis. Clin Infect Dis,2015, 60(3): 432-437.
[29] 孙娜,张丽萍.初治结核病与复治结核病患者外周血T细胞亚群的变化分析.中国医药指南,2016,14(9):183-184.
[30] 王庆枫,韩喜琴,陈玉玲,等.肺结核患者T淋巴细胞亚群的检测及临床意义.北京医学,2013,35(12):993-995.
[31] 栗群英,吴丽娟,陈莉,等.结核病患者T细胞亚群检测临床意义分析.国际检验医学杂志,2012,33(19):2346-2347.
[33] Rodrigues DS, Medeiros EA, Weckx LY,et al. Immunophenotypic characterization of peripheral T lymphocytes inMycobacteriumtuberculosisinfection and disease. Clin Exp Immunol,2002,128(1): 149-154.
[34] Gao Y, Zhang S, Ou Q,et al.Characterization of CD4/CD8+αβ and Vγ2Vδ2+T cells in HIV-negative individuals with differentMycobacteriumtuberculosisinfection statuses. Hum Immunol,2015,76(11):801-807.
[35] 曹彦,吴冬梅,王心静,等. 肺结核患者外周血CD4+、CD8+T细胞Blimp-1表达下降.临床肺科杂志,2015,20(5):777-780.
[36] 刘宁,苏明霞,李雯,等.肺结核患者肺泡灌洗液及外周血淋巴细胞亚群检测分析.中国临床医生杂志,2016, 44(4):49-51.
[37] 翟慧,刘一典,唐神结,等.肺结核患者外周血NKT细胞、NK细胞、T淋巴细胞亚群的变化及意义.同济大学学报(医学版),2010, 31(5):42-46.
(本文编辑:孟莉 薛爱华)
StudyoncorrelationbetweenexaminationresultsofTlymphocytesubsetsinperipheralbloodofpatientswithpulmonarytuberculosisandseverityoftheirdisease
YANGMing,YUANPing,WUHuai-ge,WANGYan,TIANMing,HUANGXiao-qiu.
DepartmentofTuberculosis,PublicHealthClinicCentreofChengdu,Chengdu610061,China
Correspondingauthor:YUANPing,Email: 153198312@qq.com
ObjectiveTo explore the correlation between the examination results of peripheral blood T lymphocyte subsets and the severity of the disease in adult patients with smear positive pulmonary tuberculosis (PTB).MethodsThe information and data of 1561 adult patients who were diagnosed as smear positive PTB and had the examination results of peripheral blood T lymphocyte subsets, and treated in Chengdu Public Health Clinical Centre from January 1st, 2014 to December 31st, 2015 were collected. Those enrolled patients were grouped according to the levels of CD3+, CD4+and CD8+cell counts: group with low CD3+(876 cases, the CD3+level was lower than 770/μl), group with normal CD3+(666 cases, the CD3+level ranged 770-2041/μl), group with high CD3+(19 cases, the CD3+level was higher than 2041/μl); group 1 with low CD4+(99 cases, the level of CD4+was lower than 100/μl), group 2 with low CD4+(173 cases, the level of CD4+was 100-199/μl), group 3 with low CD4+(267 cases, the level of CD4+was 200-299/μl), group 4 with low CD4+(264 cases, the level of CD4+was 300-413/μl), group 5 with normal CD4+(719 cases, the level of CD4+was 414-1123/μl), group 6 with high CD4+(39 cases, the level of CD4+was higher than 1123/μl); group with low CD8+(743 cases, the level of CD8+was lower than 238/μl), group with normal CD8+(790 cases, the level of CD8+was 238-874/μl), group with high CD8+(28 cases, the level of CD8+was higher than 874/μl). The correlation between the levels of CD3+, CD4+and CD8+cell counts and the clinical conditions of these patients was analyzed. The data obtained from above mentioned groups were analyzed by using Spearman correlation coefficient (rs), linear trend test andχ2test, andP<0.05 was considered to be statistically significant.ResultsIn 1561 adult smear-positive PTB patients, the T lymphocyte subsets in all patients had changed in varying degrees. Among them, the proportions of the patients with reduced CD3+, CD4+and CD8+cell counts were 56.12% (876/1561), 51.44% (803/1561) and 47.60% (743/1561) respectively. The different levels of CD3+, CD4+and CD8+cell counts ((464.35±189.53)-(2417.80±421.24)/μl, (65.71±22.51)-(1334.80±192.01)/μl, (140.70±59.37)-(1049.10±220.56)/μl) and the patients’ sputum smear results (65.64% (575/876)-84.21% (16/19), 65.66% (65/99)-74.36% (29/39), 67.16% (499/743)-85.71% (24/28)) were closely related (Spearman correlation coefficient (rs)=-0.10,P<0.001;rs=-0.06,P=0.014;rs=-0.05,P=0.035) and there was a linear trend (χ2=15.13,P<0.001;χ2=6.80,P=0.009;χ2=5.54,P=0.019); the different levels of CD3+, CD4+and CD8+cell counts and the lesions of lung involved (92.01% (806/876)-89.47% (17/19), 94.95% (94/99)-82.05% (32/39), 91.79% (682/743)-78.57% (22/28)) were closely related also (rs=-0.19,rs=-0.16,rs=-0.16,P<0.001), and there was a linear trend (χ2=42.39,χ2=34.64,χ2=32.07,P<0.001).ConclusionThe levels of CD3+, CD4+and CD8+cell counts in peripheral blood of the adult patients with smear positive PTB were closely related to the disease severity of those patients; the lower of CD3+, CD4+and CD8+cell counts, the higher number of sputum bacteria in these patients and the more lesions involved.
Tuberculosis, pulmonary; T-lymphocyte subsets; Severity of illness index; Statistics, nonparametric; Data interpretation, statistical
10.3969/j.issn.1000-6621.2017.10.013
成都市卫生和计划生育委员会临床科研项目(2015173)
610061 成都市公共卫生临床医疗中心结核科(杨铭、袁平、吴怀戈),医院感染管理科(王燕),疾病防治科(田明),病案管理科(黄晓秋)
袁平,Email:153198312@qq.com
2017-03-13)

