PD-1和PD-L1在胃癌组织中的表达及临床意义
朱卫伟
安阳市肿瘤医院 河南 安阳 455000)
PD-1和PD-L1在胃癌组织中的表达及临床意义
朱卫伟
安阳市肿瘤医院 河南 安阳 455000)
目的检测PD-L1和PD-1在胃癌组织中的表达情况,探讨其与患者临床病理特征和疾病进展的关系。方法回顾性分析2015年2月至2016年11月在安阳市肿瘤医院行根治性手术的64例胃癌患者的临床资料,选取手术区标本作为观察组,随机选取癌旁组织标本作为对照组。观察对比两组PD-1和PD-L1的检测结果,分析其与患者临床病理特征和疾病进展的关系。结果观察组标本PD-L1阳性率高于对照组(65.6%比0.0%),PD-1阳性率高于对照组(39.1%比0.0%),差异均有统计学意义(P<0.05);浸润到浆膜层,有淋巴结转移,Ⅲ、Ⅳ期者PD-L1阳性率高于其他患者,差异有统计学意义(P<0.05);PD-1表达水平和癌灶浸润情况、淋巴结转移情况、分期无关。结论PD-1和PD-L1在胃癌组织中表达水平明显升高,且PD-L1的表达和患者病理特征关系密切,可能成为预测胃癌进展的新型分子标志物,阻断PD-L1/PD-1信号通路可能是对肿瘤患者展开免疫治疗的重要途径,为胃癌患者免疫治疗提供新思路。【
】 胃癌;PD-L1;PD-1
胃癌是一种常见的消化系统恶性肿瘤,早期多无明显症状,少数人有恶心、呕吐或类似溃疡病的上消化道症状,在中国其发病率居首位,严重威胁患者的生命健康[1-3]。针对胃癌患者,临床提倡早诊断、早治疗,及时有效的治疗是良好预后的前提[4]。程序性死亡受体1(programmed death 1,PD-1)是一种重要的免疫抑制分子,以其为靶点的免疫调节对抗肿瘤、抗感染、抗自身免疫性疾病及移植器官存活等均有重要意义,其配体PD-L1也可作为靶点,相应的抗体也可以起到相同的作用[5]。本研究选取64例胃癌患者,旨在检测PD-L1和PD-1在胃癌组织中的表达情况,探讨其与患者临床病理特征和疾病进展的关系。
1 资料与方法
1.1一般资料回顾性分析2015年2月至2016年11月在安阳市肿瘤医院行根治性手术治疗的64例胃癌患者的临床资料,选取手术区标本作为观察组,随机选取癌旁组织标本作为对照组。所有患者均经手术病理确诊为胃癌。其中男40例,女24例,年龄32~75岁,平均(56.3±4.2)岁。所有患者术前均未接受化疗或放疗,无远处转移,临床资料完整。
1.2检测方法应用免疫组织化学PV-6000两步法进行指标检测。所采集的标本均制为蜡块,连续切片,厚度为4 μm,经脱蜡、水化处理,滴入3%过氧化氢溶液,在室温中反应10 min,以PBS缓冲液冲洗3次,5 min/次,放入柠檬酸盐缓冲液(pH=6.0),于微波炉内加热20 min,实施抗原修复;取出后自然冷却,恢复室温后再用PBS进行3次冲洗,5 min/次,滴入1∶200稀释的鼠抗人PD-1单克隆抗体和1∶200稀释的兔抗人PD-L1多克隆抗体,在4 ℃条件下过夜,孵育后以PBS冲洗液冲洗3次,5 min/次;以PV-6000二抗试剂盒向每张切片加入50 μl二抗,室温中孵育20 min,以PBS冲洗液再冲洗3次,5 min/次;每张切片滴加新配置的DAB显色剂100 μl,室温条件下避光显色,光学显微镜下控制显色时间,3~5 min后以蒸馏水冲洗,显色终止;以苏木精行1 min复染,采用自来水冲洗,返蓝,用梯度酒精脱水并干燥,并用二甲苯行透明处理,采用中性树胶封片。所有的免疫组化切片均由固定的2位病理科医师进行独立评估。
1.3观察指标观察对比两组PD-1和PD-L1的检测结果,分析其与患者临床病理特征和疾病进展的关系。PD-1和PD-L1阳性判定标准:以细胞膜或细胞浆中可见黄色至棕褐色颗粒为阳性显色。
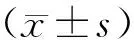
2 结果
2.1PD-1和PD-L1检测结果观察组标本PD-L1阳性率高于对照组(65.6%比0.0%),PD-1阳性率高于对照组(39.1%比0.0%),差异均有统计学意义(χ2=62.51、31.07,P<0.05)。
2.2观察组PD-1和PD-L1表达情况与患者临床特征及疾病进展的关系浸润到浆膜层、有淋巴结转移、Ⅲ、Ⅳ期者PD-L1阳性率高于其他患者,差异均有统计学意义(P<0.05);PD-1表达水平和癌灶浸润情况、淋巴结转移情况、分期无关。见表1。

表1 观察组PD-1和PD-L1表达情况与患者临床特征及疾病进展的关系[n(%)]
3 讨论
PD-L1是氨基酸跨膜蛋白,含有胞外区域与中间疏水结构,有蛋白磷酸化活化位点,在诸多恶性肿瘤如胃癌、乳腺癌、食管癌、肺癌中均有过度表达。PD-1为具有单一胞外IgV样功能区域的Ⅰ型穿膜蛋白,包含氨基酸残基288个,是一种负性共刺激信号分子。在诸多肿瘤组织淋巴细胞内,特别是T淋巴细胞中,均可见PD-1的过度表达。
本研究结果显示,观察组标本PD-L1阳性率高于对照组(65.6%比0.0%),PD-1阳性率高于对照组(39.1%比0.0%),差异均有统计学意义(P<0.05),提示PD-1和PD-L1在胃癌组织中均高度表达,呈正相关。分期为Ⅲ、Ⅳ期患者PD-L1阳性率明显高于Ⅰ、Ⅱ期,提示PD-L1表达水平高的胃癌患者其病理分期较晚,这可能是缺少正常的免疫监视所引起的。浸润到浆膜层、有淋巴结转移的患者PD-L1表达水平高于浸润到肌层或黏膜或黏膜下、无淋巴结转移的患者,可能是因为PD-L1可通过调节免疫功影响肿瘤微环境,促进肿瘤的转移机浸润。PD-L1结合其受体后,可诱导T细胞凋亡,促使效应T细胞失活,抑制抗肿瘤免疫。肿瘤细胞内PD-L1升高和其在肿瘤微环境中的免疫反应负向调节功能说明,通过阻断PD-L1/PD-1信号通路可能是对肿瘤患者展开免疫治疗的可靠途径,有待进一步深入研究。
综上所述,PD-1和PD-L1在胃癌组织中表达水平明显升高,且PD-L1的表达和患者病理特征关系密切,可能成为预测胃癌进展的新型分子标志物,阻断PD-L1/PD-1信号通路可能是对肿瘤患者展开免疫治疗的重要途径,为胃癌患者免疫治疗提供新思路。
[1] 张锋,韦海涛,王作培,等.食管鳞癌组织中程序性死亡分子1表达变化及意义[J].山东医药,2016,56(26):41-43.
[2] 雷泽民,余宗阳.非小细胞肺癌T细胞PD-1免疫靶向治疗研究现状与展望[J].中国肿瘤,2015,24(5):398-402.
[3] 宗云辉,何宋兵,游凤涛,等.PD-1和TIM-3在胃癌病人免疫组织CD3+T细胞中的表达分析[J].免疫学杂志,2014,5(10):902-905.
[4] 骆飞,孙昭,白春梅.PD-1/PD-L1在胃癌中的研究进展[J].癌症进展,2016,14(6):503-506.
[5] 祁玲,黄镜.PD-1/PD-L1抑制剂在晚期胃癌治疗中的临床研究进展[J].中国生化药物杂志,2016,36(7):4-7.
R 735.2doi: 10.3969/j.issn.1004-437X.2017.18.016
2017-01-25)

