颞下-乙状窦后联合锁孔入路显微手术治疗岩斜区巨大脑膜瘤临床观察
袁 亮 曲瑞杰 李鹏起 苏鑫洪 闫志强△ 李文德 陈立华△
1)第四军医大学西京医院神经外科,陕西 西安 710032 2)中国人民解放军32133部队分队,山西 大同 037034 3)中国人民解放军陆军总医院附属八一脑科医院,北京 100700
·论著科研之窗·
颞下-乙状窦后联合锁孔入路显微手术治疗岩斜区巨大脑膜瘤临床观察
袁 亮1)曲瑞杰2)李鹏起1)苏鑫洪1)闫志强1)△李文德3)陈立华3)△
1)第四军医大学西京医院神经外科,陕西 西安 710032 2)中国人民解放军32133部队分队,山西 大同 037034 3)中国人民解放军陆军总医院附属八一脑科医院,北京 100700
目的探讨应用颞下-乙状窦后联合锁孔入路显微手术治疗岩斜区大型、巨大型脑膜瘤的手术方法及疗效。方法回顾性分析采用颞下-乙状窦后联合锁孔入路显微手术治疗的24例大型、巨大型岩斜区脑膜瘤患者的临床资料,总结手术经验和临床疗效。结果24例患者肿瘤全切除(Simpson Ⅰ、Ⅱ级)20例(83.3%),次全切除(Simpson Ⅲ级)4例(16.7 %)。术后新增神经功能障碍7例(29.2%),出现脑干出血1例(4.2%),脑干梗死1例(4.2%),脑脊液漏1例(4.2%),颅内感染1例(4.2%),肺部感染2例(8.3%)。无围手术期死亡病例。术后随访3~59个月,无肿瘤复发或残余肿瘤明显进展。结论对于中后颅窝和(或)幕上下骑跨的大型、巨大型岩斜区脑膜瘤,采用颞下-乙状窦后联合锁孔入路进行显微手术切除是一种安全有效的治疗方式。
岩斜区脑膜瘤;显微外科手术;联合锁孔入路
岩斜区脑膜瘤(petroclival meningiomas,PCMs)是指起源于以岩斜裂为中心的中上斜坡、Ⅴ~Ⅷ脑神经出颅处内侧岩骨的脑膜瘤,也包括起源于岩尖、Meckel腔和后床突来源的脑膜瘤[1]。PCMs为良性肿瘤,治疗首选手术切除,保守治疗意义不大。然而,PCMs位于颅底近中线处,肿瘤位置深,与脑干、海绵窦、多组脑神经、基底动脉及其分支关系密切,解剖复杂,手术难度高,并发症多。因此,PCMs的手术治疗至今仍被认为是显微神经外科颅底手术的难题之一[2]。本文回顾性分析2011-01—2016-06在陆军总医院附属八一脑科医院采用颞下-乙状窦后联合锁孔入路显微手术治疗的24例大型、巨大型PCMs患者的临床资料,总结颞下-乙状窦后联合锁孔入路显微手术切除岩斜区大型和巨大型脑膜瘤的手术经验和临床治疗效果。现报道如下。
1 资料与方法
1.1一般资料本组病例共24例,其中男9例,女15例;年龄26~67(48.4±11.3)岁;病程3 d~11 a,平均2.9 a。
1.2临床症状和体征PCMs患者的临床首发症状多种多样,本组病例主要临床症状和体征包括:面部麻木或疼痛14例,头痛、头晕12例,眼球运动障碍、复视5例,听力减退3例,共济运动障碍2例,视力下降或视野改变2例,吞咽困难、饮水呛咳2例,锥体束征阳性2例,感觉障碍2例,面瘫1例,颈强直1例,智力异常1例,癫痫1例。
1.3影像学检查本组24例患者全部在术前进行了MRI增强扫描检查,肿瘤均明显强化。MRI影像提示脑干部分水肿的患者1例,肿瘤与脑干之间失去明显的蛛网膜界面4例,侵袭海绵窦4例。本组7例患者术前进行了岩骨薄层CT扫描,其中3例提示颅底骨质被肿瘤侵蚀。6例患者术前行DSA检查以判断肿瘤供血来源和椎基底动脉移位方向,为手术做准备。本组病例肿瘤均起源于岩斜区,呈中、后颅窝骑跨和(或)幕上下骑跨生长。按照Sekhar标准[3],肿瘤大小35~73(50.4±10.5)mm。其中肿瘤直径25~44 mm的大型肿瘤8例,≥45 mm的巨大型肿瘤16例。
1.4方法
1.4.1 手术方法:采用患侧朝上的侧卧位,Mayfield头架固定头部,头顶稍下垂,面部向健侧旋转15°,置患侧乳突于手术区域高点。用宽布带将患侧肩膀向下牵开固定,将患者固定在手术床上,以便手术过程中根据需要旋转手术床调整体位。埋置针性电极,连接电生理监测仪,常规术中监测体感诱发电位和面肌肌电图。分别在耳前颞下和枕下乙状窦后锁孔骨瓣成形(见图1~2)。颞下锁孔入路取颧弓上缘耳前直切口约4 cm,乳突牵开器牵开皮肤和颞肌,作颧弓上颞骨游离骨瓣,直径约3 cm。枕下乙状窦后锁孔入路沿发际作耳后乳突上弧形切口约4 cm,乳突牵开器将枕部肌肉牵向内侧,以星点作为骨窗的上外侧界,作枕部直径2.5~3.0 cm骨窗,骨窗尽量偏向外侧,暴露横窦下缘和乙状窦内侧缘。在开颅时使用神经导航准确定位肿瘤、岩骨嵴、横窦和乙状窦,以指导骨瓣成形。在显微镜下剪开硬脑膜,通过脱水、打开脑池释放脑脊液等方法缓慢充分降低颅内压。待颅内压下降,脑组织塌陷满意后,先自枕下乙状窦后入路,从神经间隙之间仔细操作切除幕下肿瘤;然后切开天幕,从幕下切除部分位于天幕上方的肿瘤;再从颞下锁孔入路切除中颅底、鞍旁、岩尖、幕上部分的肿瘤。分别从幕上、幕下通过颅神经之间的间隙进行操作分离并切除肿瘤,以瘤内切除的方式行肿瘤内减压,肿瘤内减压完成后因肿瘤体积缩小可以使手术操作空间增大,再沿蛛网膜间隙仔细分离肿瘤壁,最后分离肿瘤与脑神经、颅底血管及脑干之间的粘连,最终分块全部切除肿瘤。采取边分离肿瘤、边离断肿瘤根部、边切除肿瘤交替进行的方法,逐步缩小肿瘤的体积,最后将肿瘤全部切除。肿瘤切除后,用激光刀处理肿瘤基底部无法切除的硬脑膜等。
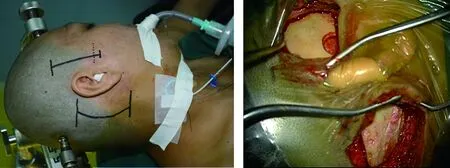
图1 手术切口 图2 骨瓣成形
1.4.2 术后处理:术后持续监测颅内压,根据颅内压的变化决定是否需要脱水降颅压药物。酌情使用血管活性药物,预防脑血管痉挛的发生。对未能够全部切除而残余的少量肿瘤术后进行立体定向放射外科治疗。本组4例患者术中无法将肿瘤完全切除而于术后接受了伽玛刀治疗。
1.4.3 随访:采取门诊复查、电话询问的方式对患者进行术后定期随访。随访时间点常规选为术后第3、6及12个月。如患者无新发症状,同时影像学检查也未发现肿瘤复发或残余肿瘤进展,则以后每年复查1次。本组患者末次随访时间到2016-09-30。
1.4.4 生活质量评定:患者术前、术后及随访生活质量评估采用经典的卡诺夫斯基健康状况量表(Karnofsky performance scale,KPS)[4]进行评定。KPS评分≥80分,能正常生活工作为优秀;KPS评分60~70分,生活能基本自理为良好;KPS评分≤50分,生活不能自理,需要他人照顾为差。
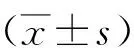
2 结果
2.1肿瘤的病理性质及其与周围组织结构的关系本组病例术后病理结果证实均为脑膜瘤,根据组织病理分级标准,WHOⅠ级23例(95.8%),WHOⅡ~Ⅲ级1例(4.2%)。根据术前影像学资料及术者术中观察,血供丰富的肿瘤14例(58.3%),缺乏血供的肿瘤10例(41.7%),质硬肿瘤4例(16.7%),质韧肿瘤7例(29.2%),质软肿瘤13例(54.2%)。肿瘤侵犯脑干4例(16.7%),侵犯海绵窦4例(16.7%),侵犯颅骨7例(29.2%),包绕血管4例(16.7%)。
2.2肿瘤的切除程度根据术者术中确认和术后复查的MRI影像资料综合判断,本组肿瘤全切除(SimpsonⅠ、Ⅱ级)20例(83.3%),次全切除(SimpsonⅢ级)4例(16.7%)。
2.3术后并发症本组术后新增神经功能障碍或原有神经功能障碍加重7例(29.2%),包括眼球运动障碍3例(12.5%),面瘫4例(16.7%)。听力障碍1例(4.2%),偏瘫2例(8.3%),为分离肿瘤时牵拉所致损伤。术后出现脑干出血1例(4.2%),脑干梗死1例(4.2%),脑脊液漏1例(4.2%),颅内感染1例(4.2%),肺部感染2例(8.3%),均经保守治疗痊愈出院。无乙状窦栓塞、Labbe静脉损伤等手术相关并发症。无围手术期死亡病例。
2.4随访情况本组患者术前KPS评分(77.50±8.47)分,术后(72.92±15.17)分。本组24例均得到随访,末次随访时KPS评分(80.42±14.29)分,其中生活质量评分优秀21例(87.5%),良好1例(4.2%),差2例(8.3%)。术后随访3~59个月,无肿瘤复发或残余肿瘤明显进展。
3 讨论
3.1岩斜区脑膜瘤的治疗策略PCMs是良性肿瘤,全切肿瘤可以使患者获得终身治愈。因此,对于PCMs手术全切一直是神经外科医师追求的目标。手术全切PCMs,不仅能减轻占位效应,缓解症状,还能明显降低肿瘤术后复发率[5]。然而,PCMs位于颅底近中线处,肿瘤位置深,与脑干、海绵窦、多组脑神经、基底动脉及其分支关系密切,解剖复杂,手术难度高,术后并发症多,且大多数PCMs患者往往出现症状就诊时肿瘤体积已经较大了,这更增加了手术全切肿瘤的难度,使手术治疗存在较高的致死率和致残率。因此,手术全切PCMs所伴随的风险和代价往往让患者难以承受。
随着放射外科学的发展,有研究发现伽马刀治疗可以有效控制PCMs的进展和术后复发。Roche等[6]提出对于3 cm以下的PCMs放射外科治疗可以作为手术切除的替代治疗。Zachenhofer等[7]报道伽马刀治疗的PCMs患者,肿瘤控制率为94%。正是因为放射外科学的进步与成熟,许多学者对PCMs手术切除采取了保守的态度,即在遇到肿瘤与颅底重要的血管、神经以及脑干、海绵窦等结构紧密粘连,且预见到激进切除肿瘤可能损伤颅底重要的神经、血管以及脑干、海绵窦等结构引起严重并发症时,采取保守切除而造成残留部分肿瘤,从而保证患者在术后仍具有较好的神经功能状态和较高的生活质量,对残余的肿瘤可以进行放射外科治疗。
随着生物—心理—社会医学模式的发展,现在越来越多的患者非常重视术后的生活质量。因此,神经外科医生不再一味追求PCMs的全切,而是追求在保留患者神经功能的前提下,最大程度切除肿瘤[8]。我们也赞同这一观点,并作为治疗PCMs的主要策略,即在保证患者术后生活质量的前提下尽最大努力尽量切除肿瘤,对于因为肿瘤与颅底重要的神经和血管粘连紧密、侵犯脑干和(或)海绵窦等实在无法全部切除而残余的肿瘤,术后给予立体定向放射外科治疗。笔者认为,不能以牺牲患者的神经功能为代价而片面追求肿瘤的完全切除,从而导致不良的手术后果,降低患者术后生活质量。
综上所述,我们认为PCMs患者的治疗策略应是将提高生存质量和生存时间结合起来,不能一味追求肿瘤的全部切除,对于侵袭性脑膜瘤以及挤压脑干并与脑干粘连紧密的PCMs,脑干减压就成为手术治疗的主要目的,对于术后残留的肿瘤可以行立体定向放射外科治疗。但同时要避免两种倾向:(1)本来经过努力可以做到全部切除的PCMs,由于认识和经验不足错失了肿瘤全切的机会,导致患者带瘤生存;(2)由于技术不成熟,在过于追求肿瘤全部切除思想的引导下,导致不良后果。
3.2岩斜区脑膜瘤手术入路的选择PCMs影像学分型的多样性、生长方式的复杂性及其周围组织结构的重要性,决定了在手术切除肿瘤时选择合适的手术入路十分重要。合适的手术入路能够获得充分的肿瘤及其周围解剖结构的显露,有利于肿瘤切除,并能减轻对脑组织的牵拉,避免对重要神经和血管的损伤。针对PCMs的主体部位所在、侵袭方向的不同、血供来源情况及与周围组织结构关系等差异,其手术入路的选择也应趋向于个体化。因此,在选择手术切除PCMs的手术入路时,要根据具体情况综合考虑以下因素:(1)选择距离肿瘤路径较短的手术入路;(2)选择对肿瘤显露良好且创伤较小的手术入路;(3) 选择对脑组织暴露少、牵拉程度轻,对脑神经干扰较小的手术入路;(4) 选择易于早期处理肿瘤基底并阻断肿瘤血供的手术入路;(5)选择解剖结构熟悉,显微手术操作熟练的手术入路;(6)选择的手术入路能充分利用颅内已经存在的自然腔隙或潜在的手术空间;(7)根据手术要达到的目的(全切除肿瘤、仅行脑干减压或活检)选择合适的手术入路。选择PCMs的手术入路时遵从这些原则对提高肿瘤的切除程度有很好的帮助,但也不能思维僵化,仅局限于某一现有的手术入路生搬硬套,而应该视具体情况进行个体化的设计,最适合的手术入路才是最好的手术入路。
近年来,在外科手术微创潮流的影响下,神经外科的手术入路也逐渐向微创化、简单化、实用化、小型化方向发展[9]。锁孔手术入路就是在这一基础上发展起来的。目前各种锁孔手术入路已经广泛应用于颅内动脉瘤夹闭、鞍区肿瘤切除、神经微血管减压等手术中。有学者报道[10-12],将锁孔手术入路应用于PCMs切除,也取得较满意效果。
前文所述,选择PCMs手术入路的依据包括肿瘤类型、肿瘤自身的病理特征、肿瘤的侵袭方向、肿瘤与周围组织结构的解剖关系以及患者的主要临床症状和期望等。这其中最重要的是肿瘤的类型,即肿瘤的大小和其在颅内的具体位置。对于体积较小的仅位于中颅窝或后颅窝的PCMs尚可以使用单一手术入路进行切除,而对于体积较大的中后颅窝骑跨或幕上下骑跨的PCMs往往需要使用联合手术入路切除肿瘤。传统手术入路创伤大,并发症较多,而微创锁孔手术入路不仅创伤小,并发症少,并且可以达到与传统手术入路相同的肿瘤切除效果[10]。目前,手术治疗PCMs的锁孔手术入路主要是颞下锁孔入路和枕下乙状窦后锁孔入路。颞下锁孔入路可以显露中颅窝、鞍旁和幕上桥前池、脚间池下部、环池前部,对幕上肿瘤显露有利,并有利于早期控制脑膜垂体干的肿瘤供血,但对幕下部分暴露不佳。枕下乙状窦后锁孔入路可以显露同侧桥小脑角区、同侧桥前池、环池后部,对幕下岩斜区暴露良好,但受内听道上结节遮挡,上斜坡延伸至中颅窝及海绵窦区域,该入路不可及。因此,对于体积较大且呈中后颅窝骑跨和(或)幕上下骑跨的复杂PCMs,需要联合使用颞下锁孔和枕下乙状窦后锁孔入路进行手术切除,术中岩斜区暴露区域存在互补性,可消除单一锁孔入路存在的术野盲区[11]。术中再通过切开小脑幕使幕上、幕下显露区域沟通,可以扩大颅内手术操作空间,并分别从幕上和幕下多个角度进行操作,对侵犯至桥小脑角、脑干前方、中颅窝底、海绵窦外侧壁和Meckel腔的肿瘤切除并不困难[12]。对于岩斜区大型和巨大型脑膜瘤,采用联合锁孔手术入路进行肿瘤切除,术野显露充分的同时,也可以将手术创伤降到最低程度。
3.3联合锁孔入路显微手术治疗岩斜区巨大脑膜瘤的疗效
3.3.1 肿瘤切除程度:肿瘤的全切率是评价一种手术方式的重要指标。20世纪70年代以前,PCMs的全切率极低,而手术病死率>50%[13]。随着神经影像学、颅底外科、显微手术技术和术中神经电生理监测的发展进步,手术病死率显著下降,肿瘤全切率提高到20%~85%[1,5,8,14-26]。本组病例肿瘤全切除(SimpsonⅠ、Ⅱ级)20例,全切率为83.3 %。表1列举了近年来国内外几组PCMs手术切除的治疗结果,单从肿瘤全切率来看,本组病例的肿瘤全切率并不低。未全切除的4例主要是因为肿瘤质地硬韧,侵犯CS或与脑干粘连紧密,或包绕颅底重要的血管和神经,为避免严重不良后果发生而仅行肿瘤的次全切除。
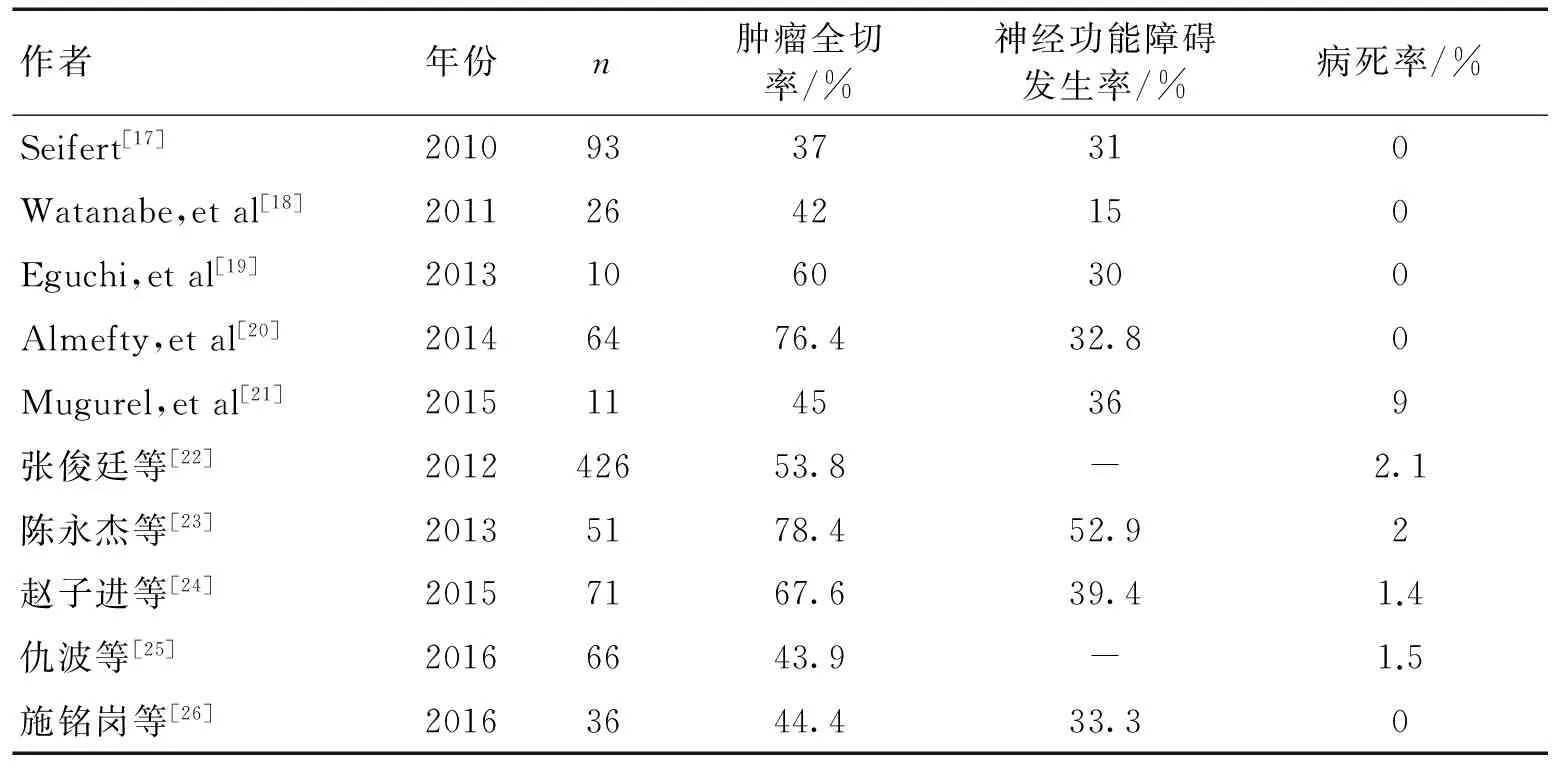
表1 几组岩斜区脑膜瘤手术治疗结果分析
3.3.2 手术相关并发症及病死率:手术相关并发症及病死率是评价一种手术方式的另一重要指标。本组24例患者术后新增神经功能障碍或原有神经功能障碍加重7例(29.2%),包括眼球运动障碍3例(12.5%),面瘫4例(16.7%),听力障碍1例(4.2%),偏瘫2例(8.3%),为分离肿瘤时牵拉所致损伤。其中部分脑神经麻痹患者在术后6个月内得到不同程度好转。本组术后出现脑干出血1例(4.2%),脑干梗死1例(4.2%),脑脊液漏1例(4.2%),颅内感染1例(4.2%),肺部感染2例(8.3%),均经保守治疗痊愈出院。无乙状窦栓塞、Labbe静脉损伤等常见的手术相关并发症。对比表1中术后神经功能障碍发生率可见,本组病例的术后神经功能障碍发生率属于较低水平。本组无围手术期死亡病例。
3.3.3 术后生活质量:PCMs患者术后及术后远期的生活质量可以受到多种因素的影响,但其也间接反映了一种手术治疗方式的效果。对患者术前、术后及末次随访时的KPS评分进行配对t检验,统计得出患者末次随访时KPS评分与术后KPS 评分之间的差异有统计学意义(t=-6.912,P<0.05),表明患者末次随访时KPS评分明显高于术后KPS评分。而患者末次随访时KPS评分与术前KPS评分之间(t=-1.098,P=0.284),术后KPS评分与术前KPS评分之间差异无统计学意义(t=1.748,P=0.094)。可能是因PCMs较高的术后神经功能障碍发生率导致术后KPS平均评分较术前低,但从长期随访结果来看,随着患者神经功能障碍逐渐好转,KPS平均评分逐渐升高。生活质量评定为优秀者所占比例的变化趋势(术前62.5%,术后58.3%,末次随访时87.5%),也能证实这一判断。
3.4联合锁孔入路显微手术切除岩斜区巨大脑膜瘤的手术经验我们在分析了采用颞下-乙状窦后联合锁孔入路显微手术治疗的24例岩斜区大型、巨大型脑膜瘤患者的临床资料及术后生活质量后,总结出一些经验供大家参考和借鉴。
术前做好充分准备,仔细研读影像学资料,对肿瘤的侵袭范围、与周围重要解剖结构的关系等了然于胸。术前准确判断肿瘤的质地、血供等特征,做好充分的准备,必要时先行肿瘤供血动脉栓塞,再行开颅手术。有条件的还可以行颅内结构及肿瘤三维影像重建,模拟手术。
手术时先自枕下乙状窦后锁孔入路切除肿瘤,可在术中早期显露并处理肿瘤基底,有利于早期切断肿瘤血供,不但可以减少术中出血,保证术野的清晰,而且有利于早期肿瘤体积的回缩。若肿瘤基底不能轻易完全离断,可釆取离断肿瘤基底与切除肿瘤交替进行的方法,逐步缩小肿瘤体积。术中操作耐心仔细,应尽可能保持肿瘤周围尤其是与脑干间蛛网膜界面的完整,并在界面内进行肿瘤切除。术中尽可能少用电凝,以避免破坏蛛网膜界面,不断冲洗以保持术野的清晰。对于质地较硬的肿瘤,可采用CUSA吸除,但应严格控制在瘤内操作,将肿瘤均匀吸除,切不可盲目突破瘤壁而伤及瘤周正常组织。在分离肿瘤壁的操作过程中,如果感觉到有一定的阻力,则表明分离部位存在供瘤血管,应细心游离供应肿瘤的分支,予以电凝离断后再分离肿瘤。与脑干粘连紧密的肿瘤不宜强行分离,以避免造成脑干损伤。肿瘤与基底动脉粘连时,应注意保护基底动脉的“过路”穿支血管。小脑幕切开是使幕上、幕下显露区域沟通的关键步骤,动眼神经和滑车神经的走行与小脑幕游离缘关系密切,滑车神经紧贴小脑幕下缘,小脑幕切开时最容易损伤。切开小脑幕时轻牵幕缘探查滑车神经及动眼神经的走行,并分离二者与肿瘤及小脑幕的粘连。岩骨嵴后方5 mm处电凝切开部分天幕,使幕上、幕下显露区域沟通,可以扩大颅内手术操作空间,分别从幕上和幕下多个角度进行操作。显微镜下或在神经导航引导下,根据术中需要采用高速磨钻分别磨除内听道上结节、Kawase三角和部分岩尖。骨质磨除前,必须先切开覆盖在上述区域骨质上的硬脑膜。然后由内向外、由浅入深慢慢磨除上述骨性结构,可扩展视野。
术中使用神经导航和电生理监测辅助切除肿瘤,可以避免损伤重要血管和神经,保证手术安全,减少神经功能障碍的发生。应用神经导航可以准确定位横窦、乙状窦、岩尖、内耳道等,指导开颅时骨瓣成形及术中操作定位,避免损伤上述重要结构。应用术中电生理监测技术,能警示手术误操作,保护脑神经及脑干功能,配合使用刺激电极,可以定位脑神经,减少神经功能的损害。
总之,对于中后颅窝和(或)幕上下骑跨型的PCMs,采用颞下-乙状窦后联合锁孔入路进行显微手术切除,术野暴露更加充分,手术创伤进一步降低,并发症更少,且肿瘤全切除率并不低,是一种安全有效的手术方式。当肿瘤与脑干、海绵窦、颅底重要血管和神经粘连紧密时,切不可强行分离切除肿瘤,以免造成严重的不良后果,对残余肿瘤行放射外科治疗也是一种选择。PCMs患者的术后生活质量并非取决于肿瘤是否全切,不能以牺牲患者的神经功能为代价而片面追求肿瘤全切,从而导致不良的手术后果,影响患者术后生活质量。
[1] Al-Mefty O,Fox JL,Smith RR.Petrosal approach for petroclival meningiomas[J].Neurosurgery,1988,22(3):510-517.
[2] 杨军,于春江,齐震,等.大型、巨大型岩斜区脑膜瘤显微外科入路的选择[J].中华神经外科杂志,2008,24(3):190-192.
[3] Sekhar LN,Jannetta PJ,Burkhart LE,et al.Meningiomas involving the clivus:a six-year experience with 41 patients[J].Neurosurgery,1990,27(5):764-781.
[4] 赵子进.显微手术切除岩斜区脑膜瘤的疗效分析:附116例病例报告[D].长沙:中南大学,2014:16-17.
[5] Little KM,Friedman AH,Sampson JH,et al.Surgical management of petroclival meningiomas:defining resection goals based on risk of neurological morbidity and tumor recurrence rates in 137 patients[J].Neurosur-gery,2005,56(3):546-559.
[6] Roche PH,Pellet W,Fuentes S,et al.Gamma knife radiosurgical management of petroclival meningiomas results and indications[J].Acta Neurochir(Wien),2003,145(10):883-888.
[7] Zachenhofer I,Wolfsberger S,Aichholzer M,et al.Gamma-knife radiosurgery for cranial base meningiomas:experience of tumor control,clinical course,and morbidity in a follow-up of more than 8 years[J].Neurosurgery,2006,58(1):28-36.
[8] Nanda A,Javalkar V,Banerjee AD.Petroclival meningiomas:study on outcomes,complications and recurrence rates[J].J Neurosurg,2011,114(5):1 268-1 277.
[9] Zhou QJ,Liu B,Geng DJ,et al.Microsurgery with or without Neuroendoscopy in Petroclival Meningiomas[J].Turk Neurosurg,2015,25(2):231-238.
[10] 兰青,康德智,钱志远,等.前颞下“锁孔”入路显微手术的临床应用[J].中国微侵袭神经外科杂志,2004,9(9):395-397.
[11] Zhu W,Mao Y,Zhou LF,et al.Combined Subtemporal and Retrosigmoid Keyhole Approach for Extensive Petroclival Meningiomas Surgery:Report of Experience with 7 Cases[J].Minim Invasive Neurosurg,2008,51(2):95-99.
[12] Chen LS,Yang Y,Wei Q,et al.Microsurgical management of petroclival meningiomas combined trans-subtemporal and suboccipital retrosigmoid keyhole approach[J].Beijing Da Xue Xue Bao,2016,48(4):738-742.
[13] Cherington M,Sohneck SA.Clivus meningiomas[J].Neurology,1966,16(1):86-92.
[14] Samii M,Ammirati M,Mahran A,et al.Surgery of petroclival meningiomas:report of 24 cases[J].Neurosurgery,1989,24(1):12-17.
[15] Spetzler RF,Daspit CP,Pappas CT.The combined supra-and infratentorial approach for lesions of the petrous and clival regions:experience with 46 cases[J].J Neurosurg,1992,76(4):588-599.
[16] Roberti F,Sekhar LN,Kalavakonda C,et al.Posterior fossa meningiomas:surgical experience in 161 cases[J].Surg Neurol,2001,56(1):8-20.
[17] Seifert V.Clinical management of petroclival meningiomas and the eternal quest for preservation of quality of life:Personal experiences over a period of 20 years[J].Acta Neurochir(Wien),2010,152(7):1 099-1 116.
[18] Watanabe T,Katayama Y,Fukushima T,et al.Lateral supracerebellar transtentorial approach for petroclival meningiomas:operative technique and outcome[J].J Neurosurg,2011,115(7):49-54.
[19] Eguchi K,Tahara A,Yamaguchi S,et al.Feasibility and Limitations of the Retrosigmoid and Presigmoid Approaches Combined With the Anterior Petrosal Approach to Meningiomas in the Petroclival Area[J].Neurosurg Q,2013,23(1):7-12.
[20] Almefty R,Dunn IF,Pravdenkova S,et al.True petroclival meningiomas:results of surgical management[J].J Neurosurg,2014,120(1):40-51.
[21] Mugurel R,Florin S,Ram V,et al.Surgery of petroclival meningiomas:Recent surgical results and outcomes[J].Romanian Neurosurg,2015,22(1):27-37.
[22] 张俊廷,李达,郝淑煜.岩斜区脑膜瘤手术治疗及预后分析[J].中华神经外科杂志,2012,28(4):327-332.
[23] 陈永杰,刘晓谦,赵刚.岩斜区脑膜瘤的临床治疗[J].中国微侵袭神经外科杂志,2013,18(5):213-215.
[24] 赵子进,袁贤瑞,邹华元,等.显微手术切除岩斜区脑膜瘤的疗效分析[J].中华神经外科杂志,2015,31(2):137-140.
[25] 仇波,陶钧,欧绍武,等.岩斜区脑膜瘤颅底侵袭的半定量分析及手术入路选择:66例报告[J].中华神经外科疾病研究杂志,2016,15(1):21-24.
[26] 施铭岗,佟小光.不同手术入路切除岩斜区脑膜瘤的疗效[J].中华神经外科杂志,2016,32(1):30-34.
(收稿2017-04-10)
责任编辑:张喜民
MicrosurgicaltreatmentoflargeandgiantpetroclivalmeningiomasviacombinedSubtemporalandretrosigmoidkeyholeapproach
YuanLiang*,QuRuijie,LiPengqi,SuXinhong,YanZhiqiang,LiWende,ChenLihua
*DepartmentofNeurosurgery,XijingHospitalofFourthMilitaryMedicalUniversity,Xi'an710032,China
ObjectiveTo study the method and effect of microsurgical treatment of large and giant petroclival meningiomas via combined subtemporal and retrosigmoid keyhole approach.MethodsThe clinical data in a consecutive series of 24 patients with large and giant petroclival meningiomas who had
microsurgical treatment was analyzed retrospectively.These patients were treated via combined subtemporal and retrosigmoid keyhole approach.The technique of combined keyhole approach,the effect of clinical treatment and the quality of post-operative life were analyzed.ResultsThe gross total resection (Simpson GradeⅠand Ⅱ) was achieved in 20 cases (83.3%).The subtotal resection (Simpson GradeⅢ) was achieved in 4 cases (16.7%).New-onset post-operative neurological dysfunction appeared in 7 cases (29.2%).The post-operative complications included brain stem hemorrhage in 1 case (4.2%),brain stem infarction in 1 case (4.2%),cerebrospinal fluid leakage in 1 case (4.2%),intracranial infection in 1 case (4.2%),and pulmonary infection in 2 cases (8.3%).There was no death during perioperative period.The post-operative follow-up period ranged from 3 to 59 months,and there was no tumor recurrence or progress.ConclusionThe combined subtemporal and retrosigmoid keyhole approach is a safe and effective approach for microsurgical treatment of large and giant petroclival meningiomas.
Petroclival meningiomas;Microsurgery;Combined keyhole approach
10.3969/j.issn.1673-5110.2017.16.001
国家自然科学基金(项目编号:81201000)
R747.9
A
1673-5110(2017)16-0001-06
△通信作者:闫志强,男,副主任医师,副教授,硕士生导师。研究方向:颅内肿瘤。Email:neurozqyan@163.com
陈立华,男,主任医师,教授,硕士生导师。研究方向:颅底肿瘤。Email:chenlihuallx@yahoo.com.cn

