聚(3-氨基-5-巯基-1,2,4-三唑)/多壁碳纳米管修饰的玻碳电极同时检测尿酸、黄嘌呤与次黄嘌呤
王 存,张 毅,孟 丽,赵 欣,王 跃
(重庆市功能性食品协同创新中心,重庆市功能性食品工程技术研究中心,重庆市功能性食品研发工程实验室,重庆第二师范学院,重庆 400067)
聚(3-氨基-5-巯基-1,2,4-三唑)/多壁碳纳米管修饰的玻碳电极同时检测尿酸、黄嘌呤与次黄嘌呤
王 存,张 毅,孟 丽,赵 欣,王 跃*
(重庆市功能性食品协同创新中心,重庆市功能性食品工程技术研究中心,重庆市功能性食品研发工程实验室,重庆第二师范学院,重庆 400067)
采用滴涂法得到多壁碳纳米管(MWCNTs)修饰的玻碳电极(GCE),通过电沉积方法将3-氨基-5-巯基-1,2,4-三唑(TA)沉积在MWCNTs/GCE表面,制备了聚(3-氨基-5-巯基-1,2,4-三唑)/多壁碳纳米管修饰电极(pTA/MWCNTs/GCE)。采用循环伏安法(CV)和示差脉冲伏安法(DPV),研究了尿酸(UA)、黄嘌呤(XA)和次黄嘌呤(HX)在该修饰电极上的电化学行为。结果表明,该修饰电极对UA、XA和HX均有较好的电催化活性作用,能实现对3种物质的同时测定。UA、XA和HX在该修饰电极上的线性范围分别为9.0~739.0、2.0~259.0、1.0~353.0 μmol/L; 检出限分别为0.67、0.17、0.33 μmol/L。该修饰电极已成功用于尿液和血清实际样品中UA、XA和HX的同时测定,回收率为98.8%~105.5%。
多壁碳纳米管;3-氨基-5-巯基-1,2,4-三唑;尿酸;黄嘌呤;次黄嘌呤;电化学
尿酸(UA)、黄嘌呤(XA)和次黄嘌呤(HX)是人体中嘌呤降解代谢的主产物,主要存在于血液、肝脏和尿液中[1-2]。人体中UA、XA和HX的含量变化可以直接反映人体免疫和代谢等机能的状况,同时也可检测与嘌呤代谢有关的疾病。当UA、XA和HX出现异常时,会出现如痛风、高尿酸血症、肾功能衰竭、白血病和肺炎等病症[3-5]。因此,建立简便、灵敏、准确的检测分析UA、XA和HX的方法是十分必要的。当前,UA、XA和HX的测定通常采用酶催化法[6]、高效液相色谱法(HPLC)[7]、毛细管电泳法[8]以及电化学方法[9]等。但酶催化法、HPLC法和毛细管电泳法普遍存在设备昂贵、耗时长、灵敏度低、检测组分单一且不能做活体实时分析等缺点,难以满足日常检测要求[10]。而电化学方法因具有选择性与稳定性好,灵敏性高,抗干扰能力强,能多组分同时检测且可活体实时分析等优点成为研究的热点[11-13]。但是由于UA、XA和HX在传统的电极上具有很高的过电位,并且这3种物质在传统电极上的检测电位非常接近,从而导致电极同时检测三者比较困难,进而导致传感器的选择性差[14-16]。鉴于此,本文采用聚(3-氨基-5-巯基-1,2,4-三唑)/多壁碳纳米管修饰的玻碳电极对 UA、XA和HX进行同时测定。
3-氨基-5-巯基-1,2,4-三唑(TA)是一种低分子量的化学物质,具有5个潜在的配位位点:3个N原子和2个C原子构成骨架环,环外有1个NH2基团和1个SH基团[17]。采用电聚合的方法将TA修饰到电极表面,得到聚(3-氨基-5-巯基-1,2,4-三唑)薄膜(pTA)。研究表明,pTA不仅具有良好的导电性,好的化学稳定性以及很强的电催化活性等优点,而且该聚合膜具有好的渗透性,能促进生物活性小分子的检测[18-21]。多壁碳纳米管(MWCNTs)因具有高的导电性,大的比表面积,好的化学稳定性和机械强度,引起了科学界的巨大兴趣,成为材料科学研究热点,此外,MWCNTs还具有良好的生物相容性。因此,MWCNTs的电催化性能及其在传感器中的应用受到了强烈的关注[19]。本文将pTA和MWCNTs共同修饰到玻碳电极表面,制成了一种新型的传感器。该传感器响应快速、灵敏度高、选择性好,对UA、XA和HX 有着良好的催化氧化性能,已成功用于实际样品(尿液和血清)中UA、XA和HX 的同时测定。
1 实验部分
1.1 试剂与仪器
尿酸、黄嘌呤、次黄嘌呤和3-氨基-5-巯基-1,2,4-三唑(分析纯,Aladdin试剂公司);磷酸盐缓冲溶液(PBS)由K2HPO4-KH2PO4配制,支持电解质为0.1 mol/L KCl。其他试剂均为分析纯,实验用水为二次蒸馏水。
FA2004B电子天平(上海恒平科技有限公司),KQ5200型超声仪(昆山市超声仪器有限公司),1000B扫描电子显微镜(美国Amray公司)。CHI-660E型电化学工作站(上海辰华仪器有限公司),实验采用常规的三电极系统:表面修饰的玻碳电极(直径3 mm)为工作电极,铂丝为对电极,饱和甘汞电极为参比电极。以循环伏安法(CV)和示差脉冲伏安法(DPV)考察电极的电化学特性。
1.2 修饰电极的制备
将玻碳电极(GCE)在金相砂纸上依次用1.0、0.3、0.05 μm的氧化铝粉抛光,然后分别在蒸馏水、乙醇、蒸馏水中超声洗涤,清洗后的电极置于室温下晾干。2 mg MWCNTs超声分散于5 mL二次蒸馏水中,移取20 μL上述分散液滴涂于GCE表面,室温下晾干,得到多壁碳纳米管修饰电极(MWCNTs/GCE)。将MWCNTs/GCE放入聚合液中电沉积3-氨基-5-巯基-1,2,4-三唑(TA),聚合液由1 mmol/L TA和0.1 mol/L H2SO4组成,采用循环伏安法(CV),在-0.2~1.7 V之间以50 mV/s 循环扫描15圈,沉积结束后用蒸馏水冲洗电极,然后在0.1 mol/L PBS(pH 7.0) 缓冲溶液中扫至循环伏安曲线稳定,室温晾干,得到聚(3-氨基-5-巯基-1,2,4-三唑)/多壁碳纳米管修饰的玻碳电极(pTA/MWCNTs/GCE)。
2 结果与讨论
2.1 修饰电极的SEM表征
采用扫描电子显微镜对MWCNTs/GCE和pTA/MWCNTs/GCE电极的表面形貌进行表征(图1)。由图1A可见,许多单壁碳纳米管缠绕,表明MWCNTs已均匀分散在玻碳电极表面。当MWCNTs/GCE上进一步修饰pTA后,在MWCNTs/GCE上可见一层均匀的聚合膜,且MWCNTs大部分包埋在pTA薄膜中(图1B),表明pTA/MWCNTs复合膜修饰电极制备成功。
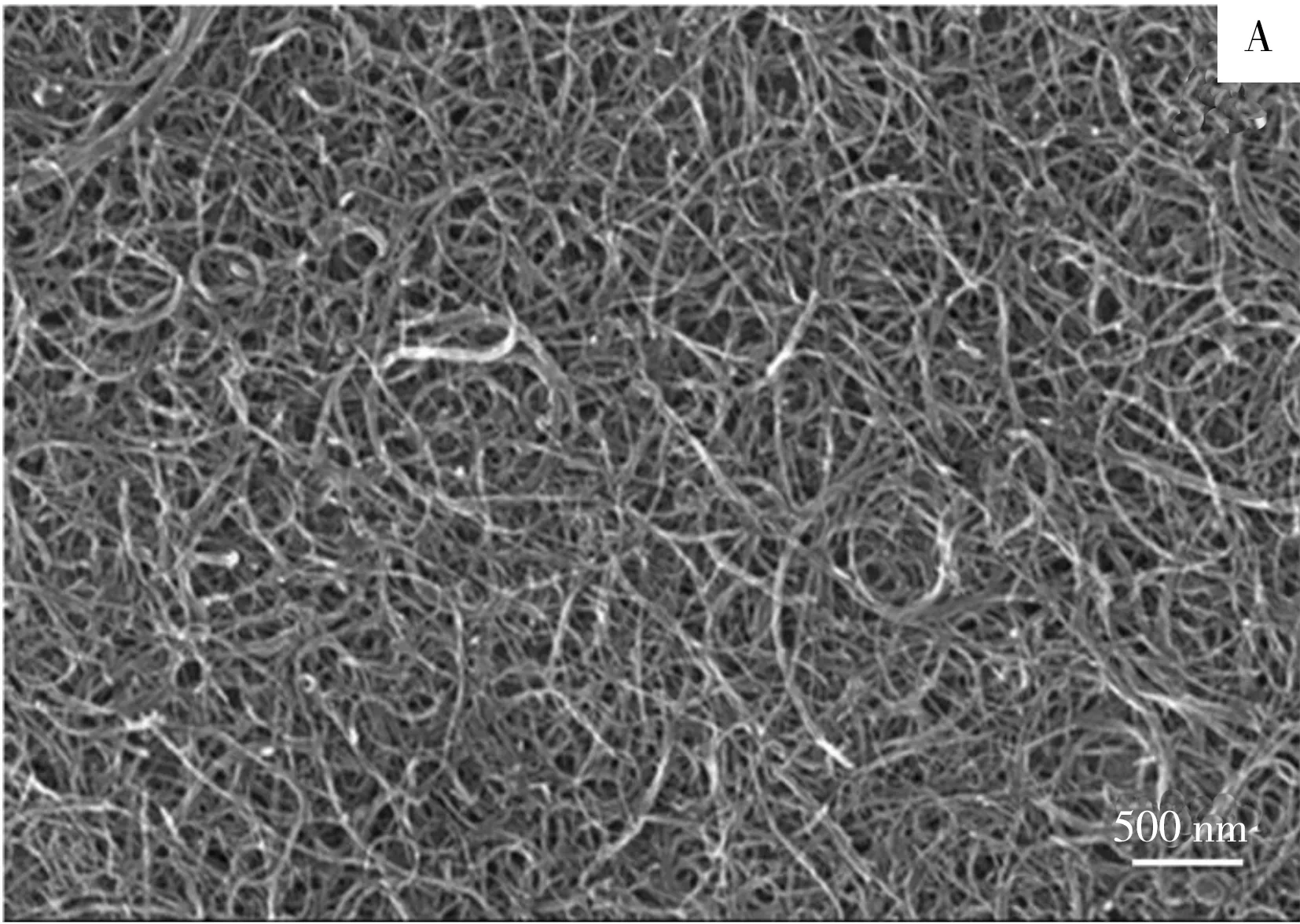

图1 MWCNTs/GCE(A)与pTA/MWCNTs/GCE(B)电极表面的扫描电镜图Fig.1 Scanning electron microscopy images of MWCNTs/GCE(A) and pTA/MWCNTs/GCE(B)
2.2 UA、XA及HX在不同修饰电极上的电化学响应
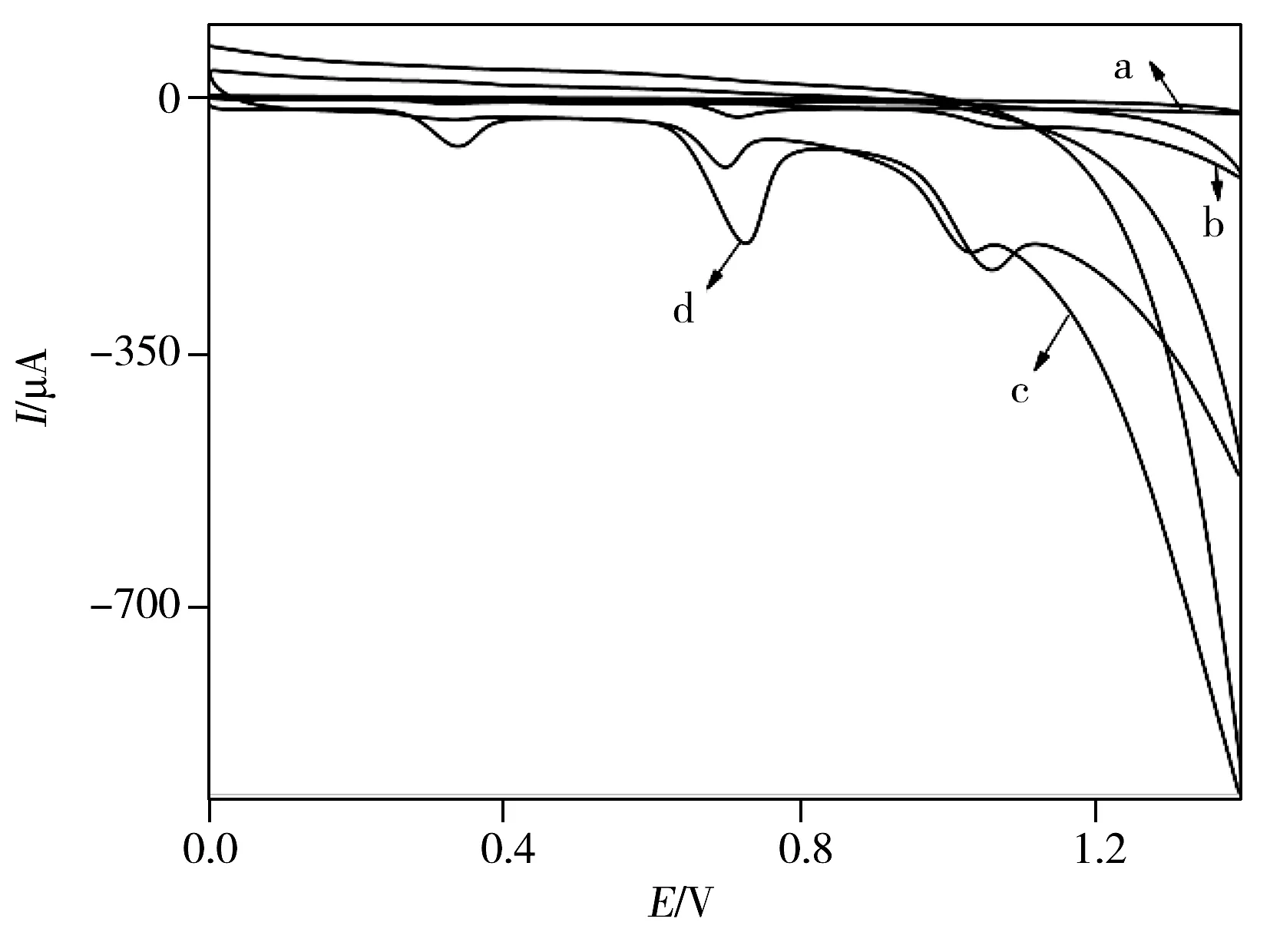
图2 GCE(a)、TA /GCE(b)、MWCNTs/GCE(c)与pTA/MWCNTs/GCE(d)的循环伏安图Fig.2 Cyclic voltammograms at GCE(a),TA /GCE(b),MWCNTs/GCE(c) and pTA/MWCNTs/GCE(d)
为研究pTA/MWCNTs/GCE的性能,实验比较了不同修饰电极在200 μmol/L UA、200 μmol/L XA和200 μmol/L HX混合溶液中的CV响应,结果如图2所示。由图2可以看出,裸GCE(曲线 a)在检测3种物质时只有1个重叠的宽峰。TA/GCE(曲线 b)和MWCNTs/GCE(曲线 c)对XA和HX的响应峰电流较小,对UA则几乎没有响应。而目标电极pTA/MWCNTs/GCE(曲线 d)上,UA、XA和HX的电信号明显得到分离,其峰电位分别为0.34、0.73、1.06 V。UA、XA和HX之间的峰电位差分别为0.39、0.33 mV。结果表明,目标电极对UA、XA和HX具有良好的催化活性,可望用于UA、XA和HX 混合物的同时检测。
2.3缓冲液pH值对UA、XA与HX同时检测的影响
本文采用CV研究了缓冲液pH值对pTA/MWCNTs/GCE同时检测 50 μmol/L UA、50 μmol/L XA和50 μmol/L HX的影响。结果显示,UA的峰电流随pH值升高而降低。XA和HX的峰电流在pH 3.0~9.0范围内先增加后减小,在pH 7.0时达到最大值。而随着pH值的增大,UA、XA和HX的峰电位逐渐负移,表明这是质子参与的电极反应过程[22]。由于人体生理pH值约在7.0左右,为获得高的灵敏度和选择性,选择pH 7.0的磷酸缓冲液作为测试底液。
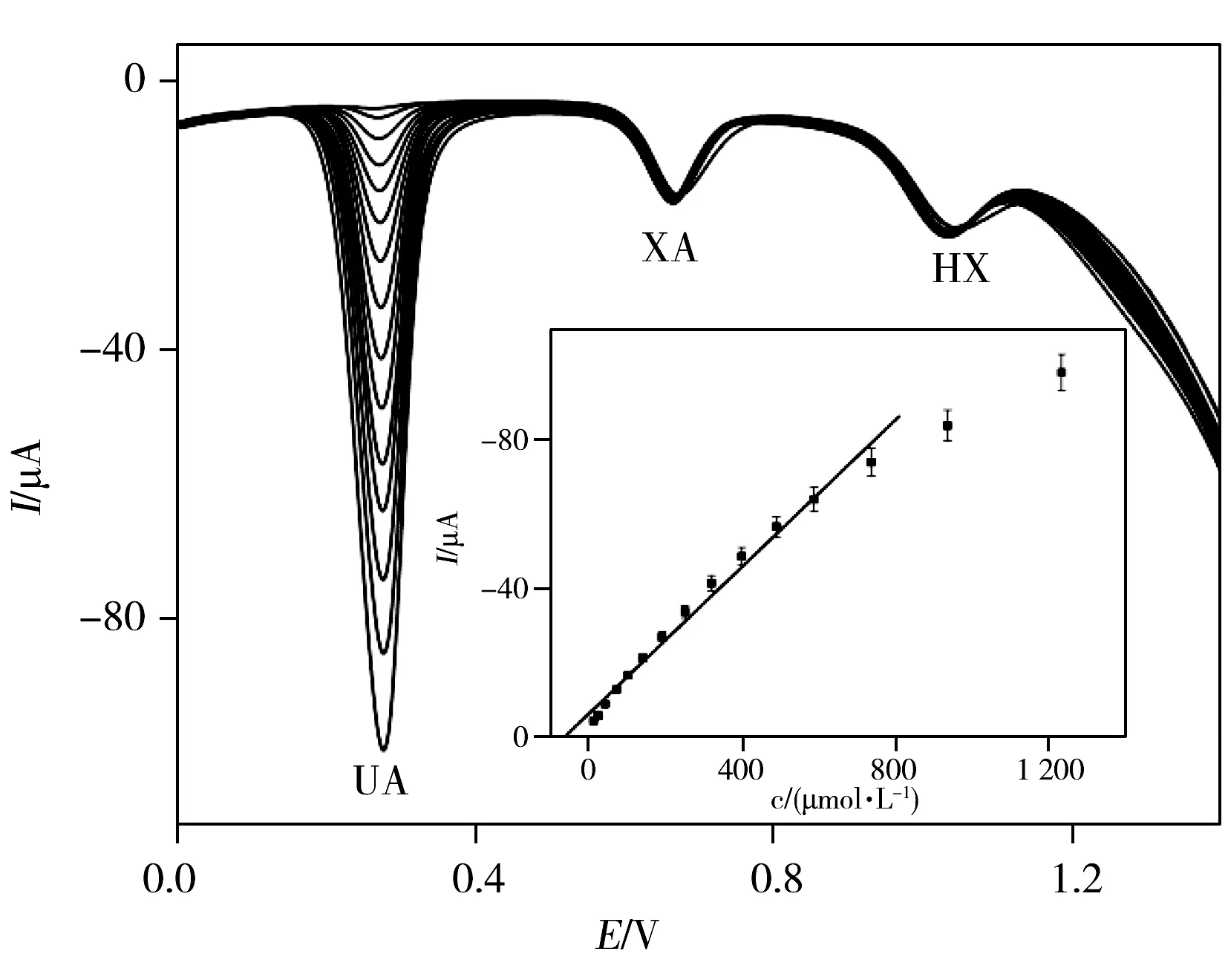
图3 传感器对不同浓度UA的差分脉冲伏安图Fig.3 Differential pulse voltammogram for different concentrations of UA at pTA/MWCNTs/GCE in 0.1 mol/L PBS(pH 7.0) HX:100 μmol/L,XA:70 μmol/L;concentrations of UA(from inner to outer):9,21,39,69,99,139,189,249,319,399,489,589,739,939,1 239 μmol/L;insert:plot of Ip vs.concentration for UA
2.4 示差脉冲伏安法同时测定UA、XA与HX
由于示差脉冲伏安法(DPV)比CV法具有更高的灵敏度和更好的检测效果,因此本文选择DPV同时检测UA、XA和HX。将三者的混合溶液作为测试底液,改变其中1种物质的浓度,保持其他2种物质的浓度不变,然后分别检测UA、HX和XA。结果表明,在最优的条件下,UA、XA和HX的线性范围分别为9.0~739.0、2.0~259.0、1.0~353.0 μmol/L,线性方程分别为:IUA(μA)=-6.618 18-0.098 27cUA(μmol/L)(r=0.987 0);IXA(μA)=-7.217 07-0.148 22cXA(μmol/L)(r=0.980 1)和IHX(μA)=-13.367 5-0.091 53cHX(μmol/L)(r=0.981 2)。检出限(3S/N)分别为0.67、0.17、0.33 μmol/L,图3为100 μmol/L HX和70 μmol/L XA存在时不同浓度UA的差分脉冲伏安图。
pTA/MWCNTs/GCE对UA、XA和HX选择性响应的机理推测如下:首先,在0.1 mol/L PBS(pH 7.0 ) 的缓冲溶液中,UA(pKa=5.75) 和 XA(pKa=7.70) 以阴离子的形式存在;HX(pKa=8.90)以阳离子的形式存在[12,23]。阴离子形式存在的UA和XA通过静电作用被pTA薄膜骨架环吸引,阳离子形式存在的HX则通过氢键作用被pTA薄膜表面杂原子(N和S)吸引[12,24-25]。其次,pTA薄膜具有π-π共轭键,存在大量活性位点,这导致分析物与电极界面的不相似共轭效应,有助于分析检测电位相近的生物活性小分子[26-27]。此外,多壁碳纳米管(MWCNTs)具有高的导电性,大的比表面积和良好的生物相容性等性质,因此MWCNTs可以增强修饰电极检测UA、XA和HX的电流响应能力[28-29]。表1是本文与研究文献的比较,相对文献中碳纳米管修饰电极或聚合物薄膜修饰电极,本文TA/MWCNTs修饰电极的检出限较低,检测范围宽。

表1 不同研究电极之间的比较Table 1 Comparison of the response characteristics of different modified electrodes
2.5 干扰实验、稳定性与重现性

2.6 实际样品分析
采用pTA/MWCNTs/GCE对人血清和尿液样品中的UA、XA和HX进行测定,并进行加标回收实验。人血清和尿液未进行任何处理,先分别用0.1 mol/L PBS(pH 7.0) 缓冲溶液稀释100倍,检测其中UA、XA和HX的含量,随后加入一定量的UA、XA和HX标准溶液,最后检测溶液中UA、XA和HX的总含量,测定结果见表 2。该方法对UA、XA和HX的测定回收率为98.8%~105.5%。
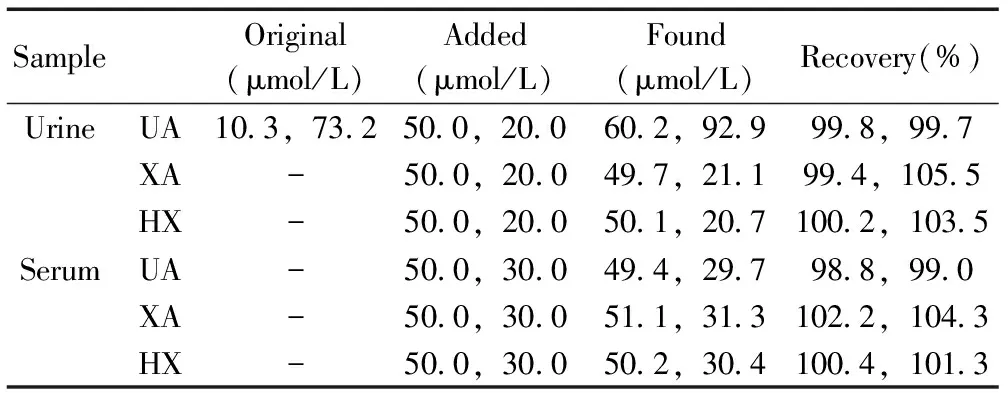
表2 实际样品中UA、XA和HX的测定Table 2 Determination of UA,XA and HX in samples
3 结 论
本文成功制备了pTA/MWCNTs/纳米复合材料,并将其用于修饰电极,构建了一种新型的传感器。该传感器在同时检测UA、XA和HX时表现出很高的电催化活性,解决了三者峰电位的重叠问题,同时降低了过电位,且很大程度上提高了峰电流。研究表明,该方法简单快速,具有较宽的线性范围、较高稳定性、较强抗干扰能力,可用于人尿液和血清实际样品中UA、XA和HX的同时测定。因此,该方法在实际样品中同时检测UA、XA和HX具有一定的研究意义和参考价值。
[1] Kesavan S,John S A.Sens.ActuatorsB,2014,205(9):352-362.
[2] Ibrahim H,Temerk Y.Sens.ActuatorsB,2016,232(9):125-137.
[3] Çubukçu M,Timur S,Anik Ü.Talanta,2007,74:434-439.
[4] Sharma V K,Jelen F,Trnkova L.Sensors,2015,15(1):1564-1600.
[5] Albelda J A V,Uzunoglu A,Santos G N C,Stanciu L A.Biosens.Bioelectron.,2017,89(3):518-524.
[6] Shan D,Wang Y N,Zhu M J,Xue H G,Cosnier S,Wang C Y.Biosens.Bioelectron.,2009,24(5):1171-1176.
[7] Cooper N,Khosravan R,Erdmann C,Fiene J,Lee J W.J.Chromatogr.B,2006,837(1):1-10.
[8] Caussé E,Pradelles A,Dirat B,Negre-Salvayre A,Salvayre R,Couderc F.Electrophoresis,2007,28(3):381-387.
[9] Ubukc M C,Timur S,Anik U.Talanta,2007,74(3):434-439.
[10] Ibrahim H,Temerk Y.Sens.ActuatorsB,2016,232(9):125-137.
[11] Ojani R,Alinezhad A,Abedi Z.Sens.ActuatorsB,2013,188(11):621-630.
[12] Lan D X,Zhang L.J.Electroanal.Chem.,2015,757(2):107-115.
[13] Luo A,Lian Q W,An Z Z,Li Z,Guo Y Y,Zhang D X,Xue Z H,Zhou X B,Lu X Q.J.Electroanal.Chem.,2015,756(1):22-29.
[14] Zhang F Y,Wang Z H,Zhang Y Z,Zheng Z X,Wang C M,Du Y L,Ye W C.Talanta,2012,93(2):320-325.
[15] Sekar N L,Ravi R M.Mater.Sci.Eng.C,2016,65(1):278-286.
[16] Dervisevic M,Custiuc E,Çevik E,Durmus Z,Senel M,Durmus A.FoodControl,2015,57(1):402-410.
[17] Sun Y X,Wang S F,Zhang X H,Huang Y F.Sens.ActuatorsB,2006,113(1):156-161.
[18] Kalimuthu P,John S A.Anal.Chim.Acta,2009,647(1):97-103.
[19] Liu X G,Peng Y H,Qu X J,Ai S Y,Han R X,Zhu X B.J.Electroanal.Chem.,2011,654(1):72-78.
[20] Kalimuthu P,John S A.Talanta,2010,80(5):1686-1691.
[21] Wang C,Yuan R,Chai Y Q,Zhang Y,Hu F X,Zhang M H.Biosens.Bioelectron.,2011,30(1):315-319.
[22] Lavanya N,Sekar C,Murugan R,Ravi G.Mater.Sci.Eng.C,2016,65(1):278-286.
[23] Xue Y,Sheng Z H,Zhao H,Wu Z J,Li X J,He Y J,Yuan Z B.Electrochim.Acta,2012,59(4):256-263.
[24] Kalimuthu P,John S A.Talanta,2010,80(5):1686-1691.
[25] Revin S B,John S A.Sens.ActuatorsB,2012,161(1):1059-1067.
[26] Raj M A,John S A.Anal.Chim.Acta,2013,77(7):14-20.
[27] Liu X F,Ou X,Lu Q Y,Zhang J J,Chen S H,Wei S P.RSCAdv.,2014,4(80):42632-42637.
[28] Merkoci A,Pumera M,Llopis X,Perez B,Valle M D,Alegret S.TrendsAnal.Chem.,2005,24(9):826-838.
[29] Wang Y.ColloidsSurf.B,2011,88(2):614-621.
[30] Zhang F Y,Wang Z H,Zhang Y Z,Zheng Z J,Wang C M,Du Y L,Ye W C.Talanta,2012,93(2):320-325.
[31] Wang Y,Tong L L.Sens.ActuatorsB,2010,150(1):43-49.
[32] Wang Z H,Dong X Y,Li J.Sens.ActuatorsB,2008,131(2):411-416.
[33] Kumar A S,Swetha P.J.Electroanal.Chem.,2010,642(2):135-142.
[34] Zen J M,Lai Y Y,Yang H H.Sens.ActuatorsB,2002,84(2):237-244.
[35] Dalkiran B,Kacar C,Erden P E,Kilic E.Sens.ActuatorsB,2014,200(9):83-91.
[36] Kumar A S,Shanmugam R.Anal.Methods,2011,3(9):2088-2094.
[37] Dervisevic M,Custiuc E,Çevik E,Senel M.FoodChem.,2015,181(2):277-283.
Simultaneous Determination of Uric Acid,Xanthine and Hypoxanthine Based on poly(3-Amino-5-mercapto-1,2,4-triazole)/Multi-walled Carbon Nanotubes Modified Glassy Carbon Electrode
WANG Cun,ZHANG Yi,MENG Li,ZHAO Xin,WANG Yue*
(Chongqing Collaborative Innovation Center for Functional Food,Chongqing Engineering Research Center of Functional Food,Chongqing Engineering Laboratory for Research and Development of Functional Food,Chongqing University of Education,Chongqing 400067,China)
In this paper,the poly(3-amino-5-mercapto-1,2,4-triazole)/multi-walled carbon nanotubes modified glassy carbon electrode(pTA/MWCNTs/GCE) was successfully prepared by electrodepositing 3-amino-5-mercapto-1,2,4-triazole(TA) on the MWCNTs/GCE.The electrochemical behaviors of uric acid(UA),xanthine(XA) and hypoxanthine(HX) at the pTA/MWCNTs/GCE were investigated using cyclic voltammetry(CV) and differential pulse voltammetry(DPV).The results showed that the chemically modified electrode displayed excellent electrochemical catalytic activities towards UA,XA and HX.The calibration curves for UA,XA and HX were obtained over the ranges of 9.0-739.0,2.0-259.0,1.0-353.0 μmol/L with the detection limits of 0.67,0.17,0.33 μmol/L,respectively.In addition,the modified electrode was applied in the determination of UA,XA and HX in real samples(urine and serum),with the recoveries of the samples ranged between 98.8%-105.5%.
multi-walled carbon nanotubes; 3-amino-5-mercapto-1,2,4-triazole; uric acid; xanthine; hypoxanthine;electrochemistry
O657.1;O646
:A
:1004-4957(2017)09-1124-05
2017-04-27;
:2017-06-05
重庆市工程技术研究中心建设项目(cstc2015yfpt_gcjsyjzx0027)
*
:王 跃,博士,副教授,研究方向:材料化学,Tel:18716277698,E-mail:wangyue@cque.edu.cn
10.3969/j.issn.1004-4957.2017.09.012

