禾草内生真菌与2种AM真菌互作对黑麦草生长的影响
李芳,李彦忠,段廷玉
(草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
禾草内生真菌与2种AM真菌互作对黑麦草生长的影响
李芳,李彦忠,段廷玉*
(草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
在温室盆栽条件下,以侵染内生真菌和未侵染内生真菌的黑麦草为材料,接种幼套球囊霉(Claroideoglomusetunicatum)和根内球囊霉(Rhizophagusintraradices)以及两种AM真菌的混合菌剂,通过比较单一及混合AM真菌和禾草内生真菌对黑麦草株高、根长、生物量、P含量、可溶性糖、可溶性蛋白以及光合指标等方面的差异,探究AM真菌与禾草内生真菌对黑麦草生长的影响。结果表明,接种幼套球囊霉、根内球囊霉和混合菌剂的黑麦草平均AM真菌侵染率分别为44.04%,34.13%和41.13%,禾草内生真菌降低AM真菌平均侵染率22.28%。接种AM真菌和侵染禾草内生真菌均提高了黑麦草形态和生理生化指标,且二者(尤其是幼套球囊霉与禾草内生真菌)共存时,黑麦草的形态和生理生化指标最高,与既不侵染禾草内生真菌也不接AM真菌的处理相比,幼套球囊霉与禾草内生真菌共同作用时总P含量、总生物量和净光和速率分别提高48.21%, 21.12%和73.53%,总可溶性糖和蛋白分别提高147.12%和24.27%。总体而言,AM真菌显著促进了植物地上、地下部分生长,而禾草内生真菌主要促进植物地上部分的生长。
AM真菌;禾草内生真菌;黑麦草;生长
丛枝菌根(arbuscular mycorrhizal,AM)真菌是球囊菌门(Glomeromycota)、球囊菌纲(Glomeromycetes)的一类真菌,可与大约90%以上的有花植物、蕨类和苔藓植物形成菌根结构[1-2],是世界上分布最广泛的菌根类型,广泛存在于草地、农田、森林等生态系统中[3]。AM真菌可改善土壤理化性状[1]、改善根围微生物区系[4]、改变植物形态结构[5-6]、促进植物对水分和养分的吸收利用[7-8],从而促进植物生长和提高植物抗逆性。
禾草内生真菌(Epichlo⊇)是指在禾草中度过全部或大部分生命周期,而禾草不显示外部症状的一大类真菌[9],禾草-内生真菌共生体是自然界中较为常见的一种共生体类型,植物可以为内生真菌提供光合产物和矿物质[10],内生真菌则可以提高种子活力[11],促进植物生长,提高牧草产量[12]。
AM真菌与禾草内生真菌互作的研究并不多见,仅限于球囊霉属(Glomus)AM真菌与禾草内生真菌Epichlo⊇(无性阶段为Neotyphodium)的相互作用。禾草内生真菌和AM真菌能相互影响,研究发现禾草内生真菌和AM真菌存在相互竞争的关系。Omacini等[13]发现带内生真菌N.occultans的黑麦草(Loliumperenne)降低了3种混合球囊霉的侵染,但却可以增加附近未感染内生真菌植株的AM真菌侵染率,Mack等[14]的研究也发现高羊茅(Festucaarundinacea)内生真菌的存在降低了AM真菌侵染率,并认为内生真菌和AM真菌的互作存在不对称性。然而Novas等[15-16]却发现禾草内生真菌可以增加AM真菌的侵染率,而且一定浓度的内生真菌浸提液可以增加AM真菌的菌丝长度。Liu等[17]报道禾草内生真菌降低AM真菌侵染率的同时,AM真菌反过来又减少了内生真菌菌丝密度和寄主植物叶片中生物碱的含量。目前,有关AM真菌与禾草内生真菌互作,对P等养分吸收、生长及生理生化指标影响的研究尚不多见。我国土壤普遍缺P,且P在土壤中移动性差,AM真菌对植物P吸收的贡献可达80%以上[18]。国际上目前销售的多年生黑麦草多含有禾草内生真菌,因此,研究AM真菌,尤其是在低P条件下与禾草内生真菌互作对植物生长及养分吸收的影响,对于有效利用共生微生物,促进植物养分吸收和生长具有重要意义。本研究通过比较单一AM真菌和混合AM真菌在低P条件下与禾草内生真菌互作对黑麦草生长的影响差异,筛选优势AM真菌,并明确低P条件下禾草内生真菌与AM真菌互作促进植物生长的优势组合,从而利用共生微生物促进植物生长,提高产量。这对农业生态系统的稳定、可持续发展有着积极的影响。
1 材料与方法
1.1试验材料
1.1.1供试土壤 供试土壤购于兰州花市,黑壤土,土壤过2 mm筛后,与河砂按1∶1比例充分混合,于121 ℃高压灭菌2次,每次灭菌1 h,间隔24 h。混合基质pH=5.85,速效P含量为19.17 mg/kg。
1.1.2供试植物 供试宿主植物为坪用多年生黑麦草, 种子带有禾草内生真菌(E+)和不带禾草内生真菌(E-),由兰州大学草地农业科技学院马敏芝博士提供。挑选大小一致且籽粒饱满的种子,先用75%的酒精消毒3 min,再用体积分数为3%的次氯酸钠对种子进行表面消毒10 min,用自来水和蒸馏水冲洗3次,摆放在有滤纸的培养皿中于恒温培养箱25 ℃催芽。
1.1.3供试菌种 供试AM真菌菌剂为幼套球囊霉(Claroideoglomusetunicatum)和根内球囊霉(Rhizophagusintraradices)以及这两种菌的混合菌剂,购买于北京市农林科学研究院植物营养与资源研究所中国丛枝菌根真菌菌种资源保藏中心,经三叶草扩繁所得。接种物含有真菌孢子、菌丝、侵染根段等繁殖体及混合基质。
1.1.4试验设计 试验于2014年7月到2014年10月在兰州大学草地农业科技学院榆中智能温室中进行,将供试土壤分别接种不同AM真菌,包括:1)单独接种幼套球囊霉(C.et);2)单独接种根内球囊霉(R.in);3)混合接种幼套球囊霉+根内球囊霉(Mix);4)接种灭菌AM真菌菌剂,作为对照(NM)。
每盆装1000 g 土,20 g AM菌剂。将AM菌剂与土充分混合建立AM处理,并在上述AM处理中分别移栽E+,E-幼苗,每盆移栽4株,生长1周后,选择长势较为一致的保留3株;试验共8个处理,每个处理4个重复。
黑麦草在温室生长9周后收获。生长期间隔日浇水,根据水分损失情况,补充至土壤重量10%。
收获前一天测定黑麦草株高和光合指标,收获时采集不同处理植株相同部位的新鲜叶片,用于测定可溶性糖、可溶性蛋白等指标。植物收获后,将地上部和地下部分开,根部用水冲洗干净,取部分根样测定菌根侵染率,剩余的地上部和地下部测定生物量。
1.2试验方法
1.2.1菌根侵染率的测定 染色镜检法测定菌根侵染率:称取0.2 g左右根系,置于10% KOH 溶液中30 min,然后于60 ℃ 水浴中加热1 h,倾去KOH 溶液,将根系置于1 mol/L HCl溶液中酸化30 s,倾去HCl;用蒸馏水冲洗3次,在解剖镜下检查是否已除去植物根部皮层中的有色物质,若色素已基本去除,用0.05% Trypan Blue(乳酸∶甘油∶水=1∶1∶1)染色[19],60 ℃水浴保持5~10 min,冷却后测定AM真菌侵染率[20]。
1.2.2形态学指标的测定 株高:从土表面的部位开始到植株最高点的高度,定苗后第2周开始测定,每周1次,共6次。
根长:从基质界面开始到根最长部分长度,收获植物后,将根系冲洗干净,每盆植株的全部根系平铺在报纸上,用厘米尺测量每盆植株根系长度。
生物量:地上、地下部分均先称取鲜重(W1),然后采用烘干法测定,先在105 ℃杀青20 min,然后于80 ℃烘箱烘48 h,称重(W2)。地上、地下生物量根据测定可溶性糖、AM真菌侵染率等相关指标的鲜重(W3)与干重比,计算获得。

1.2.3植物地上地下部分全P含量的测定 采用钼锑抗吸光光度法[21],建立标准曲线,用分光光度计(Pectrum, Shanghai 721,中国),于700 nm处测定吸光度值。
1.2.4可溶性糖含量和可溶性蛋白含量的测定 可溶性糖和可溶性蛋白含量分别采用王学奎[22]的蒽酮比色法和考马斯亮蓝G-250法,建立标准曲线,并用分光光度计(Pectrum, Shanghai 721,中国)分别于620 nm和595 nm波长处测定吸光度值。
1.2.5光合指标的测定 收获前在室内选择天气晴朗的上午9:00-11:00,从盆栽植株中随机选取叶片,于普通空气条件下采用Li-6400便携式光合仪测定叶片光合,每盆取5个值,每个处理测4个重复。测定参数包括叶片的净光合速率(Pn,μmol/m2·s)、蒸腾速率(Tr,μmol/m2·s)、气孔导度(Gs,μmol/m2·s)以及水分利用效率(WUE)等指标[23]。
1.3数据处理
将所有试验数据录入Microsoft Excel 2007进行整理并计算、作图。用SPSS 19.0统计软件对不同处理间数据进行差异显著性比较分析。
2 结果与分析
2.1AM真菌侵染率
NM处理的黑麦草根系未检测到菌根结构。接种AM真菌的黑麦草均不同程度地受到侵染。E+和E-黑麦草均以幼套球囊霉侵染率最高,根内球囊霉侵染率最低,E+、E-黑麦草的AM真菌平均侵染率分别为34.78%和44.75%,E+较E-降低AM真菌平均侵染率22.28%(表1)。
2.2黑麦草株高和根长
AM真菌和禾草内生真菌均显著提高了黑麦草株高,但未显著影响植物根长。其中AM真菌对黑麦草株高的影响因AM真菌而异。与NM处理相比,C.et提高了黑麦草株高,而R.in则降低了黑麦草株高,Mix对黑麦草株高和根长均无显著影响。AM真菌(除R.in)与禾草内生真菌共同作用时,黑麦草株高显著高于对照,但二者不存在交互作用(图1)。
2.3黑麦草生物量

表1 AM和禾草内生真菌处理下的多年生黑麦草AM真菌侵染率Table1 Perennial ryegrass AMF colonization under AM fungi and grass endophyte treatments %
E+:侵染禾草内生真菌 Infected grass endophyte;E-:未侵染禾草内生真菌Un-infected grass endophyte;NM:接种灭菌AM真菌菌剂 Inoculated sterized inoculant;C.et:接种幼套球囊霉 InoculatedC.etunicatum;R.in:接种根内球囊霉InoculatedR.intraradices;Mix:接种混合菌剂 Inoculated mix ofC.etunicatumandR.intraradices.
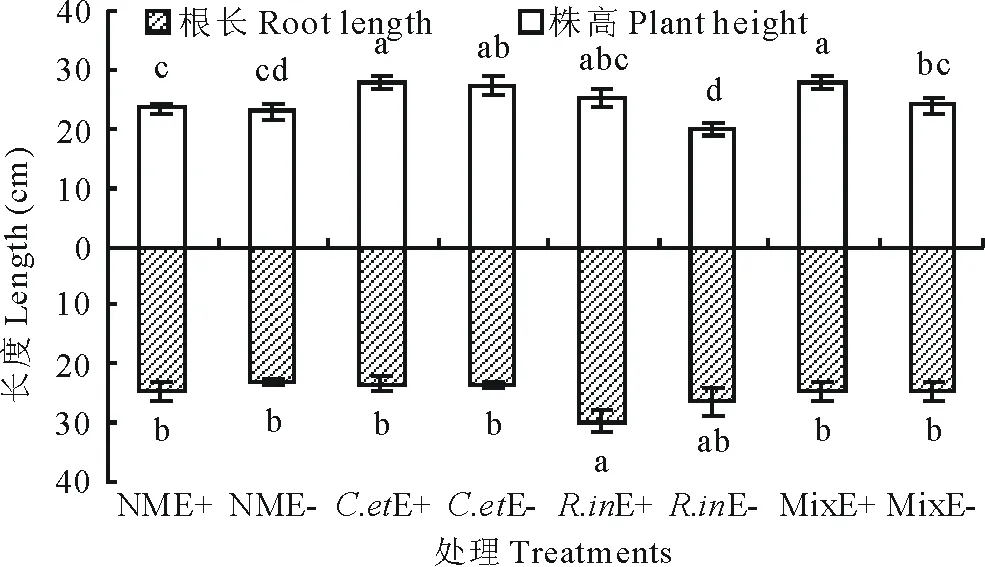
图1 AM真菌和禾草内生真菌处理下的黑麦草株高和根长 Fig.1 Perennial ryegrass plant height and root length under AM fungi and grass endophyte treatments 不同字母表示不同处理间存在显著差异 (P<0.05) Different letters show significant differences among different treatments (P<0.05). NME+:未接种AM真菌只侵染禾草内生真菌Non-inoculated AMF but infected grass endophyte;NME-:未接种AM真菌也未侵染禾草内生真菌Neither inoculated AMF nor infected grass endophyte;C. etE+:幼套球囊霉与禾草内生真菌共存Co-exist by C. etunicatum and grass endophyte;C. etE-:接种幼套球囊霉未侵染禾草内生真菌Inoculated C. etunicatum but not infected grass endophyte;R. inE+:根内球囊霉与禾草内生真菌共存Co-exist by R. intraradices and grass endophyte;R. inE-:接种根内球囊霉未侵染禾草内生真菌Inoculated R. intraradices but not infected grass endophyte;MixE+:混合菌剂与禾草内生真菌共存Co-exist by C. etunicatum, R. intraradices and grass endophyte;MixE-:接种混合菌剂未侵染禾草内生真菌Inoculated C. etunicatum and R. intraradices but not infected grass endophyte. 下同The same below.
AM真菌与禾草内生真菌均显著促进了黑麦草的生长,与NM处理相比,接种AM真菌显著提高了黑麦草地上生物量、地下生物量、总生物量,其中接种C.et分别提高地上、地下和总生物量21.71%,20.63%和21.32%。R.in提高地上生物量1.25%,地下生物量10.90%,总生物量1.19%。Mix处理下黑麦草生物量介于2种AM真菌单独接种处理之间。禾草内生真菌显著提高植物地上生物量18.17%,地下生物量12.72%和总生物量16.12%。AM真菌与禾草内生真菌同时存在时,地上生物量、地下生物量、总生物量有显著交互作用,显著大于二者都不存在或二者单独存在的处理,这表明两种共生微生物对黑麦草生长的促生效应是叠加的。
与NM处理相比,接种AM真菌的处理(除C.et)提高了黑麦草的根冠比,其中R.in提高1.39%,Mix提高14.45%。禾草内生真菌显著降低黑麦草根冠比。AM真菌与禾草内生真菌共同作用时二者之间没有交互效应(表2)。
2.4黑麦草P含量
AM真菌与禾草内生真菌对黑麦草养分吸收的影响与对生物量的影响相似。与NM处理相比,接种AM真菌显著影响了黑麦草地上、地下和总P含量,其中以接种C.et效果最为显著。C.et分别提高地上、地下和总P含量28.05%,58.41%和36.12%。R.in反而降低了黑麦草地上、地下和总P含量,降低程度分别为10.34%,11.38%和10.62%。Mix处理下黑麦草P含量介于2种AM真菌单独接种处理之间。与E-植株相比,禾草内生真菌显著提高地上P含量23.77%,地下P含量41.13%,总生物量28.48%。AM真菌与禾草内生真菌共同作用时,仅对黑麦草总P含量有显著交互作用,其中C.et与禾草内生真菌共同作用时效果最好,黑麦草地上、地下和总P含量较两者都不存在的处理提高35.37%,88.69%和49.30%,且这种协同效应显著大于C.et和禾草内生真菌单独存在的处理,这表明两种共生微生物对黑麦草生长的促生效应是叠加的(表3)。
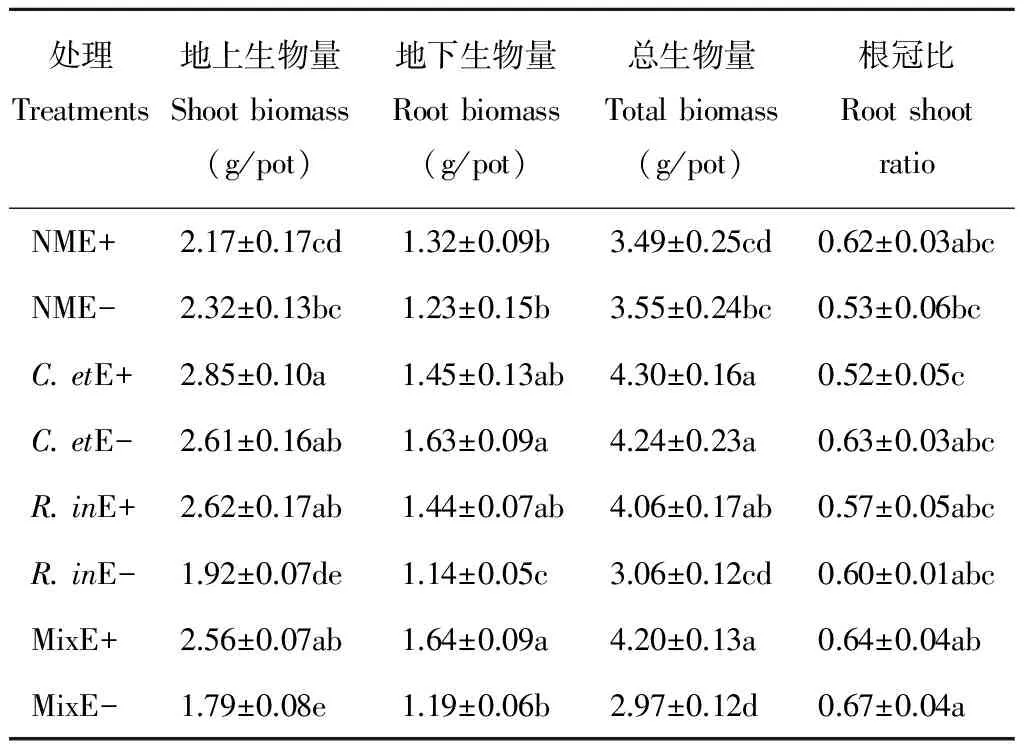
表2 AM真菌与禾草内生真菌处理下黑麦草生物量Table 2 Perennial ryegrass biomass under AM fungi and grass endophyte treatments

表3 AM真菌与禾草内生真菌处理下黑麦草地上、地下和总P含量Table 3 Perennial ryegrass shoot P, root P and total P content under AM fungi and grass endophyte treatments mg/pot
注:同列不同字母表示处理间差异显著 (P<0.05)。下同。
Note:Different letters in the same column mean the significant differences among different treatments atP<0.05. The same below.
2.5黑麦草可溶性糖含量
AM真菌与禾草内生真菌均显著提高了黑麦草的可溶性糖含量。与NM处理相比,接种AM真菌显著提高黑麦草地上、地下和总可溶性糖含量。其中接种C.et分别提高地上、地下和总可溶性糖含量89.33%,232.44% 和114.64%,R.in分别提高地上、地下和总可溶性糖含量45.43%,61.82%和48.33%,Mix处理下黑麦草可溶性糖含量介于2种AM真菌单独接种处理之间。与E-植株相比,禾草内生真菌提高地上可溶性糖含量36.77%和总可溶性糖含量23.17%,而对地下可溶性糖含量没有显著影响。AM真菌与禾草内生真菌共同作用时,黑麦草的可溶性糖含量高于其他处理,但二者间不存在交互作用(表4)。
2.6黑麦草可溶性蛋白含量
AM真菌与禾草内生真菌均显著提高了黑麦草的可溶性蛋白含量。与NM处理相比,接种AM真菌显著提高黑麦草地下和总可溶性蛋白含量,而对地上可溶性蛋白含量没有显著影响。其中C.et,R.in和 Mix处理下地下可溶性蛋白含量分别提高16.76%,21.14%和21.81%,总可溶性蛋白含量分别提高11.74%,10.43%和10.87%。与E-植株相比,侵染禾草内生真菌仅对地上可溶性蛋白含量和总可溶性蛋白含量有显著差异,其中地上可溶性蛋白含量提高17.42%,总可溶性蛋白含量提高8.64%。AM真菌与禾草内生真菌共同作用时,黑麦草的可溶性蛋白含量高于其他处理,但二者间没有交互作用(表5)。
2.7黑麦草光合效率
AM真菌与禾草内生真菌均能显著提高黑麦草的光合速率。与NM处理相比,接种AM真菌能提高黑麦草净光和速率、气孔导度、蒸腾速率和水分利用效率。其中C.et提高净光和速率42.67%,气孔导度23.63%,蒸腾速率25.98%和水分利用效率50.00%;R.in提高净光和速率8.83%,水分利用效率49.38%;Mix处理下黑麦草光合速率介于2种AM真菌单独接种处理之间。与E-植株相比,侵染禾草内生真菌提高净光和速率23.98%,气孔导度14.48%,蒸腾速率13.04%,水分利用效率25.29%。AM真菌与禾草内生真菌共同作用时,黑麦草的光合速率高于其他处理,但二者之间没有显著交互作用(表6)。
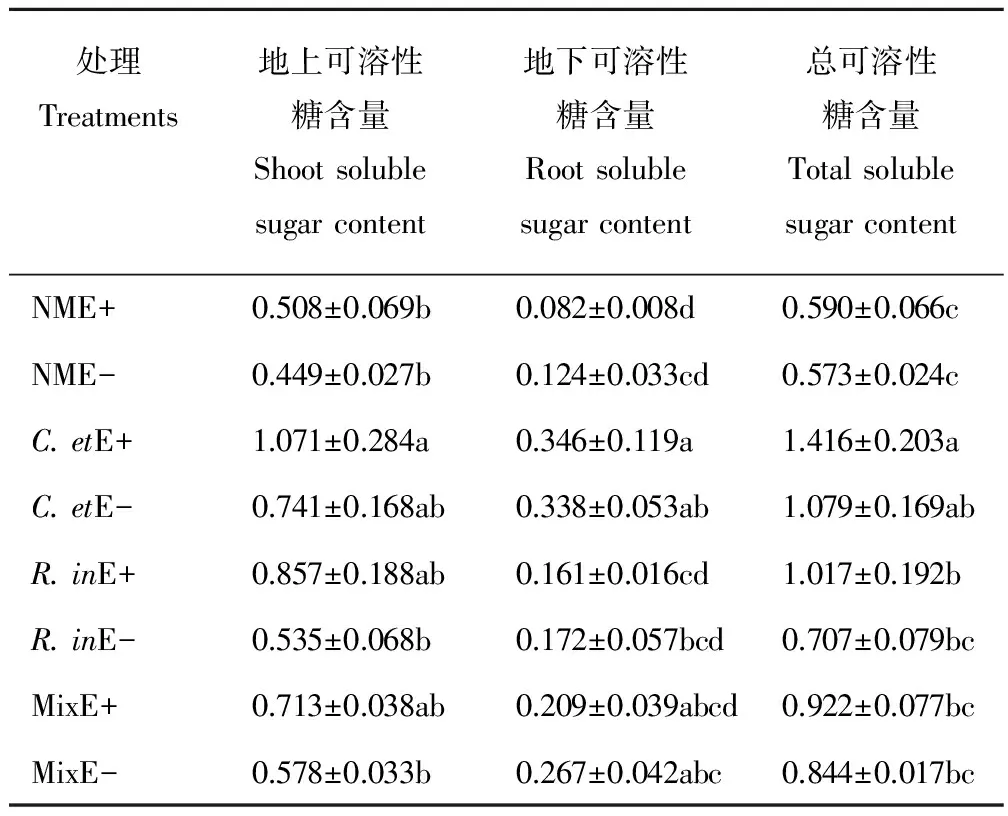
表4 AM真菌与禾草内生真菌处理下黑麦草可溶性糖含量Table 4 Perennial ryegrass soluble sugar content under AM fungi and grass endophyte treatments %
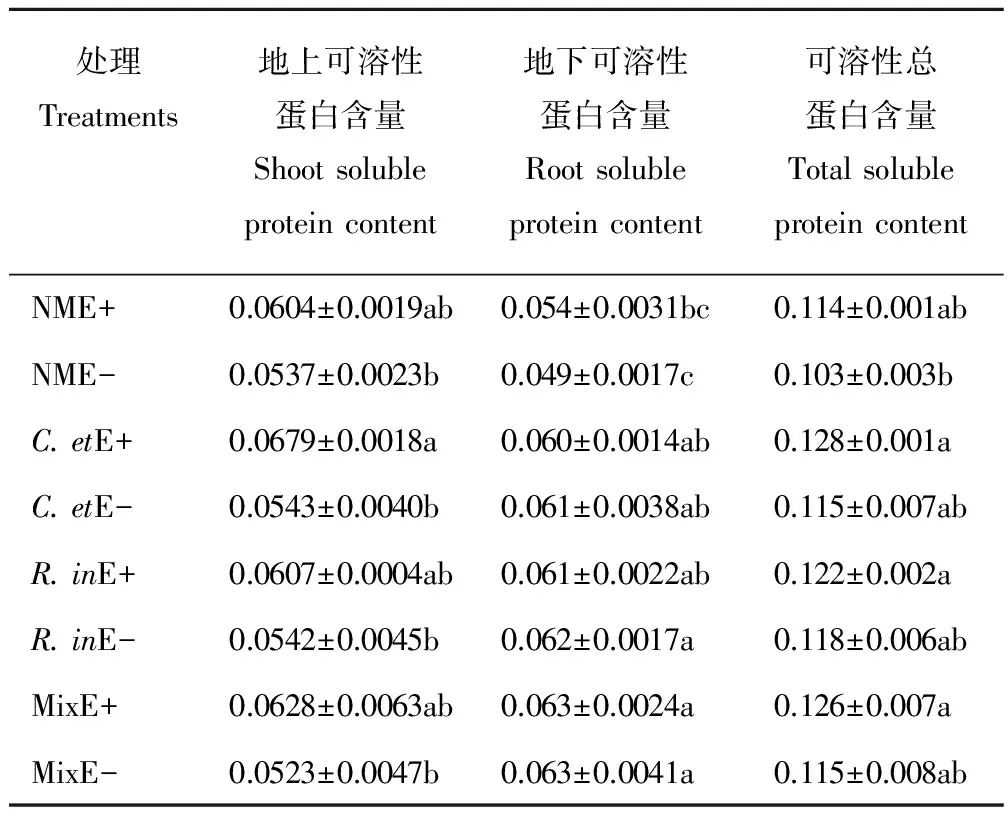
表5 AM真菌与禾草内生真菌处理下黑麦草可溶性蛋白含量 Table 5 Perennial ryegrass soluble protein content under AM fungi and grass endophyte treatment mg/g

表6 AM真菌与禾草内生真菌处理下的黑麦草光合指标Table 6 Perennial ryegrass photosynthetic indexes under AM fungi and grass endophyte treatments
3 结论与讨论
AM真菌和禾草内生真菌广泛存在于农业生态系统中,能与宿主植物形成共生体,早在20世纪90年代人们便已知道禾草内生真菌能够影响土壤中的AM真菌,本研究结果表明,接种AM真菌,对黑麦草形态指标和生理生化指标的影响都是C.et>Mix>R.in,Mix处理的效果优于根内球囊霉,却低于幼套球囊霉,这可能是因为同时接种不同的AM真菌时,两种AM真菌间存在竞争,从而在促进植物生长方面并没有表现出叠加的优势。此外,侵染禾草内生真菌降低了AM真菌的侵染率,说明禾草内生真菌能抑制AM真菌的侵染,这和Mack 等[14]、Muller[24]的研究结果一致,这可能是因为禾草内生真菌和AM真菌之间也会存在竞争,而禾草内生真菌相对于AM真菌有短期的优越性[14]。本研究还发现禾草内生真菌与不同AM真菌互作,对黑麦草生长的促进作用不同,禾草内生真菌与幼套球囊霉互作对黑麦草生长的促进作用大于根内球囊霉,这和Larimer等[25]发现内生真菌Epichlo⊇elymi促进摩西球囊霉(G.mosseae)侵染,抑制近明球囊霉(G.Claroideum)侵染的结果相似。这可能是因为AM真菌对植物的促进作用因真菌而异的缘故。
幼套球囊霉和禾草内生真菌都能显著提高黑麦草株高,根内球囊霉能促进黑麦草根系生长,而禾草内生真菌对黑麦草的根系无显著差异。这与鹿金颖等[26]在酸枣(Zizyphusspinosus)实生苗上接种AM真菌,发现实生苗的生长量(株高、叶面积、鲜重、干重)显著增加,Berta等[27]在红叶李(Prunuscerasifera)组培苗上接种摩西球囊霉和根内球囊霉,导致根长显著增加,Bacon等[28]证实禾草内生真菌的感染可提高多年生黑麦草的地上生长能力的结果一致。方爱国等[29]的试验表明内生真菌和AM真菌都能促进野大麦(Hordeumbrevisubulatum)地上生物量的增加,此外,AM真菌主要促进野大麦地下生物量的增加,而内生真菌对野大麦地下生物量无显著贡献。Muller[24]的试验也表明禾草内生真菌不能增加宿主植物的地下生物量,本研究结果与此相似,本研究结果表明:AM真菌和禾草内生真菌都能提高黑麦草地上、地下和总生物量,而AM真菌能同时提高地上、地下生物量、总生物量和根冠比,其效果是C.et>Mix>R.in。这可能是因为AM真菌侵染植物根系,能运输根系吸收的水分和矿质养分到植物地上部分,同时地上部分积累的碳水化合物也能运输到根部,因此,AM真菌能同时促进地上地下部分生长,而Mix处理下的2种AM真菌之间存在养分、水分和碳水化合物竞争,从而减少了养分、水分和碳水化合物的运输,因此,生物量的积累介于2种AM真菌单独接种处理之间。禾草内生真菌菌丝体存在于禾草的所有地上部分:茎秆、叶鞘、叶片、花序及种子,但未发现存在于根系中[30],所以,禾草内生真菌对地下生物量的影响较地上生物量小。AM真菌与禾草内生真菌共同作用时,地上生物量、地下生物量、总生物量显著高于二者都不存在或二者单独存在的处理,这表明两种共生微生物促进黑麦草生长的效应是叠加的。
Moradi等[31]发现接种AM真菌显著提高了寄主植物根部可溶性糖含量,张盼盼[32]发现披碱草(Elymusdahuricus)内生真菌能提高寄主植物叶片的可溶性糖含量;此外,刘润进等[1]的研究发现接种摩西球囊霉、根内球囊霉和珠状巨胞球囊霉6~7周后洋葱(Alliumcepa)根系内可溶性蛋白的含量显著高于未接菌植株,并诱导植株分泌合成一些新的蛋白质,陈娜[33]的研究也发现醉马草(Achnatheruminebrians)内生真菌能提高寄主植物叶片可溶性蛋白含量。这些研究表明AM真菌和禾草内生真菌均能提高植物的可溶性糖含量和可溶性蛋白含量,本研究结果与此一致。AM真菌与禾草内生真菌共同作用时,多年生黑麦草的可溶性糖含量和可溶性蛋白含量高于二者都不存在或二者单独存在的处理。
光合作用是衡量植物生长状况的重要指标,是植物合成有机物质和获得能量的根本所在,本研究发现,AM真菌和内生真菌都能提高多年生黑麦草净光和速率、气孔导度、蒸腾速率和水分利用效率,这与Amalric等[34]研究多年生黑麦草E+植株的气孔导度、蒸腾速率以及净光合速率高于E-植株以及朱先灿等[35]研究的AM真菌促进了玉米(Zeamays)叶片叶绿体的形成和叶绿素的合成速率,进而提高了菌根植株的光合能力的结果一致,其中对黑麦草净光和速率和水分利用效率的促进作用C.et>Mix>R.in,这可能是因为AM真菌菌丝体促进水分和营养物质在地上、地下部分的吸收、转运,从而能有效地促进光合作用的进行,而混合接种的AM真菌之间存在养分和碳水化合物的竞争,因此Mix处理的光合作用能力介于2种AM真菌单独接种处理之间。AM真菌和内生真菌同时存在时,多年生黑麦草的光合作用强于AM真菌与禾草内生真菌都不存在的处理和二者单独存在的处理,其中以幼套球囊霉和禾草内生真菌同时存在时效果最佳。
本研究结果表明,AM真菌和禾草内生真菌共同作用时,黑麦草形态指标和生理生化指标高于二者都不存在或二者单独存在的处理,这与方爱国等[29]的研究结果一致。对于AM真菌处理,Mix处理下多年生黑麦草的形态和生理生化指标介于2种AM真菌单独接种处理之间,这可能是因为2种AM真菌促进植物吸收养分(P)的同时,二者间也存在养分和碳水化合物的竞争,而Mix处理下2种AM真菌通过竞争消耗的养分和碳水化合物大于它们为植物做出的贡献,所以黑麦草长势变弱。
禾草内生真菌促进植物生长主要是因为内生真菌的侵染影响植物体内的物质代谢, 提高植物的资源利用效率,从而促进植物生长;AM真菌促进植物生长主要是因为AM 真菌与宿主植物形成共生关系后, 其根外菌丝能够扩大宿主根系吸收范围,促进水分和矿物质(尤其是P)的吸收利用和转运,从而促进植物生长[36]。关于二者的互作机理,Mack等[14]提出的一种假说:禾草内生真菌的密度能够改变宿主植物对营养元素的需求,从而间接影响AM真菌对植物的侵染。因此筛选优势AM真菌,明确低P条件下禾草内生真菌与AM真菌互作促进植物生长的优势组合,并探究二者互作的内在机制,从而为利用共生微生物促进植物生长,提高产量奠定一定的理论基础。
References:
[1] Liu R J, Chen Y L. Mycorrhizology[M]. Beijing: Science Press, 2007. 刘润进, 陈应龙. 菌根学[M]. 北京: 科学出版社, 2007.
[2] Renker C, Heinrichs J, Kaldorf M,etal. Combining nested PCR and restriction digest of the internal transcribed spacer region to characterize arbuscular mycorrhizal fungi on roots from the field. Mycorrhiza, 2003, 13(4): 191-198.
[3] Willis A, Rodrigues B F, Harris P J C. The ecology of arbuscular mycorrhizal fungi. Critical Reviews in Plant Sciences, 2013, 32(1): 1-20.
[4] Saldajeno M G B, Ito M, Hyakumachi M. Interaction between the plant growth-promoting fungusPhomasp. GS8-2 and the arbuscular mycorrhizal fungusGlomusmosseae: impact on biocontrol of soil-borne diseases, microbial population, and plant growth. Australasian Plant Pathology, 2012, 41(3): 271-281.
[5] Affokpon A, Coyne D L, Lawouin L,etal. Effectiveness of native West African arbuscular mycorrhizal fungi in protecting vegetable crops against root-knot nematodes. Biology and Fertility of Soils, 2011, 47(2): 207-217.
[6] Han T T, Wang W H, Guo S X. Effects of arbuscular mycorrhizal fungi on photosynthetic characteristics ofColeusblumei. Journal of Qingdao Agricultural University: Natural Science Edition, 2011, 28(1): 9-12. 韩婷婷, 王维华, 郭绍霞. AM 真菌对彩叶草光合特性的影响. 青岛农业大学学报: 自然科学版, 2011, 28(1): 9-12.
[7] Fougnies L, Renciot S, Muller F,etal. Arbuscular mycorrhizal colonization and nodulation improve flooding tolerance inPterocarpusofficinalisseedlings. Mycorrhiza, 2007, 17(3): 159-166.
[8] He C, Chen W Y, He X L,etal. Interactive effects of arbuscular mycorrhizal fungi under different soil water and fertilizer conditions on the plant growth and nutrients ofScutellariabaicalensis. Acta Ecologica Sinica, 2016, 36(10): 2798-2806. 贺超, 陈伟燕, 贺学礼, 等. 不同水肥因子与AM真菌对黄芩生长和营养成分的交互效应. 生态学报, 2016, 36(10): 2798-2806.
[9] Siegel M R, Latch G C M, Johnson M C. Fungal endophytes of grasses. Annual Review of Phytopathology, 1987, 25(1): 293-315.
[10] Ren A Z, Gao Y B. Growth characteristics of endophyte-infected and endophyte-freeLoliumperenneseedlings under osmotic stress conditions. Acta Ecologica Sinica, 2003, 23(11): 2307-2317. 任安芝, 高玉葆. 渗透胁迫下内生真菌感染对黑麦草幼苗生长的影响. 生态学报, 2003, 23(11): 2307-2317.
[11] Reed K F M. Perennial ryegrass in Victoria and the significance of the ryegrass endophyte[C]//Proceedings Perennial Ryegrass without Staggers Symposium. Australian Institute of Agricultural Science and Australian Society of Animal Real Production, 1987: 1-7.
[12] Li H Q. Influence of Grass Endophyte on Perennial Ryegrass Growth and Drought Stress[D]. Lanzhou: Lanzhou University, 2016. 李会强. 内生真菌对多年生黑麦草生长及抗旱性能的影响[D]. 兰州: 兰州大学, 2016.
[13] Omacini M, Eggers T, Bonkowski M,etal. Leaf endophytes affect mycorrhizal status and growth of co-infected and neighbouring plants. Functional Ecology, 2006, 20(2): 226-232.
[14] Mack K M L, Rudgers J A. Balancing multiple mutualists: asymmetric interactions among plants, arbuscular mycorrhizal fungi and fungal endophytes. Oikos, 2008, 117(2): 310-320.
[15] Novas M V, Cabral D, Godeas A M. Interaction between grass endophytes and mycorrhizas inBromussetifoliusfrom Patagonia, Argentina. Symbiosis, 2005, 40(1): 23-30.
[16] Novas M V, Iannone L J, Godeas A M,etal. Evidence for leaf endophyte regulation of root symbionts: effect ofNeotyphodiumendophytes on the pre-infective state of mycorrhizal fungi. Symbiosis, 2011, 55(1): 19-28.
[17] Liu Q, Parsons A J, Xue H,etal. Competition between foliarNeotyphodiumloliiendophytes and mycorrhizalGlomusspp.fungi inLoliumperennedepends on resource supply and host carbohydrate content. Functional Ecology, 2011, 25(4): 910-920.
[18] Smith S E, Read D J. Mycorrhizal Symbiosis[M]. New York: Academic Press, 2010.
[19] Koske R E, Gemma J N. A modified procedure for staining roots to detect VA mycorrhizas. Mycological Research, 1989, 92(4): 486-505.
[20] Giovannetti M, Mosse B. An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots. New Phytologist, 1980, 84: 489-500.
[21] Wen H Y, Fu H, Zhao H L. The relationship between plant species biodiversity and soil fertility in degraded sandy grassland. Pratacultural Science, 2008, 25(10): 6-9. 文海燕, 傅华, 赵哈林. 退化沙质草地植物群落物种多样性与土壤肥力的关系. 草业科学, 2008, 25(10): 6-9.
[22] Wang X K. Principle and Technology of Plant Physiological and Biochemical Experiments[M]. Beijing: Higher Education Press, 2006: 105-285. 王学奎. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 2006: 105-285.
[23] Ma M Z, Nan Z B. Effect of fungal endophytes against rust disease of perennial ryegrass (Loliumperenne) on growth and physiological indices. Acta Prataculturae Sinica, 2011, 20(6): 150-156. 马敏芝, 南志标. 内生真菌对感染锈病黑麦草生长和生理的影响. 草业学报, 2011, 20(6): 150-156.
[24] Muller J. Artificial infection by endophytes affects growth and mycorrhizal colonisation ofLoliumperenne. Functional Plant Biology, 2003, 30(4): 419-424.
[25] Larimer A L, Bever J D, Clay K. Consequences of simultaneous interactions of fungal endophytes and arbuscular mycorrhizal fungi with a shared host grass. Oikos, 2012, 121(12): 2090-2096.
[26] Lu J Y, Mao Y M, Shen L Y,etal. Effects of VA mycorrhizal fungi inoculated on drought tolerance of wild jujube (Zizyphusspinosus) seedlings. Acta Horticulturae Sinica, 2003, 30(1): 29-33. 鹿金颖, 毛永民, 申连英, 等. VA菌根真菌对酸枣实生苗抗旱性的影响. 园艺学报, 2003, 30(1): 29-33.
[27] Berta G, Trotta A, Fusconi A,etal. Arbuscular mycorrhizal induced changes to plant growth and root system morphology inPrunescerasifera. Tree Physiology, 1995, 15(5): 281-293.
[28] Bacon C W, Siegel M R. Endophyte parasitism of tall fescue. Journal of Production Agriculture, 1988, 1(1): 45-55.
[29] Fang A G, Li C J. Effect ofNeotyphodiumendophyte and AMF onHordeumbrevisubulatumgrowth. Pratacultural Science, 2014, 31(3): 457- 461. 方爱国, 李春杰.Neotyphodium属禾草内生真菌和球囊霉属菌根真菌对野大麦生长的影响. 草业科学, 2014, 31(3): 457-461.
[30] Nan Z B, Li C J. Roles of the grass-Neotyphodiumassociation in pastoral agriculture systems. Acta Ecologica Sinica, 2004, 24(3): 605-616. 南志标, 李春杰. 禾草-内生真菌共生体在草地农业系统中的作用. 生态学报, 2004, 24(3): 605-616.
[31] Moradi A, Younesi O. Influence of arbuscular mycorrhiza on membrane lipid peroxidation and soluble sugar content of soybean under salt stress. Agriculturae Conspectus Scientificus (ACS), 2015, 79(4): 227-232.
[32] Zhang P P. Characteristic of Endophytic Fungi Isolated fromElymusand Their Effect on Host Resistances[D]. Urumchi: Xinjiang Agricultural University, 2013. 张盼盼. 披碱草内生真菌的特性及其对寄主抗逆性的作用研究[D]. 乌鲁木齐: 新疆农业大学, 2013.
[33] Chen N. Genetic Diversity of Drunken Horse Grass (Achnatheruminebrians) and Effects of Its Endophyte Infection on Cold Tolerance[D]. Lanzhou: Lanzhou University, 2008. 陈娜. 醉马草遗传多样性及内生真菌对其抗寒性影响[D]. 兰州: 兰州大学, 2008.
[34] Amalric C, Sallanon H, Monnet F,etal. Gas exchange and chlorophyll fluorescence in symbiotic and non-symbiotic ryegrass under water stress. Photosynthetica, 1999, 37(1): 107-112.
[35] Zhu X C, Song F B, Xu H W. Effects of arbuscular mycorrhizal fungi on photosynthetic characteristics of maize under low temperature stress. Chinese Journal of Applied Ecology, 2010, 21(2): 470-475. 朱先灿, 宋凤斌, 徐洪文. 温胁迫下丛枝菌根真菌对玉米光合特性的影响. 应用生态学报, 2010, 21(2): 470-475.
[36] Ruiz-Lozano J M, Azcón R. Hyphal contribution to water uptake in mycorrhizal plants as affected by the fungal species and water status. Physiologia Plantarum, 1995, 95(3): 472.
Effectsofinteractionsbetweenagrassendophyteandanarbuscularmycorrhizalfungusonperennialryegrassgrowth
LI Fang, LI Yan-Zhong, DUAN Ting-Yu*
StateKeyLaboratoryofGrasslandAgro-ecosystems,CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730020,China
The aim of this study was to determine the effects of interactions between an arbuscular mycorrhizal (AM) fungus and an endophyte on the growth of perennial ryegrass (Loliumperenne). Ryegrass plants were grown in pots in a greenhouse and inoculated with the AM fungusClaroideoglomusetunicatum,Rhizophagusintraradices, and a mixture ofC.etunicatumandR.intraradices, and then plant height, root length, biomass, phosphorus content, soluble sugars content, soluble protein content, and photosynthetic indexes were monitored. The results showed that the average AM colonization byC.etunicatum,R.intraradices, and the mixture of both species was 44.04%, 34.13%, and 41.13%, respectively. The average AM colonization was 22.28% lower in endophyte-infected ryegrass than in endophyte-free ryegrass. Both the AM fungus and the endophyte increased the morphological, physiological, and biochemical indexes of perennial ryegrass. The total P content, total dry weight, photosynthetic rate, total soluble sugars content, and soluble protein content was 48.21%, 21.12%, 73.53%, 147.12%, and 24.27% higher, respectively, in the plants co-inoculated withC.etunicatumand grass endophyte than in uninoculated plants. Both fungi enhanced shoot growth and root growth, but in general, the AM fungus significantly increased shoot and root growth, while the endophyte mainly increased the shoot growth of perennial ryegrass.
arbuscular mycorrhizal fungi; grass endophyte;Loliumperenne; growth
10.11686/cyxb2016445
http://cyxb.lzu.edu.cn
李芳, 李彦忠, 段廷玉. 禾草内生真菌与2种AM真菌互作对黑麦草生长的影响. 草业学报, 2017, 26(9): 132-140.
LI Fang, LI Yan-Zhong, DUAN Ting-Yu. Effects of interactions between a grass endophyte and an arbuscular mycorrhizal fungus on perennial ryegrass growth. Acta Prataculturae Sinica, 2017, 26(9): 132-140.
2016-11-29;改回日期:2017-03-22
中央高校基本科研业务费(2022016zr0003),国家绿肥产业技术体系(CARS-22)和国家自然科学
基金项目(31100368/C0309)资助。
李芳(1990-),女,青海西宁人,在读博士。E-mail:lif2013@lzu.edu.cn *通信作者Corresponding author. E-mail:duanty@lzu.edu.cn

