PEG介导的柳枝稷叶肉细胞原生质体瞬时表达体系的建立
祁泽文,孙鑫博,樊波,张雪,袁建波,韩烈保*
(1.北京林业大学草坪研究所,北京 100083;2.河北农业大学河北省作物生长调控重点实验室,河北 保定071001;3.深圳市园艺园林建设有限公司,广东 深圳518038)
PEG介导的柳枝稷叶肉细胞原生质体瞬时表达体系的建立
祁泽文1,孙鑫博2,樊波3,张雪1,袁建波1,韩烈保1*
(1.北京林业大学草坪研究所,北京 100083;2.河北农业大学河北省作物生长调控重点实验室,河北 保定071001;3.深圳市园艺园林建设有限公司,广东 深圳518038)
为了建立以PEG介导的柳枝稷叶肉细胞原生质体瞬时表达体系,本研究以柳枝稷 Alamo品种的叶片为材料,通过设计梯度实验确定柳枝稷原生质体分离的最佳条件, 每组梯度实验重复3次, 方案如下:1)对植物培养的时间进行优化。酶解时间固定在8 h, 甘露醇浓度为0.6 mol/L, 将培养了1, 2, 3和4周的黄化苗用作实验材料;2)渗透压优化。选取2周的黄化苗为实验材料, 酶解时间固定在8 h, 甘露醇浓度分别为0.4, 0.5, 0.6, 0.7和0.8 mol/L;3)酶解时间优化。选取2周的黄化苗为实验材料, 甘露醇浓度为0.6 mol/L, 酶解时间分别为6, 7, 8, 9和10 h。通过对比分析发现,苗龄为2周的柳枝稷黄化苗叶片在甘露醇为0.6 mol/L的酶解液中, 黑暗, 28 ℃并裂解8 h后分离的原生质体最为理想。接下来构建了能够在植物细胞内表达GFP-MYB103融合蛋白(GFP为绿色荧光蛋白)的重组质粒LN-OsMYB103, 利用PEG介导法将质粒LN-OsMYB103转化进入柳枝稷原生质体, 并且在激光共聚焦显微镜下观察到了强烈的绿色荧光蛋白信号。该结果表明, 分离的原生质体可以行使正常生物学功能。综上所述, 利用柳枝稷叶片建立了一套完整的柳枝稷叶肉细胞原生质体瞬时表达体系。这将为深入开展柳枝稷的功能基因组学研究奠定了基础。
柳枝稷;PEG;原生质体;瞬时表达
在现代分子生物学中, 瞬时表达方法已经成为了研究基因的重要手段, 被逐渐应用到各类生物学的研究中。植物细胞瞬时表达系统的建立, 为研究启动子活性、基因功能和蛋白质定位提供了便利[1-2]。柳枝稷(Panicumvirgatum)属禾本科黍亚科黍属, 是一种多年生高秆的C4植物, 它起源于北美洛基山脉以东、北纬55°以南[3-4], 柳枝稷能用种子繁殖, 具有耐干旱, 耐贫瘠, 适应性强, 生物量潜力高等优良品质, 常被用于放牧、生态建设, 目前也是一种重要的生物燃料作物。在化石燃料储量逐步下降、环境保护日益严峻的今天, 生物燃料受到了各国的高度重视, 生物燃料的原料来源成为生物燃料可持续发展的重要课题, 因此柳枝稷引起了国内外的重视[5-9]。
柳枝稷是一种异源多倍体植物, 具有自交不亲和的遗传特性, 通过传统育种方法对其进行改良存在巨大的困难[5]。随着技术的进步, 现代生物技术的发展, 通过基因工程手段进行遗传改良成为一种快捷、有效的育种手段, 可以弥补传统育种的不足[10-11]。
外源基因在植物中表达有两种方式:一种通过农杆菌或者基因枪介导的方式, 外源基因整合到植物基因组中, 进行稳定表达;一种是在植物材料中进行顺利表达的方法。而瞬时转化的方法主要有:基因枪轰击法[12]、农杆菌侵染法[13]、PEG(polyethylene glycol, 聚乙二醇)[14]介导的原生质体转化等方法。PEG转化法是一种通过PEG的渗透作用, 将外源基因转入原生质体中的方法, 使用PEG法不仅费用低、操作简便、不需特定仪器而且结果准确[15-16]。通过这种方法在很多植物中获得了成功, 例如在拟南芥(Arabidopsisthaliana)、马铃薯(Solanumtuberosum)、玉米(Zeamays)、柑橘(Citrusparadisi)和软枣猕猴桃(Actinidiaargute)等原生质体瞬时表达体系中, 外源 DNA 转化率均能达到10%以上[17]。模式植物拟南芥的外源DNA转化率更是达到90%[2,18-20], 并为其功能基因组和基因功能的研究奠定了基础。
在柳枝稷的遗传转化研究中, 国内外已经有很多学者进行了尝试, 如Liu等[21]、Mazarei等[22]成功地建立了柳枝稷的遗传转化方法。而在原生质体瞬时表达的研究中, 国内外尚处于体系建立的探索阶段[23-25]。因此针对这点, 本课题组进行原生质体瞬时表达体系的建立。要优化以PEG介导法建立的柳枝稷叶肉原生质体瞬时表达体系, 优化原生质体制备条件尤为重要。水稻(Oryzasativa)和柳枝稷同属于禾本科植物, 可借鉴中国科学院遗传与发育生物学研究所朱立煌课题组的水稻原生质体分离方法分离柳枝稷的原生质体, 以此为基础, 本研究使用柳枝稷品种Alamo黄化苗原生质体为材料, 借鉴水稻原生质体分离方法并利用PEG介导的转化法, 对柳枝稷原生质体分离主要因素进行分析及优化, 建立分离的原生质体的体系,并在此基础上建立一套简单、高效的柳枝稷叶肉原生质体瞬时表达体系, 优化柳枝稷的遗传转化体系, 旨在为提高柳枝稷遗传转化效率和改良柳枝稷的遗传特性奠定基础, 并推动柳枝稷在分子及细胞生物学领域的发展。
1 材料与方法
试验于 2016年 9 月至 2016 年12 月在中国科学院遗传与发育生物学研究所朱立煌组实验室完成。
1.1供试材料
供试柳枝稷 Alamo品种的成熟种子购于美国 Ernst Conservation Seeds 公司。
1.2黄化苗的准备
选取柳枝稷种子, 在70%酒精中浸泡2 min 后, 将种子放在灭菌液(成分:巴士消毒液20%, 灭菌水80%)中, 在150 r/min的摇床上, 室温, 30 min。种子灭完菌后用灭菌水洗净, 在超净工作台下吹干, 然后播在灭菌的营养土中, 并维持在(28±2) ℃, 黑暗条件下培养。
1.3酶解液优化
参考水稻原生质体的提取方法[26], 在此基础上优化条件, 使该方法适用于柳枝稷。原配方成分为酶解液, W5溶液, Mmg溶液和40% PEG溶液。具体的配方如下:酶解液为0.6 mol/L甘露醇(D-mannitol), 10 mmol/L MES [2-(N-吗啡啉)乙磺酸,pH 5.7], 1.5% 纤维素酶(Cellulase RS), 0.75%果胶酶(Macerozyme), 0.1% BSA(牛血清白蛋白), 3.4 mmol/L CaCl2, 5 mmol/L β-羟基乙醇(β-mercaptoethanol)和50 μg/mL羧苄青霉素(carbenicillin);W5溶液为154 mmol/L NaCl, 125 mmol/L CaCl2, 5 mmol/L KCl和2 mmol/L MES;Mmg溶液为0.6 mol/L甘露醇, 15 mmol/L MgCl2和4 mmol/L MES;40% PEG溶液为0.6 mol/L甘露醇, 100 mmol/L CaCl2和40% PEG4000 (聚乙二醇4000)。
设计梯度实验, 确定柳枝稷原生质体分离的最佳条件, 每组梯度实验重复3次。具体方案如下:1)对植物培养的时间进行优化。 酶解时间固定在8 h, 甘露醇浓度为0.6 mol/L, 将培养了1, 2, 3和4周的黄化苗用作实验材料;2)渗透压优化。 选取2周的黄化苗为实验材料, 酶解时间固定在8 h, 甘露醇浓度分别为0.4, 0.5, 0.6, 0.7和0.8 mol/L;3)酶解时间优化。 选取2周的黄化苗为实验材料, 甘露醇浓度为0.6 mol/L, 酶解时间分别为6, 7, 8, 9和10 h。
1.4原生质体提取方法
首先使用全新的刀片将柳枝稷黄化幼苗的叶片切割成1 mm宽的细条。用镊子将切好的苗条放在含20 mL酶溶液的150 mL烧瓶中, 放置28 ℃的黑夜中振荡(40~60 r/min)培养, 4 h后从烧瓶中取10 μL, 在显微镜下观察原生质体。健康的原生质体应是圆形的并没有其他细胞。酶解完成后, 原生质体及酶的混合液经35 μm(100 μm)的筛网, 除去未完全酶解的材料。滤液经916 r/min离心5 min, 去掉上清。向沉淀(原生质体)加入3 mL的W5溶液使其悬浮, 再向管底加入5 mL的CPW20溶液[附加20%蔗糖的CPW盐溶(细胞原生质体清洗液,cell protoplast wash medium)], 916 r/min离心4 min, 两相中间出现一条纯净的原生质体带, 小心取出并以W5溶液重悬后等到纯净的原生质体。取少量纯化后的原生质体悬浮液滴加在血球计数板上, 在显微镜下观察计数, 依次计数中央大方格内原生质体数, 重复3次。
原生质体的密度(个/mL)=大方格(0.1 mm3,即0.1 μL)的原生质体数×104
原生质体产量(个/g)=原生质体密度×原生质体悬浮液总体积(mL)/制备原生质体所用材料的鲜重
1.5载体构建及显微观察
选用pEZR(K)-LN双元载体用作亚细胞定位载体。该载体含CaMV 35S启动子和加强型的绿色荧光蛋白eGFP。OsMYB103基因是MYB家族的转录因子, 根据Yang等[27]的方法, 将OsMYB103连接上LN载体 (pEZR-LN), 用于亚细胞定位的实验。
将制备好的原生质体冲悬浮于Mmg溶液中。取10 μg的质粒LN-PCF5放入2 mL离心管, 再加入200 mL重悬液, 轻轻混匀后在室温下放置15 min, 接着加入220 μL的 40% PEG溶液, 轻轻混匀,室温放置 15 min。用 880 μL的W5 溶液重新悬浮原生质体, 轻弹管底混匀, 1183 r/min离心 2 min, 弃上清液。加入1 mL WI溶液(即洗涤培养液, washing and incubation solution, 配方为0.5 mol/L 甘露醇, 20 mol/L KCl和4 mmol/L MES) 重悬浮并转移至经BSA(牛血清白蛋白)预冲洗过的培养皿中, 24 ℃过夜培养。之后用激光共聚焦显微镜(Leica, Germany)观察鉴定。
2 结果与分析

图1 不同时期的黄化苗提取柳枝稷原生质体Fig.1 The preparation of switchgrass protoplasts with different periods of etiolated seedlings 甘露醇浓度为0.6 mol/L,酶解时间为8 h。 The concentration of mannitol: 0.6 mol/L; Enzymolysis time: 8 h. 不同小写字母表示差异显著(P<0.05), 下同。Different lowercase letters mean significant difference (P<0.05). The same below.
2.1原生质体提取条件优化
2.1.1黄化苗培养时间 植物的幼嫩程度会极大地影响原生质体提取效率, 在此首先针对植物培养的时间进行优化。在保持渗透压和酶解时间不变的条件下, 选择不同培养时间的黄化苗进行原生质体的提取。如图1所示, 培养1周左右的黄化苗得到的数量较少, 且细胞也偏小, 不利于亚细胞定位的观察;而培养2~3周的黄化苗能得到数量很多的原生质体, 并且2周左右的苗子能得到最多数量原生质体, 适用于亚细胞定位实验观察。而超过3周后的柳枝稷黄化幼苗, 提取原生质体的量开始减少。
2.1.2渗透压优化 植物细胞在缺少细胞壁的保护之后, 对外界的渗透压会非常敏感。因此, 渗透压的优化是原生质体提取的一个重要环节。选择2周大的黄化苗在保持酶解时间不变的条件下, 选择不同渗透压条件进行原生质体的提取。如图2所示, 当甘露醇浓度为0.4 mol/L时, 得到非常少量的原生质体, 随着浓度上升, 原生质体提取量迅速增大, 在甘露醇浓度为0.6 mol/L时原生质体提取量达到了最大值。之后随着甘露醇浓度的增大, 原生质体的量又迅速的减少。
2.1.3酶解时间优化 在黄化苗苗龄及渗透压一致的条件下, 酶解时间能明显影响原生质体的产量。如图3所示, 酶解7和8 h都能获得大量的原生质体, 并且8 h获得的原生质体数最多。在酶解6~8 h之间, 原生质体数量随着酶解时间增大而显著增加, 当大于酶解8 h时, 原生质体数量则随着酶解时间的增大而减小, 而且发现游离的细胞碎片明显增多。

图2 不同渗透压下提取柳枝稷原生质体Fig.2 The preparation of switchgrass protoplasts under different osmotic pressure
2周的黄化苗, 酶解时间8 h。 Etiolated seedlings of two weeks, enzymolysis time: 8 h.

图3 不同酶解时间下提取原生质体Fig.3 The preparation of switchgrass protoplasts in different enzymolysis time
甘露醇0.6 mol/L, 2周的黄化苗。The concentration of mannitol: 0.6 mol/L, etiolated seedlings of two weeks.
综合分析影响柳枝稷叶肉原生质体制备的主要因素, 柳枝稷叶肉原生体质体系得以优化。选取2周大的柳枝稷黄化幼苗为实验材料, 酶解液中甘露醇浓度为0.6 mol/L, 酶解8 h。流程如下:对Alamo柳枝稷种子进行灭菌处理, 维持在(28±2) ℃, 黑暗条件下培养2周, 取柳枝稷黄化幼苗的叶片切割成1 mm宽的细条, 将切好的苗条与酶解液充分接触(图4a),对得到的原生质体进行沉淀纯化, 消除分离过程中的破裂细胞和未酶解的碎片, 获得原生质体(图4b)。基于上述流程所得到的原生质体大, 碎片少, 量多, 活性强(图4c), 满足进一步的遗传转化实验条件。

图4 柳枝稷原生质体的分离Fig.4 Separation of switchgrass protoplasts a:样品的酶解反应The enzymatic hydrolysis of the sample;b:原生质体的沉淀纯化Purification of protoplasts;c:柳枝稷原生质体Protoplasts.
2.2亚细胞定位载体构建
从水稻基因组数据库中(http://rice.plantbiology.msu.edu)下载OsMYB103(ID:Os08g05520)的基因序列。根据序列信息LN载体的引物LN-EcoRI-103: AGCTCAAGCTTCGAATTCATGGGGCATCACTCTTGCTGC; LN-BamHI-103: AGCGGCAGCAGCCGGATCCTTAATCATGGTCATTTGGTCCCATA, 用高保真酶进行扩增, 其长度约为1000 bp。将扩增片段连上载体pEASY-T5(CT501, 全式金), 通过热激导入到菌株为BH5a的感受态大肠杆菌中(CD-201, 全式金), 之后挑菌测序。将携带正确质粒的大肠杆菌扩繁, 提取pEASY-103质粒, 用NEB公司的酶切体系, 分别对pEASY-103和LN载体进行双酶切。结果如图5a, pEASY-103酶切后有个1000 bp的片段, 这是目标基因OsMYB103, LN载体酶切后为10 kb以上的片段(图5b), 分别将这两段切胶回收, 再利用NEB公司的连接酶进行反应, 得到LN-103(LN-OsMYB103),之后导入感受态大肠杆菌, 挑选阳性克隆测序。经酶切与测序检测, 质粒LN-103完全正确(图5c)。

图5 载体PCR扩增Fig.5 PCR amplification of pEZR MYB指的是含有MYB结构域的转录因子;LN指的是双元表达载体; marker为DL2000的marker;a:从植物cDNA中扩增得到的OsMYB103基因, 大小为1 kb左右;b:载体LN的双酶切胶图;c:LN-103(LN-OsMYB103)的双酶切图, 载体大小完全正确。MYB refers to the transcription factor; LN refers to the binary expression pEZR; marker:DL2000 marker; a:The OsMYB103 gene, which is about 1 kb in size, was amplified from cDNA;b: The double enzyme map of pEZR-LN;c:The double enzyme map of LN-103 and the pEZR size is correct.
2.3亚细胞定位分析
将制备好的柳枝稷原生质体分别和LN-103(LN-OsMYB103), LN空载体共培养12 h, 在共聚焦显微镜下进行检测。如图6所示, 在激发光为488 nm条件下LN-103和LN空载体都检测到了绿色荧光;在激发光为580 nm下, 原生质体检测到了红色荧光。携带OsMYB103基因的质粒始终定位于细胞核上, 这与Yang等[27]的实验结果一致。同时空载体LN的荧光蛋白在细胞、细胞核及细胞膜上。上述结果表明,LN载体适用于柳枝稷的亚细胞定位实验, 并且可用于转录因子等相关基因的分析。
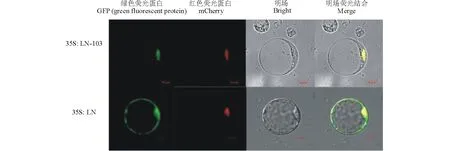
图6 携带OsMYB103基因的LN-103载体和LN空载体的亚细胞定位图(10 μm)Fig.6 Subcellular localization of pEZRLN-103 and empty pEZR-LN carrying OsMYB103 gene (10 μm)
3 讨论
植物原生质体是研究基因功能的强有力工具, 在植物功能基因研究中扮演非常重要的角色[28]。20世纪中期原生质体的分离得到了初步的研究, 目前已经有很多的物种进行了原生质体体系的建立, 然而在柳枝稷中却鲜有报道[23-25]。虽然水稻和柳枝稷是近缘物种, 都隶属于禾本科植物, 但种间差异会影响基因的功能研究, 因此建立一个柳枝稷原生质体的亚细胞定位体系是很重要的。
植物的各个器官如根、茎、叶、种子及愈伤组织等都能分离出原生质体[29]。愈伤组织容易获得大量原生质体, 但需要长时间的材料准备, 且不利于叶绿体相关的基因研究。借鉴中国科学院遗传与发育生物学研究所朱立煌课题组的水稻原生质体分离办法发现, 分离禾本科植物的黄化幼苗(包括茎, 叶)能满足各类基因功能的研究工作。因此, 本课题组决定用两周龄柳枝稷黄化幼苗的茎和叶作为实验材料。
由于原生质体是去壁的细胞, 对外面环境的刺激非常敏感, 分离有效原生质体会被很多因素影响, 获得高质量的原生质体, 需要优化渗透压、 酶解时间等几个关键因素[30]。最直接重要的就是外界环境的渗透压, 只有维持在一定渗透压内才能保证原生质体的产量及活力。在本实验中, 发现甘露醇在0.6 mol/L能使外界环境的渗透压达到最佳状态, 浓度过大或过小都会影响原生质体的产量及质量, 低于0.6 mol/L原生质体会因部分失水变瘪, 过高导致细胞过分吸水而破裂, 直接影响原生质体产量。
原生质体提取是植物细胞去壁的过程, 因此细胞壁的酶解时间和细胞的幼嫩程度都会极大影响原生质体的提取。酶解时间过短, 细胞壁水解的不充分, 原生质体难以分离;而酶解时间过长, 会影响原生质体的存活, 使得无法得到有效的原生质体[31]。本实验的结果表明, 酶解8 h是最佳的时间, 产量能达到9×105个/g, 并且酶解时间在7~8 h间都能获得大量原生质体以满足实验需求。植物细胞的幼嫩程度则决定了细胞壁是否易于分解, 苗龄在两周大的黄化苗能获得最多的原生质体。小于两周, 细胞壁过嫩较易水解;大于两周, 细胞壁过老而不利于水解。
在确立了柳枝稷原生质体分离体系之后, 本课题组用已报道过的基因进行了验证, 该基因是MYB家族的基因, 定位于细胞核上。实验结果表明, 分离出的原生质体适用于基因的亚细胞定位。
4 结论
本研究结果显示, 2周左右的苗子能得到最多数量原生质体, 原生质体提取量均超过8.43×105个/g, 并适用于亚细胞定位的实验观察;其他条件相同, 在甘露醇浓度为0.6 mol/L时原生质体提取量达到了最大值, 原生质体提取量均超过7.98×105个/g;其他条件相同, 酶解8 h获得的原生质体数最多, 原生质体提取量均超过8.61×105个/g;经酶切与测序检测, 质粒LN-103完全正确;将制备好的柳枝稷原生质体和LN-103载体共培养12 h, 在共聚焦显微镜下进行检测发现:LN载体适用于柳枝稷的亚细胞定位实验, 并且可用于转录因子等相关基因的分析, 通过本研究可为柳枝稷遗传改良及功能基因研究奠定一定的基础。
References:
[1] Zhou D D, Yu J N. The progress of establishing transient expression system in plant cell. Chinese Agricultural Science Bulletin, 2013, (24): 151-156. 周丹丹, 俞嘉宁. 植物细胞中瞬时表达系统的建立及研究进展. 中国农学通报, 2013, (24): 151-156.
[2] Liu X, Wei X N, Zhang X W,etal. Establishment of a highly-efficient transformation system of wheat protoplasts. Journal of Plant Genetic Resources, 2017, (1): 117-124. 刘鑫, 魏学宁, 张学文, 等. 小麦原生质体高效转化体系的建立. 植物遗传资源学报, 2017, (1): 117-124.
[3] Gao Y, An Y, Wang Z F,etal.Studies on the mixed growth characteristics and competitive effects ofPanicumvirgatumand alfalfa. Northern Horticulture, 2016, (3): 61-65. 高阳, 安雨, 王志锋, 等. 柳枝稷与苜蓿混作生长特征及竞争作用研究. 北方园艺, 2016, (3): 61-65.
[4] Xu K J, Yan M X, Chai G Q,etal. Effects ofAgrobacteriumtumefaciensconcentration on seed germination and growth of seedling. Acta Prataculturae Sinica, 2012, (1): 206-212. 徐开杰, 燕明献, 柴乖强, 等. 农杆菌不同菌液浓度对柳枝稷种子萌发及幼苗生长发育的影响. 草业学报, 2012, (1): 206-212.
[5] Lewandowski I, Scurlock J M O, Lindvall E,etal. The development and current status of perennial rhizomatous grasses as energy crops in the US and Europe. Biomass and Bioenergy, 2003, 25(4): 335-361.
[6] Liu Y R, Cen H F, Yan J P,etal. Optimizing ofAgrobacterium-mediated transformation of switchgrass cultivars. Scientia Agricultura Sinica, 2016, (1): 80-89. 刘燕蓉, 岑慧芳, 严建萍, 等. 农杆菌介导的柳枝稷遗传转化体系的优化. 中国农业科学, 2016, (1): 80-89.
[7] Srivastava A C, Palanichelvam K, Ma J,etal. Collection and analysis of expressed sequence tags derived from laser capture microdissected switchgrass (PanicumvirgatumL. Alamo) vascular tissues. Bio Energy Research, 2010, 3(3): 278-294.
[8] Liu J L, Zhu W B, Xie G H,etal. Research progress of switchgrass of energy crops. Acta Prataculturae Sinica, 2009, 18(3): 232-240. 刘吉利, 朱万斌, 谢光辉, 等. 能源作物柳枝稷研究进展. 草业学报, 2009, 18(3): 232-240.
[9] Huang Q. Ecological construction and ecological modernization in China. Acta Prataculturae Sinica, 2008, 17(2): 1-8. 黄黔. 我国的生态建设与生态现代化. 草业学报, 2008, 17(2): 1-8.
[10] Lv Y, Wang P R, Sun Y Y,etal. Application ofAgrobacterium-mediatetrans formation in rice genetic engineering. Molecular Plant Breeding, 2005, (4): 543-549. 吕彦, 王平荣, 孙业盈, 等. 农杆菌介导遗传转化在水稻基因工程育种中的应用. 分子植物育种, 2005, (4): 543-549.
[11] Huang C Q, Liu G D, Bai C J. Application advances of genetic engineering in pasture breeding. Acta Agrestia Sinica, 2013, (3): 413-419. 黄春琼, 刘国道, 白昌军. 基因工程在牧草育种中的应用进展. 草地学报, 2013, (3): 413-419.
[12] Ananthakrishnan G, Orboviĉ V, Pasquali G,etal. Transfer of citrus tristeza virus (CTV)-derived resistance candidate sequences to four grapefruit cultivars throughAgrobacterium-mediated genetic transformation. In Vitro Cellular & Developmental Biology-Plant, 2007, 8(6): 61-68.
[13] Schinkel H, Jacobs P, Schillberg S,etal. Infrared picosecond laser for perforation of single plant cells. Biotechnology and Bioengineering, 2008, 99(1): 244-248.
[14] Sabovljevic A, Sabovljevic M, Rakic T,etal. Establishment of procedures forinvitromaintenance, plant regeneration and protoplast transfection of the resurrection plant ramondaserbica. Belgian Journal of Botany, 2008, 141(2): 178-184.
[15] Matsuoka H, Komazaki T, Mukai Y,etal. High throughput easy microinjection with a single-cell manipulation supporting robot. Journal of Biotechnology, 2005, 116(2): 185-194.
[16] Romano A, Raemakers K, Bernardi J,etal. Transgene organisation in potato after particle bombardment-mediated (co-)transformation using plasmids and gene cassettes. Transgenic Research, 2003, 12(4): 461-473.
[17] Lazzeri P A, Brettschneider R, Lührs R,etal. Stable transformation of barley via PEG-induced direct DNA uptake into protoplasts. Theoretical and Applied Genetics, 1991, 81(4): 437-444.
[18] Zhang Q. Establishment of Citrus Protoplast Transient Expression System and Creation of GFP Transgenic Murcotttang Orgermplasm[D]. Wuhan: Huazhong Agricultural University, 2009. 张倩. 柑橘原生质体瞬时表达体系的建立及默科特橘橙转GFP种质的创造[D]. 武汉: 华中农业大学, 2009.
[19] Yoo S D, Cho Y H, Sheen J.Arabidopsismesophyll protoplasts: a versatile cell system for transient gene expression analysis. Nature Protocols, 2007, 2(7): 1565-1572.
[20] Sheen J. Signal transduction in maize andArabidopsismesophyll protoplasts. Plant Physiology, 2001, 127(4): 1466-1475.
[21] Liu Y R, Cen H F, Yan J P,etal. Inside out: high-efficiency plant regeneration andAgrobacterium-mediated transformation of upland and lowland switchgrass cultivars. Plant Cell Reports, 2015, 34(7): 1099-1108.
[22] Mazarei M, Alahmad H, Rudis M R,etal. Protoplast isolation and transient gene expression in switchgrass,PanicumvirgatumL. Biotechnology Journal, 2008, 3(3): 354-359.
[23] Xi Y, Ge Y, Wang Z Y. Genetic transformation of switchgrass. Methods in Molecular Biology, 2009, 581: 53-59.
[24] Frame B R, Shou H, Chikwamba R K,etal.Agrobacteriumtumefaciens-mediated transformation of maize embryos using a standard binary vector system. Plant Physiology, 2002, 129(1): 13-22.
[25] Li R Y, Qu R D. High throughputAgrobacterium-mediated switchgrass transformation. Biomass and Bioenergy, 2011, 35(3): 1046-1054.
[26] Bart R, Chern M, Park C J,etal. A novel system for gene silencing using siRNAs in rice leaf and stem-derived protoplasts. Plant Methods, 2006, 2(1): 1-9.
[27] Yang C H, Li D Y, Liu X,etal.OsMYB103L, an R2R3-MYB transcription factor, influences leaf rolling and mechanical strength in rice (Oryzasativa). BMC Plant Biology, 2014, 14(1): 158.
[28] Wang H Z, Chen Y P, Chen P D. Plant transient expression system in functional genomics. Chinese Journal of Biotechnology, 2007, (3): 367-374. 王华忠, 陈雅平, 陈佩度. 植物瞬间表达系统与功能基因组学研究. 生物工程学报, 2007, (3): 367-374.
[29] Hao Y F, Wang L Q, Liu Y,etal. Research progress of protoplast culture in cereal crops. Chinese Agricultural Science Bulletin, 2016, 32(35): 19-23. 郝艳芳, 王良群, 刘勇, 等. 禾谷类作物原生质体培养研究进展. 中国农学通报, 2016, 32(35): 19-23.
[30] Bai S S, Yin M J, Zhang L,etal. Isolation and purification of callus-derived protoplasts ofPopulousalbavar.pyramidalis. Letters in Biotechnology, 2011, (1): 49-52. 白姗姗, 尹敏娟, 张磊, 等. 新疆杨愈伤组织原生质体的游离与纯化. 生物技术通讯, 2011, (1): 49-52.
[31] Qi Y C, Zou Y, Xu D F,etal. Preparation of protoplast of leaf and petal ofNicotianatabacumL. cv. Samsun NN. Journal of Anhui Agricultural Sciences, 2016, (14): 11-14, 100. 齐耀程, 邹禹, 许大凤, 等. 三生烟叶片与烟花的原生质体制备研究. 安徽农业科学, 2016, (14): 11-14, 100.
Establishmentofagenetransientexpressionsystemmediatedbypolyethyleneglycolinswitchgrass(Panicumvirgatum)mesophyllprotoplasts
QI Ze-Wen1, SUN Xin-Bo2, FAN Bo3, ZHANG Xue1, YUAN Jian-Bo1, HAN Lie-Bao1*
1.TurfgrassResearchInstitute,BeijingForestryUniversity,Beijing100083,China; 2.KeyLaboratoryofCropGrowthRegulationofHebeiProvince,HebeiAgriculturalUniversity,Baoding071001,China; 3.ShenzhenHorticulturalGardenConstructionCompany,Shenzhen518038,China
Leaves of Alamo switchgrass (Panicumvirgatum) were used as materials to establish a transient expression system for mesophyll protoplasts cells. To determine the optimal conditions to obtain protoplasts from switchgrass, we designed a gradient experiment, with three replicates per treatment. First, we determined the optimal age of plants as the source of material. The leaves of etiolated seedlings grown for 1, 2, 3, and 4 weeks were subjected to enzymolysis for 8 h in a solution containing D-mannitol at 0.6 mol/L. Next, we determined the optimal osmotic pressure by exposing leaf material from 2-week-old etiolated seedlings to solutions containing D-mannitol at 0.4 mol/L, 0.5 mol/L, 0.6 mol/L, 0.7 mol/L and 0.8 mol/L. The optimal duration of enzymolysis was determined by subjecting leaf material from 2-week-old etiolated seedlings to enzymolysis for 6, 7, 8, 9, and 10 h in a solution containing 0.6 mol/L D-mannitol. This series of assays showed that the optimal conditions to isolate protoplasts were as follows: 2-week-old etiolated seedlings as the source material, and enzymatic hydrolysis in a solution containing 0.6 mol/L D-mannitol in the dark for 8 h at 28 ℃. The protoplasts obtained using this method were transformed with the plasmid LN-OsMYB103 by a polyethylene glycol-mediated method, and strong green fluorescence was detected by laser confocal microscopy. These results indicated that the protoplasts retained normal biological functions. In summary, we established an integrated transient expression system for protoplasts obtained from switchgrass leaves. This method will be very useful for functional genomics research on switchgrass.
switchgrass (Panicumvirgatum); PEG; protoplast; transient expression
10.11686/cyxb2017029
http://cyxb.lzu.edu.cn
祁泽文, 孙鑫博, 樊波, 张雪, 袁建波, 韩烈保. PEG介导的柳枝稷叶肉细胞原生质体瞬时表达体系的建立. 草业学报, 2017, 26(9): 113-120.
2017-01-18;改回日期:2017-03-29
深圳市科技计划项目(JSGG20160229155434792和JCYJ20160331151245672)资助。
祁泽文(1992-),男,江苏连云港人,硕士。E-mail: qizewen0404@163.com*通信作者Corresponding author. E-mail: hanliebao@163.com
QI Ze-Wen, SUN Xin-Bo, FAN Bo, ZHANG Xue, YUAN Jian-Bo, HAN Lie-Bao. Establishment of a gene transient expression system mediated by polyethylene glycol in switchgrass (Panicumvirgatum) mesophyll protoplasts. Acta Prataculturae Sinica, 2017, 26(9): 113-120.
——现代牙刷的由来

