不同收获期贯叶连翘花中抗氧化能力、主要活性物质变化及挥发性组分分离鉴定
葛莉, 姚园园, 康天兰, 李京耀, 何恒军, 杨德龙, 栗孟飞*
(1.甘肃省干旱生境作物学重点实验室,甘肃农业大学生命科学技术学院,甘肃 兰州730070;2.甘肃省经济作物技术推广站,甘肃 兰州730030;3.甘肃省康县中药材技术指导站,甘肃 陇南746500;4.甘肃省康县恒茂源中药材专业合作社,甘肃 陇南746500)
不同收获期贯叶连翘花中抗氧化能力、主要活性物质变化及挥发性组分分离鉴定
葛莉1, 姚园园1, 康天兰2, 李京耀3, 何恒军4, 杨德龙1, 栗孟飞1*
(1.甘肃省干旱生境作物学重点实验室,甘肃农业大学生命科学技术学院,甘肃 兰州730070;2.甘肃省经济作物技术推广站,甘肃 兰州730030;3.甘肃省康县中药材技术指导站,甘肃 陇南746500;4.甘肃省康县恒茂源中药材专业合作社,甘肃 陇南746500)
为了探明不同收获期(花蕾期、盛花期、结果期)贯叶连翘花中抗氧化能力、总黄酮、酚类和金丝桃素含量等的变化,以栽培花器官为实验材料,采用HPLC和GC-MS等方法对70%乙醇提取液进行测定与分析。结果表明,花蕾期和盛花期贯叶连翘花提取液自由基抑制率(inhibition percentage, I%)和铁离子还原/氧化能力(ferric reducing/antioxidant power, FRAP)均显著高于结果期,花蕾期和盛花期二者之间无显著差异;总黄酮和酚类化合物以及金丝桃素含量均呈现为盛花期>花蕾期>结果期,且在P<0.05水平下达到显著差异;盛花期花中分离鉴定得到37种挥发性化学组分,其中,主要成分有1,1-二乙氧基-乙烷(19.26%)、1-十六醇(17.85%)、β-衣兰烯(10.71%)、(Z, Z)-9,12-十八碳二烯酰氯(8.42%)、十六烷酸乙酯(8.40%)、叶绿醇(5.79%)、石竹烯氧化物(4.56%)等。以上研究结果表明,花蕾期至盛花期采集贯叶连翘花器官较佳,提取液抗氧化能力较强,主要活性物质含量较高,挥发性成分较为丰富,该研究结果将对贯叶连翘生产、大面积种植栽培具有重要的参考价值和实践意义。
贯叶连翘;收获时期;抗氧化能力;总黄酮和酚类;金丝桃素;挥发性组分;GC-MS分离鉴定
贯叶连翘(Hypericumperforatum),又名贯叶金丝桃,西方称为圣·约翰草(St. John’s Wort),是藤黄科(Guttiferae) [亦作为金丝桃科(Hypericaceae)]多年生草本植物,主要分布于我国甘肃、陕西、新疆、四川等地,成熟全草具有悠久的药用历史[1-2]。传统中医认为,贯叶连翘具有抗菌消炎、收敛止血、调经活血、消肿止痛之功效,主要集中于镇静、抗炎、伤口愈合等方面[3]。现代药理学研究表明,贯叶连翘具有抗抑郁、抗癌、抗病毒、抗氧化、镇痛等作用[4-6]。由于贯叶连翘独特的药理学作用,目前已成为全球研究开发的热点草药之一[3,7]。
研究表明,贯叶连翘含有多种具生物活性的化学成分,其中主要有苯并二蒽酮类化合物,如金丝桃素、伪金丝桃素、异金丝桃素等,黄酮类化合物,如芦丁、槲皮素、金丝桃苷等,间苯三酚类化合物,如贯叶金丝桃素和加贯叶金丝桃素,以及挥发油和氨基酸类化合物等[8-9]。很多研究发现,贯叶连翘中金丝桃素及其他活性物质的含量存在组织器官、生长季节和原料产地的差异。比如,钱秋霞等[8]报道称,贯叶连翘中金丝桃素在花和种子中的含量明显高于茎和叶;温普红等[10]研究发现,贯叶连翘各部位中金丝桃素含量分布为:花>全草上>叶>全草>果>全草下>茎>根,且结果前期采集植株分枝以上部位品质最佳;前期研究也发现,贯叶连翘中金丝桃素的含量显著表现为花>叶>茎,总黄酮和酚类化合物含量在花和叶中的含量显著大于茎[2]。在挥发性成分组成方面,曾虹燕等[11]通过对长沙栽培的贯叶连翘叶进行气相色谱-质谱(gas chromatography-mass spectrometer, GC-MS)分析,54种挥发性组分得到分离鉴定,且多为倍半萜类物质;孙建勋等[12]对贵州省贯叶连翘叶进行分离鉴定,41种挥发性组分得到分离,其中,主要成分有γ-衣兰油烯、α-姜黄烯、δ-荜澄茄烯、β-反-金合欢烯等;孟祥颖等[13]通过对甘肃省通渭县贯叶连翘花进行分析,得到41种挥发性组分。王小芳等[14]从甘肃省天水市小陇山贯叶连翘全草分离鉴定出75个挥发性组分。
到目前为止,金丝桃素主要从野生贯叶连翘植株中提取分离,随着市场对金丝桃素需求的逐渐增加,使得野生贯叶连翘资源被过度采挖[6-7],因此,野生转栽培以及大规模种植研究势在必行。对于栽培贯叶连翘在不同收取时期抗氧化能力、主要活性物质含量以及挥发性组分的变化,目前研究报道较少。实验在前期野生贯叶连翘驯化栽培研究的基础上[2],采用高效液相色谱(high performance liquid chromatography, HPLC)和GC-MS等方法对不同收获期(花蕾期、盛花期、结果期)贯叶连翘花中抗氧化能力、总黄酮、酚类和金丝桃素含量以及挥发性成分进行分析,旨在为贯叶连翘生产、大面积种植栽培提供主要理论依据和参考。
1 材料与方法
1.1实验材料
以3年野生驯化栽培的贯叶连翘花器官为实验材料,采自甘肃省康县岸门口镇中节村(甘肃省中药材野生贯叶连翘引种驯化示范区),于贯叶连翘花蕾期(2016年5月29日)、盛花期(2016年6月8日)、结果期(2016年6月19日)采集实验材料,阴干后在甘肃农业大学干旱生境作物学重点实验室进行测定与分析。
1.2实验方法
1.2.1提取液的制备 取阴干的材料,研碎后过0.177 mm筛,准确称取0.50 g粉末,分别置于含20 mL 70%乙醇具塞三角瓶中,室温、黑暗、120 r/min旋转振荡提取4 d;然后在4℃、5000 r/min条件下离心10 min,取上清液,用70%乙醇定容至25 mL,提取液25 mL置于4 ℃冰箱中保存,用于抗氧化能力、总黄酮、总酚类、金丝桃素含量以及挥发性组分测定与分析。
1.2.2抗氧化能力的测定 为了更准确、全面地反映提取液的总抗氧化能力,分别采用较为广泛应用的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl, DPPH)和铁离子还原/氧化能力(ferric reducing/antioxidant power, FRAP)两种测定方法。
DPPH法参考Nencini等[15]的方法测定。具体步骤为:吸取1.2.1中提取液20 μL,加到提前制备好的7.0 mL×10-4mol/L DPPH 甲醇溶液中,室温黑暗振荡反应30 min,取出在 515 nm 下测定反应液的吸光值A(以不加样品溶液为参比对照,吸光值A0;以70%乙醇为空白对照),每个实验重复3次。计算公式为:
抑制率(inhibition percentage, I%)=[(A0-A)/A0]×100
式中:A为样品溶液的吸光值;A0为不加样品溶液的吸光值。
FRAP法参考Benzie等[16]的方法测定。具体步骤为:吸取1.2.1中提取液20 μL加到提前制备好的3.0 mL FRAP 溶液中(要求现配现用),溶液配制方法为:取10倍体积的乙酸盐缓冲液,pH 3.6;1倍体积 10 mmol/L 2,4,6-三(2-吡啶基)三嗪[2,4,6-tris (2-pyridyl)-s-triazine, TPTZ]的40 mmol/L HCl溶解液,1倍体积的20 mmol/L FeCl3·6H2O,三者混合均匀。水浴锅中37 ℃ 反应4 min后,取出在 593 nm 下测定反应液的吸光值A(以不加样品溶液为参比对照,吸光值A0;以70%乙醇为空白对照)。每个实验重复3次,样品溶液的抗氧化能力以 500 μmol/L Fe2+(FeSO4·7H2O) 为参比基础。计算公式为:
FRAP 值 (μmol/L)=[(A-A0)/(AFeSO4·7H2O-A0)]×500 (μmol/L)
式中:A为样品溶液的吸光值;AFeSO4·7H2O为FeSO4·7H2O溶液的吸光值;A0为不加样品溶液的吸光值。
1.2.3总黄酮含量的测定 采用亚硝酸钠—硝酸铝—氢氧化钠法测定总黄酮化合物的含量,参考Ma等[17]的测定方法。具体步骤为:吸取1.2.1中提取液200 μL置于试管中,依次加入2.0 mL ddH2O和0.3 mL 5% NaNO2,混合振荡5 min后,加入0.3 mL 10%AlCl3,混合振荡1 min后,加入2.0 mL 1 mol/L NaOH,充分混合后,在 510 nm下测定反应液的吸光值A,以不加样品溶液的为空白对照。每个实验重复3次,总黄酮化合物的含量以儿茶素(catechin,CE)为标准品标定。计算公式为:
总黄酮含量(mg/g DW)=(C×V2)/(V1×M×1000)
标准曲线方程C(CE μg)= 200A-5.80 (R2=0.996)
式中:C为总黄酮的量(μg);V1为测定样品溶液的体积(mL);V2为提取液的体积(mL);A为样品溶液的吸光值;M为材料的干物质重量(g)。
1.2.4总酚类含量的测定 采用福林酚(Folin-Ciocalteu)试剂法测定总酚类化合物的含量,参考Beato等[18]的测定方法。具体步骤为:吸取1.2.1中提取液20 μL置于试管中,依次加入2.0 mL 10% Folin-Ciocalteu和1.0 mL 7.5% Na2CO3,混合振荡5 min后,置于水浴锅中37 ℃ 下避光反应1 h,取出在760 nm下测定反应液的吸光值A,以不加样品溶液的为空白对照。每个实验重复3次,总酚类化合物的含量以没食子酸(gallic acid, GAE)为标准品标定。计算公式为:
总酚类含量(mg/g DW)=(C×V2)/(V1×M×1000)
标准曲线方程C(GAE μg)=34.48A+0.72 (R2=0.994)
式中:C为总酚类的量(μg);V1为测定样品溶液的体积(mL);V2为提取液的体积(mL);A为样品溶液的吸光值;M为材料的干物质重量(g)。
1.2.5金丝桃素含量的测定 采用HPLC法测定材料中金丝桃素的含量,参考吴畏等[19]的方法测定。具体步骤为:将1.2.1中提取液用0.22 μm有机滤膜过滤,色谱柱为C18(150 mm×4.6 mm, 5 μm),流动相为甲醇∶水(85∶15,氨水调pH 9.5),流速1.0 mL/min,柱温35 ℃,检测波长588 nm,进样量5 μL,每个实验重复3次。以金丝桃素(sigma,纯度>95%,HPLC,货号56690)为对照品。首先,用90%甲醇配制10.0 μg/mL的金丝桃素溶液;然后,采用梯度浓度稀释法分别获得5.0,2.0,1.0,0.5,0.25 μg/mL的低浓度溶液;以峰面积(Y)对检测浓度(C, μg/mL)进行回归计算,得到标准品金丝桃素的标准方程分别为Y=48246C+1071 (R2=0.994),说明金丝桃素在0.25~10.0 μg/mL范围内与峰面积积分值呈线性关系。样品中金丝桃素的含量计算公式为:
金丝桃素含量(mg/g DW)=(C×V)/(M×1000)
式中:C为金丝桃素的浓度(μg/mL);V为提取液的体积(mL);M为材料的干物质重量(g)。
1.2.6GC-MS分离鉴定 吸取1.2.1中提取液10.0 mL,在70 ℃条件下减压蒸发浓缩至小体积,浓缩液用无水乙醇溶解并定容至2.0 mL,用于GC-MS分离与鉴定。气相色谱条件为:PE-8700气相色谱仪(美国PE 公司),带火焰离子化检测器(FID),石英毛细管柱:30 m×0.32 cm×0.25 mm,载气为N2,柱流量为1.0 mL/min,柱前压为115 kPa,分流比为100∶1;进样量为1 μL,可编程序升温进样器(PTV):初始温度50 ℃, 10 s内升至280 ℃;FID温度为300 ℃;程序升温为80 ℃(2 min),每5 ℃/min升温至280 ℃(10 min)。质谱条件为:离子源,EI;源温,200 ℃;电离电压,70 eV;收集电流:300 μA;发射电流,1 mA;仪器分离率,600;质量范围,50~500。
1.3统计与分析
每个实验重复3次,采用Microsoft Office Excel 2007软件作图,SPSS 11.5软件进行One-Way ANOVA Duncan数据差异显著性分析。
2 结果与分析
2.1不同收获期贯叶连翘花提取液的抗氧化能力
图1为不同收获期贯叶连翘花提取液的抗氧化能力。结果显示,在利用DPPH和FRAP两种方法测定的结果中,花提取液的抑制率(图1A)和FRAP值(图1B)均表现为盛花期>花蕾期>结果期,其中,花蕾期和盛花期均显著高于结果期,但花蕾期和盛花期之间在P<0.05水平下未达到显著差异。

图1 不同收获期贯叶连翘花提取液的抑制率(A)和FRAP值(B)Fig.1 Inhibition percentage (A) and FRAP value (B) of extracts from flower of H. perforatum at different harvest stages 不同小写字母表示在P<0.05水平下达到显著性差异。下同。Different lowercase letters indicate significant differences at P<0.05 level. The same below.
2.2不同收获期贯叶连翘花中总黄酮和酚类物质含量的变化
图2为不同收获期贯叶连翘花中总黄酮(图2A)和酚类(图2B)化合物的含量。结果显示,在3个不同收获时期,盛花期花中总黄酮和酚类化合物的含量分别达到56.68和97.03 mg/g DW,均呈现为盛花期>花蕾期>结果期,且均在P<0.05水平下达到显著差异。

图2 不同收获期贯叶连翘花中总黄酮(A)和酚类(B)化合物的含量Fig.2 Content of total flavonoids (A) and phenolics (B) in flower of H. perforatum at different harvest stages
2.3不同收获期贯叶连翘花中金丝桃素含量的变化
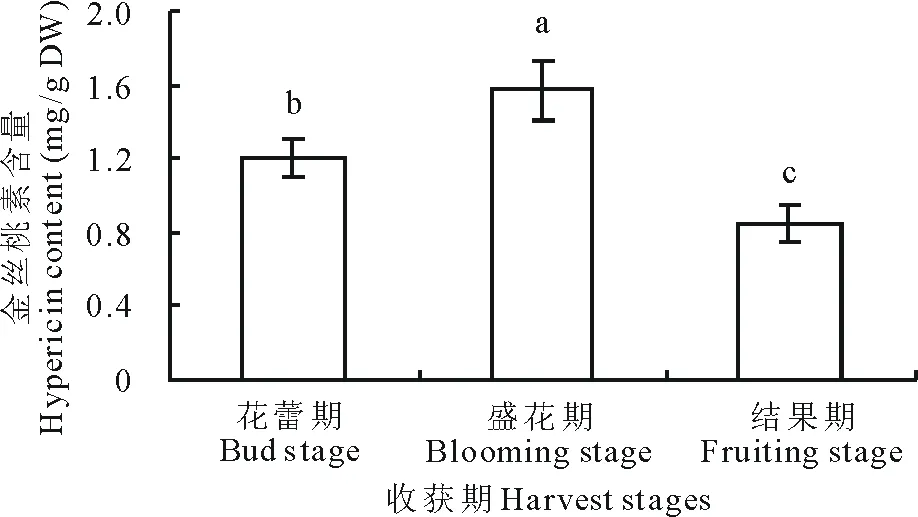
图3 不同收获期贯叶连翘花中金丝桃素的含量Fig.3 Hypericin content in flower of H. perforatum at different harvest stages
图3为不同收获期贯叶连翘花中金丝桃素的含量。结果显示,在花蕾期、盛花期和结果期3个不同收获时期,花中金丝桃素的含量分别为1.20,1.57和0.85 mg/g DW,呈现为盛花期>花蕾期>结果期,且在P<0.05水平下达到显著差异。
2.4盛花期贯叶连翘花提取液的GC-MS分离与鉴定
为了进一步了解贯叶连翘盛花期花器官中提取液挥发性组分特性,实验对70%乙醇提取液进行了GC-MS分离与鉴定。表1为盛花期贯叶连翘花提取液GC-MS分离与鉴定结果。由表1可知,盛花期花70%乙醇提取液共含有37种挥发性组分,其中,1,1-二乙氧基-乙烷、1-十六醇、β-衣兰烯、(Z, Z)-9,12-十八碳二烯酰氯、十六烷酸乙酯、叶绿醇和石竹烯氧化物相对含量较高,分别为19.26%,17.85%,10.71%,8.42%,8.40%,5.79%和4.56%,而2-肉豆蔻酰泛酰巯基乙胺、3-乙基-5-(2-乙基丁基)-十八烷、(Z,Z,Z)-8,11,14-二十碳三烯酸和辛糖相对含量较低,分别为0.08%,0.05%,0.03%和0.02%。
3 讨论与结论
植物的次生代谢是植物在长期进化过程中与环境(生物的和非生物的)相互作用的结果,次生代谢产物在植物提高自身保护和生存竞争能力、协调与环境关系上充当着重要的角色,其产生和变化比初生代谢产物与环境有着更强的相关性和对应性[20-21]。植物次生代谢具有不同于初生代谢的特点,不仅具有明显的种属特异性,就是同一种或一类次生代谢产物在植物体内也不是普遍存在,而是限制于一些特定的细胞、组织、器官或是特定的发育时期[21]。报道称,贯叶连翘中金丝桃素和伪金丝桃素含量与基因型和生长季节有关,狭叶地上部分金丝桃素含量明显高于宽叶基因型,7至9月(澳大利亚新南威尔士州)采集地上部分金丝桃素和伪金丝桃素含量较高[22]。本研究表明,在花蕾期、盛花期和结果期3个收获时期,盛花期贯叶连翘花70%乙醇提取液中总黄酮、酚类和金丝桃素含量分别达到56.68,95.89和1.57 mg/g DW,均显著高于其他两个时期;DPPH和FRAP两种抗氧化能力测定方法均显示,花器官在花蕾期和盛花期采集的抗氧化能力显著优于结果期。

表1 盛花期贯叶连翘花70%乙醇提取液的GC-MS分离与鉴定Table 1 Separation and identification of 70% ethanol extracts from flower of H. perforatum at blooming stages by GC-MS
Schwob等[23]通过对生长期、花蕾期、盛花期和结果期4个采集时期野生贯叶连翘地上部分进行挥发油GC-MS分析,97个化学组分得到分离鉴定,4个采集时期均含有64个化学组分,其中主要有石竹烯氧化物、β-石竹烯、斯巴醇、1-十四醇、柏木萜烯、1-十二醇、衣兰油烯;单萜类和脂肪族类化合物含量水平因采收季节而改变,但化学组分数量随着采集季节延迟而增加。Majid[24]对花蕾期、盛花期和结果期3个采集时期栽培贯叶连翘地上部分进行GC-MS分离鉴定,发现挥发油的总量在盛花期高于花蕾期和结果期,其中挥发油的化学组分主要有长叶烯、α和γ桉叶油醇、斯巴醇、牛儿烯、β-石竹烯、杜松醇、α-杜松萜烯和甜没药烯,并且这些化学组分的含量水平受到采集时期的影响。本研究通过对盛花期采集的栽培贯叶连翘花进行GC-MS分析,共有37个化学组分得到分离与鉴定,其中主要有1,1-二乙氧基-乙烷(19.26%)、1-十六醇(17.85%)、β-衣兰烯(10.71%)、(Z, Z)-9,12-十八碳二烯酰氯(8.42%)、十六烷酸乙酯(8.40%)、叶绿醇(5.79%)和石竹烯氧化物(4.56%)。对于不同研究报道贯叶连翘中挥发性组分存在种类和含量的差异,其主要受到贯叶连翘基因型和生长环境的影响[23,25-26]。很多研究表明,贯叶连翘中挥发性组分也具有显著的生物学活性,比如,抗菌、消炎和抗氧化活性等[2,27-28]。但是,对于挥发性组分中具体某一化合物的生物学活性,目前还鲜见报道。
研究显示,贯叶连翘各器官的分泌结构与植株中金丝桃素以及其他分泌物的积累密切相关,叶和花中具有分泌细胞团(黑色腺点)和分泌囊(半透明腺点)二类内部分泌结构,它们来源相同,而分化发育不同;金丝桃素存在于分泌细胞团中,挥发油存在于分泌囊内,并且分泌细胞团的大小和密度与金丝桃素的含量呈正比[29-30]。有报道称,分泌细胞团和分泌囊是贯叶连翘对外界伤害的一种保护机制,可以避免病虫害和食草动物的啃食[31-32]。将山林及沟边的野生贯叶连翘栽培到光照充足的向阳区域,植株呈现为较强的光合特性[2],而金丝桃素有可能是通过光合作用、脂肪酸代谢路径等在细胞质中进行初生代谢物(如乙酸、丙二酸等)的积累,进而通过一系列复杂的物质转运过程和酶促反应来合成金丝桃素[33]。另外,黄酮类和酚类化合物在植物防御食草昆虫和真菌侵袭中也起到重要作用,其还参与调节植物生长发育等各种生理活性[20],将光照不足的野生贯叶连翘栽培到光照充足的向阳区域,在盛花期黄酮和酚类化合物积累量显著增加,可能是植株适应强光的一种机制。综合以上研究表明,不同收获时期会对贯叶连翘花中总黄酮、酚类和金丝桃素含量、抗氧化能力以及挥发性组分产生显著影响,花蕾期至盛花期采集花器官品质较佳。该研究结果将对贯叶连翘生产、大面积种植栽培具有重要的参考价值和实践意义。
References:
[1] Dewick P M, Lou H X. Medicinal Natural Products: A Biosynthetic Approach[M]. Beijing: Chemical Industry Press, 2008: 56-57. 保罗·M. 戴维克, 娄红祥. 药用天然产物的生物合成[M]. 北京: 化学工业出版社, 2008: 56-57.
[2] Kang X, Ge L, Li M F,etal. Changes in physiological and biochemical characteristics, bioactive compounds and antioxidant capacity ofHypericumperforatumduring introduction and acclimatization. Acta Prataculturae Sinica, 2016, 25(4): 104-110. 康霞, 葛莉, 栗孟飞, 等. 贯叶连翘引种驯化过程中生理生化特性、活性物质含量及抗氧化能力的变化. 草业学报, 2016, 25(4): 104-110.
[3] Xu H. Study on chemical compositions and pharmacological effect ofHypericumperforatumL. Journal of Anhui Agricultural Sciences, 2007, 35(14): 4219-4221. 徐皓. 贯叶连翘的化学成分及药理作用研究. 安徽农业科学, 2007, 35(14): 4219-4221.
[4] Group H D T S. Effect ofHypericumperforatum(St John’s wort) in major depressive disorder: a randomized controlled trial. Jama, 2002, 287(14): 1807-1814.
[5] Martarelli D, Martarelli B, Pediconi D.Hypericumperforatummethanolic extract inhibits growth of human prostatic carcinoma cell line orthotopically implanted in nude mice. Cancer Letters, 2004, 210(1): 27-33.
[6] Rezaei A, Pashazadeh M, Pashazadeh M,etal. Comparative study of sedative and anxiolytic effects of herbal extracts ofHypericumperforatumwithNardostachysjatamansiin rats. Zahedan Journal of Research in Medical Sciences, 2014, 16(3): 40-43.
[7] Özdemir E, Alpnar K. An ethnobotanical survey of medicinal plants in western part of central Taurus Mountains: Aladaglar (Nigde-Turkey). Journal of Ethnopharmacology, 2015, 166: 53-65.
[8] Qian Q X, Cong X D. Determination of flavonoids inHypericumperforatumprocessed by different methods of drying by HPLC. Chinese Traditional and Herbal Drugs, 2001, 32(5): 407-409. 钱秋霞, 丛晓东. HPLC法测定不同干燥方法的贯叶连翘中黄酮类化合物的含量. 中草药, 2001, 32(5): 407-409.
[9] Li H, Jiang H C, Zou G L. Advances in studies on active constituents ofHypericumperforatum. Chinese Traditional and Herbal Drugs, 2001, 32(7): 657-660. 李宏, 姜怀春, 邹国林. 贯叶连翘活性成分研究新进展. 中草药, 2001, 32(7): 657-660.
[10] Wen P H, Wang X L. Determination of hypericin fromHypericumperforatumL. in Taibai. Journal of Shaanxi Normal University: Natural Science Edition, 2001, 29(1): 121-122. 温普红, 王晓玲. 太白贯叶连翘中金丝桃素的含量测定. 陕西师范大学学报: 自然科学版, 2001, 29(1): 121-122.
[11] Zeng H Y, Zhou P H. Studies on chemical components of the volatile oil from the leaves ofHypericumperforatum. Journal of Chinese Medicinal Materials, 2000, 23(12): 752-753. 曾虹燕, 周朴华. 贯叶连翘挥发性成分分析. 中药材, 2000, 23(12): 752-753.
[12] Sun J X, Yang F, Wang J M,etal. Analysis of volatile constituents in leaves ofHypericumperforatumin Guizhou by SPME-GC-MS. Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(11): 96-99. 孙建勋, 杨飞, 王金梅, 等. 固相微萃取-气质联用法分析贵州产贯叶连翘叶挥发性成分. 中国实验方剂学杂志, 2011, 17(11): 96-99.
[13] Meng X Y, Guo L, Yang M,etal. Analysis of the essential oils fromHypericumperforatumL. Chinese Journal of Analytical Chemistry, 2003, 31(6): 689-693. 孟祥颖, 郭良, 杨明, 等. 贯叶连翘挥发油成分的分析. 分析化学, 2003, 31(6): 689-693.
[14] Wang X F, Dong X N, Yan S C. Chemical constituents of volatile essential oil inHypericumperforatum. Acta Botanica Boreali-Occidentalia Sinica, 2006, 26(6): 1259-1262. 王小芳, 董晓宁, 闫世才. 贯叶连翘挥发性化学成分研究. 西北植物学报, 2006, 26(6): 1259-1262.
[15] Nencini C, Menchiari A, Franchi G G,etal.Invitroantioxidant activity of aged extracts of some ItalianAlliumspecies. Plant Foods for Human Nutrition, 2011, 66: 11-16.
[16] Benzie I F F, Strain J J. The ferric reducing ability of plasma (FRAP) as a measure of “antioxidant power”: the FRAP assay. Analytical Biochemistry, 1996, 239(1): 70-76.
[17] Ma M L, Karsani S A, Mohajer S,etal. Phytochemical constituents, nutritional values, phenolics, flavonols, flavonoids, antioxidant and cytotoxicity studies on Phaleria macrocarpa (Scheff.) Boerl fruits. BMC Complementary & Alternative Medicine, 2014, 14(8): 1187-1198.
[18] Beato V M, Orgaz F, Mansilla F,etal. Changes in phenolic compounds in garlic (AlliumsativumL.) owing to the cultivar and location of growth. Plant Foods for Human Nutrition, 2011, 66(3): 218-223.
[19] Wu W, Meng D S, Fu R Q,etal. Determination of hypericin in different parts ofHypericumperforatumfrom different habitats by HPLC. China Pharmacy, 2010, 21(11): 1020-1022. 吴畏, 孟德胜, 傅若秋, 等. HPLC法测定不同产地贯叶连翘不同部位中金丝桃素的含量. 中国药房, 2010, 21(11): 1020-1022.
[20] Wang L, Shi L L, Zhang Y X,etal. Biosynthesis and regulation of the secondary metabolites in plants. Journal of Wuhan Botanical Research, 2007, 25(5): 500-508. 王莉, 史玲玲, 张艳霞, 等. 植物次生代谢物途径及其研究进展. 武汉植物学研究, 2007, 25(5): 500-508.
[21] Yan X F, Wang Y, Li Y M. Plant secondary metabolism and its response to environment. Acta Ecologica Sinica, 2007, 27(6): 2554-2562. 阎秀峰, 王洋, 李一蒙. 植物次生代谢及其与环境的关系. 生态学报, 2007, 27(6): 2554-2562.
[22] Southwell I A, Bourke C A. Seasonal variation in hypericin content ofHypericumperforatum, L. (St. John’s Wort). Phytochemistry, 2001, 56(5): 437-441.
[23] Schwob I, Bessiere J M, Masotti V,etal. Changes in essential oil composition in Saint John’s wort (HypericumperforatumL.) aerial parts during its phenological cycle. Biochemical Systematics & Ecology, 2004, 32(8): 735-745.
[24] Majid A. Change in content and chemical composition ofHypericumperforatumL. oil at three harvest time. Journal of Herbs Spices and Medicinal Plants, 2007, 13(2): 79-85.
[25] Asili J. Essential oil composition and variability ofHypericumperforatumL. growing in Lithuania. Biochemical Systematics and Ecology, 2005, 33(2): 113-124.
[26] Hajdari A, Mustafa B, Nebija D,etal. Essential oil composition and variability ofHypericumperforatumL. from wild population in Kosovo. Current Issues in Pharmacy and Medical Sciences, 2016, 27(1): 51-54.
[27] Gudzic B, Djordjevic S, Smelcerovic A. Antimicrobial activity of the essential oils ofHypericumperforatumL.,HypericummaculatumCrantz andHypericumolympicumL. Flavour and Fragrance Journal, 2001, 16: 201-203.
[28] Saddiqe Z, Naeem I, Maimoona A. A review of the antibacterial activity ofHypericumperforatumL. Journal of Ethnopharmacology, 2010, 131: 511-521.
[29] Hu Z H, Lv H F. Studies on the development of secretory structures and their secretory products accumulation ofHypericumperforatum. Acta Botanica Boreali-Occidentalia Sinica, 2001, 21(2): 287-292. 胡正海, 吕洪飞. 贯叶连翘分泌结构的发育及其内含物积累的研究. 西北植物学报, 2001, 21(2): 287-292.
[30] Hu Z H, Lv H F, Li J Y. A study on the secretory structures and their relation to hypericin inHypericumL. Journal of Northwest University: Natural Science Edition, 2002, 32(5): 34-39. 胡正海, 吕洪飞, 李景原. 金丝桃属植物的分泌结构与金丝桃素关系的研究. 西北大学学报: 自然科学版, 2002, 32(5): 34-39.
[31] Sirvent T, Gibson D. Induction of hypericins and hyperforin inHypericumperforatumL. in response to biotic and chemical elicitors. Physiological and Molecular Plant Pathology, 2002, 60(6): 311-320.
[32] Sirvent T M, Krasnoff S B, Gibson D M. Induction of hypericins and hyperforins inHypericumperforatumin response to damage by herbivores. Journal of Chemical Ecology, 2003, 29(12): 2667-2681.
[33] Zobayed S M A, Afreen F, Goto E,etal. Plant-Environment interactions: Accumulation of hypericin in dark glands ofHypericumperforatum. Annals of Botany, 2006, 98(4): 793-804.
Antioxidantcapacity,bioactivecompounds,andvolatileconstituentsofflowersofHypericumperforatumatdifferentharveststages
GE Li1, YAO Yuan-Yuan1, KANG Tian-Lan2, LI Jing-Yao3, HE Heng-Jun4, YANG De-Long1, LI Meng-Fei1*
1.GansuProvincialKeyLabofAridlandCropScience,CollegeofLifeScienceandTechnology,GansuAgriculturalUniversity,Lanzhou730070,China; 2.StationofIndustrialCropPromotionofGansuProvince,Lanzhou730030,China; 3.GuidanceStationofHerbsCultivationofKangxian,Longnan746500,China; 4.HengMaoYuanProfessionalCooperativeofChineseHerbalMedicine,Longnan746500,China
The aim of this study was to investigate the antioxidant capacity and the contents of total flavonoids, phenolics, and hypericin inHypericumperforatumflowers at different harvest stages (bud stage, blooming stage, fruit stage). Flowers at each stage were extracted in 70% ethanol, and the extracts were subjected to high performance liquid chromatography (HPLC) and gas chromatography-mass spectrometry (GC-MS). The I% (inhibition percentage) and FRAP (ferric reducing/antioxidant power) values were significantly higher at the bud and blooming stages than at the fruit stage, but did not differ significantly between the bud and blooming stages. The contents of total flavonoids, phenolics, and hypericin differed significantly among stages, with the highest contents at the blooming stage, followed by the bud stage, and then the fruit stage. Thirty-seven compounds were separated and identified in the 70% ethanol extracts from flowers at the blooming stage. The main components were 1,1-diethoxy-ethane (19.26%), 1-hexadecanol (17.85%), β-ylangene (10.71%), (Z,Z)-9,12-octadecadienoyl chloride (8.42%), hexadecanoic acid ethyl ester (8.40%), phytol (5.79%), and caryophyllene oxide (4.56%). These results indicated that the optimal harvest stage ofH.perforatumflowers is at the bud to blooming stages, when the flowers contain high levels of bioactive compounds, antioxidants, and volatile components. This study provides important reference information for the large-scale cultivation ofH.perforatum.
Hypericumperforatum; harvest stages; antioxidant capacity; total flavonoids and phenolics; hypericin; volatile constituents; GC-MS separation and identification
http://cyxb.lzu.edu.cn
10.11686/cyxb2016484
2016-12-14;改回日期:2017-03-13
国家自然科学基金(81560617,31360148), 甘肃省农业科技创新(GNCX-2016-12), 甘肃省中药材产业科技攻关(GYC14-03), 国家级大学生创新创业训练计划(201510733007)和甘肃农业大学SRTP(20150801)资助。
葛莉(1993-), 女, 甘肃宁县人,在读本科。E-mail:geli199308@163.com*通信作者Corresponding author. E-mail:lmf@gsau.edu.cn
葛莉, 姚园园, 康天兰, 李京耀, 何恒军, 杨德龙, 栗孟飞. 不同收获期贯叶连翘花中抗氧化能力、主要活性物质变化及挥发性组分分离鉴定. 草业学报, 2017, 26(9): 66-74.
GE Li, YAO Yuan-Yuan, KANG Tian-Lan, LI Jing-Yao, HE Heng-Jun, YANG De-Long, LI Meng-Fei. Antioxidant capacity, bioactive compounds, and volatile constituents of flowers ofHypericumperforatumat different harvest stages. Acta Prataculturae Sinica, 2017, 26(9): 66-74.

